JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
공촛점 이미징에 대한 분리 및 성인 심장 Myocytes의 유전자 조작
요약
성인 심장 myocytes 동물 마음으로부터 격리하고 며칠 동안 교양 수있는 기본 세포입니다. 이 문화가 기간 내에 adenoviral 유전자 전송은 유전자 인코딩 biosensors (GEBs) 또는 형광 융합 단백질을 표현하는 데 사용할 수 있습니다. 두 접근 방법 공촛점 현미경에 의해 세포 조사를 허용합니다.
초록
어른 마음으로부터 격리 심장 myocytes 널리 어딘가 모델 한쪽에 배아 및 신생아 근육 세포, 다른 작업을 마음 사이의 중간 계산으로만 쓰여집니다. 따라서, cardiomyocytes 심장 세포 생리학과 pathophysiology 좋은 모델 역할, 제약 수사뿐만 아니라 유전자 변형 동물 모델의 탐험하십시오. 여기서 우리는 마음에서 세포를 분리하는 방법을 설명합니다. 또한 우리는 심장 myocytes에 대한 유전자 조작은 유전자 변형 동물을 사육하지 않고 수행할 수있는 방법을 보여주 : 이것은 장기적인 문화의 결합 (1 주) 및 adenoviral 유전자 전달됩니다. 후자의 하나는 바이러스의 건설에서 세포의 형질 도입에 설명되어 있습니다. 그것은 유전자 인코딩 biosensors (GEBs), 형광 융합 단백질의 표현을 위해 사용뿐만 아니라 표현 이상의 단백질과 규정, 예를 들어 RNAi를 사용하여 아래하실 수 있습니다. 여기 subcellular 구조 (잠돌군 Zz)를 얼룩 융합 단백질의 표현에 대한 예제를 제공합니다. 이러한 단백질 표현 subcellular 구조의 3 차원 재건에 대한 Z - 스택의 공촛점 이미징에 의해 시각하실 수 있습니다. 프로토콜은 세포 배양, 분자 생물학 및 생물 물리학의 최첨단을 구성하며 따라서 세포 심장에 새로운 지평을 개척을위한 방법을 제공합니다.
프로토콜
네 개의 주요 단계를 포함하는 프로토콜의 설계 이상의 그림 1에 그려져 있습니다. 모든 단계는 전체 상세하게 설명되어 있습니다. 약 24 시간 공촛점 이미징 다음 세포 분리, 전달 및 문화, 나중에 연속과 의무 timescale입니다. 바이러스 공사는 앞으로 세포 고립 완료해야 다음 유전자 전달에 사용됩니다.
1. 쥐의 심장에서 성인 심장 myocytes의 분리
- 성인 남성 위스타 쥐 무게가 약 250g이 (오래된 6-12 주) 100g의 bodyweight 당 170 μl 마취 솔루션의 intraperitoneal 주사로 anesthetised 아르
- 또한, 구연 산염 솔루션 (2 μl / g 체중)는 수술 중 혈액 응고를 방지하기 위해 주입니다.
- Langendorff 재관류 설정이 준비되어야합니다. 모든 솔루션은 산소 포화해야합니다.
- 쥐가 anesthetised 때, 동물은 수술 보드에 고정하고 신체의 상단 부분은 70 % 에탄올로 소독합니다.
- 동물은 경동맥을 통해 절단에 의해 살해됩니다.
- 흉부는 가위를 사용하여 열립니다. 심장과 대동맥 지금은 액세스할 수 있어야합니다. pericard가 제거됩니다.
- 얼음처럼 차가운 솔루션 A +는 (5 ML) 마음을 체포하고 혈액을 씻어 26 게이지 바늘을 사용하여 두 심실에 주입합니다.
- 대동맥은 클램프로 잡고 대동맥 아치에서 잘립니다 단지 첫 번째 분기가 발생되었습니다.
- 심장은 가슴에서 제거되고 대동맥을 역행 Langendorff - 재관류를 허용하도록 포셉하여 재관류 설정 및 클램프의 정맥에 첨부되어 있습니다. 대동맥 밸브를 foraminate하지 않을 수도 있습니다.
- 심장은 대동맥 / 정맥 주위를 끈으로 고정해야합니다. 오픈 선박도 출혈도 잡았해야합니다.
- 마음은 retrogradely 산소 포화 용액 약 70 mbar의 압력 10 분 실온에서 A + (23 ° C)와 perfused 있습니다. 기포가이 대동맥을 입력하지 있는지 확인하십시오.
- 재관류 솔루션 37 온도에서 Liberase 솔루션으로 전환됩니다 ° C 연동 펌프에 의해 4 ML / 분 속도로 약 25 분. 재관류의 끝에 마음은 대리석으로 흰색을 보일 것입니다. 소화 시간은 상황 / 조직 상태에 적응해야 할 수도 있습니다.
- 마음은 재관류 설정에서 가져온 37 ° C.의 온도에서 배양 접시가 포함된 솔루션에 배치됩니다 남은 혈관과 심방은 차단됩니다. 혈관이 폐기되고 심방 - 필요한 경우는 (- 아니이 프로토콜의 일부) 다르게 처리됩니다. 심실은 약 6 조각으로 나누어집니다.
- 조각은 37 ° C와 약간 5 분 37 ° C의 물을 욕조에 흥분.의 온도에서 20 ML 솔루션을 포함하는 100 ML Erlenmeyer 플라스크에 전송됩니다 마지막으로 뜨는가 삭제됩니다.
- 위에서 설명한 절차는 한두 번 반복됩니다. 뜨는 약간 불투명 나타납니다.
- 세포외 칼슘 농도의 증가는 37 용액 B 1 / 2 20 ML 추가 ° C를 세포 및 조직 솔루션의 잔류를 나머지에 의해 시작되는 Erlenmeyer 플라스크에. 이것은 약간 추가 5 분 37 ° C의 물을 욕조에 흥분 상태입니다. 이후에 뜨는이 삭제됩니다.
- 20 ML 솔루션에게 추가 B 1 / 2를 추가합니다. (솔루션 / 뜨는 지금은 가능한 세포를 포함해야합니다.) 세포의 방울이 거꾸로 세포 배양 현미경에 페트리 접시로 전송됩니다. 세포가 높은 자발적인 활동 (수축) 세포가 휴식 올 때까지 기다려야 하나의 요구 사항을 표시하십시오.
- 한 번 더 뜨는가 삭제됩니다 및 솔루션 B 1 / 2 20 ML이 추가됩니다.
- 플라스틱 파스퇴르 피펫의 팁을은 오프닝을 통해 흥분하면 조직 조각을 쉽게 전달할 수있는 방법으로 잘라입니다. 화염 처리와 함께 날카로운 가장자리는 (녹아) 부드럽게됩니다.
- 이제 조직 조각이 약간 있고 부드럽게 triturated. 조직 조각 세포에 "다투지"해야합니다.
- 뜨는을 포함하고있는 세포는 decanted과 실험의 종류에 따라 차이가 있으며, 경험적으로 결정되어야하는 원하는 세포 밀도를 도달하는 솔루션을 B로 희석합니다.
2. 융합 단백질 전달에 대한 아데노 바이러스의 건설
adenoviruses 생산 MP의 Biomedicals에서 TRANSPOSE - 광고 Adenoviral 벡터 시스템은 1 사용됩니다. 이 프로토콜은 형광 융합 단백질 또는 GEB의 2에 사용할 수있는 항목 및 테스트 벡터 (pCR259)로 시작합니다.
- 관심있는 유전자를 포함하는 상기 초기 pCR259 벡터 10 NG의 금액을 100 μl HighQ - 1 TRANSPOSE - AD 294 ™ 유능한 세포로 변환됩니다.
- 이 혼합물은 42 45 s에 대한 열 충격 ° C 다음과 추가 2 분 얼음에 저장된 얼음 20 분 incubated입니다.
- 900 & 뮤 추가, 4 시간 동안 교반과 함께 부드러운 unselective LB - 미디어 37에서 성장 ° C의 리터.
- 플레이트 50 μl, Chloramphenicol (CM, 20 μg / ML), 암피실린 (100 μg / ML), 테트라 사이클린 (15 μg / ML), X - 걸 (280 μg / ML와 LB - 미디어를 포함하는 접시에 100 μl 200 μl )와 IPTG (40 μg / ML). (더 강렬하고 빠른 파란 얼룩이 300μg/ml로 더 비싼 염료 Bluo - 걀를 사용하여 가능합니다. 이것은 특히 사용해야합니다 당신이 백인 / 블루 식민지를 인식하고 구별에서 너무 익숙하지 않은 경우)
- 37 24 시간 동안 성장 ° C. 블루 식민지 잘 식별이 가능 ° C까지 4 둡니다. 식민지는 식민지의 일부를 선택하고 복제 세 개의 항생제를 포함하는 다른 판, X - 걸과 IPTG와 그들이 37 박 이상 성장하게 ° 정말 하얀한지 결정하는 문제가있을 경우 C.
비고) HighQ - 1 TRANSPOSE - AD ™ 294 세포는 두 가지 중요한 plasmids 포함 위치한 아데노 바이러스 백본 (TRANSPOSE - 광고 ™ 294)과 타겟 사이트에 관심있는 유전자의 삽입을 mediates transposase을 표현하는 플라스미드 도우미를 플라스미드 전치 - AD 294의 LacZ 유전자 인치 - 바이러스 백본에 대한 관심의 유전자가 같은 2.7-2.9에서 설명한 식민지 - PCR을 수행 포함하는 긍정적인 식민지를 확인합니다. 여러 복제 사이트를 (앞으로 5 역방향 5 '가 3 GCGGATAACAATTTCACACAGG', '3 CCCAGTCACGACGTTGTAAAACG') 측면 벡터 primers를 사용하여 삽입된 유전자없이 백퍼센트 하얀 식민지와 식민지 PCR을 만들고 바꾸어 - AD 294 plasmids를 제어하는 등 파란 식민지를 사용하여 관심. 블루 식민지 당신에게 짧은 PCR의 조각 (~ 200bp), 관심의 유전자를 포함하는 식민지가 큰 PCR 제품 전시회 (관심의 유전자의 길이에 따라) 두 조각이 여러 세포 식민지 아르와 식민지를 포기하고 분리해야합니다 더 사용하면.
- 마스터 믹스 아래 표에 따라 준비해야합니다.
- autoclaved 이쑤시개와 함께 하나의 백퍼센트 하얀 식민지를 선택하고 첫번째 CM과 LB - 접시에이 식민지의 복제합니다.
- PCR - 믹스에 식민지를 전송합니다. PCR - 믹스에이 PCR - 믹스를 많이 흡수도 전에 이쑤시개를 제거보다 3-4 회 그것을 보라고. PCR 프로토콜은 삽입하고 사용하는 효소의 킬로바이트에 따라 달라집니다. primers의 어닐링 온도가 57 ° C는 35 사이클의 사용을 권장합니다.
- 긍정적인 클론의 밤 문화를 (CM과 LB - 중간)을 통해 성장과 원심력이 큰 바이러스 벡터를 방해하기 때문에, 스핀 컬럼없이 상업적인 사용 가능한 키트와 plasmids를 분리.
- 100 μl DH5α 유능한 세포의 격리 plasmids 0.5 μg을 변환. 30 분 얼음 세포와 DNA를 품어. 42 열충격 45 S ° C 2 분 얼음 설정합니다.
- 900 μl unselective LB - 미디어를 추가 ° C 부드러운 교반과 함께 1 시간 37 성장.
- 플레이트 CM, X - 걸과 IPTG와 LB - 미디어를 포함하는 접시에 50 μl. 24 시간 동안 37 ° C에서 알을 품다.
- 선택 별도의 암피실린, 테트라 싸이클린과 IPTG와 X - 걸이 포함된 Chloramphenicol 접시 20 백퍼센트 흰색 식민지까지 복제합니다. 그들이 37 박 이상의 성장하자 ° C. 백퍼센트 흰색, chloramphenicol 저항, 암피실린 및 tetracyclin 구분 식민지를 선택합니다.
- 콜로니 - PCR (선택 사항) : 긍정적인 클론들은 삽입을 포함되었는지 확인하기 위해 식민지 - PCR로 다시 테스트할 수 있습니다.
- 긍정적인 재조합의 단일 식민지를 선택하고 CM과 600 ML - LB 배지에서 성장.
- 플라스미드 맥시 키트를 사용하여 플라스미드를 분리.
- 37 두 시간 동안 팩 I와 플라스미드의 다이제스트 5 μg ° C 65에서 반응을 중지 ° C 20 분.
- 10 μl의 최종 볼륨을 30 분 실온에서 SpeedVac에서 전체 텍스트를 집중 또는 페놀 - 클로로포름 추출 방법을 사용합니다.
- 37 ° C의 물을 욕조에 부드러운 교반과 함께 냉동 QBI - HEK 293 세포의 병을 해동. 70 % 에탄올로 유리병의 바깥쪽을 씻어 살균 모자 무균 진행합니다.
- , 멸균 15 ML 튜브에 세포를 전송하는 동안 부드러운 agitating dropwise 10 ML DMEM을 (10% FCS) 추가 및 250xg에서 펠릿 세포로 10 분 원심 분리기.
- 뜨는 폐기하십시오. 부드럽게 위아래로 pipetting과 10 ML DMEM (10% FCS)의 펠렛을 Resuspend.
- 75cm 두 플라스크에서 씨앗과 세포 10 % FCS 10 ML DMEM를 추가합니다. 37 박 이상 품어 ° 5 % CO 2 배양기에서 C.
- 다음날 세포 밀도를 확인하십시오. QBI - HEK 293 세포는 1시 10분부터 1시 20분까지 비율로 분할해야합니다.
- 세포에서 매체를 제거하고 1-3 분 2 ML의 트립신과 trypsinize. 10 분 250xg에서 세포 원심 분리기 10 ML DMEM주세요.
- 신중하게 매체를 제거하고 세포 10 ML 새로운 매체를주고, resuspend 및 세포를 계산합니다.
- 2x10 5 잘 여섯 잘 하나 3x10 5 플레이트 4x10 5, 5x10 5 6x10 5 세포. 37 접시를 품어 ° C를 CO 2 배양기 인치
- 다음날에 집중 팩 I 소화와 transfect 50 %의 합류로 잘 사용합니다. 우리는 Lipofectamine 2000 transfection과 함께 좋은 경험을 가지고 있지만, 또한 다른 방법 (예 : 칼슘 인산염 transfection 등) 적합해야합니다.
- 절차를 수행하는 동안 기하 급수적인 성장으로 세포를 얻을 transfection 전에 잘 3-4 H의 매체를 변경합니다.
- 5 분 실온에서 250 μl DMEM과 부화 5 μl Lipofectamine를 섞습니다.
- DNA에 Lipofectamine - 중간 혼합주세요 (팩 I 다이제스트)과 반응 관에 대한 도청으로 혼합, pipetting으로 혼합하지 않습니다. 상온에서 혼합 20 분 알을 품다.
- 세포에 transfection 혼합물 내려 섞어 접시를 바위. 37 ° C 5 % CO 2를 품어. 4-5시간 후 매체를 변경합니다.
- transfection 후 이틀은 세포의 매체를 가지고 새로운 문화 플라스크 (75cm 2)로 그것을 제공합니다.
- 최대 5 분을 500 μl 트립신으로 세포를 Trypsinize. 세포 1 ML DMEM하고, 문화 플라스크에 17 ML 신선한 매체 (FCS와 DMEM)과 함께 전체 혼합물을 가지고 그것을 넣어. 37 세포를 배양하면 ° C 5 % CO 2 cytopathic 효과 (CPE)이 볼 때까지. CPE처럼 보일 것입니다 방법에 대한 자세한 내용은 그림 2를 참조하십시오.
- 50 ML 튜브의 매체와 세포를 수집하여 -80에서 세포를 동결 ° C. 세 동결 / 해동주기 (-80 ° C/37 ° C 물 목욕)와 세포를 휴식.
- 8000xg 4에서 20 분 원심 분리기 ° C. 100mm - 직경 요리에 뜨는를 가만히 따르다하여 펠렛을 삭제. 여과액 뜨는로 0.45μm 기공 크기와 살균 필터를 사용합니다. 이것은 최초의 바이러스 주식 (통로 1)입니다.
- 70 % 합류와 함께 QBI - HEK 293 세포와 75cm이 휴대용 술병을 transduce이 주식의 1 / 3을 사용합니다. 37 품어 ° C와 5% CO 2 CPE S 볼 때까지.
- 세포가 CPE S들을 수집하고 한 번도 같은 바이러스를 추출 표시하십시오. 이것은 바이러스의 통로 2.
- 단계 2.37 및 바이러스 통로와 2.38를 반복 2 이렇게까지에있는 바이러스의 증폭은 충분한 바이러스 주식에 도달합니다. 바이러스는 특정 원심 분리 튜브 (Millipore에서 ultracel - 100 멤브레인와 Amicon 울트라 - 15 원심 필터 단위)를 집중하고 -80 ° C.에서 몇 달 동안 저장할 수 있습니다 계산하려면 전염성 입자는 플라크 분석을 사용합니다.
- 세포를 transduce과 바이러스의 더 증폭시키기위한 바이러스 통로 2 이상을 사용하십시오.
3. 기본 세포 배양 및 형질 도입 adenoviral
- 20mm 직경의 무균 원형 커버 전표는 표준 12 - 잘 접시에 배치됩니다.
- 20 μl ECM 솔루션은 동일하게 각각의 표지 슬립에 배포됩니다. 유적은 삭제됩니다. 건조 37 1 H 최소에게 허용 ° C. 또는 코팅 방법으로 상온에서 (12 H) 밤 동안 건조하실 수 있습니다.
- 각 잘은 항생제와 ITS로 구성된 보충 1 ML 매체 M199으로 가득합니다.
- 200-400 μl의 세포 현탁액은 (1.21 단계에서) 각 잘에 추가됩니다. 세포의 Culturing 37에서 발생 ° 5 % CO 2 배양기에서 C.
- 세포 침전 수 있으며 1 일 이후 H 매체가 변경됩니다.
- 즉시 매체를 변경한 후 바이러스가 포함된 용액 (통로 2 이상에서)의 적절한 금액은 부드럽게 접시 로킹하여 혼합합니다.
- 장기 문화 매체의 경우 2 일마다 변경됩니다.
- transfection의 GEB 식을 후 24 시간이 감지할 수 있습니다.
4. 공촛점 3D subcellular 구조의 이미징 및 CA 2 + 신호
공촛점 이미징은 어떤 공촛점 현미경을 수행할 수 있습니다. 그러나, 칼슘 영상 실험은 적어도 비디오 속도 (25-30 Hz에서)의 수집 속도를 필요로합니다. 이것은 다중 빔 스캐너 (예 : Nipkow 디스크, 필드 또는 킬로 - 빔 배열 스캐너를 휩쓸) 또는 매우 빠른 단일 빔 스캐너 (예 : 공명 스캐너 또는 음향 광학 디플 렉터 (AOD) - 스캐너)로 사용 가능한 기술을 제한합니다. 개요를 보려면 참조를 참조하십시오. 3. 3D - subcellular 이미지는 Z - 드라이브가 필요합니다. 여기 킬로 - 빔 배열 스캐너 (VTinfinity, VisiTech INT., 선더랜드, 영국)가 사용됩니다.
- 현미경 및 주변 기기가 작동 모드로 설정해야합니다. 안정적인 출력에 도달할 때까지 특히 레이저에 대한이 기간까지 온난 화를 요구할 수 있습니다.
- 세포 실험 챔버 (커버 - 미끄럼 전송)로 전송해야합니다. 전지 coverslips는 실험 챔버로 전송됩니다. 1mL Tyrode 솔루션은 (1.8 MM 세포외 칼슘을 포함)가 추가됩니다.
- 실험 챔버는 현미경 스테이지에 배치해야합니다. 자극 전극, 재관류의 설정 및 periphe 추가ral 장치, 예를 들어 온도 제어가 적절하게 정렬해야합니다.
- 세포에 초점과 흰색 빛을 및 / 또는 epifluorescent 조명을 사용하여 선택됩니다.
- 이러한 레이저의 파워, 노출 시간 등 또는 전체 실험 프로토콜로 수집 파라미터 셋업이 필요합니다.
- 시계열 및 / 또는 Z - 섹션 이미지가 취득하실 수 있습니다.
- 설정 추가 고급 다중 측정에 전기 생리학 (패치 - 클램프) 또는 / 및 형광 photobleach 후 재배포 (FRAP) 또는 두 개의 광자의 광분해를 포함한 물질의 uncaging 같은 광학 조작을 사용하여 수행할 수 있습니다.
- 이미지 분석, 특히 3D - 재건 그러한 Imaris (Bitplane AG, 취리히, 스위스), 속도 (순발력, 코번 트리, 영국) 또는 Arivis 브라우저 (arivis GmbH를, 로스 토크, 독일)와 같은 전용 분석 소프트웨어에서 수행됩니다.
5. 대표 결과 :
프로토콜의 최종 결과는 더 이상 데이터를 추출하는 데 사용할 수있는 이미지 시퀀스입니다.
예를 들어 subcellular organelles의 구조와 조사입니다. 그림 3은 잠돌군 Zz 장치의 3 차원 배열의 예제를 묘사. 전자 현미경과는 달리 모든 조사는 살아있는 세포에서 수행할 수 있습니다.
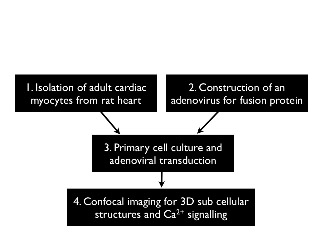
그림 1 : 주요 실험 단계의 일반적인 흐름.
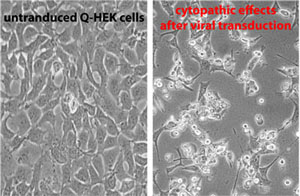
그림 2 : 왼쪽 이미지가 transduced 없습니다 90~95%의 confluency과 문화의 Q - HEK 세포를 묘사. 바이러스 형질 도입 이후 Cytopatic 효과는 오른쪽 부분에 표시됩니다. 세포가 원형 접시의 바닥에서 분리합니다. 이러한 세포에는 핵이 활성화 바이러스 생산의 결과로 세포의 주요 부분을 차지하고 있습니다.

그림 3 : 잠돌군 Zz 장치를 대상으로 YFP - 융합 단백질로 transfected 성인 쥐 심장 myocyte. adenoviral 유전자 전송 (문화 한 일) 이후에 심장 myocytes는 형광 융합 단백질을 표현. 패널 A는 Z - 스택에서 가져온 하나의 공촛점 조각을 묘사. 패널 B에서 같은 세포는 이론적 점 확산 함수 (PSF)를 사용 deconvolution 후 그려져 있습니다. 이 드 흐린 이미지 스택은 이후에 세포를 렌더링하고 패널 C 또는 3D 표면 재구성 (D)와 같이 3 차원 볼륨 재구성을하는 데 사용됩니다. 막대는 10 μm의를 나타냅니다.
Access restricted. Please log in or start a trial to view this content.
토론
쥐 cardiomyocytes의 격리에 대한 설명하는 절차는 필요한 경우 다른 종, 예를 들어, 마우스 4 적용할 수 있습니다. 적응을 필요로 매개 변수는 소화 효소 혼합 (아래 참조) 또한 소화의 기간입니다. 종 (种) (예 : 마우스)의 세포가 다른 사람 (예 : 쥐)보다 약해있을 것을 알고 있습니다.
collagenase의 선택은 아마도 격리 절차에서 가장 중요한 단계입니다. 그것이 거의없이 배?...
Access restricted. Please log in or start a trial to view this content.
감사의 말
이 작품은 독일의 국립 과학 재단 (DFG)와 위험 평가 연방 연구소 (BfR, 독일)에 의해 지원되었다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Anesthesia solution | Serumwerk Bernburg GmbH (Ursotamin), Bayer Health Care (Rompun) | Mixture of 1 ml Ursotamin (100 mg/ml Ketaminhydrochlorid) and 240 μl Rompun (2% Xylazinhydrochlorid) | |
| Citrate solution | 117,64 mg sodium citrate in 10 ml 0.9% NaCl solution | ||
| Solution A | 134 mM NaCl, 4 mM KCl, 11 mM glucose, 1.2 mM MgSO4, 1.2 mM Na2HPO4, 10 mM HEPES, pH adjusted to 7.35 using 10 M NaOH, sterile filtered | ||
| Solution A+ | Content of solution A plus 0.2 mM EGTA, pH adjusted to 7.35 using 10 M NaOH, sterile filtered | ||
| Liberase solution | F. Hoffmann‐ La Roche Ltd. | 11988476 001 | 500 μl stock solution in 15 ml solution A (stock solution:10 mg/ml Liberase Blendzyme 4 in aqua dest.) |
| Solution B | Content of solution A plus 200 μM CaCl2 and 0.1% DNase solution | ||
| Solution B1/2 | 1:1 mixture of solution A and solution B | ||
| DNase solution | Sigma-Aldrich | D4527 | Deoxyribonuclease I, Type 2 from bovine pancreas, 40 KU (15 mg) are dissolved in 5 ml of 10 mM Tris‐HCl buffer, adjusted to pH=7.35, additional content: 50 mM NaCl, 10 mM MgCl2, 1 mM dithi–rythritol; this solution is mixed with 5 ml glycerol |
| Extracellular matrix protein (ECM) solution | Extracellular matrix protein (ECM) solution | E1270 | 1 ml stock solution as purchased is diluted with 6 mLmedium M199 |
| Culture medium M199 | PAA Laboratories | E15‐834 | Medium M199 supplemented with 1 μl/ml ITS solution and 20 μl/ml penicillin‐streptomycin solution (5000 units/ml) |
| ITS solution | 25 mg Insulin, 25 mg Transferrin and 50 μl Selenite stock solution are dissolved in 5 ml aqua dest. (stock solution: 0.5 mg/ml Sodiumselenite in aqua dest.). Add a few drops of 1 M HCl until one should get a clearsolution. Aliquots can be frozen. | ||
| Tyrode | 135 mM NaCl, 5.4 mM KCl, 1.8 mM CaCl2, 2mM MgCl2, 10 mM glucose, 10 mM HEPES, pH adjusted to 7.35 using 10 M NaOH, sterile filtered | ||
| Master mix | 5 μl 10×PCR‐Buffer, 5 μl MgCl2 (25 mM), 2 μl forward primer, 2 μl reverse primer, 1 μl dNTP´s (10 mM each), 33 μl H2O, 1 μl DMSO, 1 μl Taq‐DNA polymerase for each sample | ||
| LB‐Medium | 10 g/l Tryptone, 5 g/l Yeast extract, 5 g/l NaCl (and 15 g/l Agar if used as solid medium), pH 7.0 | ||
| Pac I | New England Biolabs | R0547L | preparation: 50 μg DNA, 5 μl 10×buffer, 0.5 μl 100×BSA,0.75 μl Pac I, fill with H2O up to final volume of 50μl |
참고문헌
- Kaestner, L., Ruppenthal, S., S, Molecular Imaging II. Licha, K., Lin, C. P. Vol. 7370, SPIE. Bellingham. 737008-737008 (2009).
- Viero, C., Kraushaar, U., Ruppenthal, S. In vivo imaging of Drosophila melanogaster pupae with mesoscopic fluorescence tomography. Cell Calcium. 43 (1), 59-59 (2008).
- Shorte, S. L., Frischknecht, F. Imaging Cellular and Molecular Biological Functions. , Springer. Berlin Heidelberg. 289-289 (2007).
- Kaestner, L., Lipp, P. Optics in Life Science. Popp, J., von Bally, G. Vol. 6633, SPIE. Munich. 66330K-66330K (2007).
- Rinne, A., Littwitz, C., Bender, K. Adenovirus-mediated delivery of short hairpin RNA (shRNA) mediates efficient gene silencing in terminally differentiated cardiac myocytes. Methods Mol Biol. 515, 107-107 (2009).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유