JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Obliterative 에어웨이 질환의 발전을 연구하는 모델로 사용 마우스의 Heterotopic 및 Orthotopic Tracheal 이식
요약
이 동영상은 쇼, 생쥐의 obliterative기도 질환 (OAD)의 개발, heterotopic 및 orthotopic tracheal 이식 모델을 연구하는 두 실험 모델을 비교합니다.
초록
Obliterative 에어웨이 질병 (OAD)가 장기 생존 (1-7)를 제한 폐 transplantations 후 주요 합병증입니다.
pathophysiology을 공부하려면, 설치류에 tracheal 이식의 OAD 다른 동물 모델의 치료 및 예방은 (1-7) 개발되었습니다. 여기, 우리는 기관 이식, heterotopic 및 orthotopic 모델의 두 설립 모델을 사용하고 자신의 장점과 한계를 보여줍니다.
기증자 기관이 orthotopic 모델에서 엔드 - 투 - 엔드 문합에 의해 anastomosed 반면 heterotopic 모델, 기증자 기관은받는 사람의 큰 omentum에 싸여있다.
두 모델, 임상 OAD과 비슷한 histological obliterative 병변의 개발 (1-7) 증명되었습니다.
이 동영상이 모두를 수행하는 방법을 보여줍니다, heterotopic뿐만 아니라 orthotopic tracheal 이식 기법 마우스에서하고 조직학를 사용하여 두 모델 OAD 개발의 시간 코스를 비교합니다.
프로토콜
- 남성 Balb / C 마우스 (8-12주)는 찰스 리버 연구소 (Sulzfeld, 독일)에서 구입하고 있습니다. 생쥐는 종래의 조건, 공급 표준 쥐 음식과 물 광고 libitum 아래에 위치해 있습니다.
- 2 % Isofluran는 마취에 사용됩니다.
기증자 준비
- 복부 머리를 면도하고 betaisodona를 사용하여 지역을 소독.
- 미세한 보려면 아래에서 후두의 수준에서 흉골에 정중선 자궁 절개를 수행합니다.
- 기관의 명확한 전망을 얻을 수있는 피하 지방과 스트랩 근육을 제거합니다.
- 식도, 신경, 동맥, 그리고 결합 조직과 같은 모든 주변 조직에서 기관을 절개하다.
- 전체 기관을 (분기점으로 후두에서)를 제거합니다.
- 감기에 식염수에 이식를 플러시하고 4 그래프트를 저장 ° C.
- 기증자는 기관의 수확 다음과 같은 자궁 전위에 의해 euthanized있다.
받는 사람 : HETEROTOPIC 이식
- 절개 사이트 주변에 넓은 여백에 복부 머리를 면도하고 지역에게 알코올 다음 betaisodona (betadine)를 사용하여 세 번 소독. 눈을 밖으로 건조로부터 각막을 방지하기 위해 안과 연고 제품과 윤활해야합니다.
- 중앙 분리대 개복술을 수행하고 살균, moistured 장갑에 소장을 놓으십시오.
- 신중하게 더 큰 omentum을 전파. 중앙에 그래프트를 놓고 8-0을 (Prolene, Ethicon, 독일)를 사용하여 하나의 치료로 흥분시키는.
- 완전 큰 omentum로 이식을 커버하고 하나의 봉합사를 8-0 (Prolene, Ethicon, 독일)와 그래프트를 수정.
- 복부에 다시 창자를 변경하고 폐쇄하기 전에 따뜻한 무균 식염수에 플러시.
- 이 레이어에서 주변 지역 - 피부 근육과 7-0 Vicryl을위한 7-0 Prolene을 사용하여 지속적인 패턴으로 복벽과 피부의 레이어를.
받는 사람 : ORTHOTOPIC 이식
- 절개 사이트 주변에 넓은 여백에 복부 머리를 면도하고 지역에게 알코올 다음 betaisodona (betadine)를 사용하여 세 번 소독. 눈을 밖으로 건조로부터 각막을 방지하기 위해 안과 연고 제품과 윤활해야합니다.
- 전체 laryngotracheal 복잡한 시각화하기 위해 스트랩 근육을 나눕니다.
- 신중하게, 주변 조직에서 기관을 절개하다 회귀 후두 신경을 보존하는데주의를 기울여야.
- 반지의 꼬리기도 세 개의 반지를 나누십시오. 동물 tracheostomy를 통해 physiologic 호흡을 유지한다.
- 받는 사람뿐만 아니라 이식에 tracheal 가장자리 청소를 보장합니다.
- 이식은받는 tracheal 결함 및 해부 극성을 유지하기 위해 지향 사이 interposed입니다.
- anastomose 말초 (mediastinal) 기관과 기증자의 수술이 (Prolene, Ethicon, 독일) 8-0를 사용. 문합의 후부 측면은 지속적으로 실행하는 방식으로 수행됩니다. 앞쪽에 나서 중단 바늘을 사용하여 완료됩니다.
- 기도로부터 분비물을 제거합니다.
- 근위 문합은 다음 말초 것과 같은 방식으로 완료됩니다.
- 기도와 적절한, 자발적인 호흡의 무결성을 보장합니다.
- 스트랩 근육을 재배치하고 피하 조직과 지속적인 패턴으로 6-0 봉합을 (Vicryl, Ethicon, 독일)를 사용하여 피부의 레이어를 닫습니다.
- 따라서 동물이 호흡 관을 통해 생리 호흡 유지되며,받는 사람에 대한 사출 마취를 사용합니다. 75/1/0.2 MG / propofol, medetomidine 각각 펜타 닐의 kg의 조합은 생쥐에서 IP 마취에 사용됩니다.
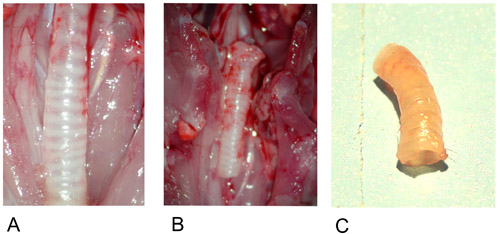
그림 1 : 기증자 기관.
1A : 준비 후 현장에서 기증자 기관.
1B : Excised 공여 기관.
1C : explantation 후 기증자 기관.
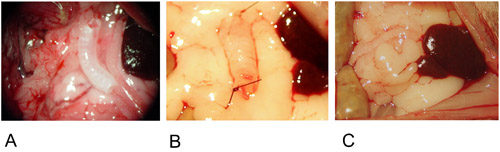
그림 2 : Heterotopic 모델입니다.
2A : 이식은 큰 omentum의 중앙에 위치합니다.
2B : 이식이 단일 봉합과 함께 양쪽에 고정됩니다.
2C : 이식이 큰 omentum로 포장해서 하나의 봉합사로 고정됩니다.
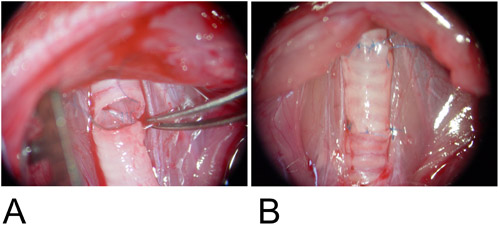
그림 3 : Orthotopic 모델입니다.
3A : 이식이받는 tracheal 결함과 후부 벽 사이 interposed는 것은 지속적인 실행 방식에 anastomosed 있습니다.
3B : 앞쪽에 벽은 하나의 봉합사를 사용하여 완료됩니다.
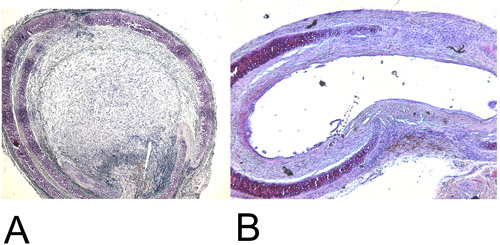
그림 4 : 조직학.
4A : H + E 역 28 일 후에 복구된 heterotopic 이식 기관ining (15x). 100 % luminal 말살을합니다.
4B : H에서 60 일 후에 orthotopic 이식 기관을 복구된 + E 염색법 (15x). 최대한 달성 luminal 말살은 대략 45 %입니다.
| Heterotopic Tracheal 이식 모델 | Orthotopic Tracheal 이식 모델 | |
| 장점 | 수행할 + 쉬운 28일 후 완전한기도 폐색과 + Luminal 말살 OAD로 동물 + 대한 신체적 애정도 | 이식편의 + 물리적 환기 가능 + 코로도 약물 관리 이러한 alloreactive IgM 항체 생산 등 + 강한 면역 반응 + 생리 흉부 환경 + Tracheal - tracheal 문합은 임상 설정을 imitates |
| 단점 | - 이식 기관의 팬도 없다 - 흡입 병원균의 없음 평가 가능 - mucociliary 통관 및 보관 분비물의 억제 - 복막 microenvironment 대신 흉부 환경 | - 필요 외과 훈련 - luminal 폐색 애플 리케이션과 함께 Luminal 말살. 60일 후 45% - 동물 OAD의 증상을 개발할 수 있습니다 |
표 1 : Heterotopic 및 Orthotopic Tracheal 이식의 장점과 단점.
토론
마우스는 다른 transgeneic 및 녹아웃 모델에서 사용할 수 있으며, OAD (4)에 관한 기계론의 질문을 연구하는 것이 적합합니다.
이 동영상에 표시된 tracheal 이식의 두 모델은 OAD 개발 연구에 대한 안정적인 모델로 사용할 수 있습니다.
그러나 각 모델은 장점과 한계를 보여줍니다.
heterotopic tracheal 이식은 수행하기 쉬운 특별 외과 훈련 (3, 5) 필요하지 않습니?...
공개
소냐 Schrepfer는 독일 Forschungsgemeinschaft (DFG) (SCHR992/3-1)에서 연구 부여를 받았습니다.]
모든 동물은 실험실 동물 관리의 원칙을 준수 인간의 치료를받은, 동물 실험에 의해 출판 연구소 동물의 관리 및 사용을위한 의료 연구 및 설명서에 대한 국립 협회가 정한 지침과 규정에 따라 수행되었습니다 보건 국립 연구소 (보건 간행물 85-23 국립 연구소, 1985 개정).
모든 동물은 찰스 리버 연구소 (Sulzfeld, 독일)에서 얻은되었고 대학 병원 함부르크 Eppendorf의 동물 보호 시설에서 유지되었다. 동물 표준 차우와 물 광고 libitum을 받았습니다.
감사의 말
저자 크리스티안 Pahrmann (연구소 관리자)를 주셔서 감사합니다.
참고문헌
- Adams, B., Berry, G., Huang, X., Shorthouse, R., Brazelton, T., Morris, R. Immunosuppressive therapies for the prevention and treatment of obliterative airway disease in heterotopic rat trachea allografts. Transplantation. 69, 2260-2266 .
- Adams, B., Brazelton, T., Berry, G., Morris, R. The role of respiratory epithelium in a rat model of obliterative airway disease. Transplantation. 69, 661-665 .
- Deuse, T., Schrepfer, S., Reichenspurner, H., Hoyt, G., Fischbein, M., Robbins, R., Pelletier, M. Techniques for experimental heterotopic and orthotopic tracheal transplantations – when to use which model; Transplant Immunology 17. , 255-261 (2007).
- Hele, D., Yacoub, M., Belvisi, M. The heterotopic tracheal allograft as an animal model of obliterative bronchiolitis. Respiratory Research. 2, 169-183 .
- Hertz, M., Jessurun, J., King, M., Savic, S., Murray, J. Reproduction of the obliterative bronchiolitis lesion after heterotopic transplantation of mouse airways. American Journal of Pathology. 142, (1993).
- McDyer, J. Human and murine obliterative bronchiolitis in transplant. Proceedings of the American Thoracic Society. 4, 37-43 .
- Schrepfer, S., Deuse, T., Hoyt, G., Sheikh, A., Hoffmann, J., Reichenspurner, H., Robbins, R., Pelletier, M. Experimental orthotopic tracheal transplantation: the stanford technique. Microsurgery. 27, 187-189 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유