JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
에서 Organotypic Murine 망막 Wholemount 문화 생체내 같은
요약
이 동영상이 문서에서는 organotypic 망막 wholemount 문화와 exogenously 유발 효과 분석을 위해 cytospin 절차의 설립을 보여줍니다. Organotypic 망막 wholemount 문화를 모방 생체내에 상황과 고전 murine 동물 모델의 단점을 우회하면서 상당히 실험적인 조작을위한 murine 망막의 접근을 용이하게합니다.
초록
동물 모델의 유전자 분석 타겟팅 ablations는 등록 망막 특정 유전자 기능에 대한 전통적인 전략이다. 그러나, 유전자 변형은 망막 특정 또는 조건부 녹아웃 마우스 모델은 종종 초기 파괴 장면을 보여 주죠를 표시하거나 배아 또는 출생 후의 초기 단계 이상의 분석을 방지 심한 기형으로 고통.
기본 세포 배양은 exogenously 적용 재조합 요인, 제한된 환경에서 유전자 또는 siRNA - 중재 유전자 최저의 overexpression의 효과를 조사하기 위해 대안입니다. Dissociated 세포 배양하므로 약리 조작 후 exogenously 발생 효과의 신분을 촉진, 대상 세포에 도달하는 내생 신호가 감소되는 장점이 있습니다. 그러나, 중요한 세포 - 세포 상호 작용은 초기에 다시 집계 retinospheroid 문화 하나를 사용하더라도, 효소 소화 또는 기계적 분리에 의해 파괴됩니다.
반대로, organotypic 망막 wholemount 문화의 연결 상호 작용 및 연결을 아직도 보존되어 2-5로 생체내 상황에 가까운 생리하는 시스템을 제공합니다.
이 동영상이 문서에서 우리는 배아, 출생 후의 성인 murine 눈 해부의 특성과의 연결을 분석 (2) 분리 및 cytospin 절차를 포함 organotypic 망막 wholemount 문화와 같은 생체내에서 (1) 설립의 단계 시범에 의해 단계를 제공합니다 apoptosis와 organotypic wholemounts에서 망막 세포 증식은 exogenously 적용 재조합 요인의 존재의 문화 후 예.
프로토콜
모든 장비와 시약은 멸균 구입해야하거나 열 또는 증기 소독 또는 70 % ETOH와 소독을해야합니다.
동물 실험 기관에 의해 규정된 동물 실험 절차와 규정에 대한 동물의 보호 및 사용에 관한 NIH의 지침에 따라, 유럽 커뮤니티 이사회 지침 (86/609/EEC)에 따라 수행다고 저자 상태 관리 및 뒤스부르크 - 에센 대학 (독일)에서위원회 (IACUC)를 사용합니다.
1 부 : 다른 발달 단계의 murine 눈 핵의 제거
배아 눈 핵의 제거
- 시간 임신 matings이 설정되고 질 플러그가 암컷의 교미에서 감지되는 하루 아침 회임 일 0 지정되어 있습니다.
- 그리고 왁스 보드 6 고정 : 태아의 발달이 원하는 단계 (배아 일 (E) 15 여기)에 도달하면 임신 여성은 자궁 전위에 의해 희생이다.
- 복벽은 정중선을 따라 잘라 피부 펄럭이 핀 6 옆으로 고정되고 70 % ETOH로 moistened있다.
- uterusses는 추위 PBS 6 분리 및 비커로 전학 복부에서 제거됩니다.
- 배아는 분리 배양 접시와 자궁 벽에 전송 및 배아 세포막은 포셉 6 사용하여 신중하게 제거됩니다.
- 배아는 잘린에 의해 살해됩니다.
- 눈은 눈 소켓에서 눈을 "필링", 괜찮아요, 곡선 집게를 사용해야 enucleated 수 있습니다.
출생 후의 성인 눈 핵의 제거
- 젊은 새끼가 자궁 전위에 의해 잘린, 나이 새끼 어른에게 살해됩니다.
- 최대 출생 후의 무대 P15로, 마우스는 그들의 눈을 열고 시점, 눈 가늘고 길게 찢어진는 기계 집게를 사용하여 열어 봄 가위로 눈 뚜껑 두 가로 삭감으로 확대해야합니다.
- 눈은 궤도에 압력을 적용, 곡선 집게의 도움으로 enucleated 있습니다.
참고 : 궤도 뼈가 아직 연골 아르 출생 후의 일 2로서, 그것은 눈을 제거하는 동안 너무 많은 압력을 적용하지 않는 것이 중요합니다.
대조적으로, 어른 생쥐에서 궤도 뼈가 회사입니다. 따라서 눈을 적출하다하기 위해서는 사전에 눈 가늘고 길게 찢어진 곳을 확대하지 않고 궤도에 압력을 적용하기에 충분합니다.
2 부 : 배아, 출생 후의 성인 murine 망막의 해부
망막의 해부
- 눈이 살균 PBS와 주변 눈 레이어가 해부 현미경 하에서 제거와 작은 페트리 접시에 배치됩니다.
- 시신경이 가능한 기초 가까운 포셉으로 스프링 가위 또는 슬쩍 해제의 도움에 의해 차단되어야 출생 후의 단계와 성인의 눈을, 외부 눈 레이어를 제거하려면 다음과 같이하십시오.
- 시신경 원래 살고 구멍과 뒷면 당신을 직면되도록 즉, 눈을 돌립니다. 시신경이 안구 레이어를 뚫고 사이트에서 두 미세 포셉의 도움말과 함께 망막 및 안료 상피 사이 subretinal 공간을 입력합니다.
참고 : 일반적으로 안료 상피 쉽게 그 어두운 색상으로 확인할 수 있습니다. 특히 흰둥이 동물 - - 일부 마우스 돌연변이 변종이 안료 레이어는하지만, 색상되지 않을 수 있으므로 탐지하기 쉽게되지 않을 수 있습니다. - 조심스럽게 두 집게로 양쪽으로 찢어하여 부착 막과 맥락막 공막엔와 안료 상피를 제거합니다.
- 다른 집게로 남아있는 망막 컵을 누른 상태, 최대 각막의 수준에 레이어에서 껍질 후, 렌즈쪽으로 눈을 컵을 돌려 및 안료 상피, 맥락막 막과 공막엔와 함께 각막을 제거합니다.
- 작은 렌즈와 함께 유리를 파악하고 집게로 찢어 동안 두 번째 포셉과 장소에서 망막 wholemount을 유지.
참고 : 배아 눈 해부하면, 완전히 유리와 함께 유리 몸 아래 삼각, 십t 같은 모세 신경 얼기를 제거할 수 있는지 확인하십시오.
어른 눈에는 유리체는 측면에서 파악해야하고 관리는 콘텐츠의 제거를 방해, 포셉에 점성과 채찍 그대로 포셉의 팁을하지 피어스 유리체로 이동합니다. - organotypic wholemount 문화 망막 컵 200 μl Dulbecco의 수정 독수리의 매체 (아래 참조)가 포함된 96 - 웰 플레이트에 수집하고 있습니다.
참고 : 각 망막의 해부 사이에, 문화 매체의 산도로 인큐베이터에있는 문화 매체를 포함하는 96 - 웰 플레이트 수집가 탄산염 시스템을 통해 CO 2에 의해 트리거됩니다 유지.
파트 3 : Murine organotypic 망막 wholemount문화
- 가중치 7.8g Dulbecco의 수정 이글 배지 / 영양 혼합 F - 12 햄 (DMEM)과 0.6g NAHCO 3 MiIliQ 물에 모두 용해하여 500 ML 문화를 준비합니다. 7.15로 산도를 조정합니다. 후드 아래와 2.5 ML gentamicine (200 ㎜), 50μl 나트륨 selenite (재고 : 52μg/ml), progesterone (60μg/ml 주식) : 50mg APO - transferin, 50μl putrescin (60mg/ml 주식)을 추가합니다. 믹스와 병 톱 필터를 통해 필터링합니다. 사용은 ML 문화 매체 당 10μl의 글루타민 (200 MM)을 추가 바로 앞.
참고 : 인슐린의 효과를 중화하지 않기 때문에이 혈청 및 인슐린없는 매체가 최대 2 주 4 ° C에서 저장하고 apoptosis 유도 실험에 사용할 수 있습니다. 24 시간 이상에 대한 wholemounts의 배양이 원하는되고 세포 사망 요금은 평가하지 않는 경우, 인슐린 혈청 (예 : 소태아 혈청, FCS)이나 보조 식품은 생존 속도를 개선하기 위해 추가되어야합니다. - 문화를 시작하기 전에, 망막 wholemounts은 37 15 분에 대한 사전 incubated 아르 ° M ller의 glia의 내부 및 외부 제한 막 들어있는 hyaluronidase를 미리 소화 0.5mg/ml hyaluronidase를 포함한 200 μl 따뜻하고, 산도 균형 DMEM과 C 전지, exogenously 적용 물질이 용이하게 침투.
- 망막은 2ml 화학적으로 정의 Dulbecco의 수정된 이글 매체 가능하고 organotypic wholemounts 같은 양식처럼 몇 hyaluronidase와 24 잘 판으로 전송됩니다.
참고 : 망막을 전송, 1ml 피펫을 사용하여 열기를 좀 더 넓혀 피펫 팁 몇 mm 잘라. 배아 눈을 들어, 200 μl 피펫 팁은 충분합니다. 절단 가장자리는 두 번째 피펫 팁의 삽입과 복잡 smoothened해야합니다.
24-48시 단기 문화, 모든 단계는 벤치에서 수행할 수 있지만, 문화의 오염 문제가 밝혀지면, 하나는 후드 아래에서 작동합니다. - 37 5 % CO 2 분위기 ° C에서 48 시간 및 재조합 요소와 약리 치료를 받게 예 - 문화가 24 유지됩니다.
4 부 : 양식 망막 wholemounts의 해리
- 원하는 문화 시간 후, 망막은 850 μl PBS 50 μl 소 혈청 albumine (; 30 MG / ML BSA)이있는 둥근 바닥과 2ml Eppendorf 튜브에 수집하고 있습니다.
- 37 가열 가열 블록 ° C.에 망막과 Eppendorf 튜브를 삽입
- 각 Eppendorf 튜브 25 μl collagenase (200 U / ML) 25 μl hyaluronidase (20mg/ml)을 추가하고 siliconized 파스퇴르 피펫을 통해 세 통과하여 단일 세포 현탁액에 망막 dissociating 시작합니다.
- 10 μl 트립신 (1mg/ml)를 추가, 3-5 분 기다렸다가 천천히 기계 조직을 떼어 놓다하는 siliconized 파스퇴르 피펫과 함께 아래로 3-5 시간을 피펫합니다.
- 10 μl DNase I (5mg/ml)를 추가, 다시 3-5 분 후 천천히 siliconized 파스퇴르 피펫과 함께 아래로 3-5 시간을 피펫하고 기다립니다.
참고 : 효소 분해에 대한 부화 시간은 눈 및 발달 단계의 크기에 각각 다양하고 따라 달라집니다. 부드럽게 위아래로 pipetting과로 조직의 효소 소화의 단계를 확인합니다. - 세포 현탁액 지금은 동질적인 것이 아니라 여전히 주요 셀 집계가 포함된 경우, 추가 10 μl 트립신, 10 μl DNase I.를 추가
- 세포 현탁액이 균질하면 조직의 소화가 10 μl EDTA (에틸렌 다이아 민 테트라 초산) (0.5 M)를 추가하여 중지, Eppendorf 튜브는 히터와 세포 suspensions에서 제거됩니다은 1ml 신선한 얼음 차가운 8 % paraformaldehyde를 추가하여 1 시간에 대한 해결됩니다 (PFA) 회전 통에 실온에서.
제 5 부 : dissociated 셀 suspensions의 워싱
- 세포 현탁액은 ° C와 0.2 RCF에서 냉각 원심 분리기 4에서 5 분 centrifuged입니다.
- 뜨는은 삭제되고 펠렛은 PBS 1ml 포함 3mg/ml BSA에 다시 일시 중지되었습니다.
- 두 번 세척이 단계를 반복 후 펠렛은 마침내 500 μl PBS 포함 3mg/ml BSA, 5mM EDTA (에틸렌 다이아 민 테트라 초산) 및 0.1 %의 나트륨 azide에 다시 일시 중지되었습니다.
참고 : 나트륨 산성의 추가 4에서 며칠 ° C.에 대한 세포 현탁액의 저장을 허용 그러나, immunocytochemical 얼룩이 따를 경우, 얼룩 품질의 손실이 결과로 resuspension 버퍼에 나트륨 산성를 추가하지 마십시오.
6 부 : 양적 apoptosis 및 확산 분석을위한 세포 suspensions의 Cytospin
- 하나 또는 두 개의 구멍과 cytospin 퍼널과 프로스트 - 엔드 현미경 슬라이드, cytospin 필터 cytospin 슬라이드 클립에 삽입됩니다. 슬라이드 클립 폐쇄하고 cytospin의 회전자에 위치합니다.
- dissociated 세포 현탁액은 부드럽게 위아래로 pipetting과로 균질입니다.
참고 : 망막의 발달 단계에 따라 분리 절차에서 세포 현탁액은해야 할 수도 있습니다세포의 셀 수있는 숫자를 얻기 위해 PBS에 희석 수 있습니다. - 세포 현탁액의 나누어지는 (100 μl)은 cytospin 퍼널에 적용됩니다.
참고 : 깔때기에 세포 현탁액을 pipetting 때 피펫의 끝은 깔때기의 바닥에있는 모든 방법을 아래에 도달해야합니다. 이것이 cytospin 후 셀 자리에서 확인할 수 있습니다 기포를 생성하고 세포 카운트를 초래할로 피펫의 두 번째 압력 지점을 통해 추진하지 않는 것이 중요합니다. - 세포 현탁액은 7 분 700 RPM에서 슬라이드에 발견됩니다.
- apoptosis 수준에 exogenously 적용 요인의 효과의 결정에 대한 세포는 4 물들일 수있다 ', 6 Diamidino - 2 - phenylindole은 (DAPI, 2μg/ml), 형광등 설치 매체 마운트. 세포 apoptosis의 변화는 cytospin 셀 장소에서 최소한 1,000 세포를 (적어도 10 pycnotic 핵 구성된) 계산과 세포 사망률이 전체 세포의 비율로 계산 3,4를 계산하여 결정하실 수 있습니다.
참고 : 또는, apoptotic 핵의 분포가 가열 치사 - 중재 dUTP 닉 엔드 라벨 (TUNEL)에서 교양 망막 wholemounts의 flatmounts 3 그라 이오 스탯 sections4으로 평가할 수 있습니다. - 세포 증식의 감지, BrDU는 (5 μm의) 문화와 BrdU의 정관의 끝나기 전에 6h가 방지 BrDU 항체 (예 : 발달 연구 브리 도마 은행, 아이오와, 미국)를 사용 immunocytochemical 염색법으로 세포 homogenates의 cytospins에 시각 추가할 수 있습니다.
- 다른 망막 세포 유형에 치료 효과가 Brn3a (신경절 세포 마커) 또는 옵신 (photoreceptor 마커)와 DAPI와 counterstaining 같은 신경 세포 특정 항체에 의해 cytospins에 시각하실 수 있습니다.
7 부 : 대표 결과
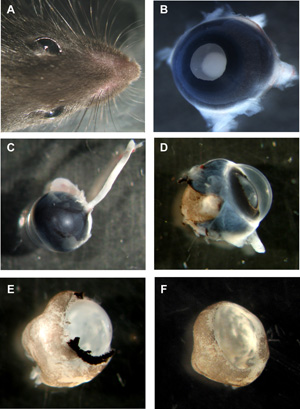
그림 1 : murine organotypic 망막 wholemounts의 준비 단계
와 두 눈으로 마우스의 머리.까지 렌즈 면을 B Murine 눈, 아직 장소에있는 모든 레이어. 시신경과 뒷면에서 C Murine 눈이 그대로. 공막엔 및 안료 상피 부분적으로 제거된 D Murine 눈이. E Murine 망막 각막, 공막엔 및 안료 상피 완전히 제거하지만, 여전히 자리에 렌즈와 유리가. 렌즈와 유리와 함께 F Murine 망막 wholemount 컵 삭제되었습니다. 하시기 바랍니다 여기를 클릭 그림 1의 더 큰 버전을 볼 수 있습니다.
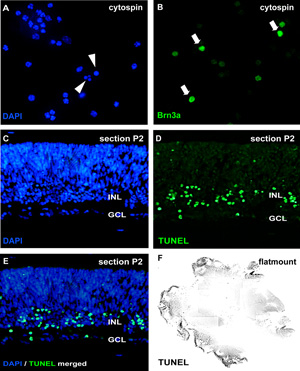
그림 2 : cytospin 및 섹션으로 organotypic 망막 wholemount 문화 분석
apoptosis의 분석을 위해, dissociated 세포 suspensions의 cytospins는 DAPI로 물들어 있고 pycnotic 핵은 (A의 화살촉) 핵 조각이나 염색질 응축에 의해 구분할 수 있습니다. 또는 wholemount 섹션 (CE, murine 망막 출생 후의 일 (P) 2) 또는 망막 flatmount (F)은 TUNEL 분석의 대상 및 DAPI (E)로 counterstained 수 있습니다. 다른 망막 세포 유형에 치료 효과는 신경절 세포 마커 Brn3a (B의 화살표)과 같은 신경 세포 특정 항체에 의해 cytospins에서 시각 수 GCL, 신경절 세포 레이어,. INL, 미래의 내면의 핵 계층. 하시기 바랍니다 여기를 클릭 그림 2의 더 큰 버전을 볼 수 있습니다.
토론
분리, monolayer 이상 murine organotypic 망막 wholemount 문화 2-5, retinospheroid하거나 다시 집계 3D 회전 타원체 문화의 연결 상호 작용 및 연결의 보존 1 거짓의 장점은 생체내 상황에을 흉내낸. 이전 보고서 2 비교, 우리의 비디오 문서는 망막을 손상시키지 않고 렌즈와 유리 신체의 제거를 포함하여 다양한 개발 단계의 망막의 murine 눈과 절개의 핵의 제거에있는 특성에 대한 ?...
감사의 말
저자는 기술 지원을 organotypic 문화와 미 Laub과 미 Gerster의 설립과 초기 도움 E. 드 라 로사와 AI Valenciano 감사하고 싶습니다.
자료
| Name | Company | Catalog Number | Comments | |
| Mice | Animal | Charles River Laboratories | ||
| Dissection microscope | Tool | Carl Zeiss, Inc. | ||
| PBS | Reagent | Sigma-Aldrich | PBS should be cold (> 4°C) and sterile | |
| Dulbecco`s modified eagle`s medium / nutrient mixture F-12 Ham | Reagent | Sigma-Aldrich | D 8900 | DMEM / F-12 |
| Apo-transferin | Reagent | Sigma-Aldrich | T 1147 | |
| Putrescin | Reagent | Sigma-Aldrich | P 5780 | |
| Sodium selenite | Reagent | Sigma-Aldrich | S 9133 | |
| Progesterone | Reagent | Sigma-Aldrich | P 6149 | |
| Gentamicine | Reagent | Invitrogen | ||
| L-Glutamine | Reagent | Invitrogen | 25030-024 | 200 mM (100X), liquid |
| Bovine serum albumine (BSA) | Reagent | Carl Roth Gmbh | 8076.3 | 30 mg/ml |
| Collagenase | Reagent | Sigma-Aldrich | C 0773 | 200 U/ml |
| Trypsin | Reagent | Sigma-Aldrich | T4799 | From porcine pancreas; 1 mg/ml |
| Hyaluronidase | Reagent | Sigma-Aldrich | H 3884 | 200 mg/ml |
| DNase I | Reagent | Roche Group | 1 284 932 | 10 mg/ml |
| EDTA | Reagent | Sigma-Aldrich | E 6511 | |
| Silicone solution | Reagent | SERVA Electrophoresis | 35130 | |
| Paraformaldehyde (PFA) | Reagent | Sigma-Aldrich | P6148 | 8% PFA in 0.1M phosphate buffer (pH 7.4). |
| 4’,6-diamidino-2-phenylindole dihydrochloride | Reagent | Sigma-Aldrich | D 0542 | DAPI |
| Fluorescent Mounting Medium | Reagent | Dako | S3023 | |
| BrDU | Reagent | Sigma-Aldrich | B 9285 | |
| 96-well plates | Tool | Falcon BD | 3072 | |
| 24-well plates | Tool | Falcon BD | 3047 | |
| Pasteur pipettes | Tool | Brand GmbH | 747720 | |
| Forceps DUMONT #5 | Tool | Fine Science Tools | 11252-30 | bevelled very fine shanks (0.05 mm x 0.02 mm tip) |
| Forceps DUMONT #7 | Tool | Fine Science Tools | 11271-30 | curved shanks (0.07 mm x 0.10 mm tip) |
| Spring scissors,straight, 8cm | Tool | Fine Science Tools | 15000-00 | fine, small straight blades |
| Standard scissors, straight, sharp/blunt | Tool | Fine Science Tools | 14007-14 | Use for decapitation or cervical dislocation |
| Eppendorf tubes | Tool | Eppendorf | 2ml; round bottom for better precipitation of pellet during centrifugation /cytospin | |
| Cooling centrifuge | Tool | Eppendorf | ||
| Rotation shaker | Tool | CAT | ||
| Cytospin | Tool | Thermo Fisher Scientific, Inc. |
참고문헌
- Rieke, M., Gottwald, E., Weibezahn, K. -. F., Layer, P. G. Tissue reconstruction in 3D-spheroids from rodent retina in a motion-free, bioreactor-based microstructure. Lab. Chip. 8, 2006-2213 (2008).
- Donovan, S. L., Dyer, M. A. Preparation and square wave electroporation of retinal explant cultures. Nature Protocols. 1, 2710-2718 (2006).
- Duenker, N., Valenciano, A. I., Franke, A., Hernandez-Sanchez, C., Dressel, R., Behrendt, M., de Pablo, F., Krieglstein, K., de la Rosa, E. J. Balance of pro-apoptotic transforming growth factor-beta and anti-apoptotic insulin effects in the control of cell death in the postnatal mouse retina. Eur. J. Neurosci. 22, 28-38 (2005).
- Franke, A. G., Gubbe, C., Beier, M., Duenker, N. Transforming growth factors beta and Bone morphogenetic proteins: Cooperative players in chick and murine programmed retinal cell death. J. Comp. Neurol. 495, 263-278 (2005).
- de la Rosa, E. J., Díaz, B., De Pablo, F. Organoculture of the chick embryonic neuroretina. Curr. Top. Dev. Biol. 36, 133-144 (1998).
- Dohle, D. S., Pasa, S. D., Gustmann, S., Laub, M., Wissler, J. H., Jennissen, H. P., Duenker, N. Chick ex ovo culture and ex ovo CAM assay: How it really works. J Vis Exp. 32, (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유