JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
라이브 영상 Drosophila melanogaster 배아 Hemocyte 마이 그 레이션
요약
Drosophila의 hemocytes은 개발 배아의 전체를 통해 분산. 이 프로토콜은 찬란 표시된 hemocytes와 배아를 사용하여 이러한 마이 그 레이션을 마운트 및 이미지하는 방법을 보여줍니다.
초록
사용하는 많은 연구 주소 셀 마이 그 레이션
프로토콜
준비
- hemocyte 특정 Gal4 드라이버 (예 : SRP - Gal4 2)와 UAS 통제 (예 : UAS - GFP)에서 유전자 인코딩 형광 기자를 포함하는 적절한 Drosophila 라인을 구합니다. SRP - Gal4, UAS - GMA 3 crq - Gal4, UAS - GFP 4, 5 homozygous 파리 이미징을 위해 (NB GMA가 moesin의 굴지 바인딩 도메인에 융합 GFP)을 특히 유용합니다;의 토론 아래 참조 Gal4 드라이버와 UAS의 범위가 (블루밍턴 증권 센터는 다양한 포함) 사용할 수 구성.
- 일반적으로 유전 십자가는 그러한 것을 돌연변이 대립 유전자가 Gal4 드라이버 및 대체 상동 염색체에서 실시 UAS 구조와 형광 balancers CTG TTG 또는 6을 사용 균형 아르 실시하고 있습니다. 이것은 가능한 CTG / TTG - 관련 GFP 형광 (이것이 단계에서 이루어집니다 2.11)의 부재에 기초하여 homozygous 돌연변를 선택할 수 있습니다.
- 사과 쥬스 한천 플레이트 7 누워있는 새장에 주식 및 장소 파리 증폭. 파리 충분 배아는 여유로운으로 시작하기 전에 누워있는 케이지에 순응하기 위해 최소한 이틀은 필요합니다. 일반적으로 각 성별 스무 파리 이미징 충분히 배아를 생성하기 위해 충분해야하지만, 그것은 다른 라인이 다산의 학위를 서로 다른 것을인지해야합니다. 우리는 공기 흐름을 허용하도록 바닥에 구멍을 플라스틱 비커의 바닥에 맞도록 55mm 페트리 요리를 사용합니다. 배아 모음의 정확한 의미는 중요하지만 타이밍이 배아를 개최 정확하게 수집하기 위해 중요합니다.
- 25 ° C 또는 초과 접시에서 유지 하룻밤 사과 쥬스 한천 플레이트에서 배아를 수집합니다. 후자의 경우 우리는 일반적으로 파리는 접시를 제거하고 이전 배아의 장착에 15~16시간 18 ° C에서 그것을 배치하기 전에 4 시간 동안 미리 예열 접시에 누워 수 있도록,이 늦게 단계 12을 통해 배아를 제공합니다 개발의 15 단계. 하룻밤 접시 단계의 큰 다양성을 포함하지만, 25 시간의 긴 기간으로 인해 hemocytes에서 형광 리포터 표현의 높은 수준의 장점을 제공 ° C의 Gal4 - UAS 시스템으로 온도를 구분합니다.
절차
- 물을 소량과 부드러운 밀고 페인트를 사용하여 사과 주스 한천 플레이트에서 배아를 이동시키다. Dislodged 태아는 육안으로 쉽게 볼 수 있습니다.
- 셀 스트레이너 (피셔) 또는 집에서 만든 폐수를 수집하는 비커를 통해 개최되는 바구니에 사과 쥬스 한천 플레이트에서 물을 붓는하여 바구니 7.하는 배아를 전송
- 당신이 당신이 사과 쥬스 한천 플레이트의 양도 충분 배아를 만족할 때까지 단계 2.2를 반복합니다.
- 물을 사용하여 셀 스트레이너 / 바구니에 배아를 씻으십시오.
- 플레이스 셀 스트레이너 / 사과 주스 한천 플레이트의 페트리 접시 뚜껑에 바구니와 셀 스트레이너 / 바구니에 배아를 중지할 정도로 깔끔한 표백제를 추가합니다.
- 브라이트 아래 해부 현미경에서 배아의 dechorionation를 따르십시오 dechorionation은 2 분 이내에 발생해야하는, 등의 부속 물에있을 때 완료됩니다.
- 표백제에서 셀 스트레이너 / 바구니 포함하는 배아를 제거하고 물을 사용하여 잔류 표백제를 씻어. 표백제의 모든 흔적은 2.8 단계로 진행하기 전에 제거되어야합니다. 잔류 표백제 파란색이 분홍색 / 흰색 표백 수가있다면 - 모든 표백제가 제거되었는지 여부를 평가하는 하나의 트릭은 파란 색 실험실 조직에 잔류 물을 떨어져 얼룩하는 것입니다.
- 셀 스트레이너 / 바구니의 아래쪽에 적용 실험실 조직 / mediwipes를 사용하여 남은 물을 내려 점이 되리.
- 페트리 접시 뚜껑에 물을 비말를 놓습니다. 고급 페인트로 배아 바구니에서 모든 dechorionated 배아를 수집하고 비말에서 그들을 resuspend. 다음 micropipette를 사용하여 물을 aspirating하거나 신중 실험실 조직 / mediwipes 그것을 흡수하여 배아를 건조.
- 배아가 건조되고 나면, 모든 배아를 충당하기 위해 voltalef 기름 한 방울을 추가합니다. 태아가 들어있는 비말에 인접한 기름의 두 번째 작은 방울을 넣어. NB 우리는 voltalef 기름의 영국 기반의 공급 업체를 찾을 수 없습니다되었습니다, 할로 카본 오일 700 (시그마)를 대신 사용할 수 있습니다.
- 형광 해부 현미경에서 적절하게 기름 비말에서 시계 포셉 한 쌍의 (5 번)를 사용하여 원하는 유전자형의 배아를 개최 선택합니다. 이 집게는 vitelline 막을 펑쳐링없이 배아를 쓸어 담은하기 위해 구부러진 안쪽 (그림 1)되어야합니다. 두 번째 석유 비말로 선정 배아를 전송합니다. 당신은 공촛점 현미경 (그림 2)에 좋은 이미지를 수집할 수하기 위해 해부 현미경에 형광 hemocytes을 볼 수있는 것이 중요합니다. 우리는 일반적으로 복부 정중선 또는 단계 15 배아에서 hemocytes의 이미지 측면 마이 그 레이션 단계 14분의 13 배아를 탑재합니다이미지 배아를 통해 분산에 따라 hemocytes의 운동성를.
- 그들 (그림 3) 사이에 약 1cm 떠나는 voltalef 오일 2 작은 방울을 사용하여 Petriperm / Lumox 요리 (Sarstedt)의 아래쪽 두 coverslips (18x18mm, 두께 1), 스틱, 이러한 이상 배치 coverslip을 지원하는 데 사용됩니다 배아은 너무으로 그들을 부수기 위해서는 없습니다. Petriperm 요리 (50mm 직경)는 소수성, 가스 투과 막가 포함되어 있습니다. 우리는 요리들이 (요리는 70 % 에탄올로 닦아하고 재사 용할 수 있습니다) 여러 번 사용되었습니다 일단 사용하기 쉽게 될 것을 압니다.
- 해부 현미경에서 브라이트에서 벤트 포셉 및 회선 그들에게 복부 측면을 함께 선택 태아에게 하나씩 픽업 및 병렬 coverslips의 가장자리 (그림 3). 당신의 손재주와 인내에 따라이 방법으로 15 배아까지 정렬하는 것이 가능합니다. 배아 및 Petriperm 요리 막 모두되기 쉽게 파열 수 있듯이 그것은 부드럽게 배아를 조작하는 것이 중요합니다.
- 일단 배아는 기름의 작은 방울을 추가하고 두 coverslips 사이에 동질적인 계층을 형성 확산하게 정렬됩니다. 기름 확산되면 (이것은 몇 분 정도 걸릴 수 있습니다) 배아가 여전히 복부쪽에 있는지 확인하십시오. 배아 조금 압연있다면, 포셉와 함께 그들을 다시 변경합니다.
- 마지막으로, 족집게 (번호 3) 장소 두 이전 준수 coverslips시 휴식 배아 통해 coverslip (18x18mm, 두께 1) 사용. 접착제 coverslip이 coverslip는 매니큐어를 (그림 3)를 사용하여 지원합니다.
- 공촛점 또는 넓은 분야 현미경을 장착 태아와 Petriperm 요리를 가지고 적절한 어댑터를 사용하여 무대에서 Petriperm 요리를 탑재합니다. 직립하거나 거꾸로 현미경은 coverslip (로 세포막을 통해 반대)을 통해 초점을 목적 렌즈와 함께 사용할 수 있습니다 어느.
대표 결과 :
이 프로토콜은 배아의 복부 측면에 hemocytes 라이브 영상에 대한 Drosophila의 배아를 탑재하는 방법에 대해 설명합니다. 제대로한다면 그것은 hemocytes의 스틸이나 영화 중 하나를 생성하기 쉬운 것입니다. 주요 결정자 이미지 hemocytes를 (특정 목적 렌즈)에 사용되는 현미경이지만, 구입한 이미지의 특성도 개발 단계에 따라 달라집니다, 온도는 배아가에서 제기되고 Gal4와 UAS 라인 사용되었습니다.
형광 단백질의 표현보다 높은 수준 hemocytes가보다 편리하게 몇 군데있을 수있게, 따라서 그것은 태아의 프로토콜 (그림 2로 찍은 배아 이내에 취소 hemocytes의 예제를 포함의 단계 2.11에있을 때 hemocytes를 볼 수 있도록 중요합니다 카메라)는 해부 현미경에 장착되어. Gal4와 UAS 구조의 따라서 증가 숫자는 큰 신호 대 잡음 비율을 설정합니다. 또한 이것은 차례로 hemocyte 동작을 가능하게 영상은 시간의 긴 기간 동안 따라야 높은 레이저 농도 또는 증가 노출 시간에 대한 필요성을 줄여줍니다.
GFP의 표현의 매우 높은 수준의 원형 세포 몸 (그림 4A - B)를 둘러싼 특히 얇은 시트 같은 lamellae을 hemocyte 형태의 세밀한 부분을 표시합니다. GFP를 제외 순환 지역 phagosomes를 (그림 4A - C) 나타냅니다. filopodia 같은 손가락도 lamellae (그림 4B)에서 새로운 모습을 볼 수 있습니다. 두 Gal4 드라이버가 하나 이상이 SRP - Gal4 특히 경우 (토론 참조) 이러한 프로세스 (그림 4C)을 볼 수있는 충분한 남아 있지만 공촛점 현미경에 느린 스캔 속도 이상의 레이저 전원이 필요할 수 있습니다. 표현의 수준 저하로 이미지 hemocytes의 라고나할까요를 더 어려워집니다, 그럼에도 불구하고 그것은 라고나할까요은 (그림 4D) 덜 명확한 경우에도 셀 몸이 분명 남아있는 이러한 조건 hemocytes의 마이 그 레이션을 추적 볼 수 있습니다.
개발의 초기 단계 (최대 13 단계)에서 hemocytes가 서로 가까이 접촉하는 마이 그 레이션하고 개별 세포를 구별하는 것이 어렵습니다. 무대의 말까지 13 hemocytes은 복부 정중선 (그림 5A) 아래 하나의 라인을 형성하고, 더 많은 운동성이있는지고, 복부 신경 코드 (그림 5B)의 가장자리에 옆으로 마이 그 레이션. hemocytes의 동적 라고나할까요 내에서 굴지의 cytoskeleton 직접 GMA (그림 5C) 또는 벚꽃 - moesin 표현을 통해 볼 수 있습니다.
이 방법으로 배아를 장착하면 가스 교환을 허용하고 탈수 방지와 태아가 가능한 다음 이미징 남아 있습니다. 배아는 배아 내용은 vitelline 막 통해 누출되므로 그것이 일반적으로 분명 설치하는 동안 손상된 경우. 배아는 다음 탈수 시작 않으면 이것은 종종 vitelline 막에 deformations하여 볼되어 있습니다. 가끔 배가 timelapse 영화의 과정 중에 롤 것입니다 그러나 이것은 더 이상 timescale 영화 문제가되는 경향이있다. LastlY는 한 번에 여러 배아를 장착하면 experimentalist들에게 실험을위한 완벽한 방향으로 배아를 얻는 최고의 기회를 제공합니다.

그림 1. dechorionated 배아의 조작을위한 포셉.
시계 포셉 (크기 번호 5)의 도움말은 패션을 위해 여기에 같이 배아를 치우도록 도구를 구부러진 안쪽에 있어야합니다. 그들이 소중히 배아를 수있는 더 날카로운 모서리를 가지고 있는것처럼 구부 러 지역의 외부 표면은 또한 Petriperm 막에 위치하면 배아를 조작하는 데 유용합니다.
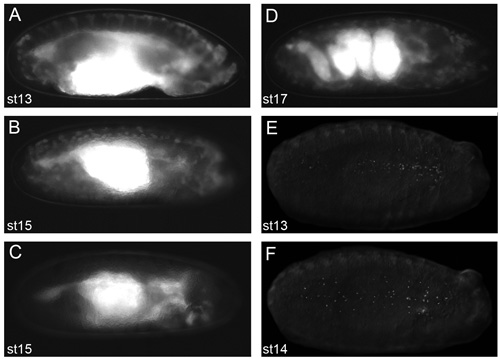
그림 2. 좋은 라이브 이미징 결과를 얻을 것입니다 배아 대표 이미지.
voltalef 기름에 dechorionated 배아 (프로토콜의 무대 2.11에서)의 이미지는 형광등 해부 현미경에서 찍은. crq - Gal4, UAS - GFP의 배아, 스테이지 13 (A) 무대 15 일 (B) SRP - Gal4, UAS - GFP의 측면 전망. 무대 15 SRP - Gal4, UAS - GFP / +의 래터럴보기, crq - Gal4, uas-GFP/uas-N17Rac의 배아는 (C)하는 hemocytes 때 hemocytes 생겼는지 보여주는 태아의 머리를 밖으로 마이 그 레이션 실패 자신의 철새 경로를 따라 명확하지 않습니다. 개발 (D)이 단계에서 창자의 뒤얽힌 구조를 보여주는 crq - Gal4, UAS - GFP의 배아,, 무대 17 SRP - Gal4, UAS - GFP의 측면 볼 근육 수축의 증상이없는 태아의 라이브 영상을 방지 개발 단계. 단계 13 (E) 무대 14 복부 전망 (F) SRP - Gal4, 찬란 표시된 핵 함께 hemocytes의 분산을 보여주는 UAS - 레드 스팅거의 배아. 프로토콜의 무대 2.11에서 형광에 의해 hemocytes 관찰 우수한 이미지를 얻을 수있는 조건이며 앞쪽에 모든 이미지에 대한 권리입니다.

그림 3. Petriperm / Lumox 접시에 배아의 장착.
두 18x18mm coverslips (두께 1) 그림과 같이 약 1cm로 구분하여 기름의 작은 방울을 사용하여 Petriperm 요리의 하단 얼굴에 붙어있다. 배아는 다음 coverslips의 가장자리에 긴 (앞쪽에 - 후부) 축 평행와 복부 쪽을 줄지어 기름의 작은 방울로 덮여있다. 일단 기름 세 번째 coverslip (18x18mm 두께 1) 부드럽게 해결해되는 배아를 방지하기 위해 다리로 두 이전 준수 coverslips를 사용하여 석유 적용 배아의 상단에 위치 두 coverslips 사이의 간격을 채우기 위해 보급하고 있습니다. 이 coverslip 그 다음 매니큐어의 두 작은 방울을 사용하여 두 coverslip 다리에 붙어있다. 일단 설정 배아는 coverslip (로 Petriperm 막 통해 반대)을 통해 아래로 집중 목적 렌즈 직립하거나 거꾸로 현미경에 몇 군데 있습니다.
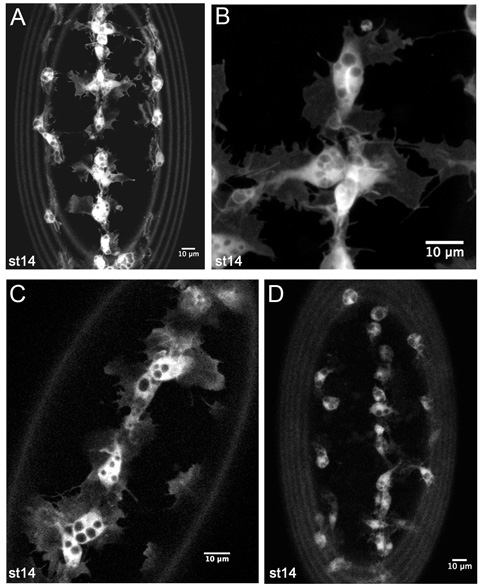
그림 4. GFP 분류 hemocytes의 라이브 영상에서 대표 발생합니다.
crq - Gal4, UAS - GFP의 배아 (AB), 무대 14 SRP - Gal4, UAS - GFP의 복부 측면에 hemocytes의 Z - 계획안. (A) timelapse 영화에 hemocyte 발달 마이 그 레이션을 모니터링하는 데 사용되는 같은 낮은 배율 이미지입니다. (B) 그들의 형태의 세밀한 부분을 보여주는, 배면의 정중선에서 hemocytes의 여전히 높은 배율입니다. (C) 무대 14 SRP - Gal4, UAS - GFP / +에서 복부 정중선에서 hemocytes의 단일 1m 슬라이스이며 crq - Gal4, UAS - GFP / + 배 (胚)가 공개되는 Gal4 드라이버와 UAS의 낮은 사본 번호 구조는 또한 좋은 이미지를 생성하기에 충분합니다. (D) 단계 14 crq - Gal4, UAS - GFP의 배아에서 hemocytes의 Z - 프로젝션을 표시합니다. 여기 hemocyte 라고나할까요 인해 GFP 낮은 표현 적은 분명 있지만 그것은 영화를 만들어 Gal4 드라이버와 UAS의 조합 구조와 hemocyte 마이 그 레이션을 추적 볼 수 있습니다. 이미지 Leica LSM510 공촛점 현미경에서 찍은 사진, 앞쪽에 모든 이미지에서이며 이미지의 주변에있는 반지는 vitelline 막 autofluorescence로 인해 발생합니다.

그림 5. GMA 표현 hemocytes의 라이브 영상에서 대표 발생합니다.
복부 단계 13 정중선 (A) 무대 14 hemocytes의 Z - 계획안 (B) SRP - Gal4, UAS - GMA의 배아는 hemocytes의 발달 마이 그 레이션을 보여주 timelapse 영화에서 가져온. 굴지 역학에 대한 자세한 정보는 GMA 표현 hemocytes (C)보다 높은 배율 영상으로 얻을 수 있습니다. GMA는 moesin 및 라벨 굴지의 필라멘트의 굴지 바인딩 도메인에 융합 GFP로 구성되어 있습니다. 앞의 모든 이미지에서이며 이미지가 공촛점 현미경에서 찍은.
토론
이 절차의 가장 중요한 요소는 명확하게 표시된 hemocytes과 건강한 태아의 선택이며, 그들을 손상하지 않고 신중하게 그들을 마운트합니다. 배아는 할로 카본 오일에 일단 그들이 탈수에 강한 있으며, 한번 장착은 몇 시간 동안 몇 군데하실 수 있습니다. 우리의 손에 우리는 40X 목적으로 매 삼분의 자이스 혈구 LSM510 공촛점 현미경에 이미지의 Z - 스택을 복용 배아 또는 사진 손상 분명 무시할 수 탈?...
감사의 말
이 프로토콜은 폴 마틴과 안토니오 하신토의 연구소와 시간 및 공동 작업을 통해 우리의 개발되었습니다. 우리는 플라이 라인을 공유하는 지속에 대한 훌륭한 서비스와 Drosophila 커뮤니티에 대한 블루밍턴 주식 센터 주셔서 감사합니다. BS는 현재 BBSRC 프로젝트 부여하여 자금이다. WW는 웰컴 트러스트 경력 개발 원정대에 의해 후원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| Cell strainer | BD Biosciences | 352350 | 70μm pores |
| Halcarbon oil 700 | Sigma-Aldrich | H8898 | |
| Lumox/Petriperm dish | Sarstedt Ltd | 96077305 |
참고문헌
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Bruckner, K. The PDGF/VEGF receptor controls blood cell survival in Drosophila. Dev Cell. 7, 73-84 (2004).
- Dutta, D., Bloor, J. W., Ruiz-Gomez, M., VijayRaghavan, K., Kiehart, D. P. Real-time imaging of morphogenetic movements in Drosophila using Gal4-UAS-driven expression of GFP fused to the actin-binding domain of moesin. Genesis. 34, 146-151 (2002).
- Stramer, B. Live imaging of wound inflammation in Drosophila embryos reveals key roles for small GTPases during in vivo cell migration. J Cell Biol. 168, 567-573 (2005).
- Wood, W., Jacinto, A. Drosophila melanogaster embryonic haemocytes: masters of multitasking. Nat Rev Mol Cell Biol. 8, 542-551 (2007).
- Halfon, M. S. New fluorescent protein reporters for use with the Drosophila Gal4 expression system and for vital detection of balancer chromosomes. Genesis. 34, 135-138 (2002).
- Sullivan, W., Ashburner, M., Hawley, R. S. . Drosophila protocols. , (2000).
- Tepass, U., Fessler, L. I., Aziz, A., Hartenstein, V. Embryonic origin of hemocytes and their relationship to cell death in Drosophila. Development. 120, 1829-1837 (1994).
- Millard, T. H., Martin, P. Dynamic analysis of filopodial interactions during the zippering phase of Drosophila dorsal closure. Development. 135, 621-626 (2008).
- Doerflinger, H., Benton, R., Shulman, J. M., St Johnston, D. The role of PAR-1 in regulating the polarised microtubule cytoskeleton in the Drosophila follicular epithelium. Development. 130, 3965-3975 (2003).
- Olofsson, B., Page, D. T. Condensation of the central nervous system in embryonic Drosophila is inhibited by blocking hemocyte migration or neural activity. Dev Biol. 279, 233-243 (2005).
- Paladi, M., Tepass, U. Function of Rho GTPases in embryonic blood cell migration in Drosophila. J Cell Sci. 117, 6313-6326 (2004).
- Vlisidou, I. Drosophila embryos as model systems for monitoring bacterial infection in real time. PLoS Pathog. 5, e1000518-e1000518 (2009).
- Jacinto, A. Dynamic actin-based epithelial adhesion and cell matching during Drosophila dorsal closure. Curr Biol. 10, 1420-1426 (2000).
- Wood, W., Jacinto, A. Imaging cell movement during dorsal closure in Drosophila embryos. Methods Mol Biol. 294, 203-210 (2005).
- Kunwar, P. S. Tre1 GPCR initiates germ cell transepithelial migration by regulating Drosophila melanogaster E-cadherin. J Cell Biol. 183, 157-168 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유