JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Adeno - 관련 바이러스성 벡터의 Intracranial 분사
요약
여기서 우리는 시각 피질의 뉴런과 glia의 형광 라벨에 대한 AAV 벡터의 intracranial 주사를 제시한다.
초록
형광 단백질을 표현할 수 있도록 설계 바이러스 벡터의 Intracranial 주사는 생체내 및 뇌 부분에서 모두 서로 다른 뇌 영역의 세포의 특정 하위 집합의 시각화를위한 다양한 분류 방법입니다. 형광 염료의 주입과는 달리, 바이러스 라벨 개별 세포 유형의 대상으로 제공하며, 유전자 변형 마우스 라인을 설정하는 것보다 소비 저렴하고 시간입니다. 이 기법에서는, adeno - 관련 바이러스 (AAV) 벡터는 intracranially 주변 조직에 피해를 최소화하여 원하는 지역 stereotaxic 좌표, micropipette와 AAV의 정확한 배달을 위해 자동 펌프를 사용하여 주입합니다. 사출 매개 변수가 주입의 주입, 주입 위치, 분사의 볼륨, 속도, AAV 혈청형 및 유전자 발현을 구동 모터에있는 동물 연령을 조정하여 각각의 실험에 맞출 수 있습니다. 선택한 조건에 따라 virally 유발 transgene 표현은 아래로 돌기 쪽이 수준으로 세포, 개별 셀 또는 미세 세포 프로세스 그룹의 시각화를 허용할 수 있습니다. 여기에 표시된 실험은 마우스 기본 시각 피질의 뉴런과 glia의 라벨에 대한 녹색 형광 단백질을 표현하는 이중 좌초 AAV의 주사를 묘사.
프로토콜
1. 바이러스 처리 및 저장
- 적절한 보호와 처리 기술을 사용하는 바이러스의 biosafety 레벨에 따라 선택하여야한다. 이러한 관행은 CDC 웹사이트에서 사용 가능한 미생물 및 바이오 메디컬 연구소 5 일 버전에 Biosafety에서 찾을 수 있습니다
( http://www.cdc.gov/od/OHS/biosfty/bmbl5/bmbl5toc.htm ). AAV 벡터의 사용은 Biosafety 레벨 1 (BSL - 1)에 대한 승인. 바이러스를 다룰 때 실험을 여기에 표시된 들어, 실험 복과 장갑은 BSL - 1 에이전트를 처리하기위한 절차에 따라 착용한다. - 바이러스의 활동을 유지하기 위해서는 반복 동결 융해를 피하기 위해 작은 aliquots로 나누어하는 것이 최선입니다.
- 불필요한 개체의 BSC를 지우고 70 % EtOH로 표면을 살균하여 바이러스를 aliquoting위한 Biosafety 내각 (BSC) 클래스 II를 준비합니다. AAV - 오염된 폐기물을 수집하기 위해 후드의 10 % 표백제 솔루션을 포함하는 비커를 놓습니다. 또한 무균 0.5mL 튜브와 드라이 아이스의 컨테이너가있는 BSC에 배치.
- BSC 외부 얼음에 바이러스 재고를 녹여.
- 소용돌이 바이러스와 BSC 내부 튜브를 엽니다.
- 0.5mL 튜브에 원하는 나누어지는 볼륨 (예 : 5 μL)를 피펫, 튜브를 닫고하는 드라이 아이스에 배치 바이러스를 플래시 동결.
- 모든 바이러스가 aliquoted되면, 바이러스 튜브와 10 %의 표백제가 들어있는 폐기물 용기에 피펫 팁 처분.
- 후드에서 폐기물 컨테이너를 제거하고 추가로 10 % 표백제를 추가한 다음 싱크대 아래 표백제를 부어. 귀하의 연구소의 biosafety 임원의 지시에 따라 생물 학적 용기에 플라스틱 폐기물의 배출.
- 10 % 표백제로 바이러스와 접촉에 와서 어떤 장비 또는 표면을 청소하십시오. 장갑을 폐기하십시오.
- -80 ° C의 냉동고에 저장 aliquots.
2. 외과
- 흡수 실험실 벤치 종이로 수술 영역을 커버. 수술 도구는 귀하의 기관의 biosafety과 동물 사용 지침에 따라 무균 조건 하에서 살균 및 수술이 완료되어야합니다.
- 바이러스와 micropipettes 로딩에 전념하게 될 외과 지역에 인접한 지역을 선택하고, 흡수 실험실 벤치 종이로 커버. 이 분야에 얼음 용기에 바이러스 나누어지는를 삽입하고, 수술이 수행되고 있기 때문입니다이 바이러스가 얼음위에 해동 수 있습니다.
- 바이러스에 접촉되는 피펫 팁 등의 처분을위한 전용 바이러스 처리 영역에서 10 % 표백제의 폐기물 컨테이너를 설치합니다.
- 약 20 미크론의 팁 직경에 유리 Wiretrol의 micropipette을 당기세요. micropipette의 뭉툭한 끝에 광유의 작은 방울을 놓고 micropipettes와 함께 제공된 와이어 플런저를 삽입합니다.
- micropump 팔 클램프의 micropipette를 확보.
- 0.5 MG / kg의 투여에 buprenorphine와 subcutaneously 마우스를 주사. 200 MG / kg의 투여와 함께 intraperitoneal 주사를 통해 Avertin와 마우스를 마취하고 절개를 입력부터 머리카락을 방지하기 위해 충분히 큰 여백을 떠나 확인하고, 수술 가위로 머리의 상단에서 머리를 제거합니다.
- 37 수술에 걸쳐 ° C의 체온을 유지하고 stereotax에 마우스를 확보 stereotax의 기본에 난방 담요를 연결합니다.
- 에탄올과 지역을 소독하기 위해 betadine 세 교대 스크럽으로 머리를 목욕.
- 수술 중에 눈을 촉촉한 유지하는 눈은 Tobradex 아이 연고의 드롭 놓습니다.
- 머리의 정중선 아래 절개를하고 두개골을 노출로 피부를 당기십시오.
- 조심스럽게 세부적으로 밀고 집게를 사용하여 두개골에서 근막을 제거하십시오.
- stereotaxic 좌표를 사용하여 주입하는 지역을 찾아 수술 볼펜으로 두개골을 표시합니다.
- 여러 세그먼트로 thinned 영역을 나누어, 두개골의 균열까지 직경의 두개골 약 2mm의 1.4mm 버, 얇은 지역과 치과 드릴을 사용합니다.
- 이 절차를 통해, 멸균 생리의 응용 프로그램과 두개골이 촉촉한 유지.
- 부드럽게 추가 - 좋아 밀고 집게를 사용하여 thinned 두개골 세그먼트를 제거하여 craniotomy을 수행합니다.
3. 사출 준비
- 뚜껑 위에 위치 KimWipe으로 parafilm의 작은 조각에 바이러스의 바이러스 및 피펫 1.5uL (1uL 주사)의 튜브를 엽니다.
- 바이러스 주식에 micropipette의 팁을 놓고 수동으로 플런저를 철회. 어려움이 micropipette에 바이러스 주식을 그리는 경험하는 경우, 끝 부분이 약간 유리의 일부를 깰 수있는 micropipette과 KimWipe을 피어싱 수 확대하실 수 있습니다.
- 바이러스의 소량 때까지 플런저로 로우어 micropump 암은 micropipette의 일각에서 무너 뜨 리신 것입니다. 와스트에서 면화 팁 작은 주걱 및 폐기 작은 주걱이 작은 방울을 제거E 컨테이너.
- micropipette이 두뇌에 넣어 져서으로 막히는 것을 방지하기 위해 micropipette의 끝부분에 미네랄 오일 한 방울을 적용합니다.
4. 바이러스 사출
- X와 Y 좌표 stereotaxic을 사용하여 주입하는 영역 micropipette 위치를. 본 실험에서는 stereotaxic은 정중선을 가로 2.7mm bregma에 후부와 2.5mm 아르 기본 시각 피질의 위치를 사용하는 좌표. 아주 천천히 적절한 Z의 위치로 micropipette을 (1mm/1minute의 대략적인 비율) 낮아집니다.
- SYS Micro4 micropump 컨트롤러 상자에 원하는 사출 매개 변수를 입력하고 주사를 시작합니다. 본 실험에서는 10 분 이상 1 microliter는 주입의 속도로 사용됩니다.
- 주입이 완료되면 제거하는 동안 바이러스의 유출을 방지에 한 2 분 동안 휴식을 피펫을 두십시오. 이 기간 후에, 아주 천천히 두뇌 (위의 동일 요금)에서 micropipette를 제거합니다.
- 두피를 봉합하고 조직 접착제로 밀봉. 72 시간 동안 0.1 MG / kg 모든 8~12시간의 복용에 buprenorphine와 subcutaneously 동물을 주사하거나, 한 동물로 고통의 흔적을 전시하고있다. 그것이 ambulating 및 케이지로 돌아 준비가 될 때까지 동물이 가열 램프에 따라 복구할 수 있습니다. 이미징 실험은 원하는 배양 시간 (바이러스 주입 후 주 일) 이후에 시작하실 수 있습니다.
5. 대청소
- 10 % 표백제로 micropipette를 씻어 샵스 컨테이너에서 삭제.
- 제 1과 같은 방식으로 폐기물 컨테이너 처리.
- 생물 학적 bin에 실험실 벤치 종이를 버리고 10 % 표백제와 바이러스에 접촉 할 수도 있습니다 모든 표면과 악기를 닦으십시오.
- 사용하지 않는 바이러스는 반복 동결 / 해동 사이클이 바이러스 저하의 원인이 점을 유념해 다시 냉동 수 있습니다.
6. 대표 결과
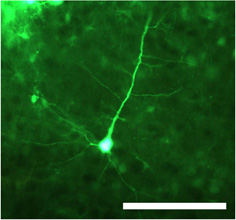
그림 1. CMV promotor의 통제하에 녹색 형광 단백질 (GFP)을 들고 두 번 좌초 adeno - 관련 바이러스 혈청형 1 (dsAAV S1)의 주사 후 신경 세포를 Transduced. 전지 본체뿐만 아니라 근위 및 말초 dendrites 고정 섹션에서 분명히 볼 수있는가 epifluorescent 현미경을 사용하여 몇 군데. 스케일 바 = 100 μm의.
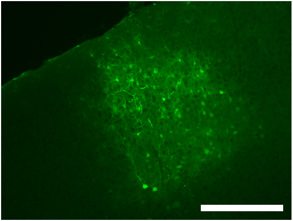
그림 2. 바이러스 확산의 범위뿐만 아니라 표시 뉴런, glia 및 프로세스를 보여주는 dsAAV의 S1을 사용하여 기본 시각 피질에 intracranial 바이러스 주입의 전형적인 라벨링. 스케일 바 = 250 μm의.
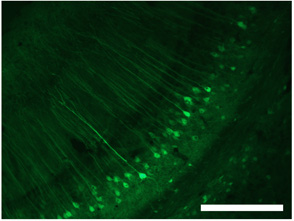
그림 3. dsAAV의 S1을 사용하는 해마의 세포의 라벨링. 스케일 바 = 250 μm의. 이러한 수치는 어리 외에서 조정됩니다. 2009 1
토론
Virally - 중재 유전자 전달은 신경 프로세스와 뇌 장애 1,2,3 치료 연구를위한 잠재력을 보유하고 있습니다. 이 기법의 가장 큰 융통성도 찬란 체외 및 생체내 4 두 이미징을위한 세포를 라벨에 악용될 수 있습니다. 여기 우리는 뉴런과 향상된 녹색 형광 단백질을 표현하는 이중 좌초 adeno - 협회 바이러스를 사용하여 마우스를 시각 피질에 glia의 도입에 대한 자세한 절차를 설?...
공개
감사의 말
이 작품은 NIH (EY012977), 버로우즈 웰컴 기금, 화이트홀 재단과 슬로언 재단 (AKM)에서 의생명 과학의 경력 수상의 부여에 의해 가능하게되었다.
자료
| Name | Company | Catalog Number | Comments |
| St–lting Mouse and Neonatal Rat Adaptor | Stoelting Co. | 51625 | Regular stereotax for securing animals for surgery may be substituted |
| Extra Fine Bonn Scissors, 8.5cm, straight tip, cutting edge 13mm | Fine Science Tools | 14084-08 | |
| Eye Dressing Forceps, 10cm, tip width 0.5mm, curved | Fine Science Tools | 11152-10 | |
| Dumont #5/45 Forceps- Dumoxel Standard Tip, 11cm, angled | Fine Science Tools | 11251-35 | Extra-fine tipped forceps for performing craniotomy |
| Standard Pattern Forceps, straight, 2.5mmx1.35mmtip, 12cm | Fine Science Tools | 11000-12 | |
| Microtorque Control Box and Tech2000 handpiece | Ram Products, Inc. | TECH2000ON/OFF | Dental drill |
| Micro Drill Stainless Steel Burrs 1.4mm tip diameter | Fine Science Tools | 19008-14 | |
| Wiretrol micropipettes, to deliver 1-5 Ul | VWR international | 5-000-1001 or 53480-287 | |
| Mineral oil | VWR international | 29447-338 | |
| Manual Micromanipulator and Tilting Base (right-handed) | World Precision Instruments, Inc. | M3301-M3-R | Used for determining stereotaxic co-ordinates |
| UltraMicroPump (UMP3) (one) with SYS-Micro4 Controller | World Precision Instruments, Inc. | UMP3-1 | |
| Sutures | VWR international | 95056-952 | |
| P-97 Flaming/Brown Micropipette Puller | Sutter Instrument Co. | P-97 | |
| Tobradex | Available from your institution’s veterinary services |
참고문헌
- Kaplitt, M. G., Leone, P., Samulski, R. J., Xiao, X., Pfaff, D. W., O'Malley, K. L., During, M. J. Long-term gene expression and phenotypic correction using adeno-associated virus vectors in the mammalian brain. Nat Genet. 8, 148-154 (1994).
- Harding, T. C., Dickinson, P. J., Roberts, B. N., Yendluri, S., Gonzalez-Edick, M., Lecouteur, R. A., Jooss, K. U. Enhanced gene transfer efficiency in the murine striatum and an orthotopic glioblastoma tumor model, using AAV-7- and AAV-8-pseudotyped vectors. Hum Gene Ther. 17, 807-820 (2006).
- Lo, W. D., Qu, G., Sferra, T. J., Clark, R., Chen, R., Johnson, P. R. Adeno-associated virus-mediated gene transfer to the brain: duration and modulation of expression. Hum Gene Ther. 10, 201-213 (1999).
- Lowery, R. L., Zhang, Y., Kelly, E. A., Lamantia, C. E., Harvey, B. K., Majewska, A. K. Rapid long-term labeling of cells in the developing and adult rodent visual cortex using double-stranded adeno-associated viral vectors. Dev Neurobiol. 69, 674-688 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유