JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
인간 조혈 세포 콜로니 형성 세포 (CFC) 어세이
요약
셀 (CFC) 분석을 형성 식민지는 조혈 progenitors은 세미 솔리드 매체 식민지를 형성하는에서 시험 관내 분석이다. 콜로니 형태, 세포 형태학 및 유동세포계측법의 조합은 다른 조혈 lineages 따라 분아 따위에 의해 번식하고 차별 progenitors의 능력을 평가하는 데 사용됩니다.
초록
인간 조혈 줄기 / 전구 세포는 보통 골수, 코드 혈액, 또는 주변 혈액에서 얻은 있으며, 조혈 및 leukemogenesis을 연구하는 데 사용됩니다. 그들은 림프 및 골수양 lineages로 차별화하는 능력이 있습니다. 셀 (CFC) 분석을 형성 식민지는 semisolid 매체 식민지를 형성하는 능력에 의해 증식 및 조혈 progenitors의 차별 패턴을 연구하는 데 사용됩니다. 입력 세포의 고정 숫자에 의해 형성된 콜로니의 숫자와 형태 차별 progenitors의 능력에 대한 사전 정보를 제공하고 세포 분열 따위에 의해 번식. 전지는 더욱 자신의 번호와 유동세포계측법 및 Giemsa 묻은 슬라이드 morphologic 평가를 사용하여 차별 상태를 평가하기 위해 각각의 식민지에서 또는 전체 접시에서 수확 수 있습니다. 이 분석은 골수양하지만 림프하지 차별을 평가하는 데 유용합니다. 이 맥락에서 용어 골수양는 granulocytic, monocytic erythroid 및 megakaryocytic lineages을 포괄하기 위해 넓은 의미에서 사용됩니다.
우리는 주변 혈액에서 파생 기본 인간의 CD34 + 세포의 분화에 oncogenes의 효과를 평가하기 위해이 분석을 사용했습니다. 이러한 목적 세포에 대한이 사건 NUP98 - HOXA9에서, 제어 retroviral 구조 또는 관심의 oncogene을 표현하는 구성 하나와 transduced 있습니다. 우리는 관심과 GFP 표지의 유전자를 생산하는 bicistronic mRNA를 표현 일반적으로 사용되는 retroviral 벡터, MSCV - IRES - GFP를 사용합니다. 세포 retroviral 전달하기 전에 이틀 동안 크린 시토킨의 면전에서 성장하여 미리 활성화됩니다. 또 이틀 뒤에는, GFP + 세포는 형광 활성화된 셀 정렬 (외과)에 의해 격리되며 크린 시토킨로 보충하고 식민지는 일반적으로 표면을 14 일에 나타날 때까지 incubated 메틸 셀룰로오스 함유 semisolid 매체와 혼합. 식민지의 개수와 형태가 설명되어 있습니다. 세포는 다음 접시에서 제거 씻어, 계산 및 유동세포계측법 및 morphologic 심사를 받게됩니다. 조혈 동안 표현 세포 표면 마커 특정 항체와 유동세포계측법는 가계와 성숙 단계에 대한 정보를 제공합니다. 라이트 - Giemsa의 얼룩 후 현미경으로 각각의 세포의 형태학의 연구는 혈통과 성숙에 관한 자세한 정보를 제공합니다. 세포의 비교 oncogene 조혈 차별에 oncogene의 효과를 밝혀와 transduced들에게 빈 벡터 제어와 transduced.
프로토콜
1. 시약의 준비
- FMS 관련 티로신 키나제 3 멸균 1000x 재고 솔루션 준비 (를 편명 - 3) 리간드, 대식 세포 / 과립구 콜로니 - 자극 인터루킨 (IL) -3 인자 (GM - CSF), 줄기 세포 인자 (SCF), thrombopoietin (TPO), 및 IL - 6 제조 업체의 지시에 따라. 무균 Retronectin 주식 솔루션 (1mg/ml)도 제조 업체의 지시에 따라 준비. 작은 aliquots하여 해당 주식 솔루션을 나누어 반복 동결 - 해동을 피하기 위해 -20 ° C에서 보관.
- IMDM에 2% FBS를 준비합니다.
- 최종 20% FBS의 농도, 2 MM의 글루타민, 100 단위 / ML 페니실린 / 스트렙토 마이신 (PS) 완벽한 IMDM 매체를 준비합니다. 바로 사용하기 전에 다음과 같은 크린 시토킨 추가 : 100 NG / ML 편명 - 3 리간드, 20 NG / ML GM - CSF, 100 NG / ML SCF, 100 NG / ML TPO, 50 NG / ML IL - 3, 100 NG / ML IL - 6.
- HBSS의 1 % BSA (페놀 레드없이 칼슘 및 MG - 무료) 및 D - PBS (CA & MG 무료)에서 2 % BSA를 준비합니다. 4 0.22 μm의 주사기 필터 및 매장 ° C. 통과하여 솔루션을 소독
- 4 HBSS와 저장소에 0.02 % EDTA (에틸렌 다이아 민 테트라 초산)을 준비 ° C.
- -80에서 aliquots에 대한 관심과 저장소의 DNA ° C. 인코딩 GaLV - pseudotyped 레트로 바이러스 준비 이 절차는이 문서의 범위 밖이지만, (1-3) 다른 설명되어 있습니다.
Giemsa의 스테 이닝을위한
- 그냥 사용하기 전에 깨끗한 유리병에 1 μm의 여과지를 통해 두 번 라이트 / Giemsa 얼룩 솔루션을 필터링합니다.
- 지오다노 공식 - 즉시 사용하기 전에 필터링 라이트 / Giemsa 얼룩 솔루션과 인산염 버퍼 솔루션, 산도 6.4 200 ML 50 ML을 혼합하여 라이트 / Giemsa 버퍼 산도 6.4 준비합니다.
- 3.5 LH 2 O.에서 KH 2 PO 27.3 g 4 나 2 HPO 4 4.62 g을 용해하여 인산 버퍼 용액, pH를 6.0 준비
- H 2 O.에서 50 %의 메탄올을 준비
2. 절차
해동 및 CD34의 사전 활성화 + 세포
- 37 신속하게 냉동 CD34 + 세포의 병을 해동 ° C 부드럽게 마지막 작은 얼음 결정이 남아 때까지 떨고 50 ML 원뿔 튜브에 세포 현탁액 (1 ML)를 송금. 부드럽게 실온 1 ML와 유리병에서 남아있는 세포를 씻어 2% FBS / IMDM하고 부드럽게 소용돌이 치는 동안 50 ML 튜브 드롭 현명한를 추가합니다. 3 분만 기다. 다음, 천천히 부드럽게 혼합하면서 2% FBS / IMDM 2 ML을 추가하고, 3 분 기다리십시오. 최종 볼륨 32 ML에 도달할 때까지, FBS / IMDM 그 3 분 간격으로 희석 세포 현탁액과 같은 볼륨 2 % 추가 추가 사이에 부드럽게 소용돌이에 의해 절차를 반복합니다.
- 실온에서 10 분 250 XG에 원심 분리기와 0.5 주변 ML 뒤에 떠나는 뜨는을 제거합니다.
- 20 ML 2퍼센트 FBS / IMDM에 정지하고 실온에서 팔분 200 XG에 centrifuging하여 펠렛을 씻으십시오.
- 뜨는을 제거하고 약 0.5 X 10 6 세포 / ML에서 전체 IMDM 매체에있는 세포를 일시 중지합니다. Trypan 파랑 솔루션의 같은 볼륨 (0.4 %)와 microtube, 혼합에 세포 현탁액의 10 μl를 타고 hemocytometer를 사용하여 계산합니다.
- (1.3 참조) 크린 시토킨와 보충 전체 IMDM 미디어를 추가하여 0.1-0.15 X 10 6 세포 / ML로 세포를 희석
- 문화 2 일 5 % CO 2 humidified 37 ° C 배양기에서 세포.
바이러스 사전로드하여 Retroviral 전달
- 형질 도입의 날, 준비하는 우물의 수를 결정하는 preloading 바이러스를 시작하기 전에 세포를 계산합니다.
- 25 μg / ML에 Retronectin 재고 솔루션을 희석하고 24 잘되지 않은 대우 조직 문화 판의 각 잘 ~ 400 μl를 추가합니다. 사전 코팅으로 층류 흐름 biosafety 후드에 실온에서 2 시간 동안 부화.
- Retronectin 솔루션을 제거하고 각 잘하는 D - PBS의 2 % BSA 400 μl를 추가합니다. 실온에서 30 분 알을 품다.
- 바이러스 주식 솔루션을 녹여 얼음 계속. BSA 솔루션을 제거하기 위해 각 물론 바이러스 준비 0.5 ML를 추가하고 4 2200 XG에서 원심 분리기 ° C 15 분.
- 우물에서 바이러스 솔루션을 제거하고 2.10보다 세 번에 설명되어있는 바이러스 로딩을 반복합니다.
- 추운 0.5 ML HBSS (+ 칼슘 & MG) 또는 IMDM 각 잘 린스.
- 상온에서 팔분 200 XG에 centrifuging하여 미리 활성화 CD34 + 세포를 수집합니다.
- 크린 시토킨 완벽한 IMDM 매체에서 1.5 ML 당 0.1-0.15 X 10 6 세포에서 세포를 Resuspend.
- 각 물론 1.5 ML의 세포 현탁액을 추가하고 2 일간 5 % CO 2 humidified 37 ° C 배양기에서 알을 품다.
의 세포 분류와 컬렉션은 세포를 transduced
- 부드럽게하지만 철저하게 바이러스 로드된 판 위에있는 세포를 일시 중지원뿔 관에 50 μm의 CellTrics 전지 필터를 통해 S 및 필터. Trypan 파랑 솔루션의 동일한 볼륨 microtube, 혼합에 세포 현탁액의 10 μl를 타고 hemocytometer를 사용하여 계산합니다. 감기 0.02 % EDTA (에틸렌 다이아 민 테트라 초산) / HBSS (페놀 레드없이 칼슘 및 MG - 무료)의 0.8 ML 각 잘 씻어 50 μm의 CellTrics 전지 필터를 통해 동일한 수집 관에 추가할 수 있습니다.
- 4 팔분 ° C 200 XG에서 세포를 원심 분리기, 4 8 분 200 XG에 centrifuging하여 추위 HBSS와 펠렛을 (페놀 레드없이 칼슘 및 MG - 무료) 씻어 ° C.
- BSA / HBSS (페놀 레드 않고 칼슘 & MG 무료) 15 X 10 6 / ML 또는 셀 정렬 0.250 ML 최소 볼륨의 농도 1 %의 펠렛을 Resuspend. 어둠 속에서 얼음 세포 보관하십시오. 감기 20% FBS / IMDM / 정렬 세포를 수집하기 위해 글루타민 / PS 매체를 포함하는 튜브를 준비합니다. 정렬은 MoFlo 고속 분류기을 (Dako, Glostrup, 덴마크)를 사용하여 의학의 워싱턴 대학 학교에서 앨빈 J. Siteman 암 센터의 고속 셀 분류기 코어에서 수행됩니다.
CFC 분석
- CFC 분석 미디어 3 ML aliquots의 필요한 번호를 녹여. 와동이 적극적으로 혼합 및 튜브 어떤 거품이 세포를 추가하기 전에 표면에 상승에 제출하도록 적어도 5 분 대기하도록.
- 각 정렬 샘플에 대한 세포 농도를 얻으려면 대략적인 세포 현탁액 볼륨으로 정렬 시설에서 제공하는 휴대폰 번호를 나누었습니다. 3000을 가지고 바이러스 transduced, 차가운 2% FBS / IMDM을 포함하는 멸균 microtube에 정렬 세포. 사전 조정의 최종 정지 볼륨 약 0.3 ML됩니다 FBS / IMDM 그런데 2 %의 볼륨을.
- , 세포를 일시 중지 및 2 MM L - 글루타민 1 % 메틸 셀룰로오스로 구성되어 있습니다 Methocult GF + H4435, 30 % FBS, 1 % BSA, 10 -4 M 2 - 메르 캅 토 에탄올의 3 ML의 나누어지는으로 전체 0.3 ML 세포 현탁액을 전송 50 NG / ML SCF, 20 NG / ML GM - CSF, 20 NG / ML IL - 3, 20, NG / ML IL - 6, 20 NG / ML G - CSF, 3 유닛 / IMDM에 ML erythropoietin. 1.3 %의 메틸 셀룰로오스 메틸 셀룰로오스로 구성되어 인간의 풍부한 미디어 (R & D 시스템), 25 % FBS, 1 % BSA, 5 × 10 -5 M 2 - 메르 캅 토 에탄올, 2 MM L - 글루타민, 50 NG / ML SCF, 20 NG / GM - CSF ML, 20 NG / ML IL - 3, 20, NG / ML IL - 6, 20 NG / ML G - CSF, 3 유닛 / IMDM에 ML erythropoietin도 사용할 수 있습니다.
- 와동이 적극적으로 혼합물이 완전히 상승하고 3-4 회를 떨어뜨릴 수 있습니다. 튜브 3 분 가만히 보자.
- 3 ML의 주사기에 16 게이지 날이 엔드 바늘을 첨부하고 2.2 ML를 그립니다. 큰 거품을 그려하지 마십시오 몇 번 데이트를 추진하여 처음에 그들을 추방. 각각의 두 개의 30mm 비 취급 그릇에 1.1 ML를 밀어 넣기 및 회전에 의해 균일하게 혼합 분산.
- 3 ML 멸균 물이 들어있는 물을 접시와 함께 100mm 접시에 접시를 중복 배치합니다. 17일 - 14 문화.
- 점수 그리드로 표시된 문화 접시에있는 40x 배율에서 거꾸로 현미경으로 자신의 형태에 따라 식민지를 특징 및 점수. 순수 erythroid, myelomonocytic 및 혼합 : 우리의 분석의 목적은 식민지 3 범주로 구분됩니다. 더 콜로니 subclassification에 대한 제조 업체의 지시 사항을 참조하십시오.
- 전체 CFC 분석 플레이트는 일반 600 DPI에서 스캐너, 그리고 식민지의 photomicrographs가 컬러 카메라가 장착된 거꾸로 현미경을 사용하는가 취해질 수 저전력을 (40x)를 사용하여 배율없이 검사할 수 있습니다.
- 분화와 확산의 자세한 분석을 위해, 전체 CFC 분석 플레이트의 세포는 실내 온도 2퍼센트 FBS / IMDM 몇 권 정지하여 복구할 수 있습니다. 4 10 분 ° C 300 XG에서 원심 분리 후, 세포가 2% FBS / IMDM, 계산하고, 두 유동세포계측법에 대한 항체와 스테인드 또는 Giemsa의 얼룩을위한 Cytospin의 원심 분리기를 사용하여 슬라이드로 전송에 resuspended 있습니다.
항체 얼룩 및 유동세포계측법
- 4 8 분 200 XG에 원심 분리기 세포 HBSS에 차가운 50% 정상 마우스 혈청에서 ° C와 resuspend (페놀 레드 않고 칼슘 & MG 무료).
- 관 당 80 μl (12 X 75mm 왕복 하단 튜브)에 약 5 × 10 5 세포를 놓고 얼음 계속. 항체 혼합물 (노 항체 컨트롤에 대한 약 20 μl 혼합 또는 부정적인 제어 솔루션)와 가볍게 튜브를 감청하여 믹스를 추가합니다. 없이 항체 또는 각 fluorochrome위한 안티 CD45 항체와 교정 제어 튜브를 준비합니다. 20 분 동안 어둡고 품어 얼음 속에서 플레이스 튜브. 가볍게 처음 10 분 후에 튜브를 도청하여 섞는다. 20 분 부화 후, 차가운 HBSS와 튜브를 작성하여 4 8 분 200 XG에 원심 분리기 ° C. 감기 0.5 % paraformaldehyde / HBSS에서 펠렛을 Resuspend.
항체의 혼합물은 일반적으로 다음과 같은 분석을 위해 사용됩니다. 골수양 차별 화를위한 : CD11b (phycoerythrin - 복합 클론 ICRF44) / CD33 (allophycocyanin - 복합 클론 WM53) / CD45 (phycoerythrin - Cy7 - congjugated 복제 HI30). erythroid 차별 경우 : CD71 (phycoerythrin - 복합 클론 M - A712) / CD235a (allophycocyanin - 복합 클론 GA - R2) / CD45 (phycoerythrin - Cy7 - congjugated 복제 HI30). - 유동세포계측법 5 색상 두 레이저 (BD Biosciences)로 업그레이 드 FACScan 흐름 cytometer에 의과 워싱턴 대학 학교에서 앨빈 J. Siteman 암 센터의 고속 셀 분류기 코어에서 수행하고 CellQuest (BD Biosciences) 또는를 사용하여 분석됩니다 FlowJO v7.2.4 (트리 스타 (주), 애쉬 랜드, OR, 미국) 소프트웨어.
Giemsa의 얼룩
- CFC 분석 플레이트에서 발견한 약 30,000 세포는 0.3에서 일시 중지 위에 설명한 ML 2퍼센트 FBS / IMDM하고 실온에서 10 분 1,000 RPM에서 Cytospin의 원심 분리기를 사용하여 슬라이드로 전학 왔어.
- 다음과 같은 순서로 솔루션을 포함하는 구 얼룩 혈관을 설정합니다.
- 절대 메탄올
- 라이트 / Giemsa 재고 솔루션
- 라이트 / Giemsa 버퍼, pH를 6.4
- H 2 O의 50 % 메탄올
- H 2 O
- H 2 O
- 인산염 버퍼, 산도 6.0
- H 2 O
- H 2 O
- 슬라이드 캐리어에 슬라이드를 삽입하고 (# 1) 절대 메탄올에서 수영 2 분 및 초과 메탄올을 얼룩.
- 즉시, 5 분 라이트 / Giemsa 주식 솔루션에 슬라이드 캐리어 (# 2) 수영.
- 라이트 / Giemsa 버퍼, pH를 6.4 (# 3)에 캐리어 전송 10 분 알을 품다.
- (# 4) 50 % 메탄올에 두 항공사를 찍어, H 2 O (# 5), H 2 O (# 6)에서 다른 10 배, 10 배 그리고 인산 버퍼, pH를 6.0에서 5 시간 (# 7) .
- H 2 O (# 8)에 캐리어를 전송 2 분 알을 품다. H 2 O (# 9)에 세척을 반복합니다.
- 슬라이드는 캐리어에서 완전히 건조 공기를 허용합니다. 각 슬라이드를 제거하고 얼룩을 제거하기 위해 메탄올 - 절어 Kimwipes와 슬라이드의 뒷면을 닦아냅니다. Cytoseal 60 방울 날인에 덮개 유리를 놓습니다.
- 500 세포 차동 개수는 올림푸스 BX51 현미경을 사용하여 각 Giemsa 묻은 슬라이드 수행됩니다. 셀 다섯 범주로 나누어집니다 : 원시 세포가 폭발하고 promyelocytes를 포함, 중간 골수양 세포가 myelocytes 및 metamyelocytes을 포함, 성숙한 골수양 세포는 밴드, 세그먼트 neutrophils, monocytes, 그리고 macrophages를 포함, 중간 erythroid 세포는 중간 hemoglobinization와 세포를 포함하며, 성숙 erythroid 세포는 다음과 같습니다 전체 hemoglobinization과 세포. Photomicrographs는 60x 기름 목적으로 올림 DP71 카메라로 찍은 있습니다.
3.0) 대표 결과 :
- CFC 분석 : 입력 셀 인구의 일부는, 분아 따위에 의해 번식 차별화, 그리고됩니다 14-17 일 잠복기 동안 반 고체 매체에 양식 식민지. 본 실험에서는, 그것은 NUP98 - HOXA9 oncogene의 표현이 두드러진 빨간색 (erythroid 식민지) (그림 1) (3)의 형성을 일으킨 것이 분명하다.
- 항체 스테 이닝 및 유동세포계측법 : CFC 분석 플레이트에서 수집한 세포의 흐름 cytometric immunophenotyping은 세포 인구의 분화 상태에 대한 정보를 제공합니다. 특정 분화 마커에 대한 항체의 결합 사용하여, 세포의 성숙의 혈통과 수준을 평가하실 수 있습니다. 이 경우에는 CD235a은 erythroid 세포를 식별하는 데 사용되었다. 그림 2A에 표시된 NUP98 - HOXA9는 CD235a + erythroid 세포의 비율 증가의 원인이 있지만, 이러한 세포 CD235a 표현의 밝기는 erythroid의 성숙의 억제를 나타내는, 컨트롤에 비해 감소했다. 그림 2B에서 골수양 세포들은 CD33 양성의 미덕에 의해 식별됩니다. NUP98 - HOXA9은 골수양 성숙 (3)의 억제와 일치하는 CD11b 표현의 밝기의 감소와 함께, CD33 + 세포의 숫자 감소가 발생했습니다. 그러므로 유동세포계측법 결과 NUP98 - HOXA9은 골수양 및 erythroid 모두 성숙의 억제와 erythroid 증식을 일으킨 것을 보여줍니다.
- Giemsa의 스테 이닝 : CFC 분석 플레이트에서 수집한 세포의 형태학의 검사는 세포 인구의 성숙의 혈통과 학위에 대한 정보를 제공합니다. morphologically 얻은 결론은 흐름 cytometric 연구에 의해 얻은과는 다를 수 있으며, 따라서 이러한 방법 (3) 서로 보완하고 있습니다. 실험은 적어도 3 회 반복되며, 위에서 설명한 각각의 시간은 500 세포 차동 개수는 세포의 5 종류를 구별하기 위해 수행됩니다. 이러한 세포의 예는 그림 3에서 지적하고 있습니다. 결과는 사이에 통계적으로 의미있는 차이 oncogene - transduced 샘플과 제어가 있는지 확인하기 위해 tabulated 및 분석입니다. 이 경우 결과는 NUP98 - HOXA9는 숫자에 전반적인 증가를 일으킨 것으로 나타났다erythroid의 증식과 erythroid 및 골수양 성숙 (3) (표시되지 않음)을 모두 억제와 세포의.
그림 전설

그림 1 : 인간의 CFC의 형태에 NUP98 - HOXA9의 효과.
기본 인간의 CD34 + 세포는 retrovirally 제어 MSCV - IRES - GFP 벡터 또는 벡터 중 하나가 NUP98 - HOXA9 표현과 transduced 있었고, 세포가 GFP의 양성을 위해 정렬했다. 한 천 세포 CFC 분석을위한 두 가지 중복 접시의 각에 씨앗을 품고 있었고, 실험 3 4 독립 번 반복되었다. 확대 (왼쪽)와 대표 erythroid 식민지 (오른쪽)의 낮은 전력 photomicrographs없이 대표 접시 (3) 표시됩니다.
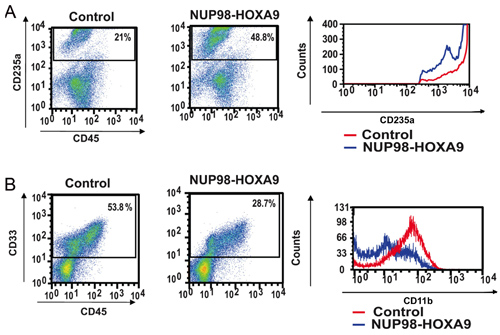
그림 2 : 유동세포계측법가 NUP98 - HOXA9에 의해 인간의 기본 CD34 + 세포 분화의 장애를 보여줍니다.
(A) erythroid의 차별 화를위한 유동세포계측법 : CFC의 접시의 세포는 (그림 1 참조) CD45와 CD235a하는 항체와 수확 및 스테인드했다. CD235a는 + 게이트는 제어 세포에 비해 CD235a의 표현을 보여주는 히스토그램 (오른쪽 패널)에 역모를했습니다 (B) 골수양 차별 화를위한 유동세포계측법 : CFC 접시의 세포는 CD45과 CD33와 수확 및 스테인드했다. CD33는 + 게이트 (오른쪽 패널) 컨트롤에 비해 CD11b 표현을 보여주는 히스토그램을 꾸몄다되었습니다. 각 게이트 이내에 떨어지는 세포의 비율 (3) 표시됩니다.
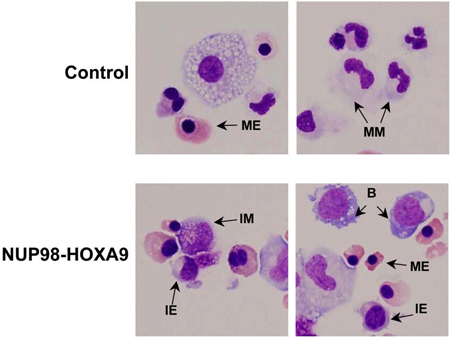
그림 3 : 셀 형태가 NUP98 - HOXA9에 의해 분화의 방해가 벡터 제어에 비해 보여줍니다.
Cytospin 얼룩은 CFC의 접시에서 준비하고 Giemsa 물들일되었습니다. Photomicrographs는 60x 오일 목적으로 대표 분야에서 찍은. B : 폭발, MM : 성숙 골수양, IM : 중간 골수양, ME : 성숙 erythroid, IE : 중급 erythroid (3).
토론
CFC의 분석은 조혈 progenitors의 확산과 차별의 패턴을 결정하고 oncogenes의 효과를 (4, 5) 연구에 광범위하게 사용되고 있습니다. 그것은 식민지가 단일 조상의 자손을 나타내는 개별적으로 추가 분석을 위해 제거할 수 있습니다 그러한 clonal 분석,되는 액체 문화 이상의 장점이 있습니다. 이러한 전지는 사용 감지 장기적인 문화 시작 셀 (LTC - IC) 분석 (6, 7). CFC 분석의 한계는 더 어려서 progenitors 또는 조...
공개
감사의 말
자료
| Name | Company | Catalog Number | Comments |
| IMDM | Life Technologies | 12440 | |
| FBS | Stem Cell Technologies | 06150 | |
| L-Glutamine | Life Technologies | 25030 | |
| Penicillin/Streptomycin (PS) | Life Technologies | 15140 | |
| FLT-3 ligand | PeproTech Inc | 300-19 | |
| GM-CSF | PeproTech Inc | 300-03 | |
| SCF | PeproTech Inc | 300-07 | |
| TPO | PeproTech Inc | 300-18 | |
| IL3 | PeproTech Inc | 200-03 | |
| IL6 | PeproTech Inc | 200-06 | |
| Bovine Serum Albumin | Sigma-Aldrich | A7030 | |
| EDTA | Fisher Scientific | BP118 | |
| Retronectin | Takara Bio Inc | T100A | |
| HBSS | Life Technologies | 14175 | |
| PBS | Life Technologies | 14200 | |
| Trypan Blue solution (0.4%) | Sigma-Aldrich | T8154 | |
| Methocult GF+ H4435 | Stem Cell Technologies | 04445 | |
| Human Methylcellulose Enriched Media | R&D Systems | HSC005 | |
| Wright/ Giemsa stain | Harleco | 64571 | |
| Phosphate Buffer Solution, pH 6.4 - Giordano formula | Ricca Chemical Company | 1450 | |
| Methanol | Fisher Scientific | A412-4 | |
| Cytoseal 60 | Thermo Fisher Scientific, Inc. | 8310 | |
| Normal Mouse Serum | Rockland Immunochemicals | D208 | |
| Anti-Human CD11b phyc–rythrin-conjugated | BD Biosciences | 555388 | |
| Anti-Human CD33 allophycocyanin-conjugated | BD Biosciences | 551378 | |
| Anti-Human CD45 phyc–rythrin-Cy7-congjugated | BD Biosciences | 557748 | |
| Anti-Human CD71 phyc–rythrin-conjugated | BD Biosciences | 555537 | |
| Anti-Human CD235a allophycocyanin-conjugated | BD Biosciences | 551336 | |
| Anti-Human CD45 phyc–rythrin-Cy7-congjugated | BD Biosciences | 557748 | |
| 24-well non-treated tissue culture plates | BD Biosciences | 35-1147 | |
| 30 mm non-treated dish | Stem Cell Technologies | 27150 | |
| 100 mm tissue culture dish | Fisher Scientific | 08-757-12 | |
| Gridded scoring dishes | Stem Cell Technologies | 27500 | |
| 15 ml centrifuge tubes | BD Biosciences | 35-2097 | |
| 50 ml centrifuge tubes | BD Biosciences | 35-2070 | |
| Syringes 3 ml | Stem Cell Technologies | 28240 | |
| 16 gauge blunt-end, 1½ inch needle | Stem Cell Technologies | 28110 | |
| 50 μm CellTrics cell filter | Partec | 04-004-2327 | |
| Hemocytometer | Fisher Scientific | 0267110 | |
| TPX sample chambers | Thermo Fisher Scientific, Inc. | A78710018 | |
| Fisherbrand Superfrost/Plus Microscope Slides, Precleaned | Fisher Scientific | 12-550-15 | |
| Shandon filter cards | Thermo Fisher Scientific, Inc. | 5991022 | |
| Shandon cytospin slide holder | Thermo Fisher Scientific, Inc. | 59920063 | |
| Shandon Complete Staining Assembly 100 | Thermo Fisher Scientific, Inc. | 100 | |
| Kimwipes | Kimberly-Clark Corporation | 34155 | |
| 1 μm filter paper | VWR international | 28307-134 | |
| Inverted microscope | Nikon Instruments | Diaphot | |
| Microscope camera | Nikon Instruments | DS-F11 | |
| Microscope | Olympus Corporation | BX51 | |
| Microscope camera | Olympus Corporation | DP71 | |
| Scanner | Microtek | Scanmaker 4 | |
| Vortex mixer | Fisher Scientific | 12-812 | |
| Tissue culture incubator | Sanyo | MCO-18AIC | |
| Cytospin | Shandon, Inc. | Cytospin 2 | |
| Bench-top centrifuge | Eppendorf | 5810-R | |
| Water purification system | Barnstead | Nanopure-Diamond |
참고문헌
- Takeda, A., Goolsby, C., Yaseen, N. R. NUP98-HOXA9 induces long-term proliferation and blocks differentiation of primary human CD34+ hematopoietic cells. Cancer Res. , 66-6628 (2006).
- Yassin, E. R., Abdul-Nabi, A. M., Takeda, A., Yaseen, N. R. Effects of the NUP98-DDX10 oncogene on primary human CD34+ cells: role of a conserved helicase motif. Leukemia. , (2010).
- Yassin, E. R., Sarma, N. J., Abdul-Nabi, A. M., Dombrowski, J., Han, Y., Takeda, A., Yaseen, N. R. Dissection of the transformation of primary human hematopoietic cells by the oncogene NUP98-HOXA9. PLoS One. 4, e6719-e6719 (2009).
- Nissen-Druey, C., Tichelli, A., Meyer-Monard, S. Human hematopoietic colonies in health and disease. Acta Haematol. 113, 5-96 (2005).
- Pereira, C., Clarke, E., Damen, J. Hematopoietic colony-forming cell assays. Methods Mol Biol. 407, 177-208 (2007).
- Coulombel, L. Identification of hematopoietic stem/progenitor cells: strength and drawbacks of functional assays. Oncogene. 23, 7210-7222 (2004).
- Hogge, D. E., Lansdorp, P. M., Reid, D., Gerhard, B., Eaves, C. J. Enhanced detection, maintenance, and differentiation of primitive human hematopoietic cells in cultures containing murine fibroblasts engineered to produce human steel factor, interleukin-3, and granulocyte colony-stimulating factor. Blood. 88, 3765-3773 (1996).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유