JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
생체내 및 아답터 - clathrin 상호 작용의 체외 연구에서
요약
Clathrin - 중재 endocytosis는 화물선 선택과 clathrin 코트 어셈블리를 조정 어댑터 단백질에 따라 달라집니다. 우리가 모델로 효모 endocytic 어댑터 단백질 Sla1p를 사용하여 어댑터 clathrin 물리적 상호 작용과 라이브 셀 이미징 방법을 연구하는 절차를 설명합니다.
초록
주요 endocytic 통로가 세포 표면부터 수송화물 1-6 endosomes 것을 clathrin - 코팅 vesicles (CCVs)의 형성과 함께 시작합니다. CCVs는 clathrin되는 외투 소포 막의 polyhedral 격자에 의해 구별하고 기계 발판 역할을하고 있습니다. Clathrin 코팅은 개별 clathrin triskelia 세 무거운 세 가벼운 체인 7,8 subunits로 구성된 clathrin의 수용성 형태의 소포 형성하는 동안 조립하고 있습니다. triskelion 직접 멤브레인에 바인딩하는 기능이 없기 때문에, clathrin 바인딩 어댑터 lipids 및 / 또는 멤브레인 단백질 9 협회를 통해 막으로 형성 clathrin 격자를 연결하기 위해 중요하다. Adaptors 또한 패키지 transmembrane 단백질과 같은 수용체와 같은화물, 그리고 서로와 CCV 형성 기계 9 다른 구성 요소와 상호 작용할 수 있습니다.
스물 이상 clathrin 어댑터는 설명했습니다 몇 가지는 clathrin 매개 endocytosis에 관여하고 다른 사람들은 트랜스 잠돌군 Zz 네트워크에 집중하거나 9 endosomes. HIP1R (효모 Sla2p)를 제외하고, 모든 알려진 clathrin 어댑터 clathrin 중쇄 9 N - 터미널 - 프로펠러 도메인에 바인딩합니다. Clathrin 어댑터는 구조화되지 않은 유연한 linkers로 연결되어 접힌 도메인으로 구성된 모듈형 단백질입니다. 이 링커 지역 내에서 짧은 바인딩 모티프는 clathrin N - 말단 도메인이나 소포 형성 기계 9 다른 구성 요소와 상호 작용을 중재. 별개의 두 clathrin 결합 모티프가 정의되었다 : clathrin - 상자와 W - 박스 9. 합의 clathrin 박스 순서는 원래로 정의했습니다 L [L / I] [D / E / N] [L / F] [D / E] 10 그러나 변종이 이후 11 발견되었습니다. W - 박스 시퀀스 PWxxW (여기서 x는 모든 찌꺼기가 어디)에 부합.
Sla1p는 (굴지 바인딩 단백질 1 합성 치명적인) 원래 굴지 관련 단백질로 식별 및 효모 세포 12 endocytic 사이트에서 정상적인 굴지의 cytoskeleton의 구조와 역학에 대한 필요했습니다. Sla1p 또한 NPFxD endocytic 정렬 신호를 바인딩하고 NPFxD 신호 13,14 베어링화물의 endocytosis를 위해 중요합니다. 최근 Sla1p는 clathrin 상자 LLDLQ과 비슷한 모티프를 통해 clathrin 바인딩하는 시연 되었음 변종 clathrin - 박스 (VCB)라고합니다, 그리고 endocytic clathrin 어댑터 15 기능. 또한, Sla1p 라이브 세포 형광 현미경 연구 16 endocytic 코트에 널리 사용되는 마커되고 있습니다. 여기 어댑터 clathrin 상호 작용 연구를위한 방법을 설명하는 모델로 Sla1p를 사용합니다. 우리가 사는 세포 형광 현미경에 초점을 아래로 GST - 끌어와 공동 immunoprecipitation 방법.
프로토콜
1. SLA1 유전자에 GFP 태그와 선택 마커의 설립
SLA1 유전자 오픈 읽기 프레임의 3 '끝 (Sla1p는 C - 말단)에 직접 GFP 태그를 융합하고 동시에 E.있는 유전자를 표시하기 위해 Longtine 방법 17 적용 G418의 선택을 허용 대장균 관 R 유전자.
- 템플릿으로 플라스미드 pFA6a - GFP (S65T) kanMX6 18 다음 primers를 사용하여 PCR하여 DNA의 조각을 생성 : 앞으로, 5' - CA AGG CAA GCC AAC ATA TTC AAT GCT ACT GCA TCA AAT CCG TTT GGA TTC CGG ATC CCC GGG ATT TTA AA - 3 '및 역방향, 5' - CA 두드리는 AGC TTG TTT TAG TTA TTA TCC 문신 AAA ATC TTA AAA TAC ATT AAT GAA TTC CTC GTT TAA 개그 AC - 3. 밑줄 순서 SLA1 유전자 특정 세그먼트 바로 앞 (전방 프라이머)와 정지 코돈 (역방향 프라이머) 다음에 해당합니다. DNA 정화 뒤에 아가로 오스 겔 전기 영동하여 PCR 제품을 분리.
- 50 ML 문화 S. 준비 cerevisiae SEY6210 변형 (MAΤα ura3 - 52, leu2 - 3, 112 his3 - Δ200, trp1 - Δ901, lys2 - 801, suc2 - Δ9 GAL - 멜) YPD에서 19, 초기 단계 로그 (OD 600 = 0.2-0.6)에서 성장. 2000 XG 3 분 상온에서 스핀, 살균 물로 두 번 씻어.
- 리튬 아세테이트 절차 20을 사용하여 세포에 1 단계에서 얻은 PCR 조각을 변환. 1 ML YPD 30 4 H에 대한 품어 ° 통에 C를 추가, 1 ML 멸균 물을 세포를 씻으십시오.
- 2-3 일동안은 30 ° C에서 품어 G418 방지 transformants에 대한 선택 YPD - G418 플레이트에있는 세포를 확산. YPD - G418 플레이트에 식민지과 탄력을 선택하십시오.
- 를 사용하여 식민지를 PCR, GFP 관 모듈이 제대로 상동 재조합에 의해 SLA1 유전자 시퀀스와 통합어진 transformants를 확인합니다. 앞으로 프라이머를 사용하는 것이 SLA1 오픈 읽기 프레임과 반대되는 입문서 이내 anneals GFP 관 모듈 내부 anneals. PCR 제품 예상 크기를 가지고 시퀀싱에 의해 확인 식민지를 식별합니다.
- 그들은 GFP의 형광을 확인하기 위해 형광 현미경에 의해 식민지를 화면.
2. SLA1 유전자의 변종 clathrin 상자 (VCB)의 돌연변이
- 두 단계 접근 15 다음 SLA1 유전자 (세포핵 2407년부터 2415년까지)에 AAALQ 변이에 LLDLQ을 소개합니다.
- 첫째, SLA1 세포핵 PCR에 의해 1207년에서 1410년까지 및 2427년에서 2589년까지를 증폭하고 각각 pBluescriptKS의 노티 / BamHI 및 EcoRI / 살리 사이트에 조각을 복제.
- BamHI / EcoRI 사이트 URA3를 포함하는 PCR의 조각에 Subclone.
- 클리브 노티 / 살리와 결과 플라스미드는 젤 정화하여 URA3 조각을 분리하고, 제 1 부, 또는 TVY614 (마타 ura3 - 52 leu2 - 3112 his3 - Δ200 trp1으로 생성된 Sla1 - GFP 스트레인에 리튬 아세테이트 변환하여 소개 - Δ901 lys2 - 801 suc2 - Δ9 pep4 : LEU2 prb1 : HISG prc1 : HIS3) 21.
- 유라실이 부족해 보충 SD 접시에있는 세포를 확산. 식민지 - PCR에 의해 확인하고 우라 + 식민지 VCB 조각을 교체 제대로 통합 URA3을 포함 순서.
- 두 번째 단계에서, subclone SLA1 세포핵 pBluescriptKS의 노티 / 살리 사이트에 1207년부터 2589년까지. 사용 QuickChange - XL 사이트 이동 돌연변이 유발 키트 (Stratagene)을 AAALQ에 VCB 잔류물에게 LLDLQ을 변화시키다. 순서로 확인합니다.
- 클리브 결과 BsgI / 아게로 구축하고, 젤 정화에 의해 조각을 포함하고있는 돌연변이 VCB을 분리. 부품 2.3에서 얻어진 변형에 pRS313 (HIS3) 22 BsgI / 아게 조각을 Cotransform.
- 히스티딘이 부족해 보충 SD 접시에있는 세포를 확산. 돌연변이 시퀀스 재생에게 있으므로, AAALQ 변이 (sla1 AAA)에 LLDLQ 들어있는 sla1 유전자를 URA3을 대체하는 세포를 식별 5 fluorotic 산성을 포함하는 한천 배지에 복제 판 그의 + 식민지. 식민지 - PCR 및 시퀀싱에 의해 확인합니다.
3. 형광 현미경
- OD 600 = 0.1-0.4에 도달 때까지 효모 변종 30에서 보충 SD 미디어 4 ML에 부품 1과 2 · 어둠의 회전에 C에서 생성된 Sla1 - GFP 및 sla1 AAA - GFP를 성장. 상온에서 1 분 4,000 XG에 microcentrifuge의 문화 1ml를 스핀. 뜨는의 ~ 950 μl를 폐기하십시오. 남은 액체 (~ 50 μl)에 세포를 Resuspend.
- 보증금 3 현미경 슬라이드에 세포 현탁액의 μl와 유리 coverslip로 커버. 빛의에서 샘플을 보호합니다.
- 마운트 회전하는 디스크 공촛점 - 현미경의 100x 기름 침지 목표에 슬라이드.
- GFP의 형광을 자극하고 감지하기 위해 적절한 필터 브라이트 조명 또는 488 nm의 레이저를 사용하여 세포의 정확한 초점 비행기를 찾습니다.
- 500 MS의 노출 시간 (또는 적절한 값)와 세포 Sla1 - GFP 및 sla1 AAA - GFP의 시간 경과 이미지를 캡처1백50초에 대한 초당 하나의 이미지의 N 간격. 예상 결과 : 신호가 빨리 사라로 GFP 표시 punctae은 세포의 세포막을 제한하는 내부 표면에 나타나는 몇 초 동안 유지하고, 세포의 중앙쪽으로 이동합니다 (해체 코트를 나타내는).
- 반점이 나타 몇 초 동안 유지하고, 사라질 볼 수있는 이미지의 부분을 선택합니다. 시간 경과 영상의 각 프레임에 이미지의이 섹션을 자르기.
- 경과 시간에 해당하는 축을 따라 프레임을 정렬하여 150초 시간 경과 이미지의 각 프레임에있는 이미지의이 섹션을 나타내는 kymograph를 생성합니다.
- (시간 경과 프레임) 명소 kymograph에 존재하는 몇 초에 따라 각 지점의 기간을 계산합니다. 각각의 장소 그것이 코트의 endocytosis와 해체를 반영, 사라와 같이 세포의 내부 향해 "곡선"해야합니다.
- sla1 AAA - GFP와 야생 타입 Sla1 - GFP를 비교합니다. 결과는 통계적으로 의미가 있는지 확인하기 위해 반복합니다. 예상 결과 : sla1 AAA - GFP 명소가 코트 형성 15 결함을 나타내는 야생 유형 (~ 30 초) 이상 (~ 80 초) 이상 크게 유지됩니다.
4. 효모 추출물 cytosolic와 전체 세포 추출물의 준비
- 같은 TVY614 21로 적절한 효모 변형과 YPD 3 리터를 예방하고, 30 성장 OD 600 = 1-2 도달 때까지 쉐이크 인큐베이터에서 ° C.
- 3,700 X g에서 20 분 상온에서 효모 문화를 원심 분리기. 뜨는을 취소, 멸균 물 3-5 ML을 추가하고 펠렛 완전히 resuspended 때까지 최대 피펫 아래로.
- 250 ML의 플라스틱 비이커에 액체 질소 ~ 150 ML 하거라. 플래시 동결 냉동 알약의 응집을 방지하기 위해 원형 모양의 액체 질소로 dropwise을 추가하여 효모합니다. 필요한 경우 더 많은 액체 질소를 추가 알약의 해동을하게하지 마십시오.
- 거기에 액체 질소를 따르고하여 스테인레스 믹서 컨테이너를 풀어. 액체 질소는 거의 완전히 증발 수 있습니다. 추위 믹서 컨테이너에 냉동 효모 알약을 추가합니다. 감기에 고무 마개와 함께 믹서 컨테이너를 닫고 10 초 동안 효모 알약을 갈아서. 내용을 섞어 두 번 연삭 단계를 반복 컨테이너 3-4 회 반전. 지면 냉동 누룩은 가루 같은 모양을 가지고 있습니다.
- 액체 질소와 퍼널 및 50 ML 원뿔 튜브를 풀어. 추위 깔때기를 사용하여 튜브에 지상 효모를 전송할 수 있습니다. 언 땅에 효모는 -80 ° C 또는 즉시 사용에 저장할 수 있습니다.
- GST - 융합 단백질 선호도 분석 (5 부), 중량 냉동 지상의 3g 15 ML 원뿔 튜브 TVY614 효모와 실온 버퍼 3 ML에 resuspend위한 cytosolic 추출물을 얻으려면 (10 MM의 HEPES, 산도 7.0, 150 MM NaCl, 1 MM EDTA (에틸렌 다이아 민 테트라 초산), 1 MM DTT)는 테아제 억제제 칵테일 (시그마)를 포함.
- 뚜껑과 관에게 완전히 해동 후 얼음에 넣어 때까지 여러 번 반전.
- 4 추출물을 초원 심 분리기 ° 300000 20 분 C X G. 조심스럽게 펠렛을 방해하지 않고 피펫을 사용하여 원뿔 관에 뜨는 (cytosolic 추출)을 전송합니다. 얼음 cytosolic 추출물 보관하십시오.
- 그것은 구슬을 pipeting 촉진하기 위해 끝의 끝을 잘라 편리 버퍼 A에서 50 % (V / V) 글루타티온 - 세파 로스 슬러리 100 μl를 추가합니다. 4 회전 ° C는 15 분, 4 원심 분리하여 비즈 스핀 다운 ° 2 천 XG에 분, 그리고 새로운 튜브에 뜨는 (cytosolic 추출)을 전송을위한 C. 입력 컨트롤에 대한 추출물의 지역 50 μl.
- 공동 immunoprecipitation 실험에 대한 전체 세포 추출물을 (6 부) 얻으려면, 스트레인 TVY614 (WT SLA1) TVY614 배경으로 제 2 부에서 생성된 AAALQ 변이에 LLDLQ를 들고 sla1 AAA 변형, 그리고의 삭제를 들고 sla1 변형을 사용하여 GPY3130 23 같은 SLA1 유전자. 무게 두 원뿔 튜브에 해당 언 땅에 효모의 g와 실온 버퍼 2 ML에서 그들을 resuspend, 테아제 억제제 칵테일 (시그마)와 2% 트리톤 X - 100을 포함하는.
- 캡 완전히 해동 후 주기적으로 역전에 의해 혼합 10 분 얼음 부화까지 튜브를 여러 번 반전.
- 4 microcentrifuge 튜브와 스핀에 자료를 전송 ° C 16,000 XG (microcentrifuge에서 최고 속도)에서 15 분. 조심스럽게 펠렛을 방해하지 않고 피펫을 사용하여 얼음에 원뿔 관에 뜨는 (총 세포 추출물)를 전송합니다.
- 4 회전 버퍼 A에서 50 % (V / V) 단백질 A - 세파 로스 슬러리 100 μl를 추가 ° 스핀 다운 15 분에 대한 C, 4 원심 분리하여 비즈 ° 1000 XG 2 분 C 및 전송 뜨는 (총 추출) 신선한 튜브 수 있습니다. 입력 컨트롤에 대한 추출물의 지역 50 μl.
5. GST - 융합 단백질 선호도 분석
- PCR 조각 containi로 확대NG Sla1p 변종 clathrin - 박스 (VCB) (잔류물 803-807)는 pGEX - 5 배 - VCB를 얻을 pGEX - 5 배로 복제. 순서로 확인합니다.
- 템플릿으로 pGEX - 5 배 - VCB를 사용하고 QuickChange - XL의 돌연변이 유발 키트 (Stratagene)를 사이트 - 감독, pGEX - 5 배 - vCBmut를 얻을 AAALQ하는 VCB 잔류물 LLDLQ을 변화시키다. 순서로 확인합니다.
- 익스프레스 GST 융합 단백질과 GST - VCB와 E.의 GST - vCBmut 대장균 (BL21 DE3)가 감소 글루타티온와 비즈에서 글루타티온 - 세파 로스, elute를 사용하여 정화, PBS에 대한 dialyze 및 단백질 농도를 결정합니다.
- 라벨 3 microcentrifuge 튜브 : GST, GST - VCB 및 GST - vCBmut하고, PBS 1 ML, 버퍼에 50 % (V / V) 글루타티온 - 세파 로스 슬러리의 30 μl dialized GST, GST의 A, 50 μg을 추가 - VCB 또는 GST - vCBmut의 융합 단백질.
- 바인딩 수 있도록 30 분 상온에서 회전.
- 4 부에 설명된대로 준비 - - 각 튜브에 효모 추출물 cytosolic 1 ML 추가 버퍼 A.있는 비즈에게 PBS로 2 회, 1 시간을 씻으십시오.
- , 5,000 펠렛 비즈에 XG에서 튜브에게 4 1 H ° C, 스핀 10 초 회전 뜨는 폐기하고, 신속하게 버퍼 A.와 버퍼와 비즈에게이 포함된 0.1 % 트리톤 X - 100, 1 시간을 3 회 씻어
- 한 시간과 젤 로딩 팁을 사용하여 가능한 한 많은 액체로 제거 비즈를 스핀 다운. 이 시점에서 샘플은 나중에 계속 -20 ° C에 저장할 수 있습니다.
- ° C 5 분 96에 품어 각 튜브에 2X Laemmli 샘플 버퍼 15 μl를 추가하고, X G. 5000 10 초 스핀
- clathrin 중쇄하는 항체를 사용하여 immunoblotting하여 샘플을 분석할 수 있습니다. 예상 결과 : clathrin는하지만 GST 또는 GST - vCBmut에 GST - VCB에 바인딩합니다. 또한 샘플은 GST 융합 단백질의 유사한 로딩을 확인하기 SDS - PAGE로 분석합니다.
6. 공동 immunoprecipitation 분석
- 라벨 3 microcentrifuge 튜브 : WT (야생 유형 SLA1), sla1 AAA, 그리고 sla1Δ, 그리고 PBS 1 ML, 버퍼에 A - 세파 로스 슬러리 50 % (V / V)는 단백질 30 μl의 A, 2 μg을 추가 토끼 반대 Sla1p 항체.
- 30 분 상온에서 회전.
- 버퍼 포함 1퍼센트 트리톤 X - 100 PBS 1 시간 두 번 구슬을 씻으십시오.
- SLA1, sla1 AAA 및 sla1Δ : 제 4 준비한 해당 총 효모 추출물 1 ML을 추가합니다. 4 1 H ° C. 회전
- 스핀 10 초 5,000에서 펠릿 비즈에 XG 뜨는 폐기하고, 신속하게 버퍼와 비즈에게 3 번 씻어 포함 0.1 % 트리톤 X - 100과 버퍼 A. 1 시간
- 한 시간과 젤 로딩 팁을 사용하여 가능한 한 많은 액체로 제거 비즈를 스핀 다운. 이 시점에서 샘플은 나중에 계속 -20 ° C에 저장할 수 있습니다.
- ° C 5 분 96에 품어 각 튜브에 2X Laemmli 샘플 버퍼 15 μl를 추가하고, X G. 5000 10 초 스핀
- clathrin 중쇄하는 항체를 사용하여 immunoblotting하여 샘플을 분석할 수 있습니다. 예상 결과 : clathrin sla1 AAA 또는 sla1Δ 샘플에서와 싶었지만 야생 유형 Sla1p와 함께 공동 - immunoprecipitates.
7. 대표 결과
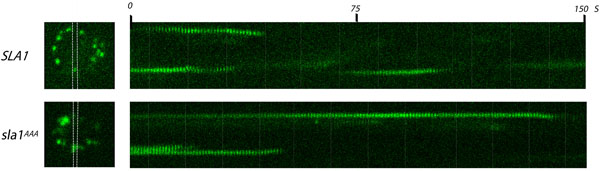
그림 1. 라이브 세포 형광 현미경에 의해 endocytic 사이트에서 Sla1p clathrin 어댑터의 분석. Sla1 - GFP 또는 AAALQ 변이에 LLDLQ를 들고 sla1 AAA - GFP를 표현하는 효모 세포의 비디오와 해당 kymographs (오른쪽)에서 하나의 프레임 (왼쪽). 야생 유형과 Sla1 - GFP 돌연변이 모두 내생 SLA1 로커스에서 표현되었다. Endocytic 사이트는 세포 주변 (왼쪽 이미지) 배포 밝은 반점으로 관찰됩니다. 화이트 라인 사이의 지역 kymographs가 생성된하는 지역에 해당합니다. 영화는 1 프레임 / 초의 프레임 속도로 촬영했다. 야생 유형 (SLA1)에 비해 AAALQ 돌연변이 (sla1 AAA)에 LLDLQ에 Sla1 - GFP의 긴 수명을 확인합니다.
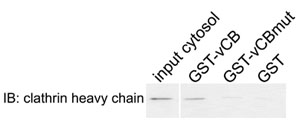
그림 2. clathrin 및 Sla1p - 변형 clathrin 상자 사이의 물리적 상호 작용. GST는 글루타티온 - 세파 로스 구슬로 묶인에서 야생 cytosolic 추출물과 함께 incubated 있던 순서 LLDLQ (GST - VCB), 해당 AAALQ 돌연변이 (GST - vCBmut) 또는 GST 혼자 (GST)를 포함하는 조각 aa798 - 813을 Sla1p하는 융합 유형 효모 세포. 관련 단백질은 clathrin 중쇄에 대한 (IB) immunoblotting에 의해 eluted하고 분석했다.
토론
Clathrin - 코팅 vesicles (CCV)는 트랜스 잠돌군 Zz 네트워크에서 endocytosis 및 수송에 참여하고, 진핵 세포 생물에 근본 아르 보존 경로를 endosomes. 이 방법은 종이에 설명된 접근 어댑터 단백질과 clathrin 사이에 특히 상호 작용에 CCV 형성에 책임이있는 분자 메커니즘을 연구하는 데 유용합니다. GST - 융합 단백질의 선호도와 공동 immunoprecipitation의 assays는 어댑터 (후보)와 clathrin 사이의 물리적인 연?...
공개
감사의 말
DF는 박사 교제에 NSF 교량에 의해 지원됩니다. 이 작품에 사용되는 현미경은 콜로라도 주립 대학에서 현미경 이미징 네트워크 코어 인프라 부여에 의해 부분적으로 지원됩니다. 저자의 실험실에서 clathrin 어댑터에 대한 작업은 CSU 시작 자금과 SD로 미국 심장 협회 상을 09SDG2280525 지원합니다
자료
| 자료 | 회사 | ||
|---|---|---|---|
| Name | Company | Catalog Number | Comments |
| QuickChange - XL 사이트 이동 돌연변이 유발 키트 | Stratagene | ||
| 프로 테아제 억제제 칵테일 | 시그마 |
참고문헌
- Mellman, I., Warren, G. The road taken: past and future foundations of membrane traffic. Cell. 100, 99-112 (2000).
- Engqvist-Goldstein, A. E., Drubin, D. G. Actin assembly and endocytosis: from yeast to mammals. Annu Rev Cell Dev Biol. 19, 287-332 (2003).
- Conner, S. D., Schmid, S. L. Regulated portals of entry into the cell. Nature. 422, 37-44 (2003).
- Bonifacino, J. S., Traub, L. M. Signals for sorting of transmembrane proteins to endosomes and lysosomes. Annu Rev Biochem. 72, 395-447 (2003).
- Ungewickell, E. J., Hinrichsen, L. Endocytosis: clathrin-mediated membrane budding. Curr Opin Cell Biol. 19, 417-425 (2007).
- Doherty, G. J., McMahon, H. T. Mechanisms of endocytosis. Annu Rev Biochem. 78, 857-902 (2009).
- Kirchhausen, T. Clathrin. Annu Rev Biochem. 69, 699-727 (2000).
- Brodsky, F. M., Chen, C. Y., Knuehl, C., Towler, M. C., Wakeham, D. E. Biological basket weaving: formation and function of clathrin-coated vesicles. Annu Rev Cell Dev Biol. 17, 517-568 (2001).
- Owen, D. J., Collins, B. M., Evans, P. R. Adaptors for clathrin coats: structure and function. Annu Rev Cell Dev Biol. 20, 153-191 (2004).
- Dell'Angelica, E. C., Klumperman, J., Stoorvogel, W., Bonifacino, J. S. Association of the AP-3 adaptor complex with clathrin. Science. 280, 431-434 (1998).
- Dell'Angelica, E. C. Clathrin-binding proteins: got a motif? Join the network!. Trends Cell Biol. 11, 315-318 (2001).
- Holtzman, D. A., Yang, S., Drubin, D. G. Synthetic-lethal interactions identify two novel genes, SLA1 and SLA2, that control membrane cytoskeleton assembly in Saccharomyces cerevisiae. J Cell Biol. 122, 635-644 (1993).
- Howard, J. P., Hutton, J. L., Olson, J. M., Payne, G. S. Sla1p serves as the targeting signal recognition factor for NPFX(1,2)D-mediated endocytosis. J. Cell. Biol. 157, 315-326 (2002).
- Mahadev, R. K., Pietro, S. M. D. i., Olson, J. M., Piao, H. L., Payne, G. S., Overduin, M. Structure of Sla1p homology domain 1 and interaction with the NPFxD endocytic internalization motif. EMBO J. 26, 1963-1971 (2007).
- Pietro, S. M. D. i., Cascio, D., Feliciano, D., Bowie, J. U., Payne, G. S. Regulation of clathrin adaptor function in endocytosis: A novel role for the SAM domain. EMBO J. 29, 1033-1044 (2010).
- Kaksonen, M., Toret, C. P., Drubin, D. G. A modular design for the clathrin- and actin-mediated endocytosis machinery. Cell. 123, 305-320 (2005).
- Longtine, M. S., McKenzie, A., Demarini, D. J., Shah, N. G., Wach, A., Brachat, A., Philippsen, P., Pringle, J. R. Additional modules for versatile and economical PCR-based gene deletion and modification in Saccharomyces cerevisiae. Yeast. 14, 953-9561 (1998).
- Wach, A., Brachat, A., Alberti-Segui, C., Rebischung, C., Philippsen, P. Heterologous HIS3 marker and GFP reporter modules for PCR-targeting in Saccharomyces cerevisiae. Yeast. 13, 1065-1075 (1997).
- Robinson, J. S., Klionsky, D. J., Banta, L. M., Emr, S. D. Protein sorting in Saccharomyces cerevisiae: isolation of mutants defective in the delivery and processing of multiple vacuolar hydrolases. Mol Cell Biol. 8, 4936-4948 (1988).
- Ito, H., Fukuda, Y., Murata, K., Kimura, A. Transformation of intact yeast cells treated with alkali cations. J. Bacteriology. 153, 163-168 (1983).
- Vida, T. A., Emr, S. D. A new vital stain for visualizing vacuolar membrane dynamics and endocytosis in yeast. J Cell Biol. 128, 779-792 (1995).
- Sikorski, R. S., Hieter, P. A system of shuttle vectors and yeast host strains designed for efficient manipulation of DNA in Saccharomyces cerevisiae. Genetics. 122, 19-27 (1989).
- Piao, H. L., Machado, I. M., Payne, G. S. NPFXD-mediated endocytosis is required for polarity and function of a yeast cell wall stress sensor. Mol Biol Cell. 18, 57-65 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유