Method Article
Nucleofection 및 배아 마우스 Hippocampal과 두피 뉴런의 주요 문화
요약
이 프로토콜은 electroporation과 문화 마우스 hippocampal 및 대뇌 피질의 뉴런을 통해 transfect, 해부하다하는 데 필요한 단계를 설명합니다. 장기 문화가 synaptogenesis 및 돌기 척추 분석 연구에 사용할 수 있지만 단기 문화는 축삭의 파생물과지도의 연구에 사용할 수 있습니다.
초록
Hippocampal과 대뇌 피질의 뉴런은 중추 신경계 (CNS)의 연결을 편광, 축삭 / dendrite 파생물 및 버렸네 형성과 기능을 연구하기 위해 널리 사용되었습니다. culturing 이러한 뉴런의 장점들은 쉽게 매우 낮은 밀도에서 2 차원 기판에 특유의 axons과 dendrites을 형성, 분극이다. 이 속성은의 연결을 개발의 여러 측면을 결정을 위해 매우 유용하게되었다. 또한, 이러한 뉴런에 glial 컨디셔닝을 제공하여 그들이 기능 시냅스 연결을 형성하고 문화에 몇 개월 동안 생존 개발 나갈 것입니다. 이 프로토콜에서 우리는 해부하다하는 기술, 문화, transfect 배아 마우스 hippocampal과 대뇌 피질의 뉴런을 설명합니다. Transfection은 nucleofection 통해 도금 전에 뉴런에 DNA를 electroporating에 의해 수행됩니다. 이 프로토콜은 분극, 축삭의 가지와 분기 동안 단백질의 역학과 기능을 연구 개발 (~ 4 8hrs 도금 후) 초기에 찬란 - 태그 융합 단백질을 표현하는 장점이 있습니다. 또한 도금 전에 하나의 transfection은 신경 세포 (문화> 2 개월)의 수명에 걸쳐 이미징에 적합한 수준에서 찬란 - 태그 융합 단백질 발현을 유지 것을 발견했습니다. 따라서,이 방법론의 연결 기능을 거의 또는 전혀 방해와 CNS 개발 전반에 걸쳐 단백질 현지화 및 기능을 공부하는 데 유용합니다.
프로토콜
1. Coverslips와 챔버의 준비
- 깨끗한 coverslips와 챔버의 준비는 건강한 문화 필수적입니다. 단축키는 다음 단계 중 하나에서 찍은해서는 안됩니다.
- 전용 유리 JAR 또는 비커에 집중되어 질산 (HNO3)에 하룻밤 - coverslips을 (카롤 어시스턴트 브랜드 12mm 또는 22mm 원형, 독일어, 유리) 씻으십시오.
- 질산에서 coverslips를 제거하고 탈이온수 (5 - 7x) 광범위하게 씻으십시오.
- 층류 흐름 후드 또는 biosafety 캐비닛에 coverslips 건조를 분리합니다. 경우 건조 30 분 동안 자외선으로 그들을 소독. 이곳은 저장을위한 살균 배양 접시에 coverslips를 소독. 12mm coverslips에 도금 뉴런 직접 살균 35mm 접시에 coverslips를 배치하고 제 2로 진행하십시오.
- 이미징 여왕님 35mm 배양 접시의 바닥에 15mm 구멍을 (모든 털은 제거) 드릴링과 파라핀, 석유 젤리의 3시 1분 혼합으로 청소 coverslips을 첨부하여 건설하고 있습니다.
- 끓는 물에 목욕 내부 원뿔 관에 파라핀 / 석유 젤리 혼합물을 용융. 작은 페인트 브러시와 코트 15mm 구멍 주변의 접시의 아래쪽을 사용합니다. 그것이 별도 있으므로 파라핀 / 석유 젤리 혼합물을 교반 보관해야합니다. 요리는 인큐베이터에 배치하는 경우 coverslip 부대의 결과, 점성이 될 것이다 석유 젤리의 높은 농도와 붙어 실에서 이것은 일반적으로 발생합니다. 나머지 파라핀 / 석유 젤리는 상온에서 저장할 수 있습니다.
- 평평한 쟁반에 뒤집어 접시를 놓고 구멍을 통해 coverslip를 놓습니다. 80 열 ° C 오븐 파라핀 혼합물을 용해까지 (~ 10 분). 평평한 표면에 요리를 제거하고 파라핀의 혼합 세트를 보자.
- 요리를 뒤집어하고 자외선으로 덮개와 챔버의 바닥의 내부를 모두 소독.
- 외투 coverslips 또는 1.0mg/mL 한 시간 만이라도 borate 버퍼 (0.1M 나트륨 borate, 산도 8.5)에서 폴리 - D - 라이신 (30kDa)와 챔버의 유리 지역. 조직 문화 등급 탈이온수의 풍부한 양의와 함께 3-5 번 씻어. borate 버퍼의 모든 흔적을 제거할 수 있는지 확인하십시오. 건조하고 나중에 사용하기 위해 즉시 또는 상점 챔버 / coverslips 사용합니다. 우리는 일반적으로 준비 1 개월 이내에 청소 coverslips을 사용합니다.
2. 의 연결을 해부 문화 매체의 준비
- 조직 문화 등급 물을 10X HBSS와 100X HEPES의 적절한 금액을 추가하여 해부 미디어 (DM)를 준비합니다. 4 스토어 ° C. 해부 동안 얼음 계속.
- 해부 전날은 도금 매체 (PM) 및 혈청없는 매체 (SFM)을 준비합니다. 오후 Neurobasal 매체, B27 보충 2 MM의 글루타민, 0.3 % 포도당, 37.5 MM NaCl과 5% 태아 소 혈청 (FBS)로 구성되어 있습니다. SFM은 Neurobasal 매체, B27 보충 2 MM의 글루타민, 0.3 %의 포도당과 37.5 MM NaCl로 구성되어 있습니다.
- 뚜껑과 야간 보육 약간 열려 있도록 매체 equilibrates의 온도와 CO 2 컨텐츠하는 조직 문화의 해부 및 저장소에 대해서만 충분합니다. 우리는 여분의 포도당을 추가하고 NaCl과 약 310mOsm에 osmolality를 증가시킵니다. 우리는 문화가보다 생리적 osmolality (Neurobasal osmolality는 일반적으로 205 - 245mOsm이다)에서 더 잘할 찾습니다.
3. 장기 문화 두피 Glial 피더 레이어 준비
- 장기 문화가 준비되고있다면, 대뇌 피질 또는 hippocampal 해부와 함께 계속하기 전에 프로토콜 2~3주의이 부분을 수행합니다.
- 멤과 glial 중간 (GM), 0.3 % 포도당, 페니실린 / 스트렙토 마이신와 10 %의 목마 혈청을 준비합니다.
- 5 분 얼음에 냉각하여 P1 - P3 마우스 새끼를 안락사. 70 % 에탄올로 얼음과 스프레이에서 각각의 강아지를 제거합니다. 신속하게 가위로 목을 베다. 감기에 DM을 (단계 2.1)이 포함된 음식을 전체 두뇌를 제거합니다.
- 두 대뇌 반구와 meninges를 제거합니다. 엑사이스 네크로 텍스와 어떤 매체를 포함하지 새로운 음식을 제거합니다. 총 4 두뇌에서 cortices를 준비합니다.
- 가능한 벌금으로 깨끗하고 살균 면도날로 cortices을 말하다 차가운 DM 12 ML을 포함한 50 ML 원뿔 관에 플라스틱 피펫과 다진 조직을 제거합니다. 각각 0.25 % (1.5 ML)와 0.1 % (1.5 ML)의 최종 농도에 트립신과 DNase를 추가합니다. 간헐적인 소용돌이와 함께 10 분 동안 37 ° C의 물을 욕조에 품어.
- 대뇌 피질의 조직을 포함하고있는 튜브를 제거하고 조직 문화 후드에 가져갈 전에 70 % 에탄올로 철저히 세척한다. 10 ML의 피펫과 Pipet 피질 조직 위쪽 및 아래쪽은 약 10-15 시간, 또는 때까지 대부분의 덩어리가 사라집니다.
- ° C 간헐 소용돌이 다른 10 분 동안 물 목욕에서 37로 튜브를 반환합니다.
- 70 % 에탄올로 튜브를 깨끗이 청소하고 조직 문화 후드로 가져 오. 5m와 Pipet의 대뇌 피질 조직 위아래L 피펫은 약 덩어리가 사라 10-15 시간, 또는 때까지.
- 15 따뜻한 GM의 ML 10 분 200xg (1000rpm)에서 원심 분리기를 추가합니다.
- 뜨는 폐기, 신선한 GM의 20 ML에 pelleted 세포를 resuspend과 hemocytometer로 계산됩니다. 75cm 2 플라스크 당 GM의 15 ML에 판 5 7.5x10 6 세포.
- 하루 문화의 모든 후속 2-3 일 후에, 손을 반대 휴대용 술병을 두드리는하여 느슨한 세포를 이동시키다. 어떤 dislodged 세포와 함께 미디어를 제거하고 신선한 GM의 15 ML로 바꿉니다.
- 그들은 70-100 % 정도 합류하는 경우 Glia는 flasks 성장 1-2 주 후에 수확 수 있습니다. glia와 코팅 개별 coverslips를 준비하려면, 장소 6 질산의 산성은 작은 페인트 브러쉬와 삼각 패턴의 각 coverslip에 파라핀 / 석유 젤리의 3시 1분 혼합물의 3 점 청소하고, 10cm 접시에 25mm 원형 coverslips을 소독하고, 장소 . 30 분 자외선을 걸고 요리를 취급합니다. 코트 borate 버퍼 0.1 MG / ML 폴리 - D - 라이신 (30kDa) 1 시간 후, 무균 조직 배양 등급 탈이온수와 함께 (3 배) 광범위하게 씻어 건조하게 함께 coverslips.
- 인큐베이터에서 glial 함유 플라스크를 제거 매체를 버리고 미리 예열 트립신 / EDTA (에틸렌 다이아 민 테트라 초산) 솔루션의 5 ML와 린스. 술병에서 트립신 / EDTA (에틸렌 다이아 민 테트라 초산) 솔루션을 제거하고 플라스크에 신선한 사전 예열 트립신 / EDTA (에틸렌 다이아 민 테트라 초산) 3 ML을 피펫. ° C trypsinization를 중지 GM의 5 ML을 추가하기 전에 37 일분에 대한 휴대용 술병을 품어.
- 10-15 번 반복 pipetting하여 플라스크에서 glia를 제거하고 15 ML 원뿔 관에 미디어를 전송합니다. 팔분에 대한 200xg (1000rpm)에 원심 분리기. 뜨는을 제거하고 coverslips을 포함 10cm 요리 당 GM의 12.5 ML 10 GM의 ML, 개수 세포 및 플레이트 5x10 5 세포를 추가합니다.
- 신선한 사전 예열 GM 모든 2-3일와 매체를 교환. 신경 세포의 해부 전날은 GM을 제거하고 SFM (섹션 2.2)로 대체합니다. 피질 또는 hippocampal 문화를 홍수 때 단계 4.12이 glial - 냉방 SFM을 사용합니다.
4. 피질 및 / 또는 Hippocampal 해부 및 Electroporation
- nucleofection 솔루션 (Lonza)의 적절한 금액을 제거, 절개를 시작하기 전에 결합하고, 실온에 따뜻한. 결합하면 Nucleofection 솔루션은 한정된 수명을 가지고 있기 때문에, 우리는 각각의 준비 (transfection 당 100 μL)에 필요한 금액을 결합하여.
- CO 2 (플러그의 날이 E0.5 임) E15.5에서 임신 마우스를 안락사와 10cm의 페트리 접시에 자궁을 제거합니다. 추운 DM (섹션 2.1)로 fetuses과 참살을 제거합니다.
- 감기 DM 별도의 그릇에 전체 두뇌를 제거하고 구부러진 텅스텐 바늘로, 두 neocortices를 제거합니다. 감기 DM의 새로운 그릇에 microforceps 및 장소 cortices로 meninges를 제거합니다. 작은 홍채 또는 웨커 가위로, 감기 DM 1.0 ML 가득 1.5 ML Eppendorf 튜브에있는 피질이나 해마과 장소를 제거합니다. 얼음이 튜브 보관하십시오.
- 모든 cortices 또는 hippocampi을 해부 후 20 분 동안 37 ° C 배양기에서 조직과 장소 튜브가 들어있는 Eppendorf 튜브에 2.5 %의 트립신 110 μL를 추가합니다.
- 부드럽게 반전 Eppendorf 튜브에 의해 1.0 ML PM (섹션 2.2)로 뜨는 및 세척 cortices 또는 hippocampi를 제거합니다. 튜브 PM 1 ML을두고 두 번 세척을 반복합니다.
- P1000 피펫으로 청크 15 번 씹다하고, Eppendorf 튜브에 남아있는 청크를 떠나, PM 4 ML를 포함하는 새로운 15 ML 원뿔 관에 / 뜨는 세포를 제거합니다.
- 브레이크 해제되는 7 분 20xg (350rpm)에서 15 ML 튜브를 스핀. 뜨는을 취소하고 각각의 transfection에 대해 premixed, 방 온도 nucleofection 솔루션 (Lonza) 100 μL를 추가합니다. P1000 피펫의 최대 부드럽게 아래 모션 5 번 씹다.
- 각각의 새로운 Eppendorf 튜브에 nucleofection 솔루션 / 셀 혼합 100 μL를 제거하고 DNA의 해당 금액을 추가합니다. 장기 문화 우리는 일반적으로 transfection마다 DNA의 1 2μg를 사용합니다. 그러나이 전용 라벨 문화의 뉴런의 작은 <10 %의 비율. 단기 문화 높은 transfection 효율을 원한다면 우리는 일반적으로 transfection마다 DNA의 5 - 10μg을 사용합니다. 서로 다른 두 가지 plasmids와 transfecting 때 우리는 DNA의 40μg의 총까지 사용하고 있습니다. Plasmids는 μL / 1μg에서 TE 버퍼에 저장됩니다.
- 쿠베트 (Lonza)에 세포 현탁액 / DNA를 추가 및 프로그램 O - 005 (마우스 CNS의 뉴런)를 사용, Nucleofector (Lonza)에 세포를 electroporate.
- 신속하게 작업, 쿠베트 사전 예열 및 equilibrated PM 500 μL을 추가하고 솔루션 / 새로운 1.5 ML Eppendorf 튜브에 세포를 제거합니다. 1.0 ML 각 transfection의 볼륨을 가지고 충분한 PM을 추가합니다. 장기 문화 청소년 문화, 또는 5 - 10x10 3 셀 / cm 2 3 5x10 3 셀 / cm 2 hemocytometer 및 플레이트로 세포를 계산합니다. <은/ 리>
- 을위한 단기 문화, 홍수 예열 2.0 ML, 도금 한 시간 후 CO 2 - equilibrated SFM과 함께 35mm 문화 요리. coverslips를 사용하는 경우, 우리는 PM의 절반을 제거하고 SFM로 교체 후, 두 번 더 반복합니다. 어느 이미징 회의소를 홍수 또는 매우 낮은 혈청 콘텐츠 (<0.5 %)에 coverslips 결과를 세척. 단기 문화 glial 피더 계층과 교양이 되야 할 필요는 없어 다시 먹이 필요가 없습니다.
- 장기 문화를 위해, 우리는 파라핀 / 석유 젤리 세 점들을 포함하는 glia 대상 coverslip을 제거하고 35mm 접시에 15mm 구멍, 초기 도금 후에도 한 시간 이상을 반전. glial 접시에서 시설 SFM 두 밀리리터는 다음 이미징 챔버에 추가됩니다. 장기적으로 문화를 피드하기 위해, 우리는 SFM 모든 2~3일의 3 분의 1을 제거하고 신선한 사전 예열 및 CO 2 - equilibrated SFM로 바꾸십시오.
5. 대표 결과 :
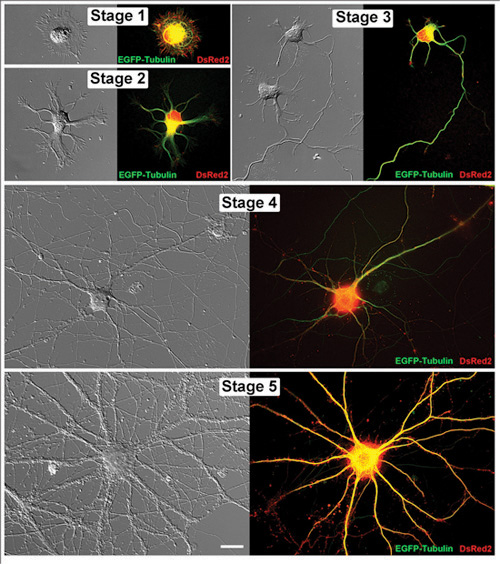
그림 1. hippocampal 뉴런 살아있는 대리인의 개발 단계 연속 hippocampal 뉴런 생활. 결합하여 이미지가 차등 간섭 대비 이미지와 해당 형광 현미경 모두로 표시됩니다. 이들 세포의 각각은 pCAX 벡터에서 EGFP - Tubulin과 DsRed2와 transfected되었습니다. 1 단계 (1DIV), 2 단계 (1DIV), 3 단계 (2DIV), 4 단계 (11DIV)와 5 단계 (32DIV) : 뉴런은 체외에 다음과 같은 일 (DIV)에서 몇 군데 있었다. 스케일 바 20μm이다.
토론
culturing 배아 hippocampal 및 대뇌 피질의 마우스 뉴런에이 프로토콜은 쥐 신경 1,2을 사용 뱅커 프로토콜의 변경으로 개발되었습니다. 우리는 잘 3,4,5,6,7로 culturing 마우스와 햄스터 뉴런에이 프로토콜을 사용하고 있습니다. 이 프로토콜은 hippocampal과 neocortical 두 뉴런에 동일하게 잘 작동하고 Meberg와 밀러 8 시까지 출판 프로토콜과 유사합니다. 그들이 잘 특징과 더 설립 모델 시스템이기 때문에 일반적으로, 우리는 장기적인 문화 hippocampal 뉴런을 사용합니다. 또한, 그들은 네크로 텍스 이상의 뉴런보다 균일한 인구를 포함할 가능성이 높습니다. 그러나, neocortical 뉴런은 생존과 (되지 않은 데이터) 마찬가지로 차별이 프로토콜을 사용하는 양식. 우리는 일상적으로 단기 문화 hippocampal과 neocortical 뉴런을 사용합니다. 네크로 텍스의 절개는 또한 서양 예를 들어, 모래 바닥에 대한 자료를 더 나은 선택하게 hippocampal 해부 (hippocampi의 쌍 당 2.5x10 5 뉴런)보다 실질적으로 더 많은 뉴런 (cortices의 쌍 당 1.5x10 6 뉴런)의 결과.
어떤 차 문화와 마찬가지로, 그것은 동물의 죽음에서 세포의 도금을하는 데 걸리는 시간을 최소화하는 것이 필수적입니다. 그것은 일반적으로 절개하고 도금에서 일관 빠른 될 10-20 해부를 취할 것입니다. 그들이 nucleofection 버퍼에 남아있는 경우 뉴런의 생존이 빠르게 감소로 또한, Lonza Nucleofector 작업을 할 때, 그것은, electroporation 과정에서 신속하게 작업하는 것이 중요합니다.
대부분의 이미징의는 총 내부 반사율의 형광 현미경 (TIRFM)에 실시됩니다. 현미경 이런 유형의 coverslip 넘어 이미징 수백 나노미터에 불과 가능합니다. 따라서, 우리는 자주 이미지, axonal 성장 원뿔과 돌기의 쪽이은 coverslip에 직접 준수하는 뉴런의 영역을 필요. 따라서, 우리는 장기적인 문화 glial 먹이를 필요로 저밀도 문화를 사용합니다. 우리는 장기적인 문화, glial 피더 레이어없이 (> 2x10 4 셀 / cm 2) 높은 밀도 문화를 사용하고 그들이 약간의 먹이로 잘 살아남을 것으로 나타났습니다. 그들이 쉽게 와이드 필드 현미경이나 공촛점 현미경과 함께 발견 될 수 있지만 그러나 이러한 뉴런의 돌기 쪽이은 자주 너무 멀리 기판에서 TIRFM의 이미지입니다.
우리의 연구의 대부분 우리는 도금 전에 신경을 transfect, 최대 문화에 3 개월에 대한 찬란 - 표시된 단백질을 몇 군데있다. 찬란 - 분류 단백질의 장기 표현은 DNA (1 2μg)의 낮은 농도를 사용하여 우리는 뉴런에서 overexpression 유물을 생산하지 않는 우리에게 자신감을 준다. 그러나,이 절차는 또한 DNA의 높은 금액가 (10 - 20μg) 사용하는 경우에는 단백질 overexpression을 연구하는 데 사용할 수 있습니다. 우리도 DsRed2 또는 혼자 EGFP로의 연결을 세포질에 레이블을하지만, 우리가 신경을 transfect하는 데 사용하는 plasmids은 일반적으로, EGFP 또는 mCherry 융합 단백질을 포함하고 있습니다. 이 electroporation 기술은 벡터의 번호와 잘 작동합니다. 우리는 CMV 향상제 및 β - globin과 β - 굴지의 프로 모터를 포함 plasmids를 선호 쓰임새 표현의 상대적으로 높은 수준으로 인해 꼬리 (pCAGGs 또는 pCAX plasmids) 9,, 그들은 뉴런에 의해 잘 용납있다는 사실 - 단기 및 장기 문화를 모두 인치 일반적으로, 단백질은 도금의 약 4 시간 이내 Express 및 10 - 24 10 시간 영상에 충분한 수준에 도달하기 시작합니다. 우리는 성공적으로 단기 문화에 CMV - 발기인 기반 plasmids를 사용해야하지만, 그들은 장기적인 문화에 신경을 죽일 것을 overexpression 높은 수준을 일으킬 수 있다고 나타났습니다. 그럼에도 불구하고, 우리는 낮은 밀도 문화의 glial 에어컨 높은 밀도를 (비 - glial 공급) 문화에 비해, CMV - 발기인 구동 plasmids와 transfected 뉴런의 생존과 도움 것으로 나타났습니다.
공개
감사의 말
모든 절차 애니멀 케어에 위스콘신 대학위원회의 승인 및 NIH의 지침에 따라 하였다. 우리는 그녀의 Nucleofector 장치의 관대한 사용하기 위해 박사 캐서린 칼릴 감사합니다. 우리는 프로토콜에 대한 덧글에 대한 덴트 실험실의 구성원을 또한 감사드립니다. 이 작품은 EWD 부여 NIH R01 - NS064014, 다나 재단과 화이트홀 재단에 의해 지원되었다
크리스토퍼 Viesselmann, 제이슨 Ballweg와 데릭 Lumbard이 종이에 똑같이 기여.
자료
우리는 -80에서 저장소 ° C가뿐만 아니라 -20 ° C에 저장된 수 있습니다 * 대부분의 시약. -80에서 그들을 저장 ° C들의 수명과 약간 더 일관성있는 문화의 결과를 길게.
참고문헌
- Goslin, K., Asmussen, H., Banker, G., Goslin, K., Banker, G. Chapter 13. Culturing Nerve Cells. , 339-370 (1998).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nat Protoc. 1, 2406-2415 (2006).
- Dent, E. W., Callaway, J. L., Szebenyi, G., Baas, P. W., Kalil, K. Reorganization and movement of microtubules in axonal growth cones and developing interstitial branches. J Neurosci. 19, 8894-8908 (1999).
- Dent, E. W., Kalil, K. Dynamic imaging of neuronal cytoskeleton. Methods Enzymol. 361, 390-407 (2003).
- Dent, E. W. Filopodia are required for cortical neurite initiation. Nat Cell Biol. 9, 1347-1359 (2007).
- Hu, X., Viesselmann, C., Nam, S., Merriam, E., Dent, E. W. Activity-dependent dynamic microtubule invasion of dendritic spines. J Neurosci. 28, 13094-13105 (2008).
- Lebrand, C. Critical role of Ena/VASP proteins for filopodia formation in neurons and in function downstream of netrin-1. Neuron. 42, 37-49 (2004).
- Meberg, P. J., Miller, M. W., Hollenbeck, P. J., Bamburg, J. R. Chapter 7. Neurons: Methods and Applications for the Cell Biologist. , 112-129 (2003).
- Osumi, N., Inoue, T. Gene transfer into cultured mammalian embryos by electroporation. Methods. 24, 35-42 (2001).
- Zeitelhofer, M. High-efficiency transfection of mammalian neurons via nucleofection. Nat Protoc. 2, 1692-1704 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유