JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
블랙 위도우 스파이더 실크 생산 땀샘의 Microdissection
요약
여기 우리는 여성의 검은 과부 거미의 복부에서 비단 생산 땀샘을 제거하는 효율적인 전략을 설명합니다. 이 절차는 일곱 별개의 비단 생산이 높은 정화 패션, 거미 실크의 생산 및 섬유 조립을 공부 조사를위한 중요한 프로세스의 분비를의 급속한 고립 수 있습니다.
초록
현대 스파이더는 운동, 먹이 캡쳐 및 자손 1,2을 개발의 보호를 포함하여 생물 학적 기능의 광범위한 높은 성능의 실크 섬유를 스핀. 거미는 다양한 기계적 특성을 가지고 몇 가지 서로 다른 파이버 유형을 회전하여 이러한 작업을 수행. 섬유 종류의 이러한 전문 작은 biofactories 같은 기능을 다른 비단 생산 분비의 진화를 통해 발생했습니다. 이러한 biofactories 제조 및 섬유 생산을위한 실크 단백질의 대량를 저장합니다. 생화 학적 사건의 복잡한 일련의를 통해 다음과 실크 단백질은 압출시 고체 물질로 액체에서 변환됩니다.
기계 연구 거미 비단 높은 인장 강철 3보다 더 강한 것을 증명하고있다. 거미 실크 스레드의 구조와 기능 사이의 관계를 이해하는 분석 거미 실크는 크게 자신의 단백질 시퀀스 4 이내 블록 반복을 가지고 단백질, 또는 fibroins들로 이루어져 것으로 나타났다있다. 놀라운 인장 강도와 거미 실크 옷의 확장성에 기여하는 일반적인 분자 서명 번역 실크 cDNAs의 분석을 통해 풀어되고 있습니다. 거미 실크 옷의 특별한 재료 속성을 감안할 때, 전세계 연구소 이해하고, 상업 군사 및 산업용 애플 리케이션을위한 합성 실크 섬유를 생산하기 위해 회전 과정을 모방하기 위해 경주하고 있습니다. 연구 실험실에서 인공 거미 실크를 회전하는 주요 과제 중 하나는 실크 생산 땀샘에서 섬유의 압출하는 동안 발생하는 생화학 과정의 전체 이해를 포함한다.
여기서 우리는 7 개의 비단 생산의 주요 및 사소한 ampullate의 땀샘을 포함 cobweaving 검은 과부 거미에서 분비를 5,6, tubuliform [합성 달걀 케이스 실크] [드래그 라인 및 발판 실크를 제조] 7 격리하는 방법을 제시 , 8, flagelliform [코브 - 위버스에서 알 수없는 함수], 집계 [글루 실크하게], aciniform [합성의 먹이 포장 계란 케이스 스레드] 9 pyriform 10 [첨부 디스크 실크를 생산]. 이 접근법은 이산화탄소 가스, 복부에서 cephalothorax의 후속 분리 및 비단 생산 분비를 얻기 위해 복부의 microdissection와 거미 anesthetizing을 기반으로합니다. 다른 비단 생산 분비의 분리에 따라,이 조직은 식별 정량적 실시간 PCR, 북부 및 서부 모래 바닥, 질량 분석계 (MS 또는 MS / MS)는 분석을 포함하여 별개의 생화 학적 분석에 대해 다른 macromolecules를 검색하는 데 사용할 수 있습니다 새로운 실크 단백질 시퀀스, 실크 조립 경로에 참여하거나, 세포 배양 또는 histological 실험에 대한 손상 조직을 사용하는 단백질을 검색합니다.
프로토콜
1. 복부의 스파이더와 절연을 Anesthetizing
- 플라스틱 (그림 1A)이 줄지어 판지 상자에 유리 항아리에서 거미를 전송합니다. 우리는 일반적으로 woodpiles, 차고 또는 덤불에서 거미를 수집하고 유리 단지에있는 실험실에서 그들을 집. 거미가 플라스틱 안감을 올라가 수 없기 때문에, 그것은 anesthetizing 목적을 위해 작은 유리병에 유리 병 또는 커피하실 수 있습니다 거미를 전송하는 효율적인 방법을 제공합니다. 이 시점에서 거미를 처리하는 동안, 당신은 안전을 위해 라텍스 장갑이나 원예 장갑 두 쌍을 착용해야합니다.
- 거미 플라스틱 줄지어 상자에있는 동안 그 후면에서 거미에 접근하고 플라스틱 문화 약병에 거미 슬라이드를 보자. 거미가 병을를 입력 후, 즉시 상단 (그림 1B)를 통해 플러그인을 놓으십시오. 우리는 약 101.6 mm X 31.75 mm (L X D)입니다 병을 사용하는 것이 좋습니다. 이것은 anesthetizing 단계에 필요한 이산화탄소 가스의 양을 최소화합니다.
- 10 분 (그림 1C)에 평방 인치당 5~10파운드에서 이산화탄소 가스를 도입하여 거미를 마취. 가스의이 금액은 너무 anesthetization 후 즉시 1.4-1.5 단계를 진행해야합니다, 5 분 주위에 거미를 노크합니다.
- 작은 해부 접시에 anesthetized 거미 플레이스와 거미 등의 측면 접속 (붉은 모래 시계가 아래로 향하게)를 위치 집게를 사용합니다.
- 거미의 나머지 부분 (그림 1D)에서 복부를 공개하는 작은 꽃자루 (cephalothorax와 복부를 연결하는 좁은 줄기)를 클립. 배양 접시에있는 하룻밤 냉장고에 cephalothorax를 저장하고 다음날 냉동 후 폐기합니다. 거미의 송곳니이 세그먼트에 존재하는 것과 cephalothorax를 이동할 때주의하십시오.
- 단일 곤충 핀을 사용하여 작은 절개 요리에 Sylgard 자료에 복부를 고정. 작은 꽃자루 클리핑 (그림 1E)에서 만들어진 구멍을 통해 곤충 핀을 넣습니다. 이것은 쉽게 유체는 작은 꽃자루의 클리핑에서 신흥있는 사이트로 확인할 수 있습니다. 방적 돌기 (작은 꽃자루의 반대 끝)이 (당신에게 가장 가까운) 하단에 지향되어 있는지 확인하십시오.
2. 외골격의 제거
- 작은 꽃자루 클리핑에서 구멍에서 시작, microscissors 한 켤레를 사용하여 외장을 통해 첫 절개를합니다. 등의 측면이 양쪽 (그림 1 층)에 도달할 때까지 옆으로 잘라. 다시 앞의 외골격 세그먼트 껍질, 포셉 한 켤레를 사용하여이 위치에서 두 번째 핀을 삽입합니다. 두 번째 핀의 삽입에 따라, 초기 측면 인하에서 caudally 해부 트레이 (90 ° 각도)를 설정하고 spinnerets가 (그림 1G)에 도달까지 절단을 계속합니다. 이것은 절개는 초기 측면 절단에 수직 또는 수직 것입니다. 수직 절개가 만든 spinnerets (모래 시계로 사후 상대하고 둥근 모양을 가지고)를 통해 잘라하지 마십시오. 두 번째 핀을 삽입하지 않으면 수직 incisions을 수행할 때 회전 복부가 발생합니다.
- 버퍼 솔루션 (0.1 M의 나트륨 염화물, 0.015 M 나트륨 구연 산염, Pyrocarbonate 디에틸 0.1 %) 해부에 잠수함 복부.
- 나머지 외골격 필 다시 초기, 측면 절개부터. 이것이 완료되면, 지방 조직 (그림 1H) 명확하게 표시해야합니다.
3. 실크 생산 땀샘의 분리
- 사용 포셉은 지방 계층 (그림 1H)을 멀리 놀리는 시작합니다. 지방 노란색 외관에 약간 흰를해야합니다. 지방의 대부분 제거하고 실크 선들이 분명하게 볼 수 있습니다 때까지 계속합니다. tubuliform의 글랜드은 복강이 풍부 매우 긴 원통형 튜브이 세 켤레로 구성되어 있습니다. 쌍에서 발견되는 주요 ampullate은, 긴 뒤얽힌 말초 꼬리하고 거미의 spinnerets 접근으로 폭 감소 근위 덕트와 대형 초승달 모양 ampulla입니다. 작은 ampullate은 주요 ampullate에 형태에서 매우 유사하지만, 그것은 상당히 작습니다. 또한 쌍의 발생 flagelliform의 글랜드은, spinnerets 향해 아래로 확장 덕트가 지그 - 재그 작은 원형과 원형과 multilobular입니다. 집계 선은 (쌍에서 발견) 그 위에 대형 불규칙한 엽 (叶)을 갖고있는 매우 큰 배설 관을 가진 매우 큰, multilobular 글랜드입니다. aciniform의 땀샘이 다수 발생하고 짧은, 작은 fingerlike의 전망을 닮은. pyriform의 글랜드은 복부에서 가장 작은 선 (腺)이며 spinnerets 아래로 확장할 수 많은 작은 배설 덕트와 팬과 유사한 많은 압축, 원통형 덕트 있습니다.
- pyriform (그림 2A - B) 다음 tubuliform, 주요 ampullate, flagelliform, 사소한 ampullate, 집계, aciniform 후 우리는 다음과 같은 순서로 선들을 제거하는 것이 좋습니다.
- tubuliform으로 시작 일의 나머지 이러한 땀샘을 애타게전자 땀샘은 - 그들은 다른 선들은 (그림 2A)의 꼭대기에 앉아 있어야합니다. 단일 거미에 tubuliform 땀샘이 세 켤레가 있습니다. 그들이 무료로 부동 그러나 그들의 덕트하여 spinnerets에 첨부된 남아 수 있습니다.
- 다음의 주요 ampullate의 땀샘 멀리 애타게. 한 거미에있는 두 가지 주요 ampullate의 땀샘이 있습니다. 제거 절차 동안, 덕트의 분비 (그림 2A)에 연결된 남아 있는지 확인하십시오.
- 특히 집계 및 flagelliform의 땀샘을 분비 중 하나를 펑쳐링 않도록 조심스럽게 작업, 서로 떨어져 분비의 나머지 부분을 감히 계속합니다. 각 선은 spinnerets에 외골격으로의 출구 지점에있는 모든 방법을 떠 무료로해야합니다. 이러한 분비는 짝을 찾을 수 있습니다. 포셉와 덕트를 곤란하게하고 멀리 출구 지점에서 휴식 시간 때까지 조심스럽게 당겨 각 선 (腺)을 제거합니다. 주요 ampullate, flagelliform, 가벼운 ampullate 및 집계 선들이 짝을 찾을 수 있습니다. aciniform과 pyriform 땀샘이 많은 쌍으로 발생합니다.
- 포셉와 덕트를 곤란하게하고 방적 돌기에 의해 아래 출구 지점에서 멀리 휴식 때까지 조심스럽게 당겨 각 선 (腺)을 제거합니다. 우리는 일반적으로 선들이 젖었 저장 있지만, 우리는 추가적인 버퍼를 추가하지 마십시오.
- 이 선들이 제거됩니다로서, 살균 미리 표시 1.5 ML의 microcentrifuge 튜브에 그들을 놓으십시오. 개인 분비는 그림 3A - G에 표시됩니다. 얼음이 분비 유지하고 플래시는 액체 질소에서 그들을 동결. 액화 질소에 냉동 플래시에 따라, -80에서 그들을 자리 ° C를 저장.
4. 대표 결과
flagelliform 및 집계 선들을 처리하는 동안이 두 구조가 쉽게 구멍과 포셉 함께 손상될 수있는 여러 선들을 제거하면, 극단주의, 주의해야한다. 또한, 그것은 morphologically flagelliform 및 집계 선들 전에 자신의 제거와 매우 유사한 모양과 그들이 종종 서로 고리로 연결되었다는 것을 주목할 가치가있다. 제거시이 조직의 교차 오염을 방지하기 위해, 해부학자 신중하게 이러한 구조를 따로 애타게한다. 또한, 실크 생산 땀샘의 초기 노출시, aciniform 및 pyriform 땀샘은 즉시 그들의 작은 크기와 해부 학적 위치로 인해 시각화하는 가장 어려운 것입니다. 종종 많은 계란의 존재가 있습니다. 이 조직은 매우 끈적이고 자주 포셉을 준수하므로 또한, 추가적인 치료는 pyriform의 글랜드를 제거하면 이동해야합니다. 이 절차가 제대로 완료되면, 그것은 매우 정화 방식으로 하나의 거미에서 일곱 비단 생산 분비를 얻을 수 있습니다. 일반적으로, 하나는 하나의 거미 해부에서 총 RNA와 단백질의 마이크로 그램 수량을 복구할 수 있습니다. tubuliform 제한된 피브로인 유전자, TuSp1의 mRNA 수준을 검사 qPCR에 대한 총 RNA를 사용하는 예제는 (그림 4) 표시됩니다. 단백질이 분비에서 수집한 lysates 관련 대표 실험 MS 분석 (또한 MS / MS 분석을 위해 사용될 수) 또는 아미노산 조성 분석 (각각 그림 5-6,) 표시됩니다 다음에 - 솔루션 tryptic 소화 예를 들어.


그림 1. 처리는 anesthetizing, 그리고 여성 검은 과부 거미의 복부에서 외골격의 제거. 작은 플라스틱 약병에 거미를 이동 촉진하기 위하여 플라스틱이 줄지어 판지 상자에 거미) 전송합니다. B) 스파이더 플러그인과 플라스틱 유리병에 배치. C) 이산화탄소 가스와 거미를 Anesthetizing. microscissors를 사용하여 복부에서 cephalothorax의 D) 분리. 곤충 핀을 사용하여 해부 트레이에있는 복부의 E) 고정. F) 수평 절개가 가위와 외골격의 일부 포셉로 다시 pealed는 만든 후 볼 수 있습니다. G) Incisions은 초기 측면 잘라 직각 만들어지고. 지방 레이어의 외골격과 노출 H) 제거.

그림 2. 거미뿐만 아니라, 주변 조직의 복부 동안 그대로 7 개의 비단 생산 분비의 시각화. tubuliform의) 이미지, 주요 ampullate, flagelliform, 12 배 확대 집계, 사소한 ampullate 조직. 12 배 확대에 aciniform 및 pyriform 선들의 B) 이미지.


복부으로부터 제거 후 일곱 비단 생산 분비의 그림 3. 사진. 모든 이미지는 40X에 마쳤을 aciniform과 pyriform 땀샘의 예외 20X 확대에 점령되었다. A) 주요글랜드을 ampullate, 크기 비교를 위해 B) 전공 및 부전공 ampullate (오른쪽), C) tubuliform, D) flagelliform, E) 집계, F) aciniform, G) pyriform.

에서 총 RNA의 양적 실시간 PCR (qPCR) 다음과 격리를 사용하여 다른 비단 생산 분비에 TuSp1 mRNA 수준을 조사 후 실크 유전자, TuSp1 (pyriform의 글랜드 제외)의 표현 패턴 그림 4. 대표 결과 이 선들.
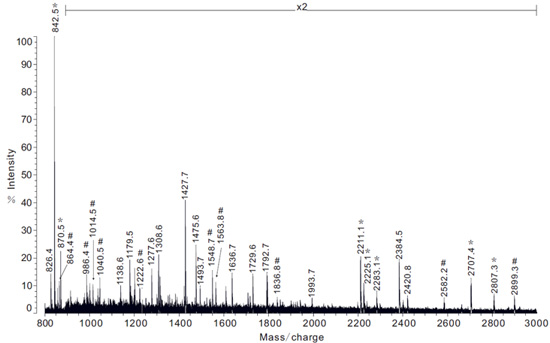
그림 5. 인 솔루션 tryptic 소화 다음 pyriform의 글랜드에서 얻은 단백질 추출물 MS 분석의 예. 참고 : X2는 스펙트럼 강도의 2 배 배율을 나타냅니다. PySp1의 피브로인의 지역에 해당하는 스펙트럼 펩타이드 이온 질량은 # 기호로 표시됩니다.

그림 6. tubuliform의 글랜드에서 추출한 단백질의 아미노산 조성 프로필의 전형적인 결과. 참고 : ASX = ASP 및 ASN, GLX = GLU과 Gln. 붉은 착색이 아닌 정반대의 사이드 체인 그룹과 아미노산 잔류물을 나타내는 반면 블루 착색은 북극 사이드 체인 그룹과 아미노산을 반영합니다.
Access restricted. Please log in or start a trial to view this content.
토론
검은 과부 거미의 실크 생산 땀샘의 microdissection을위한 우리의 방법론은 높은 정화 비단 생산 분비를 얻을 수있는 효과적인 수단을 제공합니다. 해부는 일곱 별개의 전체 집합 비단 생산 cobweavers의 분비를 항복, 1.5-3 시간에 완료할 수 있습니다. 높은 정화 실크 글랜드 샘플을 구하기 조사관에게 다른 선들에 선택적으로 표현 유전자에 대한 mRNA 수준의 질량 분광법, 분석을 사용하여 선의 luminal 내?...
Access restricted. Please log in or start a trial to view this content.
공개
감사의 말
이 작품은 블랙 위도우 스파이더 실크스의 NSF 루이 부여 MCB - 0950372받을 분자 특성에 의해 지원되었다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Sodium chloride | Electron Microscopy Sciences | SX0420-1 | 0.1 M in water |
| Diethyl pyrocarbonate | Sigma-Aldrich | D-5758 - 5 ml | 0.1% v/v |
| Sodium citrate | Sigma-Aldrich | S1804 - 1 kg | 0.015 M in water |
| Dissecting microscope | Leica Microsystems | Leica MZ16 | |
| Digital microscope camera | Leica Microsystems | DFC320 | Software - Leica Application Suite v2.8.1 |
| Vannas scissors | World Precision Instruments, Inc. | 500260 | |
| Stainless steel forceps | World Precision Instruments, Inc. | 501764 | Mini Dumont #M5S |
| Insect pins | Indigo Instruments | 33414-2 | Insect pins #2 |
| Small or large dissection dishes | Living Systems Instrumentation | DD-50-S or DD-90-S | 52 mm diameter x 18 mm H (Sylgard Depth ~6mm) or 93 mm x 22 mm |
| Drosophila culture vials | Carolina Biological | FR-17-3076 | Size is 31.75 mm diameter x 101.6 mm |
참고문헌
- Vollrath, F., Knight, D. P. Int. J. Biol. Macromol. 24, 243-243 (1999).
- Gosline, J. M., Guerette, P. A., Ortlepp, C. S. J. Exp. Biol. 202, 3295-3295 (1999).
- Gosline, J. M., DeMont, M. E., Denny, M. W. Endeavour. 10, 31-31 (1986).
- Hinman, M. B., Jones, J. A., Lewis, R. V. Trends Biotechnol. 18 (9), 374-374 (2000).
- Lewis, R. V., Xu, M. Proc. Natl. Acad. Sci. 87, 7120-7120 (1990).
- Colgin, M. A., Lewis, R. V. Protein Sci. 7 (3), 667-667 (1998).
- Tian, M., Lewis, R. V. Appl. Phys. A-Mater. 82, 265-265 (2006).
- Hu, X., Lawrence, B., Kohler, K. Biochemistry. 44 (30), 10020-10020 (2005).
- Vasanthavada, K., Hu, X., Falick, A. M. J Biol Chem. 282 (48), 35088-35088 (2007).
- Hayashi, C. Y., Blackledge, T. A., Lewis, R. V. Mol. Biol. Evol.. 21 (10), 1950-1950 (2004).
- Blasingame, E., Tuton-Blasingame, T., Larkin, L. J Biol Chem. 284 (42), 29097-29097 (2009).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유