JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
배아 줄기 세포 생활에서 염색질 단백질 역학을 측정하는 Assays (FRAP 및 플립)를 Photobleaching
요약
우리는 Photobleaching 후 형광 복구 (FRAP)와 배아 줄기 (ES) 세포에서 염색질 단백질 역학을 모니터 (플립) Photobleaching에서 형광 손실을 포함하여 photobleaching 방법을 설명합니다. 염색질 소성을 연구하는 방법 중 하나가 될 것으로 간주됩니다 염색질 단백질 역학은, pluripotent 세포 향상됩니다.
초록
Photobleaching 후 형광 복구 (FRAP)와 Photobleaching에서 형광 손실 (플립)는 좋은 공간과 시간적 해상도를 가진 살아있는 세포의 단백질 역학 연구를 활성화합니다. 여기 FRAP 및 마우스 배아 줄기 (ES) 세포에 H1과 HP1 포함 염색질 단백질의 플립 assays을 수행하는 방법에 대해 설명합니다. FRAP 실험에서 세포는 녹색 형광 단백질 (GFP) 또는 그에 파생 상품 (YFP, CFP, 체리 등) 융합 관심의 단백질과 중 transiently 또는 안정, transfected 있습니다. transfected, fluorescing 세포에서 강렬한 초점 레이저 빔을 관심의 비교적 작은 영역 (ROI)을 표백제. 레이저 파장은 융합에 사용되는 형광 단백질에 따라 선택됩니다. 레이저 빛이 irreversibly 투자 수익 (ROI)에있는 분자의 형광 신호를 표백제와 즉시 표백 다음, 표백 영역에서 형광 신호의 복구 - 표백하지 않은 분자와 표백 분자의 교체에 의해 중재가 - 시간 저속 이미징을 사용하여 모니터링할 수 있습니다. 생성된 형광 복구 곡선은 단백질의 이동성에 대한 정보를 제공합니다. 형광 분자가 고정되어있다면, 어떤 형광 복구 관찰되지 않습니다. 보완적인 접근에서, Photobleaching에서 형광 손실 (플립)은 레이저 빔을 반복 같은 자리를 표백제와 신호 강도가 다른 fluorescing 세포 단위로 측정됩니다. 뒤집기 실험 따라서 오히려 형광 복구보다 신호 부패를 측정하고 세포 구획 사이 였죠 단백질의 이동성뿐만 아니라 단백질을 확인하는 데 유용합니다. 과도 바인딩은 염색질 결합 단백질의 일반적인 속성입니다. 각 염색질 단백질의 주요 분율이 일정한 상태에서 특정 순간에 염색질에 바인딩되어 있지만, 바인딩은 일시적이며 대부분의 염색질 단백질 초의 순서에 체류 시간, 염색질에 대한 높은 매출 있습니다. 이러한 속성은 게놈의 표현 1 높은 소성을 생성하기위한 열쇠입니다. 염색질 단백질 (heterochromatin 단백질 1 (HP1), 링커 히스톤 H1 및 핵심 histones 포함)의 동적 교환이 높습니다 어디 Photobleaching 실험 따라서 특히 ES 세포에서 염색질 구조 단백질 GFP - 퓨전 버전을 사용 염색질 소성을, 결정하기 위해 특히 유용합니다 2,3 차별화된 세포보다.
프로토콜
1. ES 세포를 도금
T = 0 시간
MEF 도금
- 문장 라이브 영상 μ - 슬라이드 8 자 (ibidi, 뮌헨, 독일) 젤라틴이나 chambered 커버 안경에서 (연구실 - 테크, 로체스터, NY) 또는 유리 바닥 문화 요리 (MatTek, 애쉬, MA). 50-30 분두고 무료 젤라틴 멀리 대기음.
- 시드 22,000 MEFs / 잘 DMEM 250 μl 총 볼륨의 [10% 태아 소 혈청 (FBS)와 보충]. 세포 조직 문화 인큐베이터 (37 ° C 5 % CO2)의 성장을 허용합니다.
T는 = 6 시간
ES 세포 도금
- 기음 DMEM.
- 종자는 / 잘 ES 세포 미디어 250 μl 총 판매량 15,000 R1 세포와 잘 코팅 각 MEF은 [10% ESC 등급 태아 소 혈청 (FBS), 1 MM 나트륨 pyruvate, 0.1 MM 불필요한 아미노산, 0.1 MM의 β -와 보충 메르 캅 토 에탄올, 1000 U / ML 백혈병 억제 인자 (난생)], 다음날 30 % 50% 합류를 얻을 수 있습니다.
2. ES 세포 Transfecting
T는 = 24 시간
과도 transfection
- 250와 함께 μl / 잘 신선한 ES 세포 미디어의 ES 세포 미디어를 교체합니다.
- 1.5 ML 멸균 시험관에서, 100 μl 혈청 무료 미디어 [Opti - 멤 (Gibco)] 후 바로 혈청을 무료로 미디어에 10 μl 대중 교통 - LT1 transfection 시약 (Mirus)을 추가를 추가합니다. 부드러운 pipetting으로 혼합하고 50-20 분 실온에서 알을 품다.
- 1.5 μg의 GFP 융합 플라스미드 DNA (H1e, H1o 또는 HP1) 희석을 통과 - LT1 시약을 추가합니다. 부드러운 pipetting으로 혼합하고 15-30 분 실온에서 알을 품다.
- / 잘 transfection 혼합물의 13.5 μl를 추가합니다. 소용돌이는 μ - 슬라이드 8 - 음도 분산을 위해. 24 시간 신선한 ES 세포 미디어 250 μl로 이전 ES 세포 미디어를 교체 후.
3. FRAP 및 뒤집기 공연
T는 = 48-72 시간
- 실험이 어떤 공촛점 레이저 스캐닝 현미경 (CLSM)에서 수행할 수 있지만 정상 FRAP / 플립 실험 이후, 많은 연속 이미지를 찾았습니다, 그것은 수집 속도를 수있는 회전 디스크 공촛점 현미경을 사용하는 것이 좋습니다 그리고 보장이란 말야 표백 바람직하지 않은 샘플의 초기 의도 표백 이벤트 다음 발생합니다. 여기, 우리는 요코 CSU - X 회전 디스크 헤드와 디스크 공촛점 시스템 (www.Andor.com)을 돌고있는 혁명를 사용하는 것이 좋습니다. 이 시스템은 포인트 스캐닝 시스템을 갖춘 전문 FRAPPA 모듈을 사용하여 photobleach 수있는 듀얼 용량을 가지고 있으며, 빠르게 회전하는 디스크를 사용하여 이미지를 수집하기 위해 빛을 다시 전환할 수 있습니다. 실험을 photobleaching에 사용되는 가장 일반적인 세 fluorescing 단백질은 GFP, YFP 체리입니다. GFP 또는 YFP를 사용하는 경우, ~ 488 nm의 레이저가 필요합니다. 체리 들어, ~ 560 nm의 레이저를 사용합니다. 모든 경우에, 우리는 고체 레이저를 사용하는 것이 좋습니다. 자동 무대를 갖는 것은 유용하지만, 필요하지 않습니다. 라이브 세포가 몇 군데 있기 때문에, 그것 (우리가 LIS에서 하나를 사용하여, 스위스) 환경 챔버를 사용하는 데 필수적이며, 제어 산소, 습도, CO 2 및 온도. FRAP는 영상이 필요한 최소한의 레이저 전원 (일반적으로 형광 수준이 적합 10 % 지역에)로 이루어집니다 동안 최대의 레이저 강도를 사용하여 수행됩니다.
적절한 파장의 형광으로 세포를 관찰하고 60X 기름 침지 렌즈를 사용하여 GFP를 표현하는 셀을 선택합니다. 올바른 subcellular 분포를 확인하십시오. 때때로 표현 수준이 너무 높은 경우, 단백질의 지방화는 nucleolus 다른 구획에 '유출'수 있습니다. 이러한 세포가 선택되지 않습니다. - 지금 이미징 프로토콜을 설정 euchromatin 또는 heterochromatin (응축 GFP foci로 볼)에 다음 photobleaching 전에 photobleach 3-5 프레임을 수집하고 MS 250-1000 간격으로 photobleach 후 90-120 프레임을 수집 H1e - GFP, 1000 MS, H1o 및 HP1 - GFP, 250 MS (간격 시간 변경이 매우 역동적인 단백질은 짧은 간격 시간을 필요로하는 단백질 역학에 따라). 우리는 일반적으로 20-40 μseconds (1-2 반복)의 레이저 펄스와 photobleaching에 대한 80~100% 레이저 강도를 사용하지만,이 숫자는 분석 단백질과 표현 수준에 따라 변경할 수 있습니다. photobleaching 적절한 때, 당신은 GFP의 형광의 "블랙홀"을 준수해야합니다. 블랙홀은 점차 형광 다음과 같은 복구와 함께 다시 채워집니다. 회전 디스크가 초당 60 주변 이미지 (하나의 휴대폰으로 확대하면 좋은 형광 강도와)까지 얻을 수 있지만, 우리는 낮은 이미지 품질과 잠재력을 증가 phototoxicity로 인해 이러한 높은 속도로 시스템을 사용하지 않는 것이 좋습니다.
- 플립 실험, 다른 영상 프로토콜을 설정 : 이미지를 수집하는 동안 같은 자리에서 표백 반복 시작 후, 표백하기 전에 3-5 프레임을 수집합니다. H1o - GFP, 표백을 위해 H1e - GFP, 표백제 매 5 초마다 2 초, 그리고 HP1 - GFP 표백마다 1 초하십시오. 블리치D 전체 실험에 걸쳐 반복적으로 이미지를 수집합니다.
- 두 기법, 20-30 세포의 과정을 반복합니다. 통계 목적, 선호 다른 일에 실험을 3 회 이상 반복합니다. 동질적인 인구와 올바른 설정, 표준 편차는 (<5 %) 일반적으로 낮습니다.
FRAP 및 뒤집기 모두 들어, 표백 영역의 크기와 모양은 복구 역학에 영향을 미칩니다 및 실험 시간 상수 있어야합니다. 또한, 두 세포와 비교하는 경우, 동일한 프로토콜을 사용해야하며 전지는 전력 레이저 및 기타 조건이 변동될 수 있으며 실험의 결과에 영향을 미칠 수 있으므로 당일에 순차적으로 분석해야합니다.
4. FRAP 및 뒤집기 데이터 분석
- 모든 FRAP 프레임이 수집에서는,의 형광 강도를 측정하는 ROI (투자 수익 (ROI) B = 표백 지역), 배경 영역 (ROI BG), 그리고 전에 시간의 함수로하고 표백 후 비 표백 핵 영역 (ROI NB). 표백 영역이 무시할 때 전체 핵이 정상화 목적으로 선택할 수 있습니다.
- / (ROI NB - 투자 수익 (ROI) BG) - (ROI BG 투자 수익 (ROI) B) / (pbROI B - pbROI BG) / (pbROI NB - pbROI BG), PB 사전 표백 나타냅니다 : 매주 시점 들어, 수식에 따라 데이터를 정상화. 사전 표백 이미지 당신은 약 1의 값을 얻을 것입니다. 표백제 후 첫 번째 이미지는 블리치 깊이를 나타냅니다. 실제 블리치 깊이 값을 1에서 값을 뺍니다. 모든 세포와 각 실험에서 평균 20-30 전지 반복합니다.
- 수집된 모든 플립 프레임에서 (ROI NB = 비 표백 지역, 투자 수익 (ROI) BG = 배경) 이외의 표백 핵 영역에서 형광 강도, 그리고 배경 영역을 측정합니다. 플립 데이터의 계산은 FRAP 곡선과 유사합니다, 오직 분석 ROI (투자 수익 (ROI) NB)는 계산에 사용되지 않은 실제 표백 지역 다를되어야합니다 (ROI NB - 투자 수익 (ROI) BG) / (pbROI NB - pbROI BG) . 그것은 정규화의 목적 이웃 셀 (ROI N = 이웃 세포)를 사용하는 것도 가능합니다 : (ROI NB - 투자 수익 (ROI) BG) / (ROI N - 투자 수익 (ROI) BG) / (pbROI NB - pbROI BG) / (pbROI N - pbROI BG ).
데이터 수집에 따라, 그것은 컴퓨터 시뮬레이션으로 실험 데이터를 맞게 수 있습니다. 이것은 좋은 근접, 모바일 분수, 고정되어 분수와 반 최대와 계산할 수 있습니다. 우리는 여기서 FRAP 분석의 수학 및 통계 측면을 토론하고 다른 훌륭한 출판물 4-9로 독자를 참조하지 않습니다. 표백 깊이는 사전 표백제 (100 %) 신호 및 표백 후 첫 이미지 사이의 거리 (Y - 축)에를 말합니다, 모바일 분율은 표백제 깊이와 사이의 거리 (Y - 축)에를 말합니다 복구 신호를 반응 속도론은 고원을 도달하고, 고정되어 분수가 회복 신호와 사전 표백제 (100 %) 신호 사이의 거리 (Y 축)에 (인물 1B와 2B 참조)을 말합 때. 이 분석 외에도, 데이터에 맞는 좋은 수학적 모델이 있습니다. 단일 지수, 방정식에 대한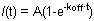
t 시간이 어디에 있는지, A는 1 - A는 모바일 분수입니다 고정되어 분수이며, K는 해제 상수 분리이며, 데이터에 맞게 사용할 수 있으며, 바인딩의에서 속도의 직접적인 추정 (K 해제)는 수 뿐만 아니라 협회 속도를 계산하는 데 사용할 수있는 매개 변수에 대해, 취득.
5. 대표 결과 :
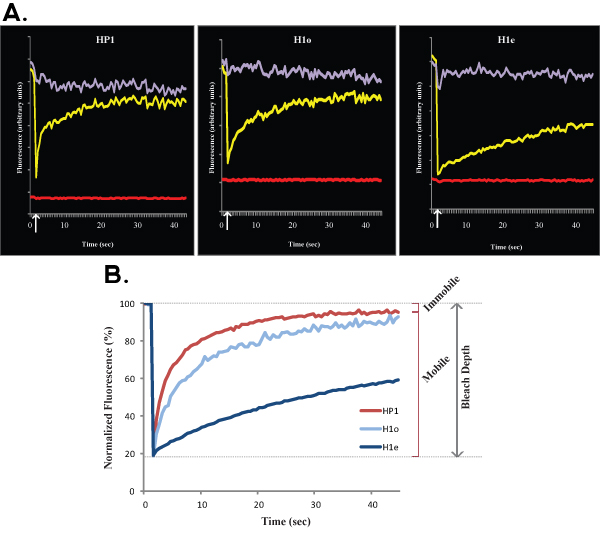
그림 1. A와 HP1 (왼쪽), H1o (가운데)과 R1 ES 세포에서 H1e (오른쪽)의 B 쇼 대표 FRAP 곡선. 단순하고 명확 그림에 대한 1A는 정상화하고 계산 전에 단세포의 원시 데이터를 보여줍니다. 노란색 곡선은 표백 지역에 해당하는, 보라색 커브가 아닌 표백 핵 영역 (표백 영역이 무시할 때 전체 핵이 정상화의 목적으로 선택할 수 있습니다)에 해당하고, 빨간색 라인은 배경 형광에 해당 이 경우 최소한. 수직 화살표는 표백제 시간을 나타냅니다. 정규와 평균 데이터는 그림 1B에 표시됩니다. HP1 (적색)와 비교 H1 (파란색)의 느린 복구를합니다. 또한 H1e 변종 (진한 파란색)은 H1o 변종 (하늘색)보다 느립니다. 모바일 및 고정되어 분수와 블리치 깊이가 HP1에 대해 표시됩니다.
2. A와 B를 비교 euchromatin 쇼 대표 FRAP 곡선 (그림R1의 ES 세포의 HP1의 heterochromatin (오른쪽)와 함께) 떠났다. 마찬가지로 1 그림, 그림 2A는 단일 세포의 원시 데이터를 보여줍니다, 노란색 곡선은 표백 지역에 해당하는, 보라색 커브가 아닌 표백 핵 영역에 해당하고, 빨간색 선은 배경 형광에 해당합니다. 수직 화살표는 표백제 시간을 나타냅니다. 정규와 평균 데이터는 그림 2B에 표시됩니다. euchromatin (조명 적색)와 비교 heterochromatin (어두운 빨강)의 느린 복구를합니다. 모바일 및 고정되어 분수와 블리치 깊이는 euchromatin에 대해 표시됩니다.
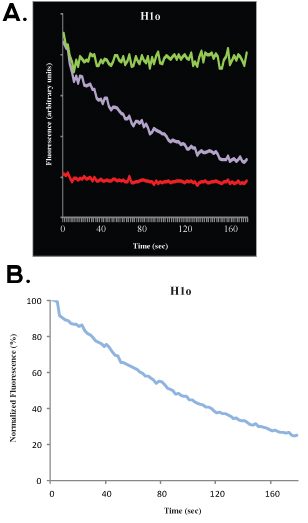
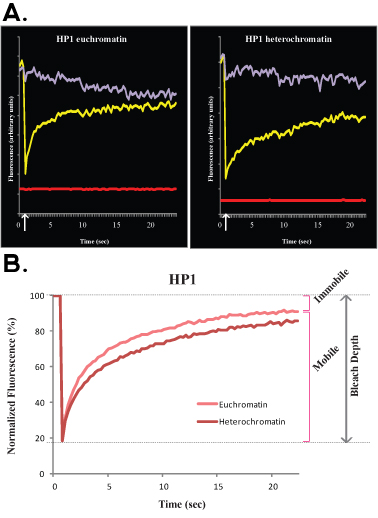
그림 3.. H1o R1 ES 세포의 전형적인 플립 실험은 그림 3A (원료, 취소 정규화된 데이터)와 B (정규 및 평균 데이터)에 표시됩니다. 본 실험에서는 자주색 곡선이 아닌 표백 핵 영역에 해당하는, 녹색 라인은 이웃 세포 핵에 해당하며 빨간색 선은 배경 형광에 해당합니다.
토론
세포 집단 또는 고정 세포, FRAP 실험에서 정화 염색질을 포함 대부분의 사용 가능한 기술과 달리 살아있는 세포에서 염색질 단백질 역학의 변화를 따릅니다. 우리는 염색질 단백질 역학 염색질 소성 좋은 지표가된다는 것을 발견. 그러나, 그것이 융합에게 GFP와 관심의 유전자를 필요로하기 때문에, 형광 태그의 추가는 단백질의 기능을 방해할 수 있습니다. 따라서, 사전 FRAP 진행하는 융합 단백질?...
공개
감사의 말
우리는 중요한 의견과 매일 문제 해결 photobleaching 실험, 특히 Meshorer 연구실의 구성원, 샤이 Melcer, 안녕 Alajem, Edupuganti Raghu RAM, Badi 스리랑카 Sailaja, 애나 Mattout 및 알바 비란 감사드립니다. EM은 조셉 H. 및 벨 R. 브라운은 생명 과학의 수석 강사이며, 이스라엘 과학 재단 (ISF 943/09), 건강의 이스라엘 교육부 (6007) 유럽 연합 (IRG - 206872 및 238176)에 의해 지원됩니다 이스라엘 암 연구 재단, 히브리어 대학과 이스라엘 Psychobiology 연구소의 내부 Applicative 의료 기금.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | |
|---|---|---|---|
| DMEM | 시그마 | D5671 | |
| 젤라틴 | 머크 | 1.04078 | |
| Opti - 멤 | Gibco | 31,985 | |
| 대중 교통 - LT1 | Mirus | MIR2300 | |
| μ - 슬라이드 8 - 잘 | ibidi | 80,826 |
참고문헌
- Phair, R. D. Global nature of dynamic protein-chromatin interactions in vivo: three-dimensional genome scanning and dynamic interaction networks of chromatin proteins. Mol Cell Biol. 24, 6393-6402 (2004).
- Meshorer, E., Girard, L. . Imaging chromatin in embyonic stem cells in StemBook. , (2008).
- Meshorer, E. Hyperdynamic plasticity of chromatin proteins in pluripotent embryonic stem cells. Dev Cell. 10, 105-116 (2006).
- Bancaud, A., Huet, S., Rabut, G., Ellenberg, J. . Fluorescence perturbation techniques to study mobility and molecular dynamics of proteins in live cells: FRAP, photoactivation, photo conversion, and FLIP. , (2009).
- Dundr, M., Misteli, T. Measuring dynamics of nuclear proteins by photobleaching. Curr Protoc Cell Biol. Chapter 13, Unit 13-Unit 13 (2003).
- Ellenberg, J. Nuclear membrane dynamics and reassembly in living cells: targeting of an inner nuclear membrane protein in interphase and mitosis. J Cell Biol. 138, 1193-1206 (1997).
- Lenser, T., Weisshart, K., Ulbricht, T., Klement, K., Hemmerich, P. Fluorescence fluctuation microscopy to reveal 3D architecture and function in the cell nucleus. Methods Cell Biol. 98, 2-33 (2010).
- Mueller, F., Mazza, D., Stasevich, T. J., McNally, J. G. FRAP and kinetic modeling in the analysis of nuclear protein dynamics: what do we really know. Curr Opin Cell Biol. 22, 403-411 (2010).
- Phair, R. D., Misteli, T. Kinetic modelling approaches to in vivo imaging. Nat Rev Mol Cell Biol. 2, 898-907 (2001).
- Poser, I. BAC TransgeneOmics: a high-throughput method for exploration of protein function in mammals. Nat Methods. 5, 409-415 (2008).
- Sigal, A. Generation of a fluorescently labeled endogenous protein library in living human cells. Nat Protoc. 2, 1515-1527 (2007).
- Cohen, A. A. Dynamic proteomics of individual cancer cells in response to a drug. Science. 322, 1511-1516 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유