Method Article
라이브 랫 두피 뉴런에서 Mitochondrial 분리막 잠재력과 반응 산소 종의 결정
요약
우리는 특정 자극의 응용 프로그램을 이전과 이후 TMRM 형광 강도의 상대적 변화를 결정하기 위해 대뇌 피질의 뉴런에서, 형광 표시기, TMRM의 응용 프로그램을 보여줍니다. 우리는 또한 형광 프로브 H의 응용 프로그램을 표시 2 DCF - DA 대뇌 피질의 뉴런의 반응 산소 종의 상대적 수준을 평가합니다.
초록
Mitochondrial 막 잠재적인 (ΔΨm)는 ATP를 생성하는 호흡 체인의 생리 기능을 유지하기위한 중요합니다. ΔΨm의 큰 손실이 이후의 죽음과 에너지의 고갈 세포를 렌더링. 반응 산소 종 (ROS)는 중요한 신호 분자 있지만, 병적인 조건에서 그들의 축적은 산화 스트레스로 연결됩니다. 세포에 ROS의 두 가지 주요 소스는 환경 독소 및 산화 인산화 과정입니다. Mitochondrial 장애 및 산화 스트레스는 많은 질병의 pathophysiology에 연루되어있다, 그러므로 ΔΨm 및 ROS를 결정하는 능력은 세포와 mitochondria의 기능의 생리적 상태에 대한 중요한 단서를 제공할 수 있습니다.
여러 형광 프로브 (Rhodamine 123, TMRM, TMRE, JC - 1) 세포 유형의 다양한 Δψm을 결정하는 데 사용, 그리고 수 많은 형광 지표 (Dihydroethidium, Dihydrorhodamine 123, H 2 DCF - DA)는 ROS를 결정하는 데 사용할 수 있습니다 . 거의 ΔΨm 또는 ROS를 평가하는 데 사용 가능한 형광 프로브의 모든 ΔΨm이나 ROS의 수준을 증가 또는 감소 자극에 비례 자신의 형광 강도를 증가 또는 감소 단일 파장 지표입니다. 따라서, 그것은 기본 수준과 특정 자극의 적용 후 이러한 프로브의 형광 강도를 측정하는 필수적입니다. 이것은 하나가 기본 수준과 자극 사이의 형광 강도의 변화의 비율을 결정할 수 있습니다. 형광 강도이 변경 사항은 ΔΨm이나 ROS의 상대적인 수준의 변화를 반영합니다. 이 비디오에서는, 우리는 기본 수준 사이 FCCP, mitochondrial uncoupler를 적용한 후에 TMRM 형광 강도의 비율 변화를 확인하기 위해 쥐 대뇌 피질의 뉴런에 형광 표시기, TMRM을 적용하는 방법을 보여줍니다. FCCP 치료 인한 TMRM 형광의 낮은 수준 mitochondrial 막 잠재력의 탈분극을 반영합니다. 우리는 또한 H 2 O 2의 신청 후에베이스 라인 처음에 대뇌 피질의 뉴런에서 ROS의 수준을 평가하고 형광 프로브 H 2 DCF - DA를 적용하는 방법을 보여줍니다. 이 프로토콜은 (작은 수정)도 다른 세포 유형과 다른 뇌 영역에서 분리된 뉴런에 ΔΨm 및 ROS의 변화를 결정하는 데 사용할 수 있습니다.
프로토콜
1. 세포 배양
- 대뇌 피질의 뉴런은 고립과 앞에서 설명한 기법과 폴리 - D - 라이신과 laminin 1 코팅 유리 바닥 (MatTek 공사, 애쉬 랜드, MA)와 문화 요리에 도금을 사용하여 재배하고 있습니다.
2. 형광 프로브 TMRM와 H 2 DCF - DA에 대한 재고 솔루션을 준비
- 무수 dimethylsulfoxide 1 ML에 TMRM의 5.0 MG를 해소하여 TMRM의 10 MM 재고 솔루션을 준비합니다. 소용돌이 1 분 동안. 그런 다음, aliquots을하고 -20 ° C에서 그들을 저장, 빛으로부터 보호하고, 1 개월 이내에 사용합니다.
- 다음 무수 DMSO 1 ML에서 H 2 DCF - DA의 4.87 밀리그램을 용해하여 H 2 DCF - DA의 10 MM 재고 솔루션을 준비합니다. 마찬가지로, 와동 1 분 동안. 그런 다음, aliquots을하고 -20 ° C에서 그들을 저장, 빛으로부터 보호하고, 일주일 이내에 사용합니다.
3. TMRM 및 H 2 DCF - DA로 로딩 쥐 대뇌 피질 뉴런
TMRM는 mitochondria의 매우 부정적인 요금 내부에 축적 potentiometric, 셀 투과 형광 표시기입니다. mitochondrial TMRM의 자동 담금질을 피하기 위해 TMRM의 낮은 농도 (10-50 nm의 범위)를 사용하는 것이 중요합니다. 그런 다음, TMRM의 형광 신호는 내부 mitochondrial 멤브레인 전체 ΔΨm 직접 공동과 관련이있을 수 있습니다. ΔΨm의 손실이 형광 강도의 손실 발생 mitochondria에서 누출 TMRM됩니다. H 2 DCF - DA는 세포 - 세포 투과 esterases하여 DCF - DA로 변환 프로브 및 형광 DCF에서의 산화 결과입니다. 높은 로딩 농도도 H 2의 부재 O 2 DCF 형광의 채도가 발생할 수 있으므로 DCF - DA는 20-10 μm의 그것 사이의 범위 H 2의 최종 농도는 서로 다른 뇌 영역에서 파생된 뉴런에서 경험적으로 테스트해야합니다. 모든 내생이나 외인성 산화제의 존재 (예 : 질산 산화, 과산화수소)는 DFC 형광 강도를 증가합니다. 아래, 우리는 TMRM와 H 2 DCF - DA와 쥐의 대뇌 피질의 뉴런 로딩을위한 프로토콜을 제공합니다.
- 결핵 : : 145 MM NaCl, 5 MM KCl, 10 MM 포도당 1.5 MM CaCl 2, 1 MM MgCl 2, 10 TMRM와 쥐 대뇌 피질의 뉴런을로드하려면, 먼저 Tyrode의 버퍼 (텍스트 오버레이와 교양 뉴런에게 3 회 씻어 MM의 HEPES;) NaOH와 7.4으로 산도를 조정합니다. 그런 다음, TB의 1 / 1000 회 10 MM TMRM 주식을 diluting하여 TMRM 20 NM를 준비하고 TB 1 ML 당 희석 TMRM 2 μl를 추가합니다. 상온에서 어두운 곳에 45 분 TMRM과 뉴런을 품어. 45 분 후, 현미경의 무대에 문화 접시를 탑재하고 영상을 시작합니다.
- H 2 DCF - DA와 쥐의 대뇌 피질의 뉴런을로드하려면, 결핵과 교양 뉴런에게 3 회 씻는다. 다음 TB의 H 2 DCF - DA 주식 10분의 1 회 10 MM을 diluting하여 H 2 DCF - DA 2 μm의 준비를하고 TB 1 ML 당 희석 H 2 DCF - DA 2 μl를 추가합니다. 그런 다음, 상온에서 어두운 45 분 H 2 DCF - DA로 뉴런을 품어. 45 분 후, 이미지를 취득하기 전에 여분의 형광 표시기를 제거하는 결핵과 뉴런에게 4 번 씻으십시오.
4. ΔΨm을 결정하는 TMRM와 incubated 뉴런의 이미징 라이브
- TMRM, 공촛점 레이저 스캐닝 현미경 (텍스트 오버레이 : LSM 510, 칼 자이스 혈구 주)와 incubated 뉴런의 라이브 영상 수행하려면, 라이브 타임 시리즈 프로그램의 응용 프로그램과 함께하는 것은, 사용됩니다. 이미지를 취득하고 photobleaching 방지하는 데 필요한 시간을 최소화하기 위해; 낮은 해상도와 감쇠 레이저 파워 (1 % : 낮은 해상도의 레이저 파워 256 X 256 텍스트 오버레이)을 적용합니다.
- . 다음 반사광을 사용 TMRM와 함께 로드된 탑재 뉴런의 초점을 조정합니다. 514 NM에서 조명과 570 nm의에서 감지하여 TMRM 형광을 검사합니다. 단지 채도 수준 아래 카메라의 감지 게인을 설정합니다.
- 취득 해상도, 레이저 파워, 카메라의 감지 이득, 그리고 시간 경과 간격을 포함 모든 매개 변수되면 이미지 설정, 실험을 사이에 이러한 설정을 변경하지 마십시오. 다음 필드를 변경합니다. 이미지를 수집 시작합니다.
- ΔΨm의 변화를 테스트하려면, 그러한 FCCP 또는 2 μg / oligomycin의 ML, 1 μm의 같은 자극이 크게 각각 mitochondrial 멤브레인 잠재력을 depolarize 또는 hyperpolarize되는, 적용할 수 있습니다. 이러한 변경 사항은 FCCP의 경우에 기준 형광 강도, 또는 oligomycin의 경우 TMRM 형광 강도의 증가와 비교 TMRM 형광 강도의 감소로 반영됩니다.
5. ROS를 확인하는 H 2 DCF - DA와 incubated 뉴런의 라이브 영상
- H 2 DCF - DA, 최초로 incubated 뉴런의 라이브 영상을 수행하려면, 현미경의 무대에 문화 접시를 탑재합니다. 우리 세포의 초점을 조정주입은 빛을 반사. 488 nm의 여기에서 그리고 515 nm의 방출에 의해 DCF 형광을 검사합니다.
- 다음 5-7 %, 검출기 이득, 256 X 256의 해상도 레이저 파워를 조정합니다. 실험을 사이에 이러한 설정을 변경하지 마십시오. 그런 다음, 시간 시리즈 프로그램을 사용하여 라이브 영상을 얻기위한 주파수를 설정합니다.
- 새로운 분야를 선택하고 이미지를 획득 시작합니다. ROS 수준의 변화를 감지하기 위해, H 2 O 2 100-200 μm의와 세포를 치료. 이것은 기준 레벨과 비교 DCF 형광 강도의 증가로 반영됩니다.
6. 데이터 분석
- 영역을 선택 LSM 프로그램에서 도구 : 관심 지역 (ROI 텍스트 오버레이)를 사용합니다. 그런 다음, TMRM 또는 ROS 형광 강도를 측정합니다. mitochondrial 지역 또는 TMRM이나 ROS의 형광 강도, 각각을 측정하는 몇 군데 세포에서 전체 세포 본체에서 로아에서 로아를 선택합니다.
- TMRM 또는 각 시점에 대한 ROS에 대한 모든 군데 세포에 대한 전체 세포 기관에서 각 세포의 모든 로아에서 평균 형광 강도를 계산합니다. 배경 형광 강도를 계산하기 위해 셀 옆에 지역을 선택합니다. 몇 가지 측정을 가지고 평균 배경 강도를 계산합니다.
- Microsoft Excel을 사용하여 각 시점의 각 세포에 로아의 평균 형광 강도의 평균 배경 형광 강도를 빼기. . 배경 강도를 공제한 후,이 수식을 (ΔF = FF O / F O X 100, F = 기본 형광 어느 시점에서 = 형광 강도, 텍스트 오버레이)를 사용하여 기준 형광에 TMRM 또는 DCF 형광 강도를 정상화 그런 다음, 시간이 지남에 따라 형광 강도의 변화를 보여주는 줄거리를 생성하는 시그마 플롯 프로그램을 사용합니다.
7. 대표 결과
그림 1A는 TMRM와 incubated 쥐의 대뇌 피질의 뉴런의 형광 이미지를 보여줍니다. FCCP, mitochondrial uncoupler의 또한 mitochondrial 탈분극 및 TMRM의 형광 강도 (그림의 1B)의 손실로 연결됩니다. 기준 TMRM의 형광 수준 FCCP를 추가 (.; 그림 1C 처음으로 350 초) 전에 안정 남아 있습니다. 시간이 지남에 따라 TMRM 형광 변화를 정량 분석 FCCP (그림 1C)를 추가 후 TMRM의 형광에 상당한 감소를 보여줍니다.
그림 1D는 DCF로로드 쥐의 대뇌 피질의 뉴런의 형광 이미지를 보여줍니다. 에서 H 2 O 2 결과 또한 (그림 1E) 세포 기관에서 DCF 형광 강도를 증가했다. 기준 DCF 형광 수준은 H 2 O 2의 응용 프로그램을 이전 (처음 120 초) 변경됩니다. DCF 형광의 시간 - 저속도 측정은 안정 수준을 보여, H 2 O 2 치료 (그림 1 층) 이후 증가하는.
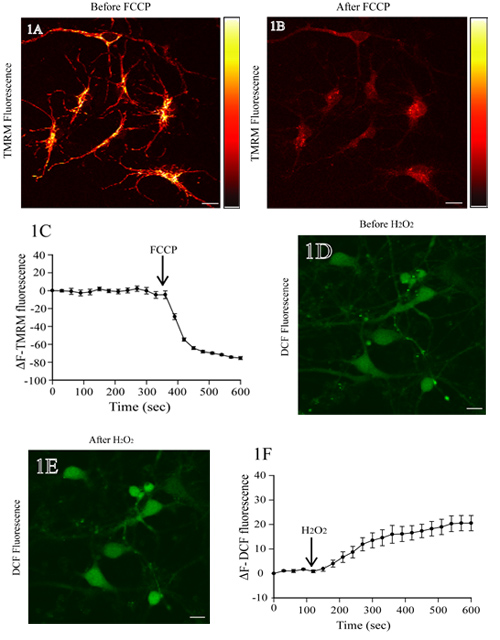
그림 1. mitochondrial 막 잠재력과 라이브 쥐의 대뇌 피질의 뉴런에서 ROS 수준의 평가. (A) 대뇌 피질의 뉴런 대표 형광 이미지 TMRM 탑재. 기본 TMRM 형광 스캔 후 뉴런은 protonophore FCCP (1 μm의)와 치료를했다. 오른쪽에있는 밝은 노란색과 검은색으로 표현하는 최대 및 최소 강도 각각과 TMRM 형광의 강도 pseudocolor 바 있습니다. mitochondrial 지역의 TMRM의 형광의 손실이 FCCP 치료 (패널 B)에 따라 ΔΨm의 붕괴를 나타냅니다. 다른 시간 시점에서 TMRM 형광 강도 변화의 양적 표현 FCCP 치료 전후 패널 C. (D)에 H2DCF - DA와 함께 로드된 쥐의 대뇌 피질의 뉴런의 형광 이미지를 볼 수 있습니다. 기본 DCF 형광을 결정 후, 세포는 200 μm의 H 2 O 2로 치료했고, DCF 형광의 변화는 평가했다. DCF 형광의 증가는 H 2 O 2 치료 (E)시 ROS 수준의 증가를 반영합니다. DCF 형광의 변화의 정량 분석, H 2 O 2 치료 전후는, 패널 F. 스케일 표시줄에 = 10 μm의를 표시합니다
Video.7.1 - labmedia 2704_Joshi.avi
40X 목표를 사용하여 FCCP 추가 전후의 대뇌 피질의 뉴런에 TMRM의 세포 이미징을 살고있다. pseudocolor 강도가 최대 (FCCP 추가하기 전에 밝은 노란색을) 보여 주며 (붉은 색, FCCP 추가 후) FCCP 추가 후 TMRM 형광 강도를 감소. 비디오를 보려면 여기를 클릭하십시오
비디오. 7.5 - labmedia 2704_Joshi.avi
40X 목표를 사용하여 H 2 O 2 또한 이전과 이후 대뇌 피질의 뉴런에서 DCF의 세포 이미징을 살고있다. 기준 DCF 형광은 세포 기관에서 밝은 녹색 색상을 보유하고 H2O2 또한 DC 증가밝은 녹색 색상 F 형광 강도. 비디오를 보려면 여기를 클릭하십시오
토론
우리는 각각 형광 표시기 TMRM와 H 2 DCF - DA를 사용하여 쥐의 대뇌 피질의 뉴런에 ΔΨm과 ROS를 결정하는 방법을 설명하는 단계별 절차를 제공합니다. 다른 세포 유형에 대한, 경험적으로 TMRM 또는 H 2 DCF - DA의 최종 농도 및 로딩 시간을 결정하는 것이 중요합니다. 일반적으로 TMRM 20-200 NM의 농도 범위, 그리고 TMRM과 세포 배양 시간은 20 60 분 다릅니다. H 2의 최종 농도는 DCF - DA는 20-10 μm의 범위에서,이 표시기를 포함하는로드 솔루션 세포의 배양은 30-45 분부터 다릅니다.
어떤 자극이없는에있는 세포 및 형광 강도의 변화 (TMRM 형광 깜빡 예를 들어)을 모두 사진 독성을 피하기 위해 이미지를 복용의 레이저 전원 및 스캔 속도를 최적화하는 것이 중요합니다. 최적화된 광학 설정은 자극의 부재에서 (요건) 포화 이상 또는 이하가 아닌 형광 신호를 발생한다. 라이브 영상을 10-15 분에 대한 자극의 부재에서 프로브의 형광 강도에 변화가없는 경우 특정 레이저 파워와 스캔 속도로 선택한 필드에서 이미지를 수집하기 위해 최적의 조건을 달성하고 있습니다.
ΔΨm을 결정하기 위해 다른 형광 프로브는 rhodamine 123와 테트라 메틸 에틸 에스테르 rhodamine (TMRE)를 포함합니다. 그러나, 그들은 고립 mitochondria 2의 호흡 과정을 억제하는 것으로 확인되었습니다. 중요한 TMRM 낮은 농도 2 mitochondrial 호흡에 영향을주지 않습니다 낮은 phototoxicity 및 기타 프로브에 비해 3 photobleaching 있습니다. H 2 DCF - DA는 잘 세포의 유지와 같이 ROS에 대한 좋은 지표 등 peroxides 같은 여러 산화제 종, 슈퍼 산화물과 질산 산화물 4 인식합니다.
공개
감사의 말
이 작품은 국립 보건원 (JCB에 K22NS050137)에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | |
|---|---|---|---|
| 유리 바닥 문화 요리 | MatTek 코퍼레이션 | P35G - 1.5-14 - C | |
| NbActive4 | BrainBits | NbActive4 | |
| TMRM | Invitrogen | T668 | |
| H 2 DCF - DA | Invitrogen | C400 | |
| NaCl | 시그마 | S6191 | |
| KCl | 시그마 | P3911 | |
| CaCl 2 • 2 시간 2 O | 시그마 | C3306 | |
| MgCl 2 • 6H 2 O | 시그마 | M2670 | |
| D - 포도당 | 시그마 | G6152 | |
| HEPES | Invitrogen | 15,630 |
참고문헌
- Hilgenberg, L. G., Smith, M. A. Preparation of dissociated mouse cortical neuron cultures. J. Vis. Exp. , (2007).
- Scaduto, R. C., Grotyohann, L. W. Measurement of mitochondrial membrane potential using fluorescent rhodamine derivatives. Biophys. J. 76, 469-477 (1999).
- Ward, M. W. The amyloid precursor protein intracellular domain (AICD) disrupts actin dynamics and mitochondrial bioenergetics. J. Neurochem. 113, 275-284 (2010).
- Gunasekar, P. G., Kanthasamy, A. G., Borowitz, J. L., Isom, G. E. NMDA receptor activation produces concurrent generation of nitric oxide and reactive oxygen species: implication for cell death. J. Neurochem. 65, 2016-2021 (1995).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유