JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
C57BL/6J 마우스의 Stromal 셀 및 암종 세포 이식 내유
요약
이 보고서에서, 우리는 분리 시스템 및 마우스 유선에서 문화 기증자 세포를 증명하고, orthotopically stromal 분석받는 마우스에서 이러한 세포를 이식 : 내유 종양 개발하는 동안 상피 상호 작용합니다.
초록
내유 종양의 진행에 섬유아 세포를 포함한 세포 stromal의 영향은 잘 생쥐의 유선에 stromal 세포와 상피 세포의 이식을 통해 특히, 마우스 모델의 사용을 통해 문서화되었습니다. 현재 이식 모델은 종종 stromal 세포와 상피 세포의 다양한 유전 배경에 의한 immunocompromised 생쥐의 사용을 포함하고 있습니다. 세포외 매트릭스는 종종 일관성있는 세포 세포 상호 작용에 대한 두 가지 세포 유형을 포함하지만, Matrigel 또는 immunogenic 기판 아르 쥐 꼬리 콜라겐의 사용을 포함하는 데 사용됩니다. immunocompromised 생쥐에서 T 세포 기능의 부족 약물 개발 및 효능에 대한 중요한 의미와 함께, 생체내에 내유 종양 진행에 stromal 세포의 정확한 평가를 방지할 수 있습니다. 또한, immunocompromised 마우스는 특별한주의 조건을 번식하고 요구, 비용이 많이 드는 어려운 있습니다. 이러한 장애물을 극복하기 위해, 우리는 orthotopically 일관성 종양 형성을 유도하는 동일한 유전적 배경에서 마우스로 stromal 세포와 상피 세포를 이식하는 방법을 개발했습니다. 이 시스템은 기증자 C57BL/6J 마우스의 정상, 암종 관련 섬유아 세포, PyVmT 내유 암종 세포와 콜라겐을 수확 포함됩니다. 세포가 콜라겐에 포함된 다음과 여성 C57BL/6J 마우스의 사타구니 내유 분비에 이식하고 있습니다. 혼자 PyVmT 세포의 이식은 만져서 알 수있는 종양 30-40일 게시물 이식을 형성합니다. 60일에서 종점 분석은 섬유아 세포와 공동 이식 혼자 이식 PyVmT 세포에 비해 내유 종양의 성장을 향상 나타냅니다. C57BL/6J 마우스의 세포와 매트릭스는 이러한 연구에 사용했지만, 세포 매트릭스 및 이식 방식의 고립은 다용도을 보여주는 서로 다른 유전 배경을 마우스 방향으로 적용될 수 있습니다. 요약이 시스템은 stromal 세포와 상피 세포 사이의 분자 상호 작용을 조사하는 데 사용될 수 있으며, immunocompromised 마우스 모델에서 중요한 한계를 극복.
프로토콜
1. C57BL/6J 마우스의 분리 및 기증 콜라겐의 추출
- 승인 IACUC 방법을 사용하여 성숙한 정상 여성 C57BL/6J 마우스를 희생.
- 꼬리를 수확하고 조직을 소독하기 위해 45 분 동안 70 %의 에탄올에 만끽해보세요. 조직 종이로 꼬리를 건조, 알루미늄 호일에 포장. 필요한 때까지 -20 ° C에 꼬리를 저장합니다.
- 이러한 층류 후드로 멸균 환경에서 꼬리를 놓습니다. 가위를 사용하여 꼬리 루트에서 피부를 분리 벗겨 버릴 꼬리에서. 꼬리의 양쪽 0.5-1 센티미터 제거하고 서너 조각으로 남아있는 꼬리를 나눕니다. 꼬리에서 힘줄을 해부하다하고 메스 또는 레이저 블레이드를 사용하여 개별 섬유에 힘줄를 구분한다.
- 무균 컨테이너에 힘줄이 섬유를 전송하고 멸균 증류수로 씻으십시오. 5-7 생쥐의 꼬리에서 35 ML 살균 드 이온화 50 단위를 포함하는 물 / ML 페니실린 페니실린, 50 μg / ML 스트렙토 마이신 250 NG / ML amphotericin하고, 0.034 N에서 희석 초산을 포함한 50 ML 원뿔 튜브로 전송 힘줄 빙초산 (17 N)의 주식 솔루션입니다. 4 로커에 장소 ° C 일주일 동안 콜라겐을 추출할 수 있습니다.
- 15 분 동안 3000 g에서 테이블 톱 원심 분리기에 파편을 스핀. 1 시간 3만5천그램 (약 17,000 RPM)에서 베크맨 50.2 티의 로터와 스핀에 대한 적응이 폴리 카보 네이트 튜브에 뜨는, 약 30 MLS를 전송합니다.
- 뜨는의 볼륨 1-2 MG / ML의 농도를 달성하기위한 삭감해야합니다. 4 15 ultracel 50 K Amicon 여과 장치와 3,000 rpm으로 테이블 톱 원심 분리기의 회전에 뜨는을 전송 ° C. 멸균 원뿔 관에 여과물을 전송 및 저장할 수 있습니다. 볼륨이 5-6 ML로 감소 때까지 원심 분리를 반복합니다.
- 단백질 농도를 읽으십시오. 우리는 BSA 기준 (Biorad)와 undiluted 샘플을 사용하여 표준 브래드 포드 분석 (Biorad)를 사용합니다. 대조군으로하여 여과액에서 샘플을 측정합니다.
- 또한 6% SDS의 polyacrylamide 젤, 10 차선, 1.5 mm의 겔 두께에 콜라겐을 정화 샘플을 해결하여 추출의 순도를 확인하십시오. 63 MM 트리스 HCL 10 % 글리세롤, 1.5 ML eppendorf 튜브에 2% SDS 0.0025 % bromophenol 파란색을 포함하는 30 μl 1X SDS - PAGE 로딩 버퍼에 샘플을 20 μg을 준비합니다. 쥐 꼬리 콜라겐 유형 긍정적인 제어로 전에서 단백질의 상당 금액을 준비합니다. 또한, 2.5, 5, 10 PBS 및 1X 로딩 버퍼에 희석 20 μg을 BSA 표준 세트를 준비합니다. ° C 5 분 95에서 샘플을 끓여.
- 결로를 스핀 다운을 (10 초 동안 최대 속도) 샘플 시원하고 잠시 microfuge합시다.
- 분자량 마커와 함께 샘플 샘플을로드합니다. 예를 들어, 만화경의 Biorad 단백질 표준의 5 μl를로드합니다. 약 1 시간 150 볼트 또는 염료 앞에까지 Electrophorese가 바닥에 도달합니다.
- 젤을 제거하고 쿠매시 푸른 버퍼에 얼룩. 쿠매시 블루, 75 ML 빙초산, 드 - 이온화된 물 포함 1000 ML의 총 볼륨 500 ML 에탄올의 2g을 혼합하여이 버퍼를 준비합니다. 또한 쿠매시 파란색 시약없이 제외 제조법을 사용하여 destain 버퍼의 동일한 금액을 준비합니다. 쿠매시 파란색과 락커에 장소 충분한 볼륨 젤 커버.
- 얼룩 RT와 가만히 따르다 1 시간 동안 부드럽게 록. 그것이 진한 파란색으로 바뀝니다 destain 솔루션을 교체합니다. 하룻밤 젤을 감금하거나 개인 밴드는 겔에 해결될 때까지. 이 콜라겐 밴드 (분자 무게가 = 90 KDA 및 130 KDA) 찾아서 표준과 컨트롤에 대한 밴드의 강도를 적어 둡니다. 이미지 젤 문서 시스템을 사용하는 젤, 필요한 경우.
2. 정상 및 PyVmT C57BL/6J 마우스의 기증자 내유 암종 세포와 섬유아 세포의 분리와 문화
- 종양이 분명하고 승인 IACUC 방법을 사용 유전자 변형 생쥐 PyVmT에 만져서 알 수있는 때 희생 연령은 나이의 10 주 후에 여성의 정상 또는 유전자 변형 생쥐 PyVmT 일치.
- 평평한 표면에의 뒷면에있는 마우스를 노출하고 테이프 접착제를 사용하여 사지를 무력화.
- 가슴과 사타구니 유선의 젖꼭지 사이에 T 절개 다운 거꾸로를 만들고 내유 선들을 폭로 다시 피부 플랩를 가져옵니다. 내유 조직을 제거하고 수술 가위를 사용하여 작은 조각으로 말하다.
- 37 200 MG 트립신, 500 MG collagenase, 4 MG DNAse, 3 H에 대해 다음 얼음에 숙박하고 100,000 멸균 PBS의 hyaluronidase 단위 항생제 ° C. : 포함하는 효소 소화 칵테일 100 ML 준비
- PBS 4에서 5 분 1,500 RPM에서 테이블 톱 원심 분리기 각 샘플과 원심 분리기 세포 펠릿 10 % 태아 소 혈청 (FBS)이있는 10 ML ° C. 추가
- 부드럽게 뜨는을 기음과 PBS/10 % FBS의 5-7 ML에있는 세포 펠렛을 resuspend. 스핀을 반복하고 두 번 더 씻는다.
- 10% FB를 포함한 DMEM 10 ML에있는 세포 펠릿을 ResuspendS 50 단위를 포함하는 / ML 페니실린, 50 μg / ML 스트렙토 마이신과 콜라겐과 함께 코트 플레이트에 콜라겐 유형 I. 코팅 10cm 요리에 250 NG / ML amphotericin는 39로 (재고 1.5 MG / ML 사용) 콜라겐 1 ML을 희석 0.02 N 아세트산의 ML은 멸균 증류수 또는 PBS에 희석. 콜라겐의 Pipet 5 MLS는 10cm의 접시에 솔루션을 작업. 10 분 동안 최소 실온에서 알을 품다. 초과 콜라겐 대기음. 4 Parafilm 않는 접시와 저장 ° 일주일 C.
- 3 회 주 - 미디어 2 변경합니다. 조직의 성공적인 소화는 스핀들 모양의 세포로 둘러싸여 fibroblastic foci 상피의 존재에 의해 특징 것입니다.
- 선택 tryspinization하여 섬유아 세포와 상피 세포를 분리합니다. 미디어를 대기음 한 번 PBS로 세포를 씻어. 0.25 % 상온에서 세포 및 부화에 trypsin/0.54 MM EDTA (에틸렌 다이아 민 테트라 초산) Pipet 1 ML. 섬유아 세포는 상피 세포보다 더 느슨하게 자기편 수 있습니다. 2 분 후에 현미경으로 fibroblast 부대 확인, 세포가 정지 부동 또는 상피 foci 여전히 표면에 준수해야하는 동안 반올림해야합니다.
- 가볍게 섬유아 세포를 제거하기 위해 접시에 혈청을 포함하는 매체의 섬유아 세포와 부드럽게 pipet 10 MLS를 풀어야 요리를 누릅니다.
- Pipet로 5 단계에 설명된 15 ML 원뿔 관과 원심 분리기에 섬유아 세포를 포함하는 미디어). 콜라겐 코팅 10cm 요리에 이들 세포를 Replate하고 섬유아 세포와 상피 세포가 완전히 분리 때까지 선택 trypsinization 프로세스를 반복합니다.
- 이러한 CK14와 CK18과 같은 알파 평활근 굴지 (α - SMA)로 fibroblast 마커로 상피 마커에 대한 immunofluorescence 염색법에 의해 세포 순도가 있는지 확인합니다.
3. 교양 세포의 Immunofluorescence 염색법
- 6cm 요리 유리 coverslips를 놓습니다. 층류 후드에 5~10분에 대한 UV 노출에 의해 소독.
- 코트 실온 (RT)에서 10 분 동안 주식 콜라겐 솔루션을 작업 1-2 ML로 coverslip. 초과를 대기음.
- 샘플 당 200,000 상피 세포 또는 섬유아 세포를 Trypsinize 및 플레이트. 전체 미디어 3-5 ML을 추가하고 24 시간 동안 부화.
- 미디어를 대기음, PBS로 세포를 씻어 7 분 -20 ° C에서 얼음 차가운 메탄올에 수정.
- 두 번 PBS는 RT에서 1 시간 동안 1퍼센트 FBS를 포함하는 1-2 ML과 에탄올, 그리고 블록을 제거하는 PBS로 세포를 씻으십시오.
- 포셉를 사용 parafilm 또는 다른 소수성 표면 덮여 큰 얕은 용기에 coverslips과 장소를 제거합니다.
- 안티 - 부드러운 근육 굴지 (α - SMA (기저 상피 마커) 안티 - CK14, 안티 CK18 (luminal 상피 마커) : 차단 솔루션 1:100 다음과 같은 기본 항체를 희석.
- 직접 RT에서 1 시간 동안 coverslips에 항체의 Pipet 100 μl. 차단 솔루션에서 세포의 별도 coverslip을 품어,이 예제는 이차 항체 제어 역할을합니다.
- 직접 씻어 coverslip에 PBS의 항체와 pipet 1 ML을 대기음. 기음과 3-5 번 반복합니다.
- 1:100에서 안티 - 마우스 - 알렉사 488, 1 biotinylated 안티 - 마우스 : 500, 안티 - 마우스 - 알렉사 - 568 차단 솔루션에서 다음 이차 항체를 희석.
- 알루미늄 호일에 coverslips과 용기를 줄 바꿈. Pipet 직접 coverslips에 해당하는 이차 항체의 100 μl : 안티 - 마우스 - 알렉사 568, 안티 - 마우스 알렉사 488과 CK 14 biotinylated 방지 마우스로 얼룩과 CK18과 α - SMA. 가시 광선에서 샘플을 보호하기 위해 컨테이너를 커버.
- 항체를 기음과) 단계 9로 PBS로 세척. CK14 얼룩을 제외하고, PBS에서 샘플을 둡니다.
- PBS의 알렉사 568 1:500으로 복합 streptavidin을 희석. 어둠 속에서 RT 30 분 strepatividin - 알렉사 568과 CK14 스테인드 샘플을 품어. ) 단계 9로 PBS에 세척
- PBS 500 : DAPI 1 희석. 샘플에서 PBS를 기음과 어두운 10 분만에 RT를위한 DAPI와 부화.
- PBS로 샘플을 씻어. 의 Pipet 100 μl은 유리 슬라이드에 방지 페이드 시약을 연장되므로 세포가 유리 슬라이드에 직면하는 동안 coverslip을 켜십시오. 부드럽게 장착 언론과의 접촉을 한 각도로 coverslip을 기울이기.
- immunofluorescence 현미경을 사용하여 샘플 이미지. 약 2 주가 지난 것이다 immunofluorescence 신호를 보호하기 위해 어둠의 샘플 보관하십시오.
4. 접목을위한 콜라겐 임베디드 세포의 준비
- 콜라겐의 세포를 포함하기 위해서는 설정을 솔루션으로 콜라겐을 혼합하여 중합을 달성하기 위해 콜라겐의 산도를 낮출 필요가 있습니다. NaHCO3의 2.45 g, 1 M NAOH의 7.5 ML 및 멸균 증류수의 42.5 ML와 10X 얼 밸런스드 소금 솔루션의 100 ML (EBSS)를 혼합하여 설정 솔루션을 준비합니다. 또한 멸균 병에 부착된 병 최고 0.22 미크론 필터 장치를 이용하여 소독. <1의 비율 : 리가> 시작 4 솔루션을 설정 콜라겐 (재고 농도 1 MG / ML)를 섞는다. 이식한 경우, eppendorf 튜브에 솔루션을 설정하는 25 μl와 콜라겐 100 μl를 섞는다. 소용돌이 짧게 또는 pipet 샘플을 위아래로 철저하게 샘플을 혼합합니다.
- 콜라겐이나 5-10 μl 단위에서 설정 솔루션을 추가하고 중립적인 산도를 반영, 오렌지 색상으로 분홍색 빛을 혼합 변경 페놀 적색 염료까지 철저히 섞는다. 어두운 분홍색 기본 산도를 반영하면서 노란 색상 산성 산도를 나타냅니다. 중합을 방지하기 위해 얼음에 혼합 보관하십시오.
- trypsinization로 접시에서 섬유아 세포와 상피 세포를 제거합니다. 먼저, 미디어를 기음과 PBS 5 ML로 씻으십시오. Pipet 0.25 % 판 당 HBSS에 trypsin/0.54 MM EDTA (에틸렌 다이아 민 테트라 초산) 1 ML. 2~5분에 대한 RT에서 섬유아 세포를 품어. 2~6분에 대한 37oC에서 상피 세포를 품어. 세포를 느슨하게하기 위해 부드럽게 번호판을 누릅니다. 접시에 완전한 매체 9 ML을 pipetting하여 microscope.Quench에게 트립신을 사용하여 분리를 확인하고 살균 15 ML 원뿔 튜브에 세포를 전송합니다.
- 50 UL를 제거하고 hemocytometer로 세포를 계산합니다. 각각의 튜브에 세포의 전체 볼륨을 (약 10 ML) 참고.
- RT에서 5 분 1,500 rpm으로 펠렛은 세포. 세포 펠렛을 대기음하고 100,000 cells/100 μl의 농도로 세포를 resuspend. 예를 들어, 전체 미디어 500 μl의 총 볼륨 500000 세포를 resuspend.
- 별도의 튜브에 250,000 stromal 세포 (250 μl)와 100,000 종양 세포를 (100 μl) 섞는다. Microfuge 10 초 1000 RPM, pipetting으로 뜨는 제거합니다. 세포로 조정 콜라겐 솔루션 50 μl를 추가합니다. 고르게 세포를 해산하기 위해 Pipet 위아래로. Pipet 멸균 6cm 조직 문화 판에있는 50 μl가 원형 드롭을 형성합니다. ° C 10 분 중합에 37 그래프트를 품어.
- 부드럽게 각도로 틸팅 접시로 접시에 완전한 미디어 5 MLS를 추가하고 천천히 접시의 한쪽하여 미디어를 pipetting. 미디어가 그래프트을 커버까지 주변의 번호판을 기울이기.
- 37 24 시간 동안 품어 ° C. 즉시 이식.
5. C57BL/6J 마우스에서 콜라겐 임베디드 세포의 시각 교정 이식
- 이식 수술을위한 얇은 유리 막대를 조작. 알콜 램프를 사용하여 유리 파스퇴르 pipet을 가열. 포셉 사용하여 두께 2-3밀리미터에 pipet의 끝을 밖으로 스트레칭. 식지, 그리고 70 % 에탄올로 소독.
- autoclaving 및 70 % 에탄올에 의해 다음과 같은 수술 악기를 소독 : 미세 수술 가위, 외과 가위 무딘, 뭉툭한 포셉, 얇은 포셉, 상처 클립, 스테이플 상처
- isoflurane 2~3%는 isoflurane 청소 기계를 이용하여 사용하여 마우스를 마취. 사용된 평균 O 2 유량은 코 콘을 통해 1 L / 분입니다.
- 의 뒷면에있는 마우스를 틀어서 테이프 또는 기타 이동식 접착제와 사지를 무력화. 같은 나이르, 화학 헤어 제거제와 머리를 제거합니다. 목화는 대상과 같은 방식으로 70 % 에탄올과 betadine 사이 또는 보라고와 복부를 소독.
- 한 손으로 무딘 집게를 사용하여 유선으로 피부의 일부를 기다려. 다른 한편으로, 무딘 외과 가위를 사용하면 내유 분비를 노출 # 9 # 10 유두 또는 # 4 사타구니 내유 분비의 # 5 젖꼭지 사이의 T - 절개 다운 거꾸로를 만들기 위해.
- 작은 수술 봄 가위로 림프절이나 내유 동맥 아래 포켓 절개를합니다.
- 포셉를 사용하여 조직 배양 접시에서 콜라겐 이식을 제거합니다. 부드럽게 닦아와 얇은 유리 막대를 사용하여 주머니에 완전히 콜라겐 이식을 슬라이드 살균에 dabbing하여 콜라겐 이식에서 초과 액체를 제거합니다.
- # 2 뱃속 흡수성 봉합이나 상처 스테이플을 사용하여 피부 플랩을 봉합해.
- 마우스에 가둬 회복하자.
- 종양에 대한 촉진, 최소한 두 주간 생쥐를 모니터링합니다. 종양 직경 1cm에 도달했을 때 생쥐를 희생. 분석을 위해 수확 조직.
6. 대표 결과 :
C57BL/6J 마우스의 분리 및 콜라겐의 추출
이러한 절차는 1에서 적응했다. 단백질 9 MG - 5-7 마우스 꼬리에서 콜라겐 단백질의 추출은 약 1-1.5 6 ML 최종 볼륨 MG / ML, 또는 6 산출. coommassie 90 KDA 및 130 KDA에 해당 얼룩, 밴드는 (그림 1) 각각 콜라겐 유형 I 및 프로 콜라겐의 존재를 나타내는 마우스 꼬리에서 추출한 샘플 로드된 차선에서 발견됩니다.
정상 및 PyVmT C57BL/6J 마우스의 내유 암종 세포와 섬유아 세포의 분리 및 문화.
절차 2에서 적응했다. PyVmT의 암종 세포와 섬유아 세포는 특정 상피와 mesenchymal Mar의 세포 형태의 차이와 표현으로 구분할 수kers. PyVmT의 암종 세포는 조약돌 모양과 공동 표현 CK18, luminal 상피 마커와 CK14, 기저 상피 마커 아니지만 표현 α - SMA (그림 2)에 의해 식별됩니다. 내유 섬유아 세포는 스핀들 모양의 표현형로 큰 세포이며, α - SMA의 높은 수준을 표현하지만, CK14 또는 CK 18 (그림 2) 표현하지 않습니다. 이러한 데이터는 명시된 절차를 사용하여 섬유아 세포와 상피 세포에 대한 95 %의 세포 순도를 통해 나타냅니다.
C57BL/6J 마우스에서 콜라겐 임베디드 세포의 시각 교정 이식
이러한 절차는 3, 4에서 조정되었습니다. 이식받는 생쥐 두 실험 그룹의 종양 직경 1.0 cm, 또는 약 60 일 도달하면 희생하고 있습니다. 30 후 만져서 알 수있는 종양에 혼자 PyVmT 세포 결과를 이식하는 동안 - 40 일, 60 일 동안 0.335 g의 의미 종양 덩어리에 도달, 0.630 g의 의미 종양 덩어리에서 내유 섬유아 세포의 결과와 PyVmT의 암종 세포의 공동 이식은 향상을 나타내는 섬유아 세포 (그림 3)에 의해 종양 성장.
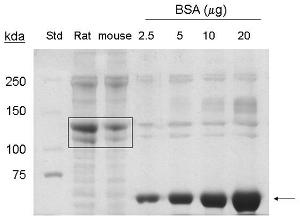
그림 1. 콜라겐 타입 마우스 꼬리부터가 추출 쿠매시 얼룩 분석. BSA는 (~ 66 KDA) 화살표로 표시됩니다. 상업 쥐 꼬리 콜라겐 (20 μg의 단백질) 및 정화 마우스 꼬리 콜라겐 (20 μg의 단백질은) 상자 (~ 130 KDA, ~ 90 KDA 단백질)에 의해 표시됩니다. 표준 = 분자량 표준.
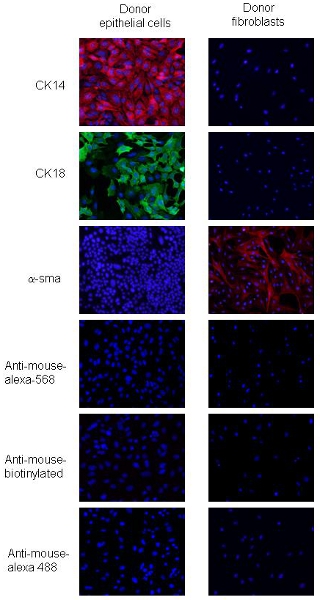
그림 2. 기증자 PyVmT 내유 암종 세포와 섬유아 세포의 Immunofluorescence 얼룩이. A와 B가 PyVmT 내유 암종 세포를 나타내는 패널 CK14과 CK18하는 항체에 대한 immunostained. 패널 C는 α - SMA에 항체 물들일 섬유아 세포를 나타냅니다. 이미지 20x 배율에서 DAPI 오버레이로 표시됩니다.
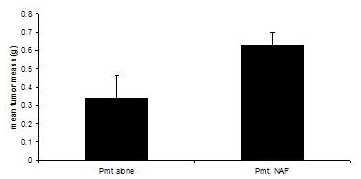
그림 3. 섬유아 세포의 존재 또는 부재에 C57BL/6J 마우스의 내유 종양 개발. 내유 종양은 내유 섬유아 세포의 존재 또는 부재에 PyVmT의 암종 세포와 이식 생쥐에서 수확 및 무게했다. 평균 + 평균의 표준 오차합니다. N = 그룹당 6.
토론
종양 진행에 섬유아 세포의 기능적 기여는 암종 관련 섬유아 세포가 증가 종양 성장과 invasiveness 5 양성 상피 세포 내유 결과와 함께 공동으로 이식하는, 이식 모델을 통해 증명되었습니다. 기존의 이식 방법은 다른 유전적 배경 마우스 또는 다른 종 공동 이식 stromal와 상피 세포 SCID이나 누드 마우스의 사용을 참여합니다. Immunocompromised 마우스는 종양 특정 항원과 종양 세포의 타겟팅 이후,...
공개
동물 실험 :
동물 실험은 캔사스 메디컬 센터의 대학에서 IACUC위원회에 의해 명시된 지침과 규정에 따라 수행되었다.
감사의 말
이 프로젝트는 NIH / NCI 부여 번호 R00 CA127357와 캔자스 암 센터 엔다우먼트 대학으로 통해 후원했다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 (옵션) |
|---|---|---|---|
| C57BL/6N 마우스 | 할런 | N / A | |
| MMTV - PyVmT 형질 전환 마우스 | 잭슨 실험실 | 002374 | |
| 태아 소 혈청 | 어부 | SH3039603PR | |
| DMEM | VWR | 10000113873 | |
| 페니실린 / 스트렙토 마이신 | 어부 | MT - 30-001 | |
| amphotericin | 어부 | BP2645 - 20 | |
| Amicon 여과 열 ultracel 50K | Millipore | UFC905008 | |
| 베크맨 TI 로터를위한 튜브 | 베크맨 | 355618 | |
| 쥐 꼬리 콜라겐 | 어부 | CB 40,236 | |
| 10X EBSS | 시그마 알드리치 | E7510 - 100ML | |
| 트립신 1X, HBSS W / O 칼슘과 마그네슘의 0.25 % | 어부 | MT - 25-050 - CI | |
| 빙초산 | 어부 | A491 - 212 | |
| Coomasie 블루 | 어부 | BP101 25 | |
| 트립신 | 시그마 알드리치 | T3924 - 100ml | |
| Collagenase | 시그마 AldrichC0130 - 50 | ||
| hyalronidase | 시그마 알드리치 | H3884 | |
| DNase | 시그마 알드리치 | D5025 | |
| 만화경 단백질 표준 | Biorad | 1,610,375 | |
| 유리 슬라이드 | 어부 | 12545-78 | |
| 유리 coverslips | VWR | 101400-042 | |
| Vimentin 항체 S - 20 | 산타크루즈 생명 공학 | SC - 7558 | |
| α - 평활근의 굴지 항체 | Abcam | ab5694 | |
| CK14 항체 | 산타크루즈 생명 공학 | SC - 53253 | |
| CK18 항체 | Abcam | ab668 | |
| DAPI | 시그마 알드리치 | D9542 | |
| 안티 - 마우스 biotinylated | 벡터 실험실 | BA9200 | 피셔 통해 배포 |
| 안티 마우스 알렉사 - 568 | Invitrogen | A10037 | |
| 안티 마우스 알렉사 - 488 | Invitrogen | A11001 | |
| Streptavidin - 알렉사 - 488 | Invitrogen | S11226 | |
| DAPI | Invitrogen | D21490 | |
| antifade을 연장 | Invitrogen | P - 36930 | |
| 외과 가위 | 파인 과학 도구 | 91400-12 | |
| 봄날의 가위 | 파인 과학 도구 | 15000-02 | |
| 블런트 포셉 | 파인 과학 도구 | 11002-12 | |
| # 5 멋진 포셉 | 파인 과학 도구 | 11251-10 | |
| 굿 삼가의 크롬을 함유하는 제품 봉합 | 어부 | NC9326254 | |
| 유리 파스퇴르 pipet | 어부 | 22-042-815 | |
| 에탄올 | 어부 | A406P 4 | |
| betadine | 어부 | NC9386574 | |
| 상처 클립 | 어부 | 12032-07 | |
| 상처 스테이플 | 어부 | 12031-07 |
참고문헌
- Hayward, S., Haughney, P. C., Rosen, M. A., Greulich, K. M., Weier, H. U., Dahiya, R., Cunha, G. R. Interactions between adult human prostatic epithelium and rat urogenital sinus mesenchyme in a tissue recombination model. Differentiation. 63, 131-131 (1998).
- Cunha, G., Hom, Y. K., Young, P., Brody, J., Asch, B. B., Ip, M. M. . Methods in Mammary Gland Biology. , (2000).
- Ethier, S. P., Ammerman, C. A., Dziubinski, M. L., Asch, B. B., Ip, M. M. . Methods in Mammary Gland Biology. , (2000).
- Medina, D., Kittrell, F., Asch, B. B., Ip, M. M. . Methods in Mammary Gland Biology. , (2000).
- Kalluri, R., Zeisberg, M. Fibroblasts in cancer. Nat Rev Cancer. 6, 392-401 (2006).
- DeNardo, D. G., Johansson, M., Coussens, L. M. Immune cells as mediators of solid tumor metastasis. Cancer Metastasis. 27, 11-18 (2008).
- Naito, M. Macrophage differentiation and function in health and disease. Pathol Int. 58, 143-155 (2008).
- Firestein, G. S. The T cell cometh: interplay between adaptive immunity and cytokine networks in rheumatoid arthritis. J Clin Invest. 114, 471-474 (2004).
- Cheng, N., Chytil, A., Shyr, Y., Joly, A., Moses, H. L. Enhanced Hepatocyte Growth Factor Signaling by Type II Transforming Growth Factor-{beta} Receptor Knockout Fibroblasts Promotes Mammary Tumorigenesis. Cancer Res. 67, 4869-4877 (2007).
- Qiu, T. H. Global expression profiling identifies signatures of tumor virulence in MMTV-PyMT-transgenic mice: correlation to human disease. Cancer Res. 64, 5973-5981 (2004).
- Schaffhausen, B. S., Roberts, T. M. Lessons from polyoma middle T antigen on signaling and transformation: A DNA tumor virus contribution to the war on cancer. Virology. 384, 304-316 (2009).
- Cepko, C. L. Immortalization of neural cells via retrovirus-mediated oncogene transduction. Annu Rev Neurosci. 12, 47-65 (1989).
- O'Hare, M. J. Conditional immortalization of freshly isolated human mammary fibroblasts and endothelial cells. Proc Natl Acad Sci U S A. 98, 646-651 (2001).
- Shay, J. W., Wright, W. E., Werbin, H. Defining the molecular mechanisms of human cell immortalization. Biochim Biophys Acta. 1072, 1-7 (1991).
- Gudjonsson, T., Villadsen, R., Ronnov-Jessen, L., Petersen, O. W. Immortalization protocols used in cell culture models of human breast morphogenesis. Cell Mol Life Sci. 61, 2523-2534 (2004).
- Raschke, W. C., Baird, S., Ralph, P., Nakoinz, I. Functional macrophage cell lines transformed by Abelson leukemia virus. Cell. 15, 261-267 (1978).
- Shen, G. Immortalization of endothelial cells differentiated from mouse embryonic stem cells. Shi Yan Sheng Wu Xue Bao. 35, 218-228 (2002).
- Wang, S. J., Greer, P., Auerbach, R. Isolation and propagation of yolk-sac-derived endothelial cells from a hypervascular transgenic mouse expressing a gain-of-function fps/fes proto-oncogene. In Vitro Cell Dev Biol Anim. 32, 292-299 (1996).
- Tiede, B. J., Owens, L. A., Li, F., DeCoste, C., Kang, Y. A novel mouse model for non-invasive single marker tracking of mammary stem cells in vivo reveals stem cell dynamics throughout pregnancy. PLoS One. 4, e8035-e8035 (2009).
- Guzman, R. Intracarotid injection of fluorescence activated cell-sorted CD49d-positive neural stem cells improves targeted cell delivery and behavior after stroke in a mouse stroke model. Stroke. 39, 1300-1306 (2008).
- Duda, D. G. Differential transplantability of tumor-associated stromal cells. Cancer Res. 64, 5920-5924 (2004).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유