JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
포유류의 상피 세포에 박테리아의 접착 시험 관내 분석
요약
이 프로토콜은 교양 세포에 준수 아르 단위를 형성하는 박테리아 식민지의 숫자를 계산에 구성된 간단한 세균 유착 분석이다. 분석은 강력한이며, adhesin 독립 공부하고, 다수의 유사 콘텐츠는 세균 pathogenesis 작업을 대부분의 실험실에 사용됩니다.
초록
감염을 원인 박테리아들은 숙주를 식민지해야합니다. 세균성 병원균은 세포 하나를 호스트하기 위해 첨부 파일을 홍보할 수 다양한 분자 또는 구조를 표현한다. 이러한 adhesins는 숙주 세포 표면 수용체 또는 박테리아와 호스트 사이의 다리 역할을 수용성 단백질과 상호 작용에 의존하고 있습니다. 접착력 전에 침략 및 / 또는 독소의 분비에 중요한 첫 번째 단계이며, 따라서 그것은 세균 pathogenesis에서 공부하는 주요 행사입니다. 또한, 준수 박테리아는 종종 정교하게 미세 조정 세포 반응, '세포 미생물학'2의 분야에 출산을 가지고있는 연구를 유도. 세균성 호스트 세포의 접착과 침략에 대한 강력한 assays 따라서 세균 pathogenesis 연구의 핵심 역할을하고 오랫동안 많은 선구자 실험실 3,4에서 사용되었습니다. 이러한 assays 이제 세균 pathogenesis 작업 대부분의 실험실에서 연습하고 있습니다.
여기, 우리는 특정 adhesin의 기여를 설명하는 표준 준수 분석을 설명합니다. 우리는 대장균 스트레인 2787 5, 확산 준수 (아이다)에 관련된 autotransporter Adhesin을 표현하는 인간 병원성 변형을 사용합니다. 컨트롤로서, 우리는 아이다 유전자, 2787Δ 아이다 (F. 버타이오메와 M. Mourez, 발표되지 않은), 그리고 E. 상업 실험실 부담을 부족한 돌연변이 변형을 사용하여 대장균, C600 (뉴 잉글랜드 Biolabs). 박테리아는 일반적으로 사용되는 C 형 간염 - 2 인간 상피 세포주에서 세포을 준수하기 위해 남아 있습니다. 이 분석은 덜 광범위 6 이전에 설명되었습니다.
프로토콜
1. 예선 : 박테리아 변종과 상피 세포.
세포 및 박테리아의 조작은 층류 후드 아래 무균 수행됩니다.
- 갓 E.을 분리 콜리 변종 2787, 2787Δ 아이다 및 C600 글리세롤 주식의 Lysogeny 스프 (LB) 한천 플레이트 (1 % tryptone, 0.5 %의 나트륨 염화물, 0.5 % 효모 추출물, 1.5 %의 한천)에 37에서 성장 ° C. 검정의 다양성을 최소화하기 위해, 그것은 갓 도금 변종을 항상을 사용하고 ° C 봉인 페트리 접시에서만 몇 주 최대 4에서 긴장을 유지 좋습니다.
- 높은 포도당 Dulbecco의 수정 이글 중간 (DMEM)에 문화 형 간염 - 2 세포 (ATCC CCL - 23) 10 % 열 inactivated 소 혈청 (열 불활 성화가 ° C 30 분 56 수행)와 보충. 일상 문화 중에 우리는 또한 10 U / ML 페니실린 및 10 μg / ML 스트렙토 마이신을 추가합니다.
- 37 형 간염 - 2 세포를 성장 ° CO 2 5 %를 포함하는 분위기 세포 배양기에서 C. 75cm 2 flasks 그들이 합류에 도달 subcultured 때마다에서 재배하는 세포를 유지하기 위해 표준 세포 배양 절차를 사용하십시오. 우리는 그들이 30-40 구절에 도달할 때까지 우리의 교양 세포를 사용하고 그들을 폐기.
- 75cm이 플라스크에있는 C 형 간염 - 2 세포가 거의 합류에 도달하기 때문에 준수 분석을위한 준비가되면 분석을 준비합니다.
2. DAY 1 : inoculum와 상피 세포를 준비
- 8g / L NaCl, 0.2 g / L KCl, 0.2 g / L KH 2 PO 4, 0.21 g / L 나 2 HPO 4 : : 7H 따뜻한 Dulbecco의 인산이 (DPBS 호수 버퍼와 한번 술병에있는 C 형 간염 - 2 세포를 씻어 2 O)
- 신선한 따뜻한 전체 매체를 추가하기 전에 5 분 EDTA (에틸렌 다이아 민 테트라 초산) - 세포는 0.05 % 트립신과 함께 incubated 있습니다. 신선한 매체가 추가되면 전지와 위아래로 pipetting하여 resuspended 있습니다.
- 5 분 2,000 RPM의 세포 현탁액을 원심 분리기와 DPBS에서 알약을 resuspend 다시 원심 분리기.
- 10 %의 혈청과 보충하지만, 2x10 5 셀 / ML의 농도에서 더 항생제를 포함하지 신선한 매체 세포를 Resuspend.
- 시드 그 중 한명은 24 잘 접시의 중앙에 중복 웰스 (각 변형에 대해 하나) 세 가지 세트의 세포 현탁액의 밀리리터와 세포 문화 인큐베이터에서 하룻밤 접시를 품어.
참고 : 혈청이 완전히 decomplemented해야하고 항생제가이 단계 이후 생략하는 것이 중요합니다. 이렇게하지 않으면 감염 박테리아를 죽일 수 있습니다. - LB의 국물 5 ML (1 % tryptone, 0.5 %의 나트륨 염화물, 0.5 % 효모 추출물)의 각 세균의 변형 중 하나를 격리 콜로니 (2787, 2787Δ 아이다 및 C600)을 접종하고 37 야간 성장 ° 활발한 잡고 C (180 RPM ).
3. DAY 2 : 세포의 감염
- 그들이 최소한 90 % 합류하고 오염되지 않은 것을 확인할 거꾸로 현미경 형 간염 - 2 세포를 검사합니다.
- 각 잘하는 따뜻한 DPBS하고있는 세포를 씻어, 10 %의 혈청과 보충 신선한 중간 1 ML을 추가하지만 항생제를 포함하지 않습니다. 세포없이 3 웰스 신선한 매체도를 추가합니다. 이것은 각 변형에 대한 inoculum에서 세균의 총 수를 결정하는 데 사용됩니다.
- 세균성 문화 600 NM (OD 0.600 nm의)에서 광학 밀도를 측정합니다. C 형 간염 - 2 세포를 포함하는 중복 웰스 중 하나를 설정 하나 잘 포함하지 않는 세포를 각 세균성 문화의 나누어지는를 추가합니다. 보통, 우리는 10 6 콜로니 형성 단위 (cfu)에 해당하는 숙박 문화의 볼륨을 사용합니다. (세포 박테리아)이 5시 1분의 감염의 다중성을 (뫄) 나타냅니다. 우리가 직접 우리의 야간 문화를 사용하지만, (예 : cytotoxins과 같은 예를 들어) 야간 문화에있는 분비 분자의 해로운 효과를 피하기 위해 박테리아를 원심과 DPBS에서 그들을 resuspend하기 위해 때로는 좋습니다
참고 : 뫄는 100:1과 1시 10분 사이 다를 수 있습니다. 높은 뫄 높은 다양성과 배경을 산출하고 박테리아가 접시의 플라스틱에 집중하는 경향이 있습니다. 뫄 로우어도 높은 다양성을 산출. 뫄이 선택되면, 그것은 일관되게이 뫄 유지하는 필수적입니다. - 37 3 시간 동안 세포 배양기 문화에 감염된 세포를 품어 ° C 5 % CO 2.
참고 : 직접 세포 접촉에있는 모든 박테리아를 가지고하기 위해 잠시 저속 (1-2 분 예 : 1000 XG)에서 번호판을 원심 수도 있습니다. 이것은 감염을 동기화의 추가 혜택을 가지고 있으며, 짧은 배양 시간 (적게 15-30로 분)을 수 있도록합니다. - 감염된 세포에서 매체를 제거하고 따뜻한 DPBS와 세포에게 3 회 씻는다. 이 단계에서 자기편 박테리아는 일반적으로 표준 현미경으로 볼 수 우리는 정기적으로이 검사를 수행할 수 있습니다.
- 세포를 lyse하고 준수 BAC를 분리teria는 트리톤 X - 100 각 1 %의 100 μl를 추가할 잘 세포를 포함하는. 기타 세제는 (예 : 예를 들어 사포닌 등) 사용할 수 있습니다.
- 실온에서 10 분에 대한 세포를 부화 후 LB 매체 900 μl를 추가합니다.
- 부드럽게 pipetting 상하 반복하여 suspensions을 균질. inoculum를 포함하는 세포가없는 우물은 비슷하게 부드럽게 균질하고 있습니다.
참고 : 일부 박테리아는 우리가 0.05 % 트립신과 부화하여 상피 세포를 분리되는 경우, 세제에 너무 민감한 것 - EDTA (에틸렌 다이아 민 테트라 초산)을 20 분에 대해 37 ° C. 준수 박테리아와 함께 세포도 피펫 팁있는 우물에서 까진 수 있습니다. - LB 한천 3 dilutions (보통 1:1,000, 1:10,000과 1:100,000 dilutions)에서 LB의 국물과 플레이트 100 μl를 사용 준수 박테리아 및 inoculum의 suspensions 일련 10 배 dilutions을 준비하고 37 밤새 품어 ° C .
4. 3 일 : cfu의 계산 및 데이터 프레 젠 테이션.
- 접시에 식민지를 카운트하고 dilutions의 각 시리즈를 평균하여 준수 박테리아와 inoculum의 cfu의 개수를 계산합니다. 10-300 식민지 사이에서만 플레이트는 계산해야합니다.
5. 대표 결과 :
다음 표는 준수 박테리아와 다른 일을 수행할 세 실험에서 inoculum의 계수 cfu의 전형적인 결과를 보여줍니다 :

그림 1A와 같이 결과는 직접으로 cfu을 준수보고 수 있습니다. inoculum 크기 때문에 성장 속도의 차이 또는 pipetting 오류의 변종마다 다를 수 있기 때문에 준수 박테리아의 비율로 결과를보고하는 것이 좋습니다. 그림 1B와 같이 준수 세균의 비율은, inoculum의 cfu의 숫자로 준수 박테리아의 cfu의 수를 나누어 계산하실 수 있습니다. 그림 1B의 모든 컬럼을 비교하기 위해 반복 측정 ANOVA와 Bonferroni 사후 테스트를 수행함으로써, 우리는 상당한 아이다 2787과 2787Δ 차이 (P는 <0.05),뿐만 아니라 2787과 C600 사이에있다는 것을 볼 수 없지만, 더 큰 차이가 있습니다 2787Δ 아이다과 C600 사이.
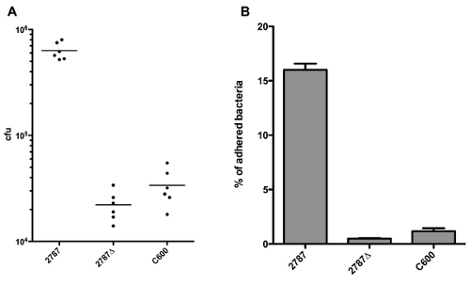
그림 1. 준수 세균 cfu (A) 또는 준수 박테리아의 비율 (B)로 검색 결과의 표현
관찰 준수의 비율은 종종 실험에 매우 의존 셋업 (그리고, 낮은 정도로, 실험자에). 특히 중요한 뫄하고 세척의 수가 너무 비율은 문자 그대로 해석해서는 안됩니다.
inoculum의 박테리아는 때때로 세포와 우물에서 세균의 실제 총수와 비교하여 inoculum의 크기를 왜곡, 세포의 존재에있는 박테리아보다 훨씬 빠르게 커질 수 있습니다. 이 문제를 완화하기 위해, 그것은 어느 것을 권장합니다 : C 형 간염 - 2 세포가 추가 우물에 씨앗을 품고 및 감염 : (I)는 inoculum을 결정하는 세포와 우물을 사용합니다. 대신 폐기의 분석의 마지막에서 뜨는 및 세탁 10 % 트리톤 100 μl는 X는 - 100은 잘에 추가됩니다. 세포가 lyse하고 준수 및 비 준수 세균을 포함하고있는 lysate는 부드럽게 반복 상하 pipetting하여 균질이며. 또는 (ii) 분석의 끝에 감염된 세포의 supernatants를 수집뿐만 아니라 supernatants에서 DPBS의 세척 및 그 풀링 supernatants에 cfu의 수를 결정합니다. 이것은 비 준수 박테리아의 cfu의 개수를 반환합니다. 준수 세균의 비율은 다음 준수 및 비 준수 박테리아의 cfu의 숫자의 추가에 의해 준수 박테리아의 cfu의 수를 나누어 계산하실 수 있습니다.
분석의 견고을 설명하기 위해, 우리는 최근에 설립 tracheal 돼지 세포 라인, NPTr 8 세포와 incubated S4074과 함께 수행한 분석, Actinobacillus pleuropneumoniae 7 접착제 돼지의의 병원성 변형,이 프로토콜을 비교할 수 있습니다. 이외에도 세균과 세포의 성장에 필요한 매체의 차이에서, 유일한 차이점은 감염에 사용되는 박테리아가 고정 상 야간 문화 기하 급수적으로 증가하는 문화, 그리고 아니라는 점이다. A.로 pleuropneumoniae 그것은 달리 독소의 분비는 세포 죽음과 바이어스 결과가 발생할 것이며, 뫄 10시 1분의를 존중하고 감염 3 시간을 초과하지하는 것도 매우 중요합니다. A.의 또한이 스트레인 그것이 합류 세포를 사용하여 세포가 꺼져 sloughing 아니라는 것을 시각적으로 확인하는 것이 중요하므로 pleuropneumoniae는 쉽게 플라스틱을 준수합니다.
토론
이 프로토콜은 (gentamicin 보호 분석 3을 사용 예) 침략을 공부하기 위해 수정할 수있는 표준 준수 세균 분석을 설명합니다. 콜로니 형성 단위의 계산은 Giemsa의 얼룩 같은 현미경 표준 시각화 기법에 의존 접근과 비교하여, 부량 수 있습니다. 후자는 접착력의 질적 전망을 제공하지만 접착력의 다양한 패턴을 차별하고 mechanistical 통찰력에게 9 줄 수 있기 때문에 종종 유용하게 보완합...
공개
감사의 말
저자의 연구실에서 작업은 자연 과학 및 캐나다의 공학 연구 협의회, 건강 연구의 캐나다 연구소, 그리고 캐나다 연구 의자 프로그램에서 교부금에 의해 지원됩니다. JL은 퐁 드 물리 엉 쌍떼 두 퀘벡에서 지원금을 통한 Groupe D' 에투드 데스 Protéines Membranaires (GEPROM)에서 화목에 의해 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| 시약 | 회사 | 카탈로그 번호 | |
|---|---|---|---|
| 높은 포도당 DMEM | GIBCO - Invitrogen | 12430-054 | |
| DDPBS | GIBCO - Invitrogen | 14190-144 | |
| 보빈 성장 세럼 | Hyclone | SH3054 | |
| 페니실린 / 스트렙토 마이신 | GIBCO - Invitrogen | 15140-148 | |
| 24 웰 플레이트 | 코닝 | 3337 | |
| 트리톤 X - 100 | 피셔 사이 언티픽 | BP151 - 100 |
참고문헌
- Kline, K. A. Bacterial adhesins in host-microbe interactions. Cell Host Microbe. 5, 580-580 (2009).
- Cossart, P., Boquet, P., Normark, S., Rappuoli, R. Cellular microbiology emerging. Science. 271, 315-315 (1996).
- Elsinghorst, E. A. Measurement of invasion by gentamicin resistance. Methods Enzymol. 236, 405-405 (1994).
- Pizarro-Cerda, J., Lecuit, M., Cossart, P., Sansonetti, P., Zychlinsky, A. . Molecular Cellular Microbiology. , 161-161 (2002).
- Srivastava, A., Isberg, R. R., Sansonetti, P., Zychlinsky, A. . Molecular Cellular Microbiology. , 179-179 (2002).
- Benz, I., Schmidt, M. A. Cloning and expression of an adhesin (AIDA-I) involved in diffuse adherence of enteropathogenic Escherichia coli. Infect Immun. 57, 1506-1506 (1989).
- Charbonneau, M. E., Berthiaume, F., Mourez, M. Proteolytic processing is not essential for multiple functions of the Escherichia coli autotransporter adhesin involved in diffuse adherence (AIDA-I). J Bacteriol. 188, 8504-8504 (2006).
- Jacques, M., Paradis, S. E. Adhesin-receptor interactions in Pasteurellaceae. FEMS Microbiol Rev. 22, 45-45 (1998).
- Auger, E. Host-pathogen interactions of Actinobacillus pleuropneumoniae with porcine lung and tracheal epithelial cells. Infect Immun. 77, 1426-1426 (2009).
- Jacques, M. Role of lipo-oligosaccharides and lipopolysaccharides in bacterial adherence. Trends Microbiol. 4, 408-408 (1996).
- Nataro, J. P., Kaper, J. B. Diarrheagenic Escherichia coli. Clin Microbiol Rev. 11, 142-142 (1998).
- Jallat, C., Darfeuille-Michaud, A., Rich, C., Joly, B. Survey of clinical isolates of diarrhoeogenic Escherichia coli: diffusely adhering E. coli strains with multiple adhesive factors. Res Microbiol. 145, 621-621 (1994).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유