Method Article
마우스의 Cajal (ICC) 네트워크의 중간 세포의 시각화
요약
Cajal (ICC)의 중간 세포는 위장 (GI) 트랙트의 맥박 조정기 세포입니다. 그들은 평활근 세포와 GI 수축성 조절에 게시할 - ganglionic의 연결 섬유 사이의 복잡한 네트워크를 형성하고 있습니다. 여기, 우리는 immunofluorescence 횡단면 방법과 murine ICC 네트워크 전체 마운트 시각화를 제시한다.
초록
Cajal (ICC)의 중간 세포가 연동에 필요한 자연 느린 파도를 생성하고 장용 신경 system1에서 입력의 연결을 중재 위장 (GI) 트랙트의 mesenchymal 파생된 "맥박 조정기 세포"입니다. ICC의 다른 subtypes은 GI 트랙트 2,3의 muscularis에서 서로 다른 네트워크를 형성하고 있습니다. 이러한 네트워크에 대한 손실이나 부상은 운동성 장애 4 번호와 연결되어 있습니다. ICC 전지는 immunostaining은 ICC 네트워크 5,6 레이블을 위해 지난 15 년 동안 사용되고있는 플라즈마 막과 KIT에 KIT 수용체 티로신 키나제를 표현한다. 중요한 것은 정상적인 KIT 활동 ICC 개발 5,6가 필요합니다. 자주 이득의 기능 키트 돌연변이 7,8을 가지고 있고, 위장 stromal 종양의 ICC 전지 결과 (지스트)의 종양을 변환. 우리는 최근 ETV1는 ICC / 요지 혈통 표현 혈통 특정 생존 요소이며 정상 ICC 네트워크 형성 모두와 지스트 tumorigenesis 9에 필요한 마스터 transcriptional 조절기는 것을 보여주었다. 우리는 더 이상 그것이 tumorigenesis에 키트 변이를 활성화 협력 것을 보여줍니다. 여기, 우리는 대부분 이전에 출판 프로토콜 10,11에 따라 마우스의 ICC 네트워크의 시각화를위한 방법을 설명합니다. 최근 염화물 채널 anoctamin 1 (ANO1)도 ICC 11,12의 구체적인 멤브레인 마커로 특징되었습니다. 때문에 자신의 플라즈마 막 현지화의 두 단백질의 immunofluorescence는 ICC 네트워크를 시각화하는 데 사용할 수 있습니다. 여기, 우리는 고정 냉동 cyrosections 및 전체 마운트 준비하여 ICC 네트워크의 시각화를 설명합니다.
프로토콜
1. 마우스 GI 넓이의 해부
- 지역 IUCAC 지침 Euthanized 마우스
- 스티로폼 표면에 각각의 다리를 핀 및 70 % 에탄올로 복부 표면을 씻어. 격막에서 치골에 긴 정중선 절개로 복강을 여십시오. 하나는 말초 식도와 말초 대장에서 두 번째 컷에서 잘라 블록 EN 위장에서 항문에 GI 트랙트를 제거, 신중하게 작은 가위를 사용하여 십이지장과 맹장에서 인대를 절단합니다. PBS와 페트리 접시에 넣어 GI 트랙트. 핀셋을 (그림 1)를 사용하여 장간막 멀리 해부하다. 위, 소장 및 대장, pylorus 및 ileocecal 접합에 상처를 구분합니다. 먹이를 바늘 (이전 마우스) 또는 뭉툭한 바늘 (이하 마우스)에 첨부된 5ml 주사기를 사용하여 PBS로 GI 트랙트의 각 부분의 루멘을 씻어.
- mesenteric 경계 열기 위, 소장 및 대장. GI 트랙트의 각 부분에 대해 두 개의 전체 탑재 시각화를위한 하나 cryosection 한 컷.
2. 전체 마운트 샘플 준비 및 immunostaining
- 4 최소한 1 시간 동안 얼음 차가운 아세톤 및 수정 샘플 1.0 ML 가득 1.5 cm의 microfuge 관 ° C.에 GI 트랙트의 각 부분의 전체 조각을 플레이스 샘플은 -20 ° C.에 최대 1 주일 저장될 수 있습니다 우리는 일반적으로 아세톤에 샘플을 저장하고 cyrosections 준비를 진행합니다.
- PBS로 샘플 2X 씻으십시오. PBS와 페트리 접시에 넣어 샘플. miscroscope를 해부에서 신중하게 muscularis두고, 핀셋 한 쌍의 한 쪽 끝을 잡고하여 메스와 점막 층을 다쳤어요.
- 근육이 서로 다른 항체와 얼룩을 위해 5mm 조각으로자를 수 있습니다. 얼룩 전에 PBS 이상 2 일간 보관하지 마십시오.
- 블록과 부화 단계 24 잘 플레이트 잘 하나 또는 1.5ml microfuge 튜브에서 할 수 있습니다. 차단 버퍼의 0.5 ML (5 % 염소 혈청, 0.1 % 트리톤 4 1 시간 PBS에서 X - 100 ° C)를 차단합니다.
- 버퍼를 차단으로 희석 주 항체와 부화하고 4 박 회전 ° C. 우리는 성공적으로 ACK - 2 쥐 방지 키트, 토끼 방지 Ano1 및 전체 마운트 immunostaining에 대한 토끼 방지 Pgp9.5 항체를 사용했습니다.
- 상온에서 회전에 PBS로 5 분 2X위한 씻으십시오.
- 회전에 상온에서 2 시간 동안 차단 버퍼에 희석 차 항체와 부화. 우리는 일반적으로 알렉사 플루어 488 안티 - 토끼과 알렉사 플루어 594 안티 쥐 항체에게 사용합니다.
- 상온에서 회전에 PBS로 3 배 15 분 씻으십시오.
- 현미경 동안 조직의 방향을 위해 위에 슬라이드, serosal 측면에 마운트합니다. 이 오리 엔테이션은 coverslip을 직시하고 하나는 현미경의 슬라이드에 초점을 맞추고로 첫째가 발생 될 serosal 측면을 보장합니다. 우리는 해부 현미경에서이 작업을 수행. 때때로, 우리는 간단히 제대로 방향을 형광 현미경 하에서 조직을 검사합니다. 키트 또는 Ano1을 시각화하기 위해 형광 현미경에서 하나는 coverslip의 측면에서 먼저 ICC - 내 네트워크를 발생한다. 다음 대기음 PBS는 가능한 한하지 않고 완전히 건조. 하드 설정 설치 미디어 (우리가 골드를 연장 사용) 50 μl를 추가하고 부드럽게 조직의 상단에 커버 슬립을 넣으십시오. -80에서 상온 및 매장 슬라이드에서 하룻밤 장착의 설정을 허용 ° C.
- 현미경 시험, 우리는 Z - 드라이브와 넓은 필드 현미경을 사용. 우리도 20X 공기 목적 (NA 0.75, 계획의 고차 색지움) 또는 60X 오일 목표 (NA 1.4 계획 고차 색지움)를 사용 2 μm의 또는 전체 muscularis에 걸쳐 Z - 섹션 1 μm의했다. 이미지는 이후 Autoquant deconvolution 소프트웨어를 사용하여 deconvoluted되었습니다. 또는, 많은 다른 사람은 유사한 결과를 대신 공촛점 현미경을 사용했습니다.
3. Cryosection 준비 및 immunostaining
- 필터 종이에 평면 다운 GI 트랙트, serosal 측면의 각 부분을 넣으십시오. 조직 주위에 필터 종이를 자르고. 상온에서 2 시간 동안 PBS (우리가 제대로 사용하기 전에 PBS로 밀폐된 유리병에 32 % paraformaldehyde를 희석)에 4 % paraformaldehyde (PFA) 필터 종이에 플레이스 조직. 또는 조직의 크기에 따라 12 자 판, 또는 1.5 ML의 microfuge 튜브 - 고정은 6 할 수 있습니다. 판에서 수행하는 경우 parafilm는 PFA 노출을 최소화합니다. 긴 고정 시간은 특히 ACK - 2 안티 키트 항체 위해 항원 마스킹이 발생할 수 있습니다.
- PBS의 30 % 자당에 PFA의 조직과 장소를 제거합니다. 조직은 4 박 싱크 허용 ° C.를
- 1 시간 동안 30 % 자당와 OCT의 1시 1분 비율과 조직을 평형. 다음 GI 트랙트의 세로축은 cyrosections과 병행되어야 OCT 가득한 cryomold에 수직으로 조직을 탑재합니다. 다른 genotypes 또는 다른 치료와 함께 생쥐를 검사하면 병렬 처리를 위해 동일한 cryomold에 다른 마우스에서 조직을 마운트하는 것이 유용할 수 있습니다. 스토리지 -80 ° C의 냉장고에 드라이 아이스와 장소에 고정.
- 10 μm의의 cryosections 컷-80 ° C의 냉동고에서 슬라이드 및 저장에. 우리는 보통 슬라이드마다 두 섹션 잘라. 우리는 또한 보통 cryosection 슬라이드의 H & E 염색법을 수행합니다.
- immunofluorescence 들어, 처음 15 분 동안 실온에서 슬라이드를 평형. 다음 PAP 펜을 사용하여 조직 주위에 원을 그립니다.
- 1 시간 동안 차단 버퍼 (전체 마운트 immunostaining에 대한 동일) 150 μl와 차단합니다.
- 차단 버퍼를 기음과 버퍼를 차단으로 희석 150 μl 일차 항체를 추가하고 4 박 품어 ° C를 humidified 챔버 인치
- PBS로 5 분 2X 씻으십시오.
- 상온에서 2 시간 동안 버퍼를 차단에 희석 차 항체와 부화. 우리는 일반적으로 488 알렉사 방지 래빗과 알렉사 594 안티 쥐 항체를 사용합니다.
- PBS로 3 배 15 분 씻으십시오.
- 완전히 조직을 건조하지 않고 슬라이드를 대기음. DAPI (우리가 골드를 연장 사용) 장소 # 1.5 coverslip와 미디어를 장착 하드 집합의 드롭을 추가합니다. -80 ° C의 냉동고에 설정하고 저장하기 위해 밤새 실온에서 플레이스 슬라이드.
- DAPI, FITC, 그리고 텍사스 레드 필터 세트를 사용하여 트리플 형광 이미지를 취득.
4. 대표 결과 :
여기서는 예제로 대장을 사용합니다. H & E는 자당의 얼룩 immunofluorescence에 사용되는 냉동 섹션을 고정 보호하는 것은 어떤 유물들이 참조 파라핀 섹션 (그림 2)에 비해 보여줍니다 어디에 원형과 세로 근육층과 녹색 라인 demarks 사이의 노란색 선은 demarks myenteric 신경 얼기를 경계 점막 및 muscularlis. serosa에서 점막으로, cryosection를 검사, 먼저 두꺼운 원형 근육 (CM) 계층 다음에 얇은 세로 근육 (LM) 레이어를 발생합니다. CM의 핵은 작고 원형되어야하는 동안 LM의 핵이 다소 길어진해야하므로 부분은 세로 근육과 병행되어야합니다. LM와 CM 사이에 Pgp9.5와 얼룩 뉴런 만든 myenteric plexi 있습니다. CM을 통해 Pgp9.5 또한 얼룩의 연결을 처리합니다. myenteric ICC 네트워크 (ICC - MY)는 myenteric 신경 얼기를 둘러싸고와 다극 세포 만들어집니다. 세로 근육 계층 내에서 바이폴라 세포가 근육과 병렬로 실행되는 희귀 근육의 ICCs은 (ICC - 인스턴트 메시지)가 있습니다. 원형 근육 계층 내에서, 또한 원형 근육과 병렬 실행이 절단와 교차 sectioned 아르 바이폴라 세포되는 ICC - 인스턴트 메시지를 풍부한 있습니다. muscularis 및 submucosa의 교차점에서, ICC - SMPS 구성된 submucosal ICC 네트워크 다극 ICCs의 평면 네트워크입니다. 그 중 하나가 coverslip에서 초점으로 대장의 immunostaining 전체 마운트 키트를 검토 하나는 (Figure. 3) CM의 ICC - IM, 그리고 ICC - SMP 네트워크 다음 ICC - 내 네트워크를 먼저 만날 기대한다 . 전체 마운트 이미지의 3D 재구성을 사용하여 ICC 네트워크의 용적 측정 10 설명했습니다. 넓은 필드에 현미경을 사용하면, (그림 3) deconvolution 후 제거할 수있는 RAW 이미지에 상당한 아웃 - 오브 - 평면 형광 있습니다. 점막의 스트립 불완전 높은 배경 형광 발생합니다. ANO1 다른 ICC의 마커와 KIT의 공동 immunostaining이며 ANO1는 ICC의 얼룩 (그림 4)의 완전한 중복을 보여줍니다.
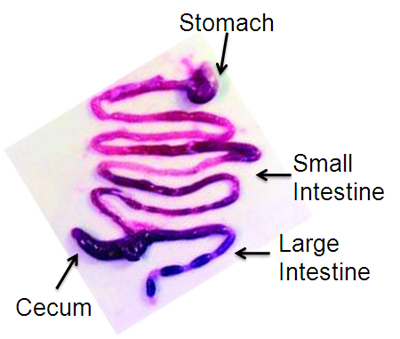
그림 1. 대표 허가 13 reprinted, 마우스 위장관를 해부.
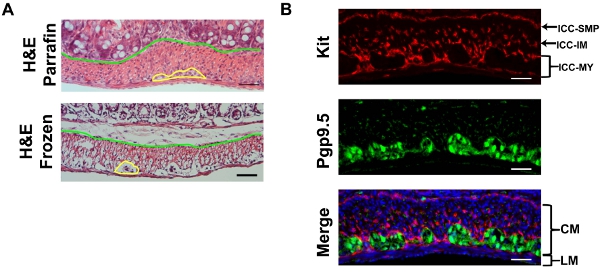
그림 2.) 대표 H & cryosections의 일부 수축 유물을 보여주는 섹션을 설명 및 참조 파라핀은 임베디드로 준비 cryosections의 마우스 대장의 전자 염색법. 노란색 라인 demarks myenteric 신경 얼기와 파란색 라인은 muscularis에서 점막을 분리합니다. B) 대표 키트 (빨간색, ACK - 2)와 Pgp9.5 (녹색) 마우스 대장의 DAPI (파란색) counterstaining 더블 immunofluorescence. LM : 세로 근육 CM : 원형 근육. 스케일 바 20 μm의.

그림 3. 대표 키트 (빨간색, ACK - 2) 전체 마운트 세 초점 비행기에서 같은 분야의 immunofluorescence, ICC - MY LM / CM 국경에서 비행기, CM에있는 ICC - 메신저 비행기, 그리고 ICC - CM / submucosa 국경에서 SMP의 비행기. RAW 이미지와 deconvoluted 이미지가 표시됩니다. 스케일 바 20 μm의.
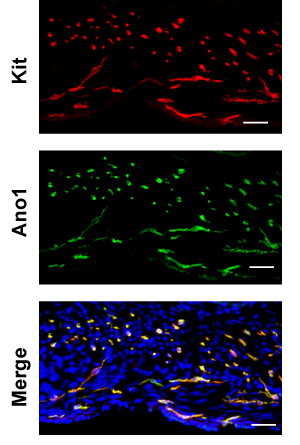
그림 4. Ano1 (녹색)과 대장의 키트 (빨간색, ACK - 2)의 대표를 두 번 immunofluorescence. 스케일 바 20 μm의.
토론
Cajal의 중간 세포는 처음에는 위장 muscularis의 메틸렌 블루와 실버 크롬의 얼룩을 사용하여 정확히 하나의 세기 전 산티아고 Ramóón Y Cajal 특징으로했다. Cajal 처음 ICC가 axons과 dendrites 연상 아르 자신의 프로세스에 따라 뉴런 줄 알았는데. 다음의 몇 년 동안, ICC 생물학의 연구는 그 KIT의 발견은뿐만 아니라 ICC 표현 때까지 특정 마커의 부족에 의해 제한되었다,뿐만 아니라 자신의 발전 6 필요합니다. 이후 KIT immunofluorescence 널리 ICC 생물학 연구에 사용되었으며 또한 오줌 방광의 수축성 다른 장기에서 ICC의 감상하게되었다. 최근 ANO1는 두 번째 신뢰할 수있는 ICC 표시로 확인되었습니다.
다양한 고정 및 장착 기술을 이용하여 ICC를 식별하는 immunofluorescence를 사용하여 지난 15 년 동안 수많은 출판물이있다. paraformaldehyde와 보호 자당 접두사가 붙은되었습니다 우리 손에 "고정 냉동"cryosections이 가장 cryosectioning 후 아세톤이나 paraformaldehyde 사후 고정에 비해 작동합니다. 전체 마운트 들어, 점막 절개로 다음 아세톤의 고정은 가장 강력한 결과를주는 것으로 확인되었습니다.
역사적으로, ACK - 2는 마우스 ICC 식별을위한 최고의 키트 항체를하고 있습니다. 그것은 세포외 도메인을 인식 단클론 쥐가이며 그것은 또한 쥐를 사는 주어진 경우 장폐색을 일으키는 차단 항체이다. 그러나, ACK - 2 에피토프 천천히 paraformaldehyde 고정에 의해 파괴되고 표준 항원 복구 방법으로 구출하지 않습니다. 우리는 ACK - 4 에피토프은 paraformaldehyde 고정이 더 강한 것으로 나타났습니다. 고정 냉동 블록 섹션, 파라핀 블록 및 임베디드 부문에 비해 더 나은 형태 보존 및 보관 장기 (그림 4) 더 많은 의무가있다. ACK - 2이나 ACK - 4 어느가 성공적으로 파라핀 섹션에 사용되었습니다. 우리는 D13A2, 새로운 토끼 단클론 항체는 GI 트랙트 모두 고정 냉동 및 파라핀 섹션에서 매우 잘 작동 특징있다.
키트는 또한 GI 트랙트에서 발견되는 melanocytes, 조혈 세포, 배아 세포, 특히 마스트 세포를 포함한 여러 다른 세포 유형에 표시됩니다. 다행히도, 대부분의 마스트 세포는 muscularis에있는 점막 및되지 않습니다 볼 수 있습니다. 토끼 방지 Ano1와 쥐 방지 키트와 함께 더블 얼룩은 각 항체가 아닌 구체적인 얼룩 (그림 4)을 제거할 수 있습니다. 또한 Kit 및 ICC의 서브 클래스 사이 Ano1의 상대적 표현이 다른 것 같다 협조할 것입니다. 예를 들어, 소장에서 키트 얼룩은 얼룩이 Ano1 비교 반면 깊은 근육 얼기의 ICC에 비해 훨씬 더 강렬 myenteric ICC에 있습니다.
공개
감사의 말
이 작품은 국립 암 연구소 (K08CA140946, YC)를 (5F32CA130372, PC에), (R01CA102774 및 PB에 R01HL055748), 국방부 (YC로 PC094302) 지스트 연구 셔먼 패밀리 기금 (에 의해 지원되었다 PC), 그리고 스타 암 컨소시엄 (PC에, YC, CLS와 PB). 우리는 cryosectioning과 immunostaining와 관련하여 도움이 카티아 Manova, 닝 팬, 그리고 MSKCC 분자 세포학 핵심 시설의 Mesurh Turkekul 감사하고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 (옵션) |
|---|---|---|---|
| 쥐 방지 키트 항체 (클론 ACK - 2) | eBioscience | 14-1172 | 2μg/ml에서 사용합니다. 에피토프는 overfixation와 함께 손실됩니다. |
| 쥐 방지 키트 항체 (클론 ACK - 4) | 시더 레인 | CL8936AP | 2μg/ml에서 사용합니다. |
| 토끼 방지 키트 항체 (클론 D13A2) | 세포 신호 | 3074 | 1:100 희석에 사용합니다. 만이 항체는 파라핀 섹션에서 잘 작동하는지 여기에 나와. |
| 토끼 방지 Pgp9.5 항체 | Abcam | ab10404 | 레이블의 연결을 세포 세포질. myenteric 신경 얼기의 신경을 표시하는 데 유용합니다. 1:1000 희석에 사용합니다. |
| 토끼 방지 Ano1 항체 | Abcam | ab53212 | 2μg/ml에서 사용 |
| 알렉사 플루어 594 염소 안티 쥐 IgG | Invitrogen | A - 11007 | 2μg/ml에서 사용 |
| 알렉사 플루어 488 염소 안티 - 토끼 IgG | Invitrogen | A - 11008 | 2μg/ml에서 사용 |
| 동물 먹이 니들 | 어부 | 01-208-87 | 실리콘 성인 생쥐의 GI 트랙트 플러싱을위한 바늘 유용한 날붙이 |
| 블런트 니들 | 백톤 디키슨 | 305180 | 사전 젖을의 새끼의 GI 트랙트 플러싱에 대한 블런트 바늘 유용 |
| DAPI와 골드 antifade 시약을 연장 | Invitrogen | P - 36931 | DAPI와 함께 대안 설정 하드 장착 미디어를 사용할 수 있습니다 |
| 조직 테크 Cryomold | 조직 테크 | 4557 | |
| 조직 테크 OCT | 조직 테크 | 4583 | |
| 32 % Paraformaldehyde (10ml 봉인 앰풀) | EM 과학 | 15,714 | 바로 사용하기 전에 열고 봉인 앰풀 및 희석에 4퍼센트 |
| 버퍼를 차단 | 5 % 염소 혈청, 0.1 % 트리톤 PBS에서 X - 100 |
참고문헌
- Sanders, K. M. A case for interstitial cells of Cajal as pacemakers and mediators of neurotransmission in the gastrointestinal tract. Gastroenterology. 111, 492-515 (1996).
- Ward, S. M., Sanders, K. M. Physiology and pathophysiology of the interstitial cell of Cajal: from bench to bedside. I. Functional development and plasticity of interstitial cells of Cajal networks. Am J Physiol Gastrointest Liver Physiol. 281, 602-611 (2001).
- Komuro, T. Structure and organization of interstitial cells of Cajal in the gastrointestinal tract. J Physiol. 576, 653-658 (2006).
- Sanders, K. M., Ordog, T., Koh, S. D., Torihashi, S., Ward, S. M. Development and plasticity of interstitial cells of Cajal. Neurogastroenterol Motil. 11, 311-338 (1999).
- Ward, S. M., Burns, A. J., Torihashi, S., Sanders, K. M. Mutation of the proto-oncogene c-kit blocks development of interstitial cells and electrical rhythmicity in murine intestine. J Physiol. 480, 91-97 (1994).
- Huizinga, J. D. W/kit gene required for interstitial cells of Cajal and for intestinal pacemaker activity. Nature. 373, 347-349 (1995).
- Rubin, B. P., Heinrich, M. C., Corless, C. L. Gastrointestinal stromal tumour. Lancet. 369, 1731-1741 (2007).
- Hirota, S. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science. 279, 577-580 (1998).
- Chi, P. ETV1 is a lineage-specific survival factor in Gastrointestinal Stromal Tumour (GIST). Nature. , (2010).
- Kwon, J. G. Changes in the structure and function of ICC networks in ICC hyperplasia and gastrointestinal stromal tumors. Gastroenterology. 136, 630-639 (2009).
- Hwang, S. J. Expression of anoctamin 1/TMEM16A by interstitial cells of Cajal is fundamental for slow wave activity in gastrointestinal muscles. J Physiol. 587, 4887-4904 (2009).
- Gomez-Pinilla, P. J. Ano1 is a selective marker of interstitial cells of Cajal in the human and mouse gastrointestinal tract. Am J Physiol Gastrointest Liver Physiol. 296, G1370-G1381 (2009).
- Sommer, G. Gastrointestinal stromal tumors in a mouse model by targeted mutation of the Kit receptor tyrosine kinase. Proc Natl Acad Sci U S A. 100, 6706-6711 (2003).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유