Method Article
Barcoded 효모 게놈 라이브러리의 경쟁력 화면
* 이 저자들은 동등하게 기여했습니다
요약
우리는 유전자 - 약물 및 유전자 - 환경 상호 작용을 이해하는 포괄적인 불편 게놈 - 와이드 스크린을 개발했습니다. 이러한 돌연변이 컬렉션을 검사 방법이 제공됩니다.
초록
차세대 시퀀싱 기술의 진보 미덕으로, 우리는 거의 매일 새로운 게놈 시퀀스에 액세스할 수 있습니다. 이러한 발전의 템포는보다 깊이와 폭이 약속, 가속됩니다. 이러한 놀라운 발전에 비추어, 유전자 기능을 정의하기 위해 고속, 병렬 방법에 대한 필요성이 점점 중요 해지고 있습니다. 효모와 E.의 게놈 전체 삭제 돌연변이의 컬렉션 대장균은 유전자 기능의 기능 특성에 대한 workhorses 역임 있지만,이 접근법은 확장성 아니라, 현재의 유전자 삭제 방법은 삭제하고 확인하는 게놈을 구성하는 유전자의 수천의 각 필요합니다. 이 작업이 완료 후에 우리는 높은 처리량 phenotyping을 추구하실 수 있습니다. 지난 10 년간 우리 연구실 경쟁, 소형, 높은 처리량 게놈 - 와이드 병렬로 수행할 수 있습니다 assays의 포트폴리오를 정제하고 있습니다. 이 parallelization은 바코드가 돌연변이에 대한 프록시 역할을 함께하기 때문에 DNA '태그'또는 각각의 돌연변이에 '바코드'의 포함 가능한이며 하나는 돌연변이 적합성을 평가하기위한 바코드 풍부한을 측정할 수 있습니다. 본 연구에서는, 우리는 DNA 시퀀스 및 barcoded 돌연변이 컬렉션 사이의 간격을 채우기 위해 추구합니다. 이를 위해 우리는 새로 합성 최대 병렬 바코드 assays를 열고 있지만, 제대로 미생물 특징 결합 transposon 중단 - barcoding 방식을 소개합니다. 이 접근법을 설명하기 위해 우리는 새로운 캔디다 albicans barcoded 중단 수집을 제시하고 모두 microarray 기반 및 차세대 시퀀싱 기반 플랫폼이 10,000 수집하는 데 사용할 수있는 방법에 대해 설명 - 단일 실험에서 1,000,000 유전자 - 유전자 및 약물 - 유전자 상호 작용합니다.
프로토콜
1. 참고 자료
바코드 태그를 가지고 돌연변를 생성하는 방법에는 여러 가지가 있습니다. 현재 골드 표준 실험실의 컨소시엄에 의해 만들어진 2002 1 완료 효모 넉아웃 (YKO) 모음입니다. 원래 YKO가 도입된 이후, 다른 효모 모음가 생성되었습니다, 다른 스트레인 배경에 이상 표현 구조를 사용하고 같은 E. 같은 다른 미생물에 대장균 2. 병렬, barcoded shRNA 라이브러리를 만들 수있는 노력은 급속하게 진행하고, 사실이 포유류의 컬렉션에 대한 디자인 원칙 많은 효모에서 채택되었습니다. barcoded transposons는 체계적인 돌연변이 컬렉션을 만들기위한 신속하고 광범위하게 적용할 수있는 전략 방법을 보여줍니다하기 위해, 우리는 최근 인간의 곰팡이 병원균, 캔디다 albicans에서 만든 그룹이 하나에 중점을두고 있습니다. 캔디다에 대한 우리의 작품은 미국에서 바코드 화면의 성공을 기반으로했습니다 cerevisiae, 그리고이 예제 유기체로서 여기에 사용됩니다. 사소한 수정이 서스펜션 문화의 성장 수있는 모든 생물을 화면으로 사용할 수있는 샘플 프로토콜 수있다. 몇 가지 생물이 변화의 필요한 높은 속도와 완벽한 삭제 돌연변이를 만드는 데 필요한 효율적인 mitotic 재조합을 가지고 있기 때문에, 그에 따라 우리는 게놈 DNA 라이브러리를 mutagenize을 체외에서 transposon의 돌연변이 유발을 사용하는 프로토콜을 개발하고 캔디다 albicans 3에 해당 barcoded 게놈의 조각을 변환 4. 게놈에서 원래 YKO 수집 및 유전자 네트워크를 5-8, 게놈 차원 haploinsufficiency 9, 약물 타겟과 액션 10,11의 메커니즘의 특성에 대한 근본적인 발견에의 역할, 그리고 유전자의 본성의 성공에서 영감을 12 우리가 다른 미생물이 접근 방식을 확대 예측하는 것은 매우 유익한 것입니다.
아래의 프로토콜은 원하는 돌연변이 컬렉션이 만들어 (예 : YKO 또는 캔디다 albicans 방해 수집)와 개별적으로 보관된 종자로 사용할 수 있습니다되었음을 가정합니다. 스트레인 건설에 대한 자세한 설명을 보려면 1,13,14를 참조하십시오.
2. 하나의 수영장에 개인 돌연변이를 결합
- 이번 주에 풀링 세포 aliquots을 (-80 ° C에서 무한정 저장할 수 있습니다)를 생성하도록 허용합니다.
- 완전히 관심의 변종에 대한 냉동 글리세롤의 주식을 녹여하지만 세포가> 2 시간을 위해 해동 유지해서는 안된다.
- , 96 - 웰 핀 도구를 소독이 70 % 에탄올 욕조에 잠겨 내리고 (예 : 피펫 팁 상자 뚜껑), 불꽃 핀 도구 및 1 분 시원한 뒤에 남아있는 세포를 제거하기 위해 물에 핀 도구를 찍어. 핀 도구 멀리 에탄올 온천에서 불꽃을 조심해. 에탄올 욕조의 수준은 이월 세포 골조 및 제거하기 위해 물에 목욕의 수준을 초과한다. 물을 매일 4-6 pinnings를 교체하십시오.
- 부드럽게 해동 96 - 웰 플레이트, 소용돌이로 멸균 96 - 웰 핀 도구를 삽입하고 적절한 항생제를 포함한 YPD - 한천을 포함 Nunc 옴니 트레이에 세포를 전송할 수 있습니다. 그들은 30 최대한의 크기에 도달할 때까지 식민지를 성장 ° C (2 - 3D). 번호판을 절약하기 위해, 우리는 ~ 384 변종과 함께 하나의 옴니 - 트레이에 네 96 자 번호판을 통합하는 것이 가장 유용.
- 식민지가 성장 후에, 어떤 없거나 느린 성장 변종을 참고로 이들을 repin ~ 긴장의 나머지 부분과 세포 덩어리를 2X.
- 미생물학 환경 (불꽃과 멸균 labware로 작업, 50-10 ML 미디어 홍수 판은 50 ML 원뿔 원심 튜브에 액체 플러스 세포를 붓고. 전지 확장기로 5 분 및 resuspend 식민지에 대한 담그다, 및 글리세롤을 추가 15% 또는 DMSO 7 % (권 / 권).
- 수영장의 OD 600 측정 및 15 % 글리세롤 또는 7 % DMSO를 포함하는 미디어와 50 OD 600 엔 / ML의 최종 농도 (희석 또는 원심 분리에 의해) 조정합니다.
- -80에서 PCR 스트립 튜브 및 동결 40 μl 권 나누어지는 ° C.
3. 실험 수영장 성장
이 절차는 그림 1에 설명되어 있습니다.
- 얼음 해동 풀 aliquots (PCR 튜브에). 로봇을 사용하지 않는 경우, 5 단계로 건너 뜁니다.
- 즉시 48 잘 플레이트에 700 μl의 총 부피에 0.0625의 OD 600에서 inoculating, 약물 또는 선택 상태로 미디어에 (gently!) 수영장 희석. 접시에 하나 이상의 적절한 용매 컨트롤을 포함합니다. (물론 이상 1 예) 성장의 5 세대를 넘어 확장 실험을 위해, 인접 미디어 또는 선택 상태로 우물지만, NO 세포를 작성하십시오.
- 플라스틱 플레이트 도장과 인감, 상태가 성장 에어로빅 (예, 비 fermentable 탄소 소스)를 요구하는 경우, 각 우물의 측면쪽으로 막 도장에서 피어스 구멍에 21 게이지 바늘을 사용합니다.
- 실험적 determi 30 ° C에서 떨고, 분광 광도계 성장네드 떨고 처방 (예 떨고 이력서, 최고의 설정 (또는 온도 제어 쉐이크) 읽고, 우물 14 분 흔들). 세포 현탁액의 일부는 사용자 정의 생성 시간 점, 일반적으로 5, 10, 15 및 성장의 20 세대의 로봇 갑판에서 차가운 접시에 로봇에 의해 수확하고 저장할 수 있습니다. (http://med.stanford.edu/sgtc/technology/access.html, 자세한 문의 C. Nislow 또는 G. Giaever 경우).
- 수동 세포 성장을위한, 250 ML 문화 플라스크에 0.002의 시작 OD 600에서 50 ML 문화의 예방. 세포가 성장 ~ 10 세대를위한 2.0의 최종 OD 600 (Saccharomyces 또는 캔디다 용)에 도달할 때까지 250 rpm으로 30 ° C에서 흔들. 성장의 추가적인 세대는 새로운 플라스크에 다시 0.02-2.0의 OD600에서 diluting 세포에 의해 얻을 수 있습니다.
- 수확 이상 ~ 안전 잠금 microcentrifuge 튜브에 각 샘플 / 시간 포인트 전지 2 OD 600 대.
참고 : 항상 설명된대로 1.5 ML 튜브에 냉동기 aliquots에서 직접 수영장 1-2에게 OD 600 추가 및 처리하여 새로 만든 수영장에 초기 변형 표현을 평가하기 위해 (즉, "T0 시점") 시작 세포 샘플을 수집 아래.
4. 게놈 DNA의 추출, PCR 및 microarray의 하이브리드화 또는 시퀀싱
- (프로토콜 나는 효모 DNA를 사용하는 경우), 또는 관심있는 유기체 (특정 다른 적합한 방법 알코올 침전 다음 표준 페놀 / 클로로포름 추출 효과가 제조 업체의 지침에 따라 Zymo 연구 YeaStar 키트와 함께 세포의 OD 600 ~ 2에서 게놈 DNA를 정화 물론 다양한 미생물에 대한). YeaStar 키트를 사용하면 프로토콜에서 지정한 1X TE의 60 μL 대신 0.1X TE 300 μL와 DNA를 elute. 게놈 DNA는 -80 ° C.에 무기한으로 저장할 수 있습니다
- 33 μl ddH 2 O, MgCl 2없이는 6 μl 10X PCR 버퍼, 3 μl 50 MM MgCl 2, 1.2 μl 다음과 같이 반응 조건에 각각의 샘플을위한 두 가지 PCR 반응, uptags 한과 downtags 한을 설정 10 MM dNTPs, 1.2 μl 50 μm의 위로 또는 아래로 뇌관 믹스, 0.6 μl 5 U / μl DNA 형성 촉매 효소, 15 μl에 ~ 0.1 μg 게놈 DNA. 총 부피는 60 μl입니다. 다음 72 ° C 3min, 4에서 개최 ° C.; 94 ° C 3 분, 94의 30주기 ° C 30, 55 ° C 30, 72 ° C 30 다음 조건에서 Thermocycle 젤의 결과 PCR 제품을 확인, 모두 PCRs에 대한 60 BP 제품은 바코드 시퀀싱을위한 amplicons)의 하이브리드화와 130bp에 사용 amplicons 위해 예정입니다. PCR 제품은 다음 -80 ° C에서 무기한으로 저장할 수 있습니다.
- 42 Prewarm 하이브 리다이 제이션 오븐 온도 ° C와 얼음 물 슬러리를 포함하는 끓는 물을 욕조와 얼음 양동이를 설정합니다.
- 천천히 120 μl 1X 하이브 리다이 제이션 버퍼로 작성하여 사전 서부 유럽 표준시 배열.
- 42 하이브리드화 버퍼에 품어 ° C 10 분 20 RPM.
- 75 μl 2X 하이브리드화 버퍼, 0.5 μl B213 제어 oligonucleotide (0.2 픔 / μl), 12 μl 혼합 oligonucleotides (오후 12시 5분 / μl), μl 3 : 다음과 같이 하이브리드화 샘플 당 혼합, 플러스 버퍼로 하나 더 90 μl 준비 잠금 - 최고 0.5 ML 튜브에 50X Denhardt의 솔루션).
- 150 μL의 총 볼륨 120 μl 하이브리드화 믹스 30 μl PCR uptag 30 μl downtag PCR을 추가합니다. 최소한 2 분 동안 이분과 얼음 물에 세트 보일. 간단히 사용하기 전에 튜브를 스핀.
- 배열에서 사전 하이브 리다이 제이션 버퍼를 제거하고 90 μl 하이브리드화 / PCR 믹스를 추가합니다. 증발을 방지하기 위해, 힘든 현장으로 배열 가스켓을 커버. 42 16 시간 동안 잡종 ° C, 20 RPM.
- 다음과 같이 갓은 600 샘플 당 μl 비오틴 라벨 믹스 플러스 하나 더 준비 : 180 μl 20X SSPE, 12 μl 50X Denhardt의 6 μl 1% 트윈 20 (권 / 권), 1 μl 1 MG / ML streptavidin - phycoerythrin, 401 μl를 ddH 2 O. 어둠의 모든 streptavidin - PE 샘플을 저장합니다. 나누어지는 두 ML 튜브에 600 μl. 칩에서 터프 - 스포트를 제거합니다.
- 천천히 피펫으로 배열의 하이브리드화 믹스를 제거하고 120 μl 씻으 A. 프라임 Affymetrix fluidics 스테이션 microarrays를 입력합니다.
- (1주기, 2 믹스) 얼룩 전에 B 온도 42 ° C 대신 와시 와시 1 개 추가 단계를 다음 수정 "유전자 Flex_Sv3_450"프로토콜을 사용하여, 제조 업체의 지시에 따라 Affymetrix fluidics 스테이션을 사용하여 배열을 씻어 40 ° C는 42에서 얼룩 ° C 대신에 25 ° C. 그것은 (참고 15 P. 396 참조) 수동으로 게시 하이브 리다이 제이션 세척, 비오틴의 얼룩 및 게시물 얼룩 세척을 수행할 수도 있습니다. fluidics 작업에 따라, fluidics 역 "SHUTDOWN_450"프로토콜을 실행합니다.
- 세척에 따라 기포가 존재하지 않습니다 보장합니다. 거품이 사라질 때까지 천천히 필요한 90 μl 워시 및 피펫를 추가하는 경우. 아무 표시도 또는 SM이있다면배열 표면 udges은 이소프로판올있는 유리 창문을 청소하고 보푸라기가없는 조직. 가스켓 / septa 이상 신선 터프 - 명소를 적용하여 스캐너에 배열을 놓으십시오.
- 560 NM의 방출 파장에서 Affymetrix GeneArray 스캐너에서 스캔.
5. 배열 분석 (캔디다 albicans 중단 컬렉션을 사용하여 얻은 예를 들어, 그림 2 참조)
- 아웃 리에 마스킹 : Affymetrix TAG4 배열이 포함되어 있기 때문에 5 임의로 가면 및 폐기 수있는 복제에서 성적 이상자 모든 바코드 프로브를 분산 각 바코드 보완을 복제합니다. 이렇게하려면 각 배열 기능에 대한 그 4 다른 비교의 신호에 따라 국외자 것으로 보인다 것은이 기능의 복제, 우리의 소프트웨어는 먼저 의심 25 기능의 매트릭스를 제작, 용의자 국외자를 둘러싸고있는 5 기능을 검사 중심에 있습니다. 이 지역> 25분의 13 프로브 이상의 10 % 그들의 개인적인 자신의 손질 복제의 의미 각 (미들 쓰리 복제의 의미, 복제 최고 및 최저 제외)과 다를 경우,이 프로브는 다음 추가 분석에서 삭제됩니다. 이러한 outliers 가장 자주 이후 하이브 리다이 제이션 세척 일관성의 결과이기 때문에, 우리는 확장 또는 "패드"영역이 의심되는 프로브를 포함. 으로 의해 정의된 5 프로브 반경 내의 모든 프로브 포함하여 패드와 같은 프로브 ((X 1 - X 2) 2 + (Y 1 - Y 2) 2) ½ <6 여기서 X 1, X 2, Y 1, Y 2 두 가지 기능에 대한 x와 y 좌표입니다. 마지막으로, 기능 픽셀의 표준 편차는 (Affymetrix 배열에 대한. 셀 파일에 포함) / 기능 픽셀을 의미하는 기능을 삭제. outliers을 제거한 후, 남아있는 모든 평균 강도 값 복제합니다.
- 사용할 태그 제거 : 낮은 강도 값 태그 것은 가난한 품질의 결과를 제공하고 제거해야합니다. 낮은 강도 프로브에 대한 제외 컷오프은 다음과 같이 계산 수 있습니다
- 배열의 처리 제어 쌍 들어, 내가 C의 제어 강도는 내가 t은 치료 강도가 어디 있는지, 각 태그에 대한 로그 2 ((전 C - B G) / (I T - B G)를) 계산하고, B G는 할당되지 않은 태그 프로브의 평균 강도입니다.
- 변형하여 uptag 및 downtag 비율을 페어 각 태그 쌍을 위해 두 샘플의 두 태그의 최소 강도를 가져가라. 이 최소 강도에 의해 비율 쌍을 정렬.
- 순위 비율 쌍 50의 슬라이딩 창 크기를 사용하여 창 안에 비율 쌍을 uptag하고 downtag의 상관 관계를 계산합니다. 또한 이전 단계에서 계산된 최소 농도의 평균을 계산합니다.
- 25쌍하여 창을 슬라이드, 모든 쌍이 넘었 때까지 이전 단계를 반복합니다.
- 모든 Windows 용 uptag - downtag 상관 대 평균 최소 강도를 플롯.
- 마지막으로, 강도 임계값을 선택, 일반적으로 우리는 상관 관계가 먼저 최대 수준의 80 %에 도달 강도 값을 사용합니다. 이 컷오프 아래 태그를 국기와 더 분석에서 제거합니다.
- 채도 보정 : 바코드 microarray의 각 기능이 포화 상태가 될 수 있기 때문에, TAG4 배열에있는 신호가 선형 태그 농도와 관련이 없습니다. 이 채도가 참조 16에서 설명하는 프로토콜을 수행을위한 해결하려면.
- 배열 정규화 : 각 배열의 경우, 별도 uptags 및 downtags을 정상화. 정상화를 quantile하려면, 증가 강도 순서로 uptags 및 downtags 각 배열에서 얻은 값을 순위. uptags 및 downtags의 각 집합에 대한 정상화 의미의 의미로 나눕니다. 모든 배열의 의미 정상화는 각 배열의 의미에 원시 데이터를 변형 두 번째 단계의 다음과 같습니다.
- 제어 치료 비교에 대한 민감도 점수 계산 : 감도의 통계로 로그인이 비율을 사용하려면 : 각 변형에 대한 로그 2 ((μ C - B G) / (μ T - B G)를) 계산 어디 μ C는 것입니다 컨트롤 샘플 강도를 뜻 μ T는 트리 트먼트 샘플 평균 강도이며, B G는 할당되지 않은 프로브의 평균 강도입니다. 긍정적인 로그 2의 비율로 계통 치료에 민감하고, 강한 사람들은 부정적인 로그인이 비율 있습니다.
6. 순서에 의해 barcoded 효모 종자의 적합성을 평가
- 로 microarrays에 대한 설명 삭제 수영장에서 DNA를 분리.
- (Illumina primers 및 amplicon의 다이어그램 그림 3의 표 참조) Illumina flowcell에 하이브 리다이 제이션에 필요한 일반적인 바코드 primers의 시퀀스와 시퀀스로 구성된 복합 primers 각 20 메르 uptag 바코드를 확대. 이들primers는 추가 정제없이 desalted 사용할 수 있습니다. ; 94 25 사이클 ° C/30 초, 55 ° C/30 초, 68 95 ° C / 3 분 : PCR은 다음 조건 Invitrogen 플래티넘 PCR Supermix (Cat. 번호 11306-016)을 사용하여, 100μL에서 수행됩니다 ° C/30 초, 68 ° C/10 분 뒤에.
- Qiagen MinElute 96 UF PCR 정화 키트 (Cat. 번호 28051)로 PCR 제품 (~ 130bp)를 정화.
- PCR 정화에 따라, Invitrogen 퀀트 - IT dsDNA BR 어세이 키트 (CAT 번호 Q32853)와 DNA를 계량. 280분의 260 수치에 의존하지 마세요!
- 정규화된 DNA의 10μg/ml과 수영장 같은 볼륨을 DNA의 농도를 정상화.
- 사용 전압에 따라 3-4시간에 대한 12 % polyacrylamide의 TBE 젤에 대한 별도의 풀링된 DNA.
- 30 분 ethidium 브로마이드 (Sybr 그린과 같이 잘 작동한다)와 젤 스테인.
- (적절한 얼굴 보호를 입고) longwave의 자외선 라이트 박스에 관심있는 밴드를 찾아 그것을 잘라 호감을 사용하여 DNA를 추출하고 에탄올 침전 다음 방법 17 만끽해보세요.
- 적절한 크기의 DNA (130bp)가 고립되어 그 primers는 애질런트 Bioanalyzer 고감도 DNA 키트 (CAT 번호 5067-4626)를 사용하여 제거되었는지 확인합니다.
- 샘플 시퀀싱 :
- Illumina GAIIx 플랫폼 :
- cBOT 및 단일 읽기 클러스터 생성 키트 (CAT 번호 GD - 300-1001)을 사용하여 단일 읽기 flowcell에 클러스터를 생성합니다. 읽기 1, 위, 아래 태그 수정 시퀀싱 primers는 100uM 재고 농도에서 풀링 및 스트립 - 튜브 (120 μl HT1 각 100uM의 시퀀싱 프라이머의 0.6μL)에 추가됩니다. 요리법 SR_Amp_Block_StripTubeHyb_v7.0는 R1 클러스터를 생성하는 데 사용됩니다.
- 게놈 분석기 IIx에서 시퀀싱. 18 순서주기에 따라, 이점 엔드 모듈은 Illumina R1 (아래)를 사용하여 합성 첫번째 가닥을 스트립과 flowcell을 rehybridize하는 데 사용됩니다. 클러스터가 생성하고 인덱스 태그를 캡처 5주기 위해 합성 수 있습니다.
- Illumina GAIIx 플랫폼 :
- 인덱스 태그 순서는 실험 방식으로 빈 시퀀스하는 데 사용됩니다.
- 각 실험 빈 내에서 효모 바코드 시퀀스는 각 바코드에 대한 카운트의 총수를 제공 집계가 조금 어렵다 수 있습니다.
- 각 실험은 같은 개수의 분포를 가지고 있으므로 계산이 quantile 정상화됩니다. 바코드 microarray 휘트니스 실험, 각 변형에 대한 적합성 결함 비율로 비유하여 로그 2 비율 (제어 / 치료)로 계산하고 표현됩니다. 긍정적인 피트니스 결함 점수는 약물 치료 중에 변형 풍부하게 감소 의미 그 변형에서 삭제된 유전자의 야생 타입 버전이되는 약물이나 억제제에 저항을 필요하는 것이 좋습니다.
참고 : 배열 하이브 리다이 제이션에 대한 대안으로 바 - seq를 고려. 높은 처리량 시퀀싱의 비용이 태그 풍요의 판독으로 높은 처리량 시퀀싱을 사용 감소와 함께이 가능한지고 많은 경우에 더 많은 비용 효율적인 18입니다. 이러한 방법으로 증폭된 PCR 제품은 오히려 배열에 hybridized와 같은 신호 강도보다는 '계산'으로 직접 측정됩니다. 이것은 잘못된 제외하고 태그를 교차 오염, 채도, 또는 매우 높거나 매우 낮은 신호 강도로 인해 발생하는 문제에 발생하는 반응을 제거합니다. 또한 여러 실험 4-8 자료의 DNA 지수 19을 추가하여 시퀀싱 이전에 조합하여 사용할 수 있습니다. 효모 바코드는 20 BP, 극도의 100 수 있도록 2 단계는 멀티 플렉스 인덱스와 고유의 바코드를 모두 캡처 26-28 기지의 읽기 하나, + 멀티플렉싱 때문이다. 이 글을 작성 당시, 바 - seq는 바코드 microarrays 이상의 비용 이점을 제공하고, 또한, 바 - seq는 읽기 / 실행 증가로 멀티플렉싱의 수준은 더욱 감소 비용을 증가시킬 수 있습니다 그러한 본질적으로 유연 . 주요 플랫폼 제조 업체에서 온 몇몇 '중간 용량 "sequencers 더욱 선택의 판독이 될 가능성이 시퀀싱과 바 - seq를 민주화 것입니다.
이 프로토콜은 또한 Illumina HiSeq2000에서 검증되었습니다.
Saccharomyces cerevisiae의 성장 제어에 근본적인 생물 학적 질문을 주소로 바 - seq의 사용 훌륭한 행동은 그레셤 외하여 최근 연구에 표시됩니다. 몇 가지 중요한 실험 설계 및 해석의 지침을 개요 20.
7. 풀링 심사 데이터의 검증
어떤 기능 유전체학 화면에서 결과는 고립된 문화의 개별 변종을 사용하여 확인해야합니다. 각각의 실험을 확인하는 후보 종자의 수를 선택 민감한 종자의 숫자 측면에서 다를 수 있기 때문에하는 것은 다소 임의입니다. 가이드로, (일반적으로 2-3 표준 데로 해석하는 로그 2의 비율 또는 Z - 점수에 의해 가장 민감한 변종을 순위 및 후보자의 맨 25~50% 테스트수영장의 모든 변종)의 의미에서 viations은 비용과 이익 사이의 적절한 균형을이다. 개별 주문 확인은 어떤 플라스크로 진행하지만 우리는 (그림 4 참조), 흔들림 분광 광도계 미디어 100 μl의 OD 600 0.06의 시작 inoculum를 사용하여 측정을 15 분마다 복용 96 잘 접시 성장의 5 세대에 대해 이러한 테스트를 수행할 수 있습니다 .
8. 대표 결과
일단 게놈 - 와이드 스크린이 완료되며, 배열을 표준 및 각 변형의 문제는 데이터가 가장 쉽게 유전자 엑셀 파일 조작 (microarray의 농도를 비교하거나 계산 / 긴장을 순서에 의해 예) 제어 치료에 비해되었습니다 제어 / 실험 log2 비율의 순위. 이러한 방식에서 큰 부정적인 log2 비율은 더 민감한 특정 긴장은 시험 조건입니다. 이 엑셀 파일은 소프트웨어 패키지를 그래프의 다양한 꾸몄다 수 있습니다. 우리는 Y 축 및 유전자 또는 X 축에 ORF 이름에 log2 비율을 계획하는 간단한 그것을 찾으십시오. 그림 2A에 표시된 예제에서는 clotrimazole 치료 (알려진 antifungal 대리인)의 그러한 음모가 표시됩니다. 2 log2 비율과 치료에 매우 민감합니다 모든 변형은 빨간색으로 강조하고 있으며, 우리는 일반적으로 약물의 동일한 농도의 존재의 각 돌연변이의 개별 성장 assays 이러한 변종의 많은를 확인합니다. 이 예제에서, 4 변종은 NCP1, ERG2 및 ERG11 2 독립적인 대립 유전자, clotrimazole의 알려진 단백질 목표를 강조 표시됩니다. 이러한 4 가지 유전자 각각의 직접 ergosterol의 생합성, 콜레스테롤의 상응하는 효모에 관한 일을하고있다. 예를 들어, NCP1은 ergosterol의 생합성 관련되고 Erg11과 관련된 규제 및 coordinately되는 NADP - 시토크롬 P450 환원 효소를 인코딩합니다. 이 예제에서는 알려진 약물 타겟 (Erg11이)이 불편 화면에서 확인뿐만 아니라, 대상 경로의 여러 다른 주요 구성 요소가있다는 사실을 강조 표시합니다. 마지막으로, 빨간색으로 강조 유전자 몇 가지는 ergosterol의 생합성 또는 뚜렷한 생물 학적 과정에 관여 유전자 수를 나타냅니다. 위에서 언급한 바와 같이 풀링 화면에 민감한으로 감지 각각의 변형은 개별 성장 분석에의 감도에 대해서 확인해야합니다. 그림 2B에 표시된 예제에서는, 넷 종자는 야생 형 부모 스트레인, BWP17에 상대적으로 자신의 성장에 따라 감소 clotrimazole에 민감한 것으로 확인됩니다. 이러한 각각의 성장 곡선은 풀링된 유전자 - 약물 화면의 중요한 기능을 강조하며 그 반드시 감도 자사의 정확한 수준을 반영하지 않는 특정 변종의 절대 순위입니다. 또한, 그림 2B 또한이 경우, 각 유전자에 대한 여러 대립 유전자를 갖는 가치를 보여주는, 두 erg11 중단의 돌연변이가 약간 감성을 다양한 있습니다. 감도의 정도와 이러한 장애의 특성을 연관하는 것은 행동의 마약 메커니즘에 추가 통찰력을 제공할 수 있습니다.
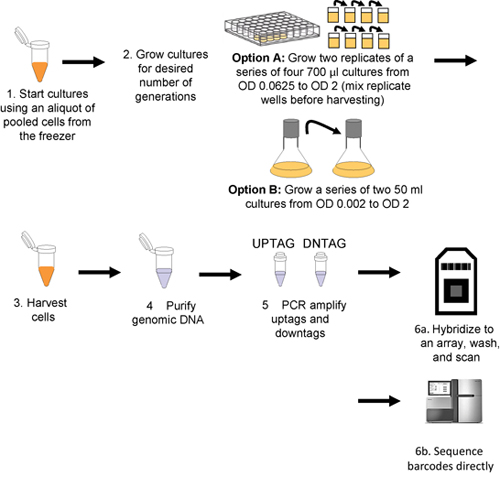
그림 1. 풀링 성장 분석 및 바코드 감지 워크플로. 문화가 풀링 세포의 해동 aliquots (1 단계)을 주사하고, 다음 중 하나 robotically 세대 원하는 번호 (2 단계)에 대한 성장 (옵션) 또는 수동 (옵션 B)입니다. 세포 원심 분리에 의해 수확입니다 (3 단계)와 게놈 DNA는 다음 수확 전지 (4 단계)에서 격리되어 uptags 및 downtags은 독립적으로 (5 단계) 증폭하고, 배열 (단계 6A 또는 직접 6B 단계 합성)에 hybridized입니다.
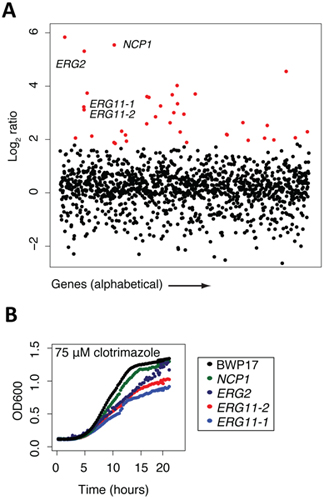
그림 2. 샘플 데이터는 프로토콜의 특정 지점에서 수집했습니다. (A) 심사 결과 (13에서 적응)에서 샘플 데이터를. 태그 돌연변이의 수영장은 clotrimazole 및 DMSO (컨트롤)의 존재에 20 세대에 걸쳐 성장했다. 이 비율 (제어 강도 / 치료 강도)를 로그하는 것은 계산 및 유전자의 기능으로 꾸몄다되었습니다. 매우 민감한 변종 (적색)은 clotrimazole, ERG11p의 알려진 목표를 포함되어 있습니다. 이 분석은 자주 화합물의 실제 대상 이외에 다른 민감한 돌연변이를 알게되어 있습니다. 일반적으로, 이러한 돌연변이가 대상과 synthetically 행동 이들 있으며, 일반적인 스트레스 / 치료 반응의 일부 이들, 또는 확인되지 잘못 탐지합니다. 확인 데이터 (B) 예 (13에서 적응). 풀링 성장 assays의 결과는 개별 문화의 부담을 증가하여 확인하고 야생 형 성장 (블랙) 비교하실 수 있습니다.
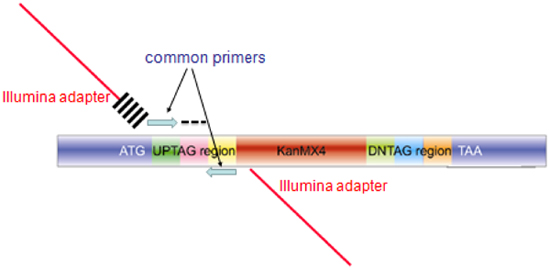
그림 3. microarray의 하이브리드화 또는 바코드 시퀀싱을위한 풀링 바코드 assays에서 생산 amplicon의 구조. 각각의 돌연변이에 대한 생산 amplicon IN 컬렉션 통합에 대한 게놈 (ATG와 TAA를 표시 파란색 영역), 고유 바코드 (AG 표시와 흑인 대시로 표시)에 상동 포함되어 있습니다. microarray의 하이브리드화 들어, 파란색 일반 primers는 microarray의 하이브 리다이 제이션을위한 60bp 프로브를 증폭하는 데 사용됩니다. 바코드 배열, 확장 primers은 Illumina 어댑터 (빨간 막대), 그리고 6bases 크로스 해치의 인덱스)와 상류 뇌관에 대한 파란색 일반적인 뇌관을 인코딩 시퀀스로 구성되어, PCR 반응에 사용하고, 같은 합성 뇌관 (마이너스 아르 두 번째 뇌관을위한 6 기본 색인).
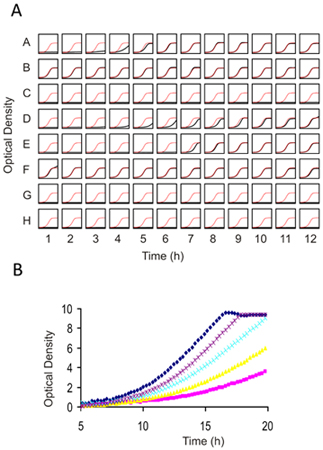
그림 4. 1 개인 성장 assays)은 게놈 와이드 스크린에서 결과를 확인) 게놈 차원의 심사 및 2에 대한 적절한 복용량을 결정하는 야생 형 효모에 대한 화합물 Prescreening. (A) 96 잘 평평한 바닥 판은 0.062의 OD에 세포 현탁액을 100 μl로 가득 차 있습니다. 각 물론 같은 스트레인 (선량 - 결정의 경우) 또는 다른 변형 및 약물 조합을 (확인 assays)을 포함할 수 있습니다. 화합물 (일반적으로 DMSO에 녹아있는) 2 μl가 추가되고 세포는 상수가 30 16-20 H에 대한 잡고 재배 ° C. DMSO의 최종 농도는 2 %를 넘지 않아야합니다. 이 예제에서는 접시의 각 우물에 성장 곡선은 빨간색으로 제어 성장 곡선의 줄거리에 대해 검정 꾸몄다 있습니다. 서로의 위에 중첩 예제 약물로 얻을 여러 prescreens의 (B) 높은 해상도의 이미지. 이 적정 시리즈, IC 10-15은 보라색 복용과 함께 취득하고 삭제 프로 파일링 (HIP 및 타)에 대한 적절한 것입니다. 높은 광학 밀도의 비 선형으로 인해 Tecan (또는 유사한 플레이트 리더) ODS는 "전통적인"1mm 경로 길이 쿠베트로 얻은 사람을 사용하여 보정해야합니다.
토론
여기, 우리가 쉽게 태그 돌연변이 컬렉션을 만드는 다른 미생물의 barcoded 돌연변이 컬렉션의 기존 컬렉션의 다양한 적용할 수 있습니다, 겸손한 수정과 프로토콜을 설명했다. 우리가 병원성 효모 C.에 대한 태그 transposon의 돌연변이 유발에 대한 프로토콜을보고있을 때 우리가 그것을 강조 albicans는 매우 유사한 프로토콜은 단세포 진균류의 다양한 적응 수 있습니다. 수정이 프로토콜은 박테리아 13 잘 작동하고, 현재 추가로 곰팡이와 세균 genomes의 번호 컬렉션 공사중입니다. 현재,이 분석은 유전자 작은 분자 상호 작용에 대한 유일한 종합 게놈 차원의 편견 화면을 제공합니다. 분석 중 하나는 특히 강력한 기능은 유전자 또는 작은 분자에 대한 사전 지식이 필요하지 않습니다 것입니다. 이러한 assays의 범위와 능력에도 불구하고, 다른 실험실 자신의 양도는 결과의 분석을위한 초기 자본 투자 및 정보학 도구에 의해 다소 방해했습니다. 분석을위한 강력한 도구와 함께 차세대 시퀀스 판독의 채택과 함께, 우리는 그들의 채택이 증가 기대합니다.
공개
관심 없음 충돌 선언하지 않습니다.
감사의 말
우리는 론 데이비스, 아담 Deutschbauer, 그리고 토론과 조언 토론토 대학에서 전체 힙합 실험실 감사합니다. CN은 국가 인간 게놈 연구소 (부여 번호 HG000205), RO1 HG003317, CIHR 청소 - 84,305, 그리고 캐나다 암 협회 (# 020380)에서 기금에 의해 지원됩니다. JO는 스탠포드 게놈 연수 프로그램 (부여 번호 T32 HG00044 국가 인간 게놈 연구소에서)와 국립 보건원 (부여 번호 P01 GH000205)에 의해 지원되었다. GG는 DRS으로 혁신에 대한 캐나다 재단의 보조금에 의해 일부 지원 NHGRI RO1 HG003317와 캐나다 암 협회, 그랜트 # 020380, TD 및 도널리 시퀀싱 센터에 의해 지원됩니다. 브렌다 앤드류스와 잭 그린 블. AMS는 토론토 오픈 원정대의 대학에 의해 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| 항생제 | 공급 업체 및 카탈로그 번호 | ||
| Carbenicillin | 시그마, 부분 # C1613 | ||
| Kanamycin | 시그마, 부분 # K1876 | ||
| spectinomycin | 시그마, 부분 # S0692 | ||
| Chloramphenicol | 시그마, 부분 # C0378 | ||
| DNA 클린 - 업 및 농도 키트 | |||
| QIAprep 스핀 Miniprep 키트 | Qiagen, 부분 # 27106 | ||
| HiSpeed 플라스미드 맥시 키트 | Qiagen, 부분 # 12663 | ||
| QIAquick PCR의 정제 키트 | Qiagen, 부분 # 28106 | ||
| QIAquick 겔 추출 키트 | Qiagen, 부분 # 28704 | ||
| PCR과 전기 영동의 시약 | |||
| DNA 형성 촉매의 DNA 중합 효소 (MG - 무료) 버퍼 | 뉴 잉글랜드 Biolabs, 부분 # M0320L | ||
| Deoxynucleotide 솔루션 믹스 | 뉴 잉글랜드 Biolabs, 부분 # N0447L | ||
| 25 MM MgCl 2 | 시그마, 부분 # 63036 | ||
| 아가로 오스, 로딩 염색하고, 핵산은 겔 전기 영동에 적합 얼룩 | 여러 | ||
| 10X 태 버퍼 | 시그마, 부분 # T8280 | ||
| 1 KB 플러스 DNA 레더 | Invitrogen, 부분 # 10787026 | ||
| YPD 수프 | |||
| 효모 추출물의 10g | 시그마, 부분 # Y1625 | ||
| 20g Bacto 펩톤 | BD Biosciences, 부분 # 211677 | ||
| 덱스 트로 오스의 20g | 시그마, 부분 # D9434 | ||
| Labware | |||
| 멀티채널 pipettes (1000, 200, 20 μL) | 여러 | ||
| 일회용 pipetting 저수지 | 여러 | ||
| 15 50 ML 원심 분리기 튜브 | 여러 | ||
| 96 - 및 384 자 딥 웰 플레이트 | Axygen 과학, 부분 # P - 2ML - SQ - CS & P - 384240SQCS | ||
| 96 - 잘하고 384 잘 PCR 플레이트 및 밀봉 필름 | 여러 | ||
| 실링 멀티 잘 번호판을위한 플레이트 롤러 | 시그마, 부분 # R1275 | ||
| 30 ° C와 37 ° C 접시에 박테리아와 효모 성장과 튜브에 incubators를 흔들어 | 여러 | ||
| 체외 transposon 돌연변이 유발에 | |||
| EZ - Tn5의 Transposase | Epicentre의 Biotechnologies, 부분 # TNP92110 | ||
| 높은 처리량 변환 | |||
| Seqprep 96 HT 플라스미드 준비 키트 | 에지 Biosystems, 부분 # 84359 | ||
| 폴리에틸렌 글리콜, 분자량 3,350 | 여러 | ||
| 리튬 아세테이트 | 시그마, 부분 # 517992 | ||
| 무균, 접시 6 - 웰 | 코닝, 부분 # 3335 | ||
| 50 MG / ML 유리딘 | 시그마, 부분 # U3750 | ||
| 100X 트리스 - EDTA (에틸렌 다이아 민 테트라 초산) 버퍼 솔루션 | 시그마, 부분 # T9285 | ||
| 1X TE/0.1M LiOAc | 여러 | ||
| 연어 testis DNA | 시그마, 부분 # 1626 | ||
| barcoded 컬렉션의 성장 | |||
| 48 잘 접시, 접시의 문화를 성장하는 경우 | 그레 이너 부분 # M9437 | ||
| 접착제 플레이트 씰 | ABgene, 부분 # AB - 0580 | ||
| 200 ML 문화 flasks | 여러 | ||
| 흡광도 수있는 분광 광도계 | 여러 | ||
| 250 ML flasks이나 흔들림 분광 광도계를위한 온도 제어 흔드는 | 여러 | ||
| 안전 잠금 Microcentrifuge 튜브, 2 ML | Eppendorf, 부분 # 0030 120.094 | ||
| 하이브리드화 장비 | |||
| 하이브 리다이 제이션 오븐 640 | Affymetrix, 부분 # 800138 | ||
| GeneChip 유체 역 450 | Affymetrix, 부분 # 00-0079 | ||
| GeneArray 스캐너 3000 | Affymetrix, 부분 # 00-0212 | ||
| 플로팅 랙과 함께 끓는 물 목욕 | 여러 | ||
| 하이브 리다이 제이션 소모품 | |||
| Genflex 태그 16K 배열 V2 | Affymetrix, 부분 # 511331 | ||
| Denhardt의 솔루션, 50X 집중 | 시그마, 부분 # D2532 | ||
| Streptavidin, R - phycoerythrin 공액 (SAPE) | Invitrogen, 부분 # S866 | ||
| 안전 잠금 Microcentrifuge 튜브, 0.5 ML | Eppendorf, 부분 # 0030 123.301 | ||
| 작은 터프 - 명소 | 다양 생명 공학, 부분 # LTTM - 1000 | ||
| 0.5 M EDTA (에틸렌 다이아 민 테트라 초산) | BioRad, 부분 # 161-0729 | ||
| 10% 트윈 | 시그마, 부분 # T2700 | ||
| MES 무료 산성 일수화물 | 시그마, 부분 # M5287 | ||
| MES 나트륨 소금 | 시그마, 부분 # M5057 | ||
| 5 M NaCl | 시그마, 부분 # 71386 | ||
| 20X SSPE | 시그마, 부분 # S2015 | ||
| 분자 생물학 등급 물 | 시그마, 부분 # W4502 | ||
| 하이브 리다이 제이션 Primers | 다양한 공급 업체 (표준 탈염) | ||
| Uptag | 5 'GATGTCCACGAGGTCTCT 3' | ||
| Buptagkanmx4 | 5 '비오틴 - GTCGACCTGCAGCGTACG 3' | ||
| Dntag | 5 'CGGTGTCGGTCTCGTAG 3' | ||
| Bdntagkanmx4 | 5 '비오틴 - GAAAACGAGCTCGAATTCATCG 3' | ||
| B213 | 5 '비오틴 - CTGAACGGTAGCATCTTGAC 3' | ||
| Uptagkanmx | 5 '3 GTCGACCTGCAGCGTACG' | ||
| Dntagkanmx | 5'GAAAACGAGCTCGAATTCATCG 3 ' | ||
| Uptagcomp | 5'AGAGACCTCGTGGACATC 3 ' | ||
| Dntagcomp | 3 5'CTACGAGACCGACACCG ' | ||
| Upkancomp | 5'CGTACGCTGCAGGTCGAC 3 ' | ||
| Dnkancomp | 5'CGATGAATTCGAGCTCGTTTTC 3 ' | ||
| 시퀀싱 Primers : Illumina 플랫폼 | 다양한 공급 업체 | ||
| UpTag 전달 (100uM) | 5 'CAA GCA GAA GAC GGC ATA CGA GCT CTT CCG GAT GTC ATC T CAC GTC TCT 개그 3' | ||
| UpTag 역방향 (100uM) | 5 'AAT GAT GCG ACG ACC ACC GAC ACT CTT TCC CTA CAC GAC CTT GCT CCG ATC T NNNNN GTC GAC CTG CGT 전투 편대 ACG 3' | ||
| DownTag 전달 (100uM) | 5 'CAA GCA GAA GAC GGC ATA CGA GCT CTT GAA CCG ATC T AAC 개그 CTC GAA TTC ATC G 3' | ||
| DownTag 역방향 (100uM) | 5 'AAT GAT GCG ACG ACC ACC GAC ACT CTT TCC CTA CAC GAC CTT GCT CCG ATC T NNNNN CGG TGT CGG TCT CGT AG 3` | ||
| 1 읽기 UP - 태그 seq 프라이머 (100uM) | 5 'GTC GAC CTG CGT 전투 편대 ACG 3' | ||
| 1 DOWN 태그 seq 프라이머 (100uM)을 읽기 | 5 'CGG TGT CGG TCT CGT AG 3' | ||
| 이 인덱스 시퀀싱 프라이머 (표준 Illumina R1 프라이머) (100uM)을 읽기 | 5 'AC ACT CTT TCC CTA CAC GAC CTT GCT CCG ATC T 3' | ||
| 추가 시퀀싱의 시약 / 장비 | |||
| Qiagen MinElute 96 UF PCR 정화 키트 | Qiagen, 부분 # 29051 | ||
| 배기기 | 모든 공급 업체 | ||
| Macherey - 나겔 진공 매니폴드 | Macherey - 나겔, 부분 # 740 681 | ||
| Invitrogen 퀀트 - IT dsDNA BR 어세이 키트 | Invitrogen, 부분 # Q32853 | ||
| Invitrogen Qubit 분석 튜브 | Invitrogen, 부분 # Q32856 | ||
| 40 % 아크릴 아미드 플러스 1 % N, N' - 메틸렌 - 비스 - 아크릴 아미드, 37.5:1 | 바이오 래드, 부분 # 161-0148 | ||
| 트리스베이스 | 시그마, 부분 # T1503 - 1KG | ||
| 붕산 | 시그마, 부분 # B6768 - 500G | ||
| 0.5M EDTA (에틸렌 다이아 민 테트라 초산), 산도 8.0 | Teknova, 부분 # E0306 | ||
| 암모늄 Persulfate | 시그마, 부분 # A3678 - 25G | ||
| TEMED | Bioshop, 부분 # TEM001.25 | ||
| Ethidium의 브로마이드 솔루션 | Bioshop, 부분 # ETB444.10 | ||
| 0.5M 질산 에틸 | Teknova, 부분 # A2000 | ||
| 10mM 마그네슘 아세테이트 tetrahydrate | 시그마, 부분 # M0631 - 100G | ||
| 1mM EDTA (에틸렌 다이아 민 테트라 초산), 산도 8.0 | 0.5M EDTA (에틸렌 다이아 민 테트라 초산), 산도 8.0를 참조 | ||
| 에탄올 | 여러 | ||
| 아세트산 나트륨, 산도 5.2 | Teknova, 부분 # S0297 | ||
| 스피드 진공 | 여러 | ||
| 단일 읽기 클러스터 생성 키트 | Illumina, 부분 # GD - 300-1001 | ||
| V4 36c 시퀀싱 키트 | Illumina, 부분 # FC - 104-4002 | ||
10X TBE 요리법
| 금액 | 시약 |
| 108g | 트리스베이스 |
| 55g | 붕산 |
| 40mL | 0.5M EDTA (에틸렌 다이아 민 테트라 초산) (산도 8.0) |
| 1L 표시 DH 2 O 추가 | |
12 % Polyacrylamide 젤 제조법
| 볼륨 | 시약 |
| 5.8 ML | 40 % 아크릴 아미드 플러스 1 % N, N' - 메틸렌 - 비스 - 아크릴 아미드, 37.5:1 |
| 12 ML | DH 2 O |
| 2 ML | 10X TBE |
| 140 μl | 10 % 질산 Persulfate |
| 총 부피 : 20ml |
프라이머 믹스를 Uptag :
Resuspend Uptag 100 μm의에서 ddH 2 O의 Buptagkanmx4 각각 다음 50 μm의 각 최종 농도에 대해 1:1 비율로 섞는다. -20 ° C.에 저장
프라이머 믹스를 Downtag :
Resuspend Dntag 및 Bdntagkanmx4 100 μm의에서 ddH 2 O에서 각 후, 50 μm의 각 최종 농도에 대해 1:1 비율로 섞는다. -20 ° C.에 저장
혼합 oligonucleotides :
100 μm의에서 ddH 2 O에 다음과 같은 여덟 oligos (표준 desalted)의 각 Resuspend :
Uptag, Dntag, Uptagkanmx, Dntagkanmx, Uptagcomp, Dntagcomp, Upkancomp, Dnkancomp.
12.5 μm의 각 최종 농도에 대한 8 oligonucleotides의 동일한 음량을 섞는다.
12 배 MES 재고 :
10 ML 들어, 8 ML 분자 생물학 등급 물 0.7 g MES 무료 산성 일수화물과 1.93 g MES 나트륨 소금을 풀다. 잘 혼합 후, 산도를 확인하고 산도 6.5-6.7 필요하면 조정합니다. 10 ML의 총 볼륨에 물을 추가합니다. 소독 필터와 4 저장 ° C 빛 (예 : 포일에있는 튜브를 랩)에서 보호. 솔루션은 눈에 보이게 노란색 또는 6 개월 후이된다면 바꿉니다.
2X 하이브 리다이 제이션 버퍼 :
50 ML 들어, 12 배 MES 재고 8.3 ML (2.9.14에서), 5 M NaCl, 0.5 M EDTA (에틸렌 다이아 민 테트라 초산) 10 % 트윈 20 0.1 ML (권 / 권)의 4.0 ML, 그리고 19.9 ML ddH 필터링의 17.7 ML를 섞어 2 O. 소독 필터.
와시 : 혼합 300 ML 20X SSPE, 1 ML 10% 트윈 (권 / 권), 699 ML ddH 2 O.을 소독 필터.
와시 B : 믹스 150 ML 20X SSPE, 1 ML 10% 트윈 (권 / 권), 849 ML ddH 2 O. 소독 필터.
바코드 시퀀싱의 primers
UP - 태그 프라이머 시퀀스에서 5 '꼬리 (굵게) F와 R 프라이머에 통합 Illumina 특정 어댑터 시퀀스입니다. 변수 순서 (이탤릭체)는 색인 / 멀티플렉싱 읽기 밖에서 사용하는 5 메르 색인 태그를 나타냅니다. 3 '꼬리 (밑줄) uptag 바코드 측면을 노릴 일반적인 뇌관을 상징하고 효모 바코드를 증폭하기 위해 필요합니다.
DOWN - 태그에 뇌관은 5 단, 3 '꼬리가 (밑줄) 증폭하는 데 사용되는 일반 primers로 대체될 것이며, UP - 태그 primers (Illumina 특정 순서)의 꼬리'꼬리가 5 동일 '시퀀스 DOWN을 태그는 바코드.
참고문헌
- Giaever, G. Functional profiling of the Saccharomyces cerevisiae genome. Nature. 418, 387-391 (2002).
- Baba, T. Construction of Escherichia coli K-12 in-frame, single-gene knockout mutants: the Keio collection. Molecular systems biology. 2, 2006.0008-2006.0008 (2006).
- Claus, H., Frosch, M., Vogel, U. Identification of a hotspot for transformation of Neisseria meningitidis by shuttle mutagenesis using signature-tagged transposons. Mol Gen Genet. 259, 363-371 (1998).
- Hava, D. L., Camilli, A. Large-scale identification of serotype 4 Streptococcus pneumoniae virulence factors. Molecular microbiology. 45, 1389-1406 (2002).
- Costanzo, M. The Genetic Landscape of a Cell. Science. 327, 425-431 (2010).
- Tong, A. H. Systematic genetic analysis with ordered arrays of yeast deletion mutants. Science. 294, 2364-2368 (2001).
- Pan, X. A robust toolkit for functional profiling of the yeast genome. Molecular cell. 16, 487-496 (2004).
- Schuldiner, M. Exploration of the Function and Organization of the Yeast Early Secretory Pathway through an Epistatic Miniarray Profile. Cell. 123, 507-519 (2005).
- Deutschbauer, A. M. Mechanisms of haploinsufficiency revealed by genome-wide profiling in yeast. Genetics. 169, 1915-1925 (2005).
- Giaever, G. Chemogenomic profiling: identifying the functional interactions of small molecules in yeast. Proceedings of the National Academy of Sciences of the United States of America. 101, 793-798 (2004).
- Lum, P. Y. Discovering modes of action for therapeutic compounds using a genome-wide screen of yeast heterozygotes. Cell. 116, 121-137 (2004).
- Hillenmeyer, M. E. The chemical genomic portrait of yeast: uncovering a phenotype for all genes. Science. 320, 362-365 (2008).
- Oh, J. A universal TagModule collection for parallel genetic analysis of microorganisms. Nucleic acids research. 38, e146-e146 (2010).
- Oh, J. Gene annotation and drug target discovery in Candida albicans with a tagged transposon mutant collection. PLoS pathogens. 6, (2010).
- Nislow, C., Giaever, G., Stark, I., Stansfields, M. J. R. Chapter 387. Yeast Gene Analysis. , 387-414 (2007).
- Pierce, S. E., Davis, R. W., Nislow, C., Giaever, G. Genome-wide analysis of barcoded Saccharomyces cerevisiae gene-deletion mutants in pooled cultures. Nature protocols. 2, 2958-2974 (2007).
- Sambrook, J., Russell, D. W. . Molecular cloning : a laboratory manual. , (2001).
- Smith, A. M. Quantitative phenotyping via deep barcode sequencing. Genome Res. , (2009).
- Hamady, M., Walker, J. J., Harris, J. K., Gold, N. J., Knight, R. Error-correcting barcoded primers for pyrosequencing hundreds of samples in multiplex. Nature. 5, 235-237 (2008).
- Gresham, D. System-Level Analysis of Genes and Functions Affecting Survival During Nutrient Starvation in Saccharomyces cerevisiae. Genetics. 187, 299-317 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유