JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
루게릭병과 외상 척수 상해에서 자궁암 복부 호른를 타겟팅하는 Intraspinal 세포 이식
요약
신경 전구체 이식은 보호 및 / 또는 척수 상해 (SCI)과 모터 신경 장애, amyotrophic 패스 경화증 (ALS)에 분실 / 역기능 자궁 phrenic 모터 뉴런을 교체 유망 전략이다. 우리는 ALS와 SCI의 쥐 모델에서 자궁 경부 척수 복부 혼까지 셀 전송을위한 프로토콜을 제공합니다.
초록
phrenic 모터 신경 세포의 손실로 인해 호흡기 손상은 인간의 외상성 척수 손상의 큰 비율 (SCI) 가지 경우 1 쇠약 결과이며, 모터 신경 장애, amyotrophic 패스 경화증 (ALS) 2 환자에서 사망의 궁극적인 원인입니다.
ALS는 상부의 비교적 빠른 변성 낮은 모터 뉴런이 특징입니다 치명적인 신경 질환이다. 평균 2-5년에있는 질병에 궁극적으로 쓰러지는 환자 때문에 횡경막 3 phrenic 모터 신경 세포의 innnervation의 손실로 인해 호흡 마비의 진단에 따라. 10 % 가족성 양식의하는 동안 대부분의 경우는 산발하고 있습니다. 가족성 가지 경우 대략 20 %가 염색체 21 4 잘라내기 / Zn 초과 산화물 dismutase 1 (SOD1) 유전자의 다양한 돌연변이 포인트로 연결되어 있습니다. 돌연변이 인간 SOD1 유전자를 (G93A, G37R, G86R, G85R) 운반 유전자 변형 마우스 4,5와 쥐 6 생성하고, 모터 신경 세포의 손실을 다른 동물 모델의 존재에도 불구하고, 현재이 질병의 가장 높은 사용 모델 아르되었습니다 .
척수 손상 (SCI)는 부상 7 종류, 위치 및 심각도에 따라 다양한 기능과 실제 결과 외상에서 척수에 발생하는 조건의 이질적인 집합입니다. 그럼에도 불구하고, 인간의 SCI 케이스의 약 절반으로 인해 phrenic 모터 신경 세포 손실 및 bulbospinal의 호흡 axons 1 내림차순으로 부상을 쇠약하게 호흡 부전의 결과, 자궁 지역에 영향을 미칩니다. SCI의 동물 모델의 숫자는 가장 일반적으로 사용하고 임상 - 관련 타박상 8되는, 개발되었습니다.
신경 전구체 세포 (NPCs)의 다양한 클래스의 이식 때문에 분실 또는 역기능 CNS 세포 종류가 제공하는 neuroprotection를 교체하고, 유전자 요인을 제공할 수있는 능력의 ALS 및 SCI를 포함한 외상 CNS의 부상과 neurodegeneration의 치료를위한 유망한 치료 전략 관심 9.
ALS와 SCI 모두의 동물 모델 phrenic 모터 신경 세포 손실 및 결과의 호흡기 손상 10,11 포함하여이 질병의 많은 임상 - 관련 측면을 모델 수 있습니다. ALS와 SCI 이러한 동물 모델에서 호흡 기능에 NPC 기반 전략의 효능을 평가하기 위해서는 세포 개입은 특히 phrenic 모터 뉴런과 같은 therapeutically 관련 목표를 포함하는 지역으로 이동해야합니다. 우리는 이러한 SOD1 G93A 마우스 및 쥐뿐만 아니라 척수 부상 쥐 및 쥐 11으로 neurodegenerative 모델의 자궁 경부 척수 복부 회색 물질로 NPCs의 멀티 segmental, intraspinal 이식에 대한 자세한 프로토콜을 제공합니다.
프로토콜
방법
1. 셀 준비
예를 들어, 우리는 이것 때문에 세포 유형과 경험의 이식에 대한 glial 전구 세포에게 12 준비 절차를 설명합니다. 그러나, 중간 및 예를 들어, 트립신의 사용을 포함한 프로토콜의 세부 사항은, 이식에 사용되는 특정 세포 종류에 따라 달라집니다.
- 37.0 미리 따뜻한 모든 솔루션 ° C 물 목욕 인치
- HBSS로 플라스크의 2X를 헹굴. 0.05 % 트립신 / EDTA (에틸렌 다이아 민 테트라 초산) 5.0 mL/T-75 플라스크를 추가합니다. 37.0 ° C 배양기에서 3 분 플라스크를 품어. 5 10mL 피펫과 플라스크에 부드럽게 배 씹다.
옵션 : 1.0 MG / DMEM/F12에 ML의 대두 트립신 억제제의 추가 5.0 mL/T-75 술병.
- 매체의 5.0 ML 각 플라스크에 2X를 헹굴. 수영장 세포와 물에 빨고. 이후의 모든 단계를 얼음에 세포 보관하십시오.
- 원뿔 관에서 5 분 200-300그램에 스핀 : 선호 원심 분리기 관련 4 냉각 ° C. 가만히 따르다 (저장) 뜨는. 매체의 1.0 ML의 세포를 다시 중지 및 전송 1.5 ML Eppendorf 튜브에.
- 가능성을 결정하기 위해 Trypan 파랑을 사용하여 hemocytometer로 세포를 세어보세요.
- . 1.5 ML 튜브 (선호 원심 분리기에 4 냉각 ° C 10 분 동안 800 RPM)에 다시 스핀 가만히 따르다 (저장) 뜨는.
- 매체의 원하는 최종 볼륨의 세포가 적절한 세포 밀도를 달성하기 위해 다시 일시 중지합니다.
- 여러 개의 1.5 ML Eppendorf 튜브에 세포 정지를 배포합니다. 이식까지 서부 유럽 표준시 얼음에 세포 보관하십시오.
해밀턴 주사기 / 바늘이 튜브에 깊이 맞지 않을 수, 0.75 ML 튜브를 사용하지 마십시오. 여러 주사 가능성이 수술 세션 중에 만들어진, 그리고 하나는 세포 여러 번 같은 튜브를 방해하지 않도록하고자합니다. 필요 이상의 세포 현탁액의 적어도 50 % 이상 볼륨을 준비하려고합니다. 수술 세션을 통해 얼음에 세포 보관하십시오. 세포 이식 후 가장 큰 가능성을 보장하기 위해 셀 정지를 준비하는 4-5시간 이내에 이식 세포.
2. 수술하기 전에 준비
- 이전 수술과 관련된 기본적인 행동 평가를 실시합니다.
- 면역 억제 : 피하 시클 로스 포린 A (CSA : 10.0 MG / 체중 kg) 또는 intraperitoneal (IP) FK-506/Rapamycin (1.0 MG / 체중 kg) 이전에 이식하기 위해 최소 3 일 시작되어야하고,해야 희생까지 매일 제공. 식수 (대신에 매일 주사의)의 관리는 권장되지 않습니다. 쥐 - 파생 세포를 이식하면 인간 파생 세포를 이식하면 FK-506/Rapamycin 우리의 선택되는 동안 CSA는 선택의 우리의 면역 반응 억제제입니다.
- 이전 수술로 수술 도구를 압력솥. 수술을 할 단정하고 깨끗한 장소뿐만 아니라 도구를 넣어 정리된 장소를 준비합니다. 유리 비드 살균기도 유용합니다. 이 절차는 훨씬 쉽게하므로 수술하는 동안 도구 청소 (특히 rongeur)를 모두 보관. 수술 중에 사용되는 모든 재료는 멸균해야합니다.
- 같은 수술 현미경으로 소독 수없는 악기 적절한 살균제로 소독 닦여 있어야하며 외과 의사, 한때 멸균 장갑과 donned가 그 / 그녀의 장갑을 오염하지 않도록은 멸균 재료 (예 : 거즈)으로 덮여 처리합니다.
- 외과 수술을 시작하기 전에 살균제 (chlorhexidine 스크럽)와 그녀 / 그의 손을 씻고해야합니다. 외과 멸균 장갑, 안면, 그리고 깨끗한 가운을 입을 것입니다.
3. 수술 : 동물 준비 및 수술
동물 준비 :
- 동물의 무게를, 그리고 마취의 적절한 복용을 관리 : Isofluorane 흡입하거나 마취 칵테일 (IP를 통해 제공되는)의 [acepromazine의 maleate (0.7 밀리그램 / kg), 마취제 (95 MG / kg)과 xylazine (10 MG / kg)]합니다.
- 핀치 발가락 및 / 또는 동물이 제대로 anesthetized 있는지 확인합니다 (점멸 관찰 솜 밀고 작은 주걱으로 위 눈꺼풀을 감동) palpebral 반사를 사용합니다. 각막은 수술하기 전에 인공 눈물 연고를 적용하여 보호해야합니다.
- 전기 면도기 (아무 첨부 파일이 필요하지 않음)로 머리를 면도. 동물의 뒤쪽의 중앙에 귀가 약간 주동이의에서 면도. 물론 면도하고, 절개에지고 머리칼을 방지하기 위해 피부에서 상처 머리카락을 제거합니다. 수술 준비는 수술을 머리카락과 함께 수술 사이트의 오염을 피하기 위해 수행됩니다 지역에서 떨어져 수행하여야한다.
- Povidine - 요오드 살균 솔루션 거즈를 적시게하고, 면도 영역 피부에 적용됩니다. 외과 사이트는 주변쪽으로 사이트의 중심에서 청소할 조심하고, Povidine - 요오드 솔루션 적어도 두 번 청소해야합니다. 사이트는 다음 70 % 알코올이나 희석 살균 스크럽과 씻어서 수 있습니다. 지역은 살균 커튼으로 덮여 있어야합니다.
- 수술 전반에 걸쳐, 난방의 사용은 내가 패드S는 높은 동물의 정상 체온을 유지하는 것이 좋습니다. 또한, 신체 온도 모니터링해야합니다. 압연 거즈 패드에 놓으 동물. 성인 밀고 들어, 압연 거즈 패드는 두께 1.0 ~ 6.0 인치 ~ 인치의 길이되어야합니다. 수술 보드 테이프이 패드가 움직이지 않도록. 가슴 / 어깨의 수준에 패드를 놓습니다 동물. 수술 보드에 팔 아래로 양쪽 패드에 팔, 그리고 테이프를 내밀 어라. 아이디어가 그래서 그것이 자궁 코드가 깊은 피부의 표면 아래에 발견되기 때문에 수술을 통해 작업하는 것이 더 쉽습니다 그 자궁 경부 척수 역시 마찬가지입니다.
수술 :
- 가장 낮은 현미경의 배율에 (우리는 8 X의 배율을 사용), 중간선 절개를 만들기 위해 메스 블레이드를 사용합니다. (절개로 피부가 쉽게되는) 피부가 긴장을 다른 손으로 옆으로 피부를 스트레칭하고, 견갑골에 두개골의 기지에서 절개합니다. (그림 1 참조)
- 척추 칼럼을 통해 3 근육층을 통해 절개를 만들기 위해 메스 블레이드를 사용합니다. 약간 다른 손으로 양쪽에 (중간에 측면에서) 근육을 쥐어 짜기. 근육 incisions 쉽게 수술 끝에 suturing하게되는, 들쭉날쭉한되지 않도록 가능한 한 상처의 최소 수를 모든 근육 레이어를 잘라 메스와 함께 단단히 정도로 언론에 있는지 확인하십시오. 그러나, 깊은 조직의 손상 (척추)를 생성 방지하기 위해 너무 단단히 눌러하지 않습니다.
- 이 목화 - 스쳐 applicators로, paraspinal 근육에서 overlying 근육을 분리하는 왜곡 움직임을 사용합니다. 하나는 여기에 활발한하실 수 있습니다. 이 출혈의 원인이되므로, 잘라내거나 눈물하지 마십시오. applicators과 움직임을 왜곡하면 친절하게 손상이나 출혈을 유발하지 않고 분리 조직을 애타게 것입니다. 출혈은 수술의 모든 단계에서 발생하는 경우, 환자가되고 좋습니다. 혈액은 수술 분야의 비전을 명확하기 때문에 출혈이 많이 진행 급히하려고하지 마십시오. 소작 또는 가벼운 압력이 출혈의 사이트에 적용하지만, 우리가 인내가 최고 찾을 수 있습니다. 연습을 통해,이 수술을 통해 거의 없거나 전혀없는 출혈이있을 것입니다.
- 4 수제 견인기 (그림 2 참조) 근육을 철회. 이러한 견인기은 견인기 (그림 2 삽입 참조)에 모양 튼튼한 클립에서 만들 수 있습니다. 수술하기 전에 다음을 압력솥. 관리는 조직의 손상을 피하기 위해 견인기의 끝을 무딘로 이동해야합니다. 견인기로 문자열을 묶어. 노출은 직사각형 모양 / 평방해야합니다. 이 형상은 4 견인기를 사용하여 네 모서리에 당겨 얻을 수 있습니다. 보드에 테이프 문자열 (그림 2 참조) 견인기을 확보하기 위해서. 상용 - 가능한 견인기도 사용하지만, 우리는 이들을 사용하지 않으 수 있습니다. 그것은 명확하게 수술을 통해 볼 수 있도록 좋은 수술 필드를 만드는 데 중요합니다. "맹목적으로"함께 계속하지 마십시오.
- 척추 등의 표면에서 삭제 paraspinal 근육. 척추 칼럼의 지느러미 표면에 paraspinal 근육 처리하기 위해 2 잠재적인 전략가 없습니다. 첫 번째 전략, 척추의 지느러미 표면에서 paraspinal 근육을 제거하는 쥐 - 톱니 포셉 중소 스프링 가위를 사용합니다. 더 뼈 표면을 노출 뼛속까지 아주 가까이 상처를보십시오. 척추의 표면에 평행 상처를 확인하지만, 코드로 줄일하지 않습니다. 두 번째 접근 방식, 패러 척추 근육의 중간선 절개를하고, 작은 견인기와 함께 옆으로 철회. 두 번째 접근 방식에서는, 근육은 다음 수술 후 다시 함께 봉합 수 있습니다.
- 물론 척추 뼈의 표면 청소. 레벨 C4, C5 및 C6 (그림 3 참조)로부터 근육을 멀리 당길 rongeur을 (가장 중요한 수술 기기)를 사용합니다. 이것은 물론, 타겟으로하는 척수 수준에 따라 달라집니다. 한 손으로 rongeur를 사용하는 동안, 다른 손에 쥐 - 톱니 포셉와 C2 과정을 통해 근육을 쥐고하여 전체 척추에 칼럼을 확보. C2는 수술 분야에서 큰 주동이의 과정입니다. C3는 물론 약간 근육 아래에 있습니다. 그들을 overlying 근육 때문에 C4, C5와 C6 액세스하기 쉽습니다.
- C5의 laminectomy와 함께 시작합니다. 다시 쥐 - 톱니 포셉와 C2를 개최하여 보안. rongeur과 : 전체 얇은 판을 (중간선 부근 잡고 그림 참조) 잡아. 위치 rongeur 있도록 도구는 척추 축을 완전히 직각이다. 천천히 얇은 판을 부술. 이 척추 조직에 손상을 일으킬 수 있으므로, 척수로 내려와서하지 마십시오. 크러시 부드럽게 뼈가 이상의 깨진 조각을 가져옵니다. 하나는 쉽게 제거하는 끌어낼 수 있도록 Rongeur이 기사를 부술해야합니다. 뼈 조각 여전히 얇은 판의 나머지 부분에 첨부되어있는 경우이 척수 출혈과 부상을 입을 수 있으므로, 예인선하지 않습니다. Rongeur이 깨끗하고 선명합니다. 같은 rongeur 같은 악기 세탁 / (그림 4 참조) 멸균 그릇에 제공될 수 있습니다 멸균 식염수와 함께 닦아해야합니다.
rongeur perpen를 위치 laminectomy의 초기 개방에 대한척추 열 dicular이 바람직합니다. 이 단계는 다음 코드 표면에 상대적으로 약 30-60도 각도로 뼈 밑에 부드럽게 rongeur를 삽입하여 laminectomy을 확장하는 작은 "nibbles"를 복용하여 다음 수 있습니다. - C4 - C6 laminae 모든 laminectomy를 확장합니다. 세 척추 수준 이상의 뼈 한 지속적인 개방을합니다. laminectomy의 범위는 intraspinal 사출의 원하는 위치 (S)에 따라 조정할 수 있습니다.
- 이 출혈의 원인이되므로 너무 멀리 옆으로 laminectomy을 연장하지 마십시오. 복부 경적을 타겟으로하기 위해 사출 사이트는 상대적으로 중간이므로 훨씬 옆으로 laminectomy을 확장할 필요가있다. (그림 5 참조)
- ~ 15 디 확대를 증가
- 날카로운 / 스트레이트 # 5 포셉과 경질의 위에 결합 조직 (및 가능한 건조 혈액)에서 청소합니다. 결합 조직과 경질의 차이는 경험과 함께 배울 수 있어야합니다.
- 절개 경질, 미니 스프링 가위 또는 microknife 중으로 매우 어려운 meningeal 층. 지느러미 rootlets의 항목 영역에 단지 중간 척추 축에 평행하게 절개를합니다. 이것은 하나가 복부 경적을 대상으로 수 있습니다. (그림 6 참조)
- 잡기 위해 날카로운 / 스트레이트 # 5 포셉를 사용하여 약간 척수의 경질을 발사. 핀치 / 척수를 다치게하지 마십시오. 이것은 연습이 걸립니다. microknife 또는 매우 작은 스프링 가위로 incisions하십시오. 척수를 다치게하지 마십시오.
- 주동이의 - 꼬리 축에 약간 절개를 확장합니다. 경질의 긴장이 약간 척수의 좋은 노출을 만드는 경질을 분리합니다.
- 각위한 사출에 대한 모든 적절한 사이트에 incisions하십시오. 척수 표면은 밝은 흰 색 외관을 가지고있는 동안 경질은 불투명 반투명 모양을하고 있습니다. 하나는 별개로 이들을 구별하는 법을 배워야합니다. 이것은 주사 바늘로 경질을 통해 주입하려고하지 않는 것이 좋습니다. 그것을 통해 피어스 힘들 수 있도록 경질은 힘든 것입니다. 또한 경질을 통해 피어싱은 바늘의 삽입의 궤도에 영향을 미칠 수 있으므로 세포의 해부학적인 몸의 구조 타겟 전달에 영향을 미칠 것입니다.
- 자궁 경부 확대의 큰 지역을 대상으로 3 가지 레벨 (총 6 사이트)에서 양자 세포를 주사. 주사의 번호와 위치 (S)는 물론, 구체적인 실험에 따라 달라집니다.
- 피어싱 경질 후 뇌척수 밖으로 부어 것입니다. 코드와 거즈 또는 솜 밀고 작은 주걱과 전체 노출의 건식 표면.
- 세포 주입 들어, 10.0μL 해밀턴 gastight RN 주사기를 사용합니다.
- 금속 RN 해밀턴 바늘을 beveled 33 게이지 / 45 정도를 연결합니다. 바늘은 예리해야합니다. 단 ~ 20 주사 (바늘 적은 주사와 함께 선명합니다)에 대해 같은 바늘을 사용합니다. 하나는 바늘 뽑아 유리 모세관 튜브를 사용할 수 있습니다. 26 게이지 뭉툭한 해밀턴 금속 바늘로 뽑아 유리 팁 부착하는 에폭시를 사용합니다. 수술 현미경 및 마이크로 미터 슬라이드를 사용하여 : ~ 75.0-100.0 μL (하나는 주입의 과정에서 세포를 손상 원치 않는 세포의 직경에 따라)에 외부 팁 직경 낸다. 우리는 33 게이지 금속 바늘을 선호합니다.
- 세포는 Eppendorf 튜브 얼음 안에서 쉽게 정지 빠지는 것입니다. 바로 전에 주입 주사기를로드하는 세포가 다시 정지 들어갈 때까지 부드럽게 튜브를 누릅니다. 너무 강렬한이 세포 및 / 또는 원인 거품을 다치게되므로 끄적하지 마십시오. 또는 부드럽게 세포를 섞어 20.0μL 피펫 - 사람을 사용 피펫의 세포 현탁액 단 하나 또는 두 번.
- 단 하나 주사의 사이트에 대한 충분한 세포 현탁액 볼륨을로드합니다. 한 계획이 여러 주사를 할 경우에는 세포가 주입 주사기 안에 정지 빠지는 것입니다. 천천히 거품 및 / 또는 세포에 손상을 피하기 위해 주사기로 세포를 차지. 특히 우리가 실험실에서 작업하는 glial 전구 세포에 대한, 우리는 2-5분 이상 1.0 μL 당 50,000-75,000 세포의 희석에 세포 현탁액 2.0 μL를 주입. 우리는 2uL/site는 자궁 경부 척수의 조직 손상을 초래하지 않는 것으로 확인되었습니다. 척수의 실질에 손상을 줄 수 있습니다 : 대신, 우리의 경험은 크게 (직경 10.0 -20.0 μm의 그들이 우리 glial progenitors보다 크기가 큰 특히 경우)이 볼륨에있는 세포의 숫자를 증가하는 것이 좋습니다. 우리는 (적어도 손상 경추 척수)를 각 사이트에 주입하는 세포의 최적의 번호를 확인하기 위해 광범위한 세포 먹이지 실험을 실시했다. 매개 변수는 특정 세포 유형과 질병 상태에 대한 결정되어야합니다.
- 제대로 원하는 해부 학적 지역을 대상으로 척추 축을과 주사기 / 주사 바늘을 병렬로 정렬. 바늘은 수술 범위 머리를 범프하지 않는 (외과 테이블에 비해 약 80도) 충분히 직각지만, 가능한 한 90도만큼 가까운 거리에 있습니다. 낮은 현미경을 사용하여 척수의 지느러미 표면을 향해 팁 (그림 7 참조).
- 항목 배리 단 중간 목표 바늘지느러미 rootlets의 NE (그림 8 참조). 부드럽게 바늘의 끝에와 척수의 표면을 만지지. 약간 바늘로 척수를 놓으면 되죠. 척수 다시 정상으로 될 때까지 주사를 철회. 로이 위치를 기록 Z micromanipulator에있는 눈금자를 사용하여 = 0.0.
참고 : 우리는 정기적으로 자궁 경부 척수 주사하는 동안 척추 컬럼을 안정하지 않습니다. 우리 마취 처방을 사용하여 무거운 인해 호흡하기 위해 자궁 경부 척수의 상하 운동이 문제가되지 않았어요. 그러나, 무거운 호흡 문제가있는 경우, 척추는 척추 뼈를 분질러하거나을 다치게하지 않도록주의하고, 부드럽게 뼈 클램핑 및 레벨 C2와 C7가 수정 집게를 이용하여 파라 척추 근육을 둘러싼하여 사용자 지정 프레임을 사용하여 안정 수 있습니다 척수 조직을 기본. 동물의 호흡이 절차를 수행하는 동안 얕은되면, 더 많은 마취 약물을 제공하여야한다. 마취의 수술 비행기가 다시 시작되기 전에 다시 얻을 때까지 수술이 중단되어야합니다. - 척수로 약간 낮은 바늘. 이 일을하면서 현미경으로보고 있는지 확인하십시오. 성인 쥐에서 복부 경적을 대상으로 1.5 mm의 깊이 감소 바늘. 성인 생쥐의 복부 경적을 대상으로 0.75 mm의 깊이 감소 바늘. (그림 9 참조). 이러한 심층 번호 (최소 3 개월) 여성과 남성 스프 - Dawley 쥐 (250~450그램) 및 C57BL / 6 마우스 (20-35그램) 성인의 대표입니다. 물론, 깊이 및 수평 위치는 관심의 특정 지역에 따라 달라집니다. 바늘이 척추 조직의 손상을 피하기 위해 척수에 삽입되는 동안 분사 시스템 / 보드 수술 또는 수술 테이블을 방해하지 마십시오.
- 주입하기 전에 원하는 깊이로 바늘을 낮추는 이후 두 분 (이상도 좋습니다) 기다려.
- 펌프 컨트롤러를 사용하여 일정한 속도로 2-5분 이상 2.0 μL를 주입.
- 천천히 척수에서 바늘을 제거하기 전에 주사 이후 두 분 (더 나은) 기다려.
- 각 주사 후 dH2O와 깨끗한 주사기 막히는 것을 방지하기 위해서. 천천히 그리기와 3-5 시간을 추방. 주사기로 공기를 그려하지 마십시오.
- 최저 배율 (~ 8 X 동일 수술의 시작 부분에 사용)로 돌아가기. 봉합사 경질은 9-0 봉합사를 사용하여 폐쇄, 그러나 이것은 확실히 필요하지 않습니다. 그것은 또한 도전입니다. 우리는 경질 과거에 폐쇄 봉합하지만, 우리는 동물의 행동, 이식 생존이나 경질이 봉합과 해결되지 척수의 조직학에 차이를 찾을 수 없습니다. 경질은 살균 젤 폼의 보호 조각으로 덮여 수 있습니다. 겔 거품은 dural 절개 사이트의 상단에 직접 배치해야합니다. 그러나, gelfoam 가끔 단단히 척수 표면을 준수 수 갑자기, 후 재관류를 해부 동안 척수의 표면 gelfoam이 조각을 떼어 내지는 않을에 처리하는 것이 중요합니다.
- 옵션 : 봉합사 paraspinal 근육은 4-0 봉합사로 마감했다.
- 봉합사는 4-0 봉합사로 한 번에 세 overlying의 근육 레이어를 마감했다. 주동이의 - 꼬리 축 세 지역에서 봉합해 근육 (그림 10 참조).
- 주식 피부는 9.0 mm의 상처 클립 (그림 11 참조) 마감했다. 전체의 상처 치유하기 전에 스테이플을 당기는 동물을 방지하기 위해 바늘 홀더와 스테이플를 조이십시오. 떨어져 우주 스테이플은 약 0.5cm. 이 장애 치료 및 괴사를 유도 할수 있기 때문이다, 상처 클립을 덮어 조여하지 마십시오.
- 젖었 거즈로 영역을 상처에 Povidine - 요오드 살균 솔루션을 적용합니다.
- 동물 온수 패드를 순환에 복구할 수 있습니다. 바로 다음과 같은 수술, 불임 Lactated 울리는의 솔루션 (마우스 0.5 ML 쥐를위한 5.0 ML)의 하위 피부 주사를주세요. 동물 건조 및 / 또는 마음이 내키지 않는 것으로 판단되는 경우 후속 주사도 제공될 수 있습니다. Cefazolin의 6.0mg/kg을 사용하여 예방 항생제 치료를 사용할 수 있습니다, 그러나, 우리의 경험은 무균 기술을 미행하고 모든 악기 / 외과 공급이 소독하는 경우이 이식 절차 후 수술 감염 발생하지 않는 것이 좋습니다. 이러한 예방 조치를 미행하는 경우, 항생제 관리가 낙담합니다.
- 희생까지 CSA 또는 FK-506/Rapamycin 매일 계속합니다.
- 전체 수술 ~ 45분 (6 사출 사이트) 미만 정도 소요됩니다. 그렇지 않으면, 동물 깨워 시작합니다 더 많이 호흡, 부정적인 척수에 주입에 영향을 미칠 수있는.
프로토콜의 여러 단계와 관련된 문제에 대한 문제 해결 팁
/ 가난한 세포 생존의 부족 : 이것은 가능성 사출과 관련된 기술적인 문제는 아니지만 아마도 및 / 또는 immunesuppression 처방로 주입되는 세포 유형의 속성 때문입니다. 이러한 문제는 경험적으로 세포 종류와 동물 모델을 특정 기준으로 평가해야합니다. 면역 - 결함 쥐, 마우스 모델 다수의 가용성또한 immunesuppression 문제를 우회하기 위해 사용할 수 있지만,이 동물은 또한 비용, 식민지를 유지 필요하고, 수술과 주택시 필요한 추가적인주의로 어려움을 제시한다.
기능성 적자는 다음과 수술을 관찰 : 우리의 경험에서 우리는 심지어 6 주사 사이트 (와 같은 forelimb 및 hindlimb 그립 강도와 신경 / 격막 물질 근육 액션 잠재력을 phrenic 같은 조치로 평가했을 때이 절차를 수행하는 기능 결손의 발생을 관찰하지 자궁 경부 척수의 2μL의 각). 조직 파괴는 관찰되지 않았습니다. 이러한 문제의 발생에 대한 가능성이있는 이유는 다음과 같습니다 (예 : # 5 코드를 곤란으로 경질를 깎다가 큰 볼륨 및 / 또는 휴대 전화 번호, 부적 절한 laminectomy에 의한 의도 손상, 진미의 부족을 주입, 제안된 바늘 게이지를 사용하지 포셉) 또는 척수 (무딘 바늘을 대체)로 해밀턴 바늘을 삽입하는 과정.
세포는 복부 회색 문제에서 찾을 수 없습니다 : 이것은 문제의 숫자로 인해 수 있습니다. 주사가 medially 또는 옆으로 대상을 그리워하는 경우 제대로 척수의 축으로 분사 시스템을 병렬 라인, 그리고 지느러미 rootlets의 항목에 단지 중간 바늘을 삽입해야합니다. 주사가 dorsally 또는 ventrally 대상을 그리워 경우, 바늘의 끝이 단지 간신히 척수의 지느러미 표면을 만져 때, 해당 베벨 (이상 베벨에 제안된 해밀턴 바늘을 사용하여 Z 축 독서를 제로로 확인 ) 타겟팅에 영향을 줄 수, 바늘을 삽입시 척수는 압축하지 않는 안심 정확히 micromanipulator를 사용하여 깊이를 측정 처리 및 제안 체중 범위 내에서 동물을 사용합니다. 당신은 일관되게 (histological 평가 및 후속 기술의 수정을 필요로하는) 위치에 세포를 주입 아르 적절 경우 기법을 조정합니다. 주사가 무작위로 사출 사이트의 모든에 흩어져있다면, 당신은 일관성을 개선하기 위해 연습해야합니다. 세포 바늘 트랙을 따라 척수의 지느러미 부분에 주로 위치하는 경향이 경우, 세포 주입 전후 이상 기다린 시간의 긴 기간 동안 실제 주사를 확장합니다.
4. 대표 결과 :
마우스 파생 glial 전구 세포가 성인 SOD1 G93A 쥐의 척수 수준 C4의 복부 나팔 소리로 (5 셀 / 사이트) 이식되었습니다. 마우스 파생 이식 세포는 마우스 특정 항체, M2와 탐지를 통해 호스트 쥐의 조직에서 구분할 수 있습니다. 이 이미지는 일개월 후 이식에서 M2 + 이식 파생 세포 (그림 12 참조)의 생존을 보여줍니다. 세포는 복부 회색 문제로 지역화된지만, 사출 사이트 medially 측면 복부 경적을 (대부분의 phrenic 모터 뉴런의 위치 : 점선으로 표시)보고 싶었어. 없음 낭종 형성은 50,000 전지가 당 사이트에 주입했을 때 볼 수 없으며, 아무런 행동 장애는 사출 과정에서 발생되지 않았습니다. 그러나, 세포의 훨씬 높은 숫자 (실제 숫자는 셀 유형에 따라 다릅니다하고, 체계적으로 평가해야합니다) 사출 사이트에서 손상과 바늘 트랙을 따라 결과 (그림 13를 참조하십시오 astrocyte 마커와 immunohistochemistry, GFAP)의 분사 .
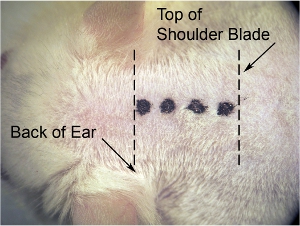
그림 1. 피부의 초기 절개가. 가장 낮은 현미경의 배율에 (우리는 8 X의 배율을 사용), 중간선 절개를 만들기 위해 메스 블레이드를 사용합니다. (잘라 피부가 쉽게되는) 피부가 긴장을 다른 손으로 옆으로 피부를 당겨와 (표시된 견갑골에 두개골의 자료 (귀 뒤쪽의 수준)에서 절개를 (굵은 점선으로 표시) 확인 얇은 점선으로).
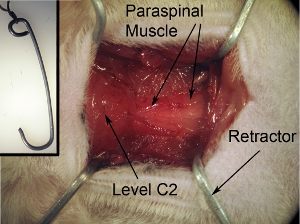
그림 2. 외과 분야의 노출. 외과 노출 직사각형 모양 / 평방해야합니다. 이 형상은 4 견인기를 사용하여 네 모서리 방향으로 주위의 근육을 당겨 얻을 수 있습니다. 견인기를 안전하고 적절하게 필드를 열어 유지하기 위해 외과 보드 견인기에 연결된 테이프 문자열입니다.
그림 2 삽입. 외과 분야 노출 견인기. 견인기는 척수와 수술을 수행하기 위해 적절한 공간의 명확한 가시성을 모두 수술 현장을 만들기 위해 근육을 뒤로 물러나게하는 데 사용됩니다. 견인기은 원하는 모양과 크기로 튼튼한 클립을 형성하여 만들 수 있습니다. 수술 전에 견인기를 압력솥. 견인기로 문자열을 묶어.
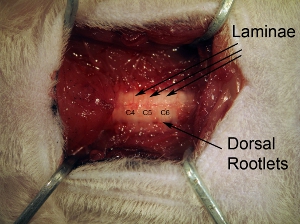
그림3. paraspinal 근육의 척추. 다음 제거, rongeur와 척추의 철저하게 세척 등의 표면. 개인 얇은 판은뿐만 아니라 척추 측면에서 입력 지느러미 rootlets로 볼 수 있습니다.
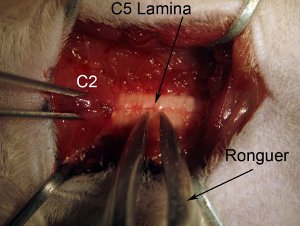
그림 4. Laminectomy가. 척수 수준 C5에서 laminectomy를 시작합니다. 쥐 이빨 포셉과 근육 overlying 수준의 C2를 개최하여 보안 척추. rongeur과 : 전체 얇은 판을 (중간선 부근 잡고 그림 참조) 잡아. 위치 rongeur 있도록 도구는 척추 축을 완전히 직각이다. 천천히 얇은 판을 부술. 이 척추 조직에 손상을 일으킬 수 있으므로, 척수로 내려와서하지 마십시오. 크러시 부드럽게 뼈가 이상의 깨진 조각을 가져옵니다. 하나는 쉽게 제거하는 끌어낼 수 있도록 Rongeur이 기사를 부술해야합니다. 뼈 조각이 아직 laminae 나머지에 첨부되어있는 경우이 척수 출혈과 부상을 입을 수 있으므로, 예인선하지 않습니다. Rongeur이 깨끗하고 선명합니다.
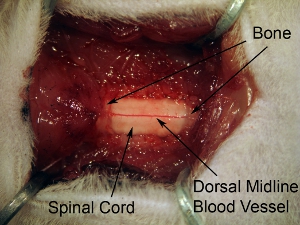
그림 5. 척수 조직 아래의 laminectomy의 노출. C4 - C6 척수를 모두 노출 laminectomy를 확장합니다. 3 레벨 이상의 척추 뼈 1 지속적인 개방을합니다. 이 출혈의 원인이되므로 너무 멀리 옆으로 laminectomy을 연장하지 마십시오. 복부 경적을 타겟으로하기 위해 사출 사이트는 상대적으로 중간이기 때문에 그것은 척추 뼈의 전체 측면 범위 laminectomy을 확장하는 필요이다.
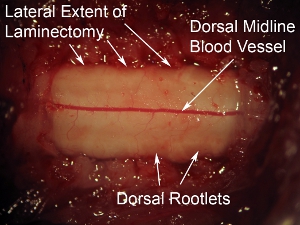
그림 6. 척수의 지느러미 표면의 높은 배율. 저명한 지느러미 혈관은 척수의 중간선을 실행하고 볼 수 있습니다. 이 혈관 패턴은 대부분의 경우에서 관찰되지만, 일부 동물은 혈관의 비 중간선 궤도를 표시합니다. 지느러미 rootlets은 척수의 지느러미 표면의 측면 측면에서 볼 수 있습니다. 척수를 overlying 경질에 비해,이 신경이 헷갈리는 모양이 있습니다.
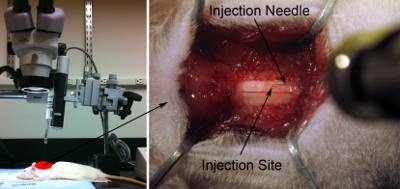
그림 7. 사출 설치. 적절히 원하는 해부 지역을 대상으로 척추 축을과 주사기 / 주사 바늘을 병렬로 정렬. 바늘은 수술 범위 머리를 범프하지 않는 (외과 테이블에 비해 약 80도) 충분히 직각지만, 척수 등의 표면을 향해 가능한 (왼쪽 패널)만큼 가까운 90도. 낮은 분사 팁의를 사용하고 있습니다 현미경 (오른쪽 패널). 부드럽게 바늘의 끝에와 척수의 표면을 만지지. 약간 바늘로 코드를 놓으면 되죠. 척수가 정상 평면 상태로 될 때까지 주사를 철회. Z는 = 0.0이 micromanipulator에있는 지도자를 사용하여 본 위치를 기록합니다.
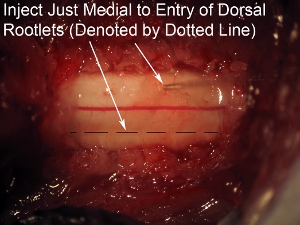
그림 8. 지느러미 rootlets (점선으로 표시)의 항목 영역에 단지 중간 척수 사출 목표 바늘 높은 확대.
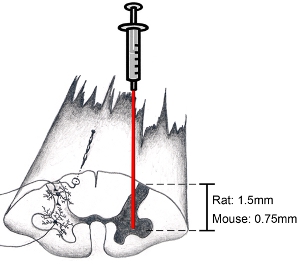
그림 9. 척수의 다이어그램 방법에 관심 해부 지역을 대상으로 복부 경적, 지느러미 rootlets의 항목 영역에 단지 중간 척추 축에 절개 경질 병렬을 대상으로 시도.. 이것은 하나가 복부 경적을 대상으로 수 있습니다. (동물의 연령과 성별에 훨씬 깊이에 차이를 만들지 않습니다) 성인 쥐에서 복부 경적을 대상으로 1.5 mm의 깊이 감소 바늘. 성인 생쥐의 복부 경적을 대상으로 0.75 mm의 깊이 감소 바늘. 물론, 깊이 및 수평 위치는 관심의 특정 지역에 따라 달라집니다.
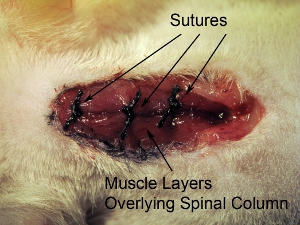
그림 10. 외과 사이트의 폐쇄. 봉합사는 4-0 봉합사로 한 번에 세 overlying의 근육 레이어를 마감했다. 주동이의 - 꼬리 축 3 위치에서 근육을 봉합해.
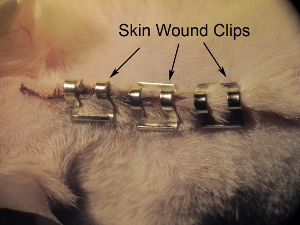
그림 11. 피부 Stapling. 스테플 피부는 9.0 mm의 상처 클립 마감했다. 전체의 상처 치유하기 전에 스테이플을 당기는 동물을 방지하기 위해 바늘 홀더와 스테이플를 조이십시오. 떨어져 우주 스테이플은 약 0.5 mm.
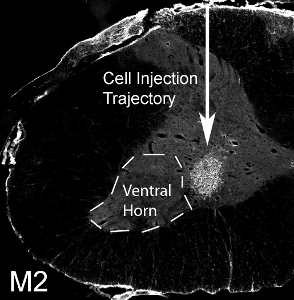
그림 12. 자궁 경부 복부 경적에 glial progenitors의 이식. 50000 마우스 파생 glial 전구 세포는 SOD1 G93A 쥐의 척수 수준 C4의 복부 나팔 소리로 이식되었다. M2 + 마우스 유래 이식 세포가 일개월 후 이식에서 살아남았습니다. 세포는 복부 회색 문제로 지역화된지만, 사출 사이트 medially 측면 복부 경적을 (표시된 놓친점선으로).
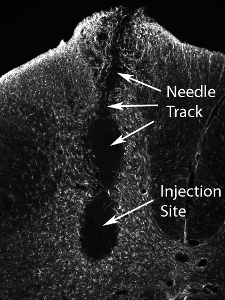
그림 13. 신경 전구체 세포의 높은 숫자의 조직 손상이 다음과 같은 이식. 전지의 훨씬 높은 숫자 (실제 숫자는 셀 유형에 따라 다릅니다하고, 체계적으로 평가해야합니다) 사출 사이트에서 손상과 바늘 트랙을 따라 결과의 사출.
토론
SOD1 G93A 마우스 및 쥐, 연령 및 그룹 내에서 동물을 섹스와 일치하고, 다른 그룹에 동일한 쓰레기 내에 동물을 배포합니다. 관련된 연구 그것은 질병 프로세스가 남성과 여성 사이에 다를 수 있기 때문에 ALS와 SCI 모델 모두에 대해 동일한 성별의 모든 동물을 사용하는 것이 바람직하지만, 그것은 또한 가능한 섹스 특정 효과를 감지하는 두 남녀의 충분한 동물을 가지고하는 것이 유용할 수 ...
공개
관심 없음 충돌 선언하지 않습니다.
감사의 말
나는 감사의 말씀을 전합니다 : Lepore의 모든 구성원, Maragakis 및 도움이 토론 Rothstein 연구소, 미국과 자금에 대한 크랙 H. Neilsen 재단의 굳는 베테랑.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | |
| HBSS | Gibco | 14,170 | |
| 0.05 %의 트립신 | Gibco | 25,300 | |
| 대두 트립신 억제제 (선택 사항) | 시그마 | T - 6522 | |
| Acepromazine의 maleate (0.7 밀리그램 / kg) | Fermenta 동물 건강 | ||
| 케타민을 (95 MG / kg) | 포트 닷지 동물 건강 | ||
| Xylazine (10 MG / kg) | 바이엘 | ||
| # 11 깃털 외과 블레이드 | 전자 현미경 과학 | 72044-11 | |
| 면과 밀고 applicators (6 인치) | 어부 | 23-400-101 | |
| 쥐 - 톱니 포셉 | 파인 과학 도구 | 쥐 : 11023-15; 마우스 : 11042-08 | |
| 중간 크기의 스프링 가위 | 파인 과학 도구 | 15012-12 | |
| 미니 스프링 가위 | 파인 과학 도구 | 15000-10 | |
| Rongeur | 파인 과학 도구 | 쥐 : 16121-14; 마우스 : 16221-14 | |
| Microknife | 파인 과학 도구 | 10056-12 | |
| 니들 홀더 | 파인 과학 도구 | 12502-14 | |
| 봉합 : 4-0 | Vicryl | S - 183 | |
| 스테이플 : 9mm | Autoclip | 427631 | |
| 스테플러 : 9mm (목표 # 203-1000) | 세계 정밀 계측기 | 5,000,344 | |
| 온수 펌프 (T / 펌프) | Gaymar | P / N 07999-000 | |
| 시클 로스 포린 A : 250.0 mg/5.0 ML의 ampules | 노바티스 / Sandimmune | NDC 0078-0109-01 | |
| FK - 506 | LC 연구소 | F - 4900 | |
| Rapamycin | LC 연구소 | R - 5000 | |
| 주사기 | 세계 정밀 계측기 | UMP2 | |
| 마이크로 네 Microsyringe 펌프 컨트롤러 | 세계 정밀 계측기 | UMC4 | |
| Micromanipulator | 세계 정밀 계측기 | 연 - R | |
| 10.0 μL 해밀턴 주사기 | 해밀턴 | 80,030 | |
| 해밀턴 바늘 : 33 게이지, 45 ° 베벨, 1 인치 | 해밀턴 | 7803-05 | |
| 유리 20.0 μL microcapillary pipettes (선택 사항) | 킴블 | 71900-20 |
참고문헌
- Lane, M. A., Fuller, D. D., White, T. E. Respiratory recovery following high cervical hemisection. Trends in neurosciences. 31, 538-538 (2008).
- Kaplan, L. M., Hollander, D. Respiratory dysfunction in amyotrophic lateral sclerosis. Clin. Chest. Med. 15, 675-675 (1994).
- Miller, R. G., Rosenberg, J. A., Gelinas, D. F. Practice parameter: the care of the patient with amyotrophic lateral sclerosis (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology: ALS Practice Parameters Task Force. Neurology. 52, 1311-1323 (1999).
- Mitsumoto, H., Chad, D. A., Pioro, E. P., Davis, F. A. . Amyotrophic lateral sclerosis. , (1998).
- Tandan, R., Bradley, W. G. Amyotrophic leteral sclerosis: Part 2. Etiopathogenesis. Annals of neurology. 18, 419-419 (1985).
- Bruijn, L. I., Miller, T. M., Cleveland, D. W. Unraveling the mechanisms involved in motor neuron degeneration in ALS. Annu Rev Neurosci. 27, 723-723 (2004).
- Rosen, D. R., Siddique, T., Patterson, D. Mutations in Cu/Zn superoxide dismutase gene are associated with familial amyotrophic lateral sclerosis. Nature. 362, 59-59 (1993).
- Bruijn, L. I., Becher, M. W., Lee, M. K. ALS-linked SOD1 mutant G85R mediates damage to astrocytes and promotes rapidly progressive disease with SOD1-containing inclusions. Neuron. 18, 327-327 (1997).
- Gurney, M. E., Pu, H., Chiu, A. Y. Motor neuron degeneration in mice that express a human Cu,Zn superoxide dismutase mutation. Science. 264, 1772-1775 (1994).
- Howland, D. S., Liu, J., She, Y. Focal loss of the glutamate transporter EAAT2 in a transgenic rat model of SOD1 mutant-mediated amyotrophic lateral sclerosis (ALS). Proc Natl Acad Sci. 99, 1604-1604 (2002).
- Nagai, M., Aoki, M., Miyoshi, I. Rats expressing human cytosolic copper-zinc superoxide dismutase transgenes with amyotrophic lateral sclerosis: associated mutations develop motor neuron disease. J. Neurosci. 21, 9246-9246 (2001).
- McDonald, W., Becker, D. Spinal cord injury: promising interventions and realistic goals. Am. J. Phys. Med. Rehabi. I82, S38-S38 (2003).
- Sandrow-Feinberg, H. R., Zhukareva, V., Santi, L. PEGylated interferon-beta modulates the acute inflammatory response and recovery when combined with forced exercise following cervical spinal contusion injury. Experimental neurology. 223, 439-451 (2010).
- Gage, F. H. Mammalian neural stem cells. Science. 287, 1433-1433 (2000).
- Lane, M. A., Lee, K. Z., Fuller, D. D. Spinal circuitry and respiratory recovery following spinal cord injury. Respiratory physiology & neurobiology. 169, 123-123 (2009).
- Lepore, A. C., Rauck, B., Dejea, C. Focal transplantation-based astrocyte replacement is neuroprotective in a model of motor neuron disease. Nature. 11, 1294-1294 (2008).
- Rao, M. S. Multipotent and Restricted Precursors in the Central Nervous System. Anat Rec. 257, 137-137 (1999).
- Rao, M. S., Mayer-Proschel, M. Glial- restricted precursors are derived from multipotent neuroepithelial stem cells. Dev Biol. 188, 48-48 (1997).
- Suzuki, M., Tork, C., Shelley, B. Sexual dimorphism in disease onset and progression of a rat model of ALS. Sexual dimorphism in disease onset and progression of a rat model of ALS. Amyotroph Lateral Scler. 8, 20-20 (2007).
- Lepore, A. C., Haenggeli, C., Gasmi, M. Intraparenchymal spinal cord delivery of adeno-associated virus IGF-1 is protective in the SOD1G93A model of ALS. Brain research. 1185, 256-256 (2007).
- Veldink, J. H., Bar, P. R., Joosten, E. A. Sexual differences in onset of disease and response to exercise in a transgenic model of ALS. Neuromuscul Disord. 13, 737-737 (2003).
- Shumsky, J. S., Lepore, A. C. Transplantation of Neuronal and Glial Restricted Precursors into Contused Spinal Cord Improves Bladder and Motor Functions, Decreases Thermal Hypersensitivity, and Modifies Intraspinal Circuitry. J. Neurosci. 25, 9624-9624 (2005).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유