JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
계면 세포 핵의 기계적 성질을 알아내기 위해 Biophysical Assays : 기판 스트레인 신청 및 Microneedle 조작
요약
우리는 글로벌 또는 지역화된 스트레인 응용 프로그램에 대한 응답으로 하나의 살아있는 자기편 세포에서 유도된 핵 및 cytoskeletal deformations을 측정하기 위해 두 개의 독립적인, 현미경 기반의 도구를 제시한다. 이러한 기술은 핵 강성 (즉, deformability)을 확인하고 핵과 cytoskeleton 세포 사이에 강제로 전송을 탐사하는 데 사용됩니다.
초록
대부분의 진핵 세포에서 핵이 가장 큰 organelle이며, 일반적으로 주변 cytoskeleton보다 2-10 배 stiffer이며 따라서 핵의 물리적 특성은 생리와 병리 학적 조건에서 세포의 전반적인 biomechanical 행동에 크게 기여하고 있습니다. 예를 들어, neutrophils를 마이 그 레이션 및 암 세포를 침해에 핵 강성이 조직 내의 좁은 공간을 통해 넘쳐 흐름 또는 통과하는 동안 중요한 장애물을 일으킬 수 있습니다. 1 한편, 같은 근육과 같은 기계적으로 적극적인 조직에있는 세포의 핵은 충분한 구조적 지원을 필요로 반복적인 기계적 스트레스를 견딜 수. 중요한 것은, 핵은 단단히 휴대폰 아키텍처에 통합되어, 그것은 육체적으로 양극 세포, 신경근육학 분기점에서 시냅스 핵의 예를 들어 세포 운동과 핵의 위치를위한 중요한 요구 사항,있는 주변 cytoskeleton에 연결하거나, 마이 그 레이션 세포 2. 아니 놀랍게도, 그러한 핵 강성 및 nucleo - cytoskeletal 커플링을 결정하는 중요한 역할을 lamins 및 nesprins 같은 핵 봉투 단백질에 돌연변이가,를 포함하여 인간의 질병의 여러 결과에 최근 게재되었습니다 에머리 - Dreifuss 근육 영양 장애, 사지 - 거들 근육 영양 장애, 그리고 확장성 심근증 3. 다양한 핵 봉투 단백질과 특정 돌연변이의 효과의 biophysical 기능을 조사하기 위해, 우리는 하나의 살아있는 세포에있는 핵의 물리적 특성을 연구하는 실험 방법을 개발 글로벌 또는 지역화된 기계 섭동를 받게. 정확하게 적용 기판 변형 응용 프로그램에 대한 응답으로 유도 핵 deformations를 측정하면 핵의 deformability에 대한 중요한 정보를 산출하고 다른 돌연변이 또는 특정 핵 봉투 단백질에 대한 결함 세포 라인 사이의 양적 비교를하실 수 있습니다. microneedle로 현지화된 cytoskeletal 변형 응용 프로그램이 분석을 보완하는 데 사용되고 핵과 cytoskeleton 세포 사이의 강제 전송에 대한 추가 정보를 얻을 수 있습니다. 그대로 살아있는 세포의 핵 역학을 공부하는 것은 정상적인 세포 구조를 유지하고 고립 핵 작업시 발생할 수있는 잠재적인 유물을 방지합니다. 또한, 기판의 변형 응용 프로그램은 근육이나 다른 조직의 세포 (예를 들어, 혈관 평활근 세포는 혈관 변형에 노출)에 의해 경험 생리적 스트레스에 대한 좋은 모델을 제공합니다. 이러한 도구는 핵 역학 연구를 주로 개발되었습니다 동안 마지막으로, 그들은 또한 cytoskeletal 단백질과 mechanotransduction 신호의 기능을 조사하기 위해 적용할 수 있습니다.
프로토콜
1. 기판 변형 응용 프로그램
정규 핵 변형의 측정은 요리에 세포를 도금하고, (uniaxial 또는 biaxial) 스트레인 신청 과정과 전후의 세포의 이미지를 획득, 세포 배양 표면으로 투명, 탄성 실리콘 점막과 변형 요리의 준비를 포함합니다.
실리콘 막 요리와 세포 접착의 준비
- 각 변형 요리 3 직경 맞춤 제작 밑이 플라스틱 접시로 구성되어 "과 세포 배양 기판 역할을하는 실리콘 막을 개최 O - 링 플라스틱. 변형 요리의 준비, 4 클램프 'X를 O - 링과 요리 사이에 실리콘 막의 4 "조각. 신중하게 초과 멤브레인 버려야 탈이온수와 린스, 그리고 변형 요리를 압력솥.
- 코팅하기 전에 막의 아래쪽 센터 (외부에)에 기준점을 선택 세포외 기질 분자 (예, fibronectin)과 실리콘 점막. 이 랜드마크는 변형 실험을하는 동안 동일한 세포를 확인하는 데 도움이됩니다. (옵션 : uniaxial 변형 응용 프로그램의 경우, 스카치 테이프의 두 평행 줄무늬 한 차원에서 막의 변형을 제한하기 위해 기준점 주위에 적용됩니다.)
- 10 ML PBS 또는 적절한 세포외 기질 단백질의 희석 3 μg / ML fibronectin과 최적의 세포 부착, 코트 실리콘 세포막을 제공한다. 거꾸로 10cm의 폴리스티렌 접시로 변형 접시를 커버하고, 4 박 이상의 요리를 품어 ° C.를
- 인산이 과잉 단백질을 제거하는 식염수 (PBS)를 버퍼로 다음날 한번 세포막을 씻어. 성장 매체 10ml (Dulbecco의 수정 이글스 중간 (높은 포도당) 10 % 태아 소 혈청, 1 % 페니실린 / 스트렙토 마이신과 보충)와 함께 요리를 입력하고 따로 설정할 수 있습니다.
- 일반 문화 조건에서 48 시간은 됐어 - 마우스 배아 섬유아 세포의 24에 대한 코팅된 실리콘 막 요리 및 부화에 약 30 %의 합류로 성장 매체 0.05 % 트립신과 씨앗을 함께 trypsinized 있습니다.
기판의 변형 실험
- 실험 현미경을 설정합니다. 실험 60x 객관적이고 적절한 이미지 수집 소프트웨어 (예 : IPLab 또는 Metamorph)를 사용하여, 형광 현미경, 위상 대비 또는 DIC에 적합한 디지털 카메라와 거꾸로 현미경에 수행됩니다. 직립 현미경이 응용 프로그램에 적합하지 않습니다. 변형 장치는 현미경 단계에 맞는베이스 플레이트로 구성되어 있으며, 중앙 원통형 실리콘 막의 변형 접시를 보유 가동 판의 중심 구역에 변형을 적용하는 역할을 압반 그가 위아래로 슬라이드 수를 보유하고 네지도 핀,뿐만 아니라로드를 적용하는 5 파운드 무게 판.
- 핵을 시각화하기 위해, 37에 15 분 Hoechst 33342 개 중 1 μg / ML로 변형 접시에있는 세포를 품어 ° C. 매체를 대기음 15 ML 페놀 - 붉은 무료 성장 매체 (10 % 태아 소 혈청, 1 % 페니실린 / 스트렙토 마이신과 보충 페놀 - 빨간 무료 Dulbecco의 수정 이글스 중간 (높은 혈당) 25 MM의 Hepes과)로 대체합니다. 접시 홀더 플레이트에 변형 접시를 보자. 조심스럽게 중앙 압반 따라 멤브레인의 글라이딩 보장하기 위해 실리콘 막의 아래쪽의 경계에 그리스 (Braycote 804 진공 그리스)를 적용할 수 있습니다. 멤브레인의 중심 섹션 명확하게해야합니다.
- 현미경 단계에베이스 플레이트를 놓습니다. 조심스럽게베이스 플레이트에 마운트 요리 홀더 플레이트. 초기 휴식 위치에, 변형 요리의 실리콘 막이 느슨하게 중앙 압반에 달려기만하면됩니다.
- 첫째, 실리콘 막의 아래쪽에 집중하고 중앙 검은 참조 점을 찾으십시오. 점은 모든 이미지 인수와 스트레칭시 후 동일한 세포의 위치에있는 에이즈의 출발점이 될 것입니다. 우리는 세포의 위치를 저장하고 실험하는 동안 이러한 세포를 재배치하는 맞춤 서면 자동 이미징 프로그램을 사용하지만, 이것은 수동으로 형성될 수 있습니다.
- 점에서 시작, 전지 및 실리콘 막의 상단을 시각화하기 위해 초점을 조정합니다. 중앙에 위치한 핵 함께 잘 확산 세포를 찾아 위상 콘트라스트와 핵 Hoechst의 형광 이미지 얼룩을 획득. 형광 이미지가 핵의 중심 비행기에 초점을 맞추어야하는 동안 위상 콘트라스트 이미지는 세포 개요 및 실리콘 막에 집중해야합니다.
- 5-15 세포의 이미지를 인수 후, 다시 중앙 점로 이동합니다. 천천히 접시의 중앙에 균일한 스트레인 응용 프로그램에서 발생, 변형 접시에 무게를 적용해야합니다. 최대한 적용 기판 변형이 수직 정렬 핀 (지도 핀)에 위치 나일론 스페이서에 의해 제한됩니다.
- 실리콘 막의 하단에 초점을 다시 참조 점을 찾습니다. 에서 시작점이 같은 세포를 변경하고 다시 밀접하게 초기 이미지의 초점 비행기를 일치하도록 노력하고, 위상 콘트라스트 및 전체 변형율에서 세포와 핵의 형광 이미지를 획득. 이 프로세스는 활성 리모델링과 긴장 기판에 대한 세포의 적응을 피하기 위해 10 분 넘지 않아야합니다.
- 모든 해당 이미지가 인수되고 나면, 시작 지점으로 다시 현미경 스테이지를 이동합니다. 조심스럽게 접시 홀더 플레이트에서 무게를 제거하고 실리콘 막 긴장 수 있습니다. 필요한 경우는 초기 위치에까지, 부드럽게 변형 접시를 밀어 올리다. 그런 다음 위상 대비하고 변형 이미지 위에서 설명한 후 변형 세포의 형광 이미지를 획득.
분석
- 세포의 이미지와 찬란 표시 핵 스트레인 응용 프로그램을하는 동안, 이전, 그리고 이후는 표준 핵 변형을 계산하기 위해 분석됩니다. 저희 연구실에서는, 우리는 분석을 위해 사용자 정의 작성된 MATLAB 스크립트를 사용할 수 있지만 몇 가지 대안 옵션을 사용할 수 있습니다. 분석은 세 단계로 수행됩니다.
- 첫째, 적용 기판 변형을 계산하기 위해, 멤브레인에 위치한 3-6 조절점의 위치는 수동으로 해당 사전, 전체 및 사후 스트레인 이미지 사이의 일치입니다. MATLAB 프로그램은 다음 사전 - 변형과 전체 변형 이미지도 미리 변형 및 사후 변형 이미지 사이의 잔류 응력 사이의 제어 포인트를 일치의 위치를 비교하여 적용 막 응력을 계산합니다. 동시에, 제어 포인트가 손상되거나 분리 세포 (그림 1 참조) 감지 데 도움이 될 것입니다 이미지 쌍을 등록하는 데 사용됩니다.
- 두 번째 단계에서 핵은 핵 크기 또는 수동으로 해당 사전, 전체 및 사후 변형 형광 이미지 사이 intranuclear 마커 중 하나를 일치하여 각 개별 핵에 대해 핵 변형을 계산 별도의 MATLAB 프로그램을 사용하여 선택됩니다. 다른 실험을 사이에 적용 멤브레인 변형의 작은 변화를위한 계정을 위해, 우리는 각각의 핵에 대한 계산 적용 멤브레인 변형으로 유도 핵 변형의 비율로 정의 표준화 원자력 스트레인 같은 결과를 표현한다. MATLAB 스크립트는 요청에 따라 Lammerding 실험실에서 사용할 수 있습니다.
- 마지막으로, 각 핵은 분리 또는 변형 응용 프로그램 (그림 1) 중 손상되어 세포의 측정을 제외하고 검증합니다.
2. Microneedle 조작 분석
요리, 자기편 세포, 그리고 microneedles의 준비
- 37 행크의 버퍼 소금 호수에서 fibronectin의 낮은 농도 (0.5ug/ml) (HBSS) 또는 2 시간 동안 모든 적합한 세포외 기질 단백질과 35mm 유리 바닥 세포 배양 접시를 품어 ° C. HBSS로 두 번 설거지를하고 다음 단계로 진행하기 전에 접시에 성장 매체 2 ML를 추가합니다.
- 마우스 배아 섬유아 세포의 fibronectin은 - 코팅 유리 바닥 요리에 7.5 X 10 4 셀 / ML에서 씨앗이 ML 성장 매체에서 0.05 % 트립신과 씨앗을 함께 trypsinized 있습니다. 밤새 다시 인큐베이터에 넣어 세포. 밤새 다시 인큐베이터에 넣어 세포. 하나는 다른 세포 유형에 대한 하나의, 자기편, 비 합류 세포를 얻기 위해 세포의 개수를 최적화해야합니다.
- 상업 피펫 풀러 (예 : 셔터 악기 회사)로 약 1-3 μm의 직경의 힌트를주고 모세 혈관 borosilicate 만들어진 microneedles을, 당겨.
Microneedle 조작 실험
- 다음날, MitoTracker와 세포를 품어 mitochondrial 얼룩 (600 μm의, Invitrogen)와 Hoechst 33342 핵 얼룩 (1 μg / ML) 37 ° C 배양기에서 30 분 동안 성장 매체에 추가됩니다.
- 상온에서 5 분 HBSS에있는 세포를 한 번 씻고 다음 이미징을위한 세포에 페놀 - 빨간 무료 성장 매체를 추가합니다.
- 위상 대조의 cytoskeleton에 삽입 microneedle없이 단일 셀 중 하나가 이미지를 수집, mitochondrial의 Hoechst 33342 얼룩 하나의 형광 이미지 중 하나 형광 이미지 반전에 60x 목적 (0.70 NA, 계획 - Achromat)와 얼룩 디지털 전하 결합 장치 카메라와 현미경.
- micromanipulator (예 : InjectMan NI 2, Eppendorf)를 사용하여, 신중하게 세포 떨어진 핵 주변에서 고정된 거리 (일반적으로 5 μm의)의 세포질에 microneedle를 삽입 한 위상 콘트라스트 이미지, Hoechst 33342 중 하나 형광 이미지를 얼룩과 mitochondrial 얼룩 중 하나 형광 이미지. 이 응용 프로그램의 경우, 지속적인 미세 조작 절차를 달성하기 위해, 컴퓨터를 통해 예 : Windows 하이퍼 터미널을 micromanipulator를 제어하는 데 도움이됩니다.
- 동시에 형광 및 위상 대비 영상 매 10를 수집하는 동안 microneedle, 1 μm의 / 초에서 셀 주변으로 특정 거리를 (보통 10 또는 20 μm의) 이동초. microneedle는 세포 주변 향해 특정 거리로 이동 때문입니다. microneedle이 세포 주변 향해 특정 거리로 이동대로 선택한 매개 변수와 함께, 이것은 조작 과정 2-3 프레임에 해당합니다.
- microneedle이 cytoskeleton에서 제거 후 마지막으로 추가로 이미지를 획득.
분석
- 변위 매핑은 핵 및 세포질의 추적 찬란 분류 기능을 기반으로하는 사용자 정의 작성된 MATLAB 스크립트를 사용 계산됩니다. (MATLAB 스크립트가 요청시 Lammerding 실험실에서 구할 수 있습니다.) 이 프로그램은 이후 이미지 프레임에 작은 이미지 영역 (크기와 간격 간격 5 μm의에 약 10 μm의이 × 10 μm의) 사이의 교차 상관 정규화 알고리즘을 사용합니다. 각 지역 센터에 변위가 X - 및 Y - 방향은 원래 위치와 새로 식별된 위치 사이의 변화로 계산된와 변위 벡터로 표시하며 수치로 저장됩니다. 변위지도에서 미리 정의된 영역 내에서 평균 변위 계산하실 수 있습니다. 핵 변위는 Hoechst 33342 신호에 해당하는 형광 채널에서 계산하는 동안 cytoskeletal 변위가, cytoskeletal 마커 (예 : MitoTracker mitochondrial 얼룩)의 형광 채널을 기반으로합니다. 우리의 응용 프로그램에 대한, 우리는 정기적으로 다음과 같은 영역 검사 :; 변형 응용 프로그램 사이트에 대한 핵 내부 영역에 (2) 핵 변형, (I) 변형 응용 프로그램 사이트, 즉, microneedle 삽입 사이트에서 cytoskeletal 변형 (3) 핵 신청 사이트에서 떨어진 지역에 핵 변형 및 핵에 걸쳐 세포질 영역에서 (IV) cytoskeletal 변형. 또한, 하나는 직접 위상 대비 또는 Hoechst 33342 형광 이미지 시퀀스에서 핵 연신율을 측정할 수 있습니다. 이 경우에는 핵 긴장이 핵 연신율 (ΔL = L - L 0) 나누어 계산 적용 L은 스트레인 응용 프로그램 및 L 0의 끝에 핵의 마지막 길이 초기 길이, L 0입니다 핵의 초기 길이. 손상 nucleo - cytoskeletal 커플링과 함께 세포의 경우 핵의 변형 응용 프로그램 사이트에 대한 길어지다 것입니다. 반면, nucleo - cytoskeletal 커플링은 즉, 중단있는 세포에서 미군이 cytoskeleton과 핵 사이에 덜 효율적으로 전송되고, 핵은 변형 응용 프로그램 사이트의 방향으로 훨씬 적은 길어지다 것으로 예상된다. 따라서 핵 및 cytoskeleton 사이 (부분) uncoupling을 암시 cytoskeletal 변형 응용 프로그램에 대응 핵 deformations을 감소.
3. 대표 결과 :
기판 변형 응용 프로그램
우리는 동안, 전에 이미지를 인수하고, heterozygous 및 homozygous lamin에서 마우스 배아 섬유아 세포로 변형 신청 후 A / C - 결함 (Lmna + / -와 Lmna - / -) 이후, 그리고 야생 타입 (Lmna + / +) 마우스 및 각 셀에 대한 표준 핵 긴장을 계산. 분석 후, 핵을 확인하고 손상되거나 변형 응용 프로그램을하는 동안 수축 세포는 분석에서 제외됩니다. 그림 1B는 분석에서 제외되어야 세포를 그린 반면 그림 1A는 유효 세 세포의 핵 모습. 정규 핵 스트레인 데이터는 적어도 세 독립 실험 (각이 ~ 50-10 핵에서 측정을 포함)에서 풀링 및 통계 분석을하여 다른 셀 또는 치료 그룹과 비교됩니다. 증가 정규 핵 긴장은 A / C (그림 2) lamin 핵 봉투 단백질의 감소 표정으로 세포에서 본 감소 핵 강성을 나타냅니다.
Microneedle 조작 분석
microneedle 조작 분석을 위해, 우리는 지역화된 cytoskeletal 변형 응용 프로그램을하는 동안 핵 및 cytoskeletal 변위 몇 군데. 손상되거나 분리된되는 전지는 분석에서 제외됩니다. 분석을 위해, 우리는 하나, 자기편 세포의 힘을 응용 프로그램 사이트 향해 핵 및 cytoskeletal 움직임의 정도를 측정합니다. 예를 들어, 그림 3에, 우리는 cytoskeletal 변형 전후 mitochondrial (cytoskeleton에 대한 마커) 변위를 추적하고 벡터로 변위를 플롯. 각 벡터는 원래 위치와 새로 식별된 위치 사이의 변화로 계산된 변위를 나타냅니다. 낮은 이미지 강도 또는 부족 질감 (예를 들어, 세포 외부 지역)와 영역은 분석에서 제외됩니다. cytoskeletal과 핵 변위는 다음 변형 응용 프로그램 사이트에서 증가 거리 (그림 4, 색깔 보에 해당하는 영역에서 선택 영역에 계량 아르삽입에 xes). 그대로 nucleo - cytoskeletal 커플링과 마우스 배아 섬유아 세포에서 세력이 서서히 변형 응용 프로그램 사이트 (그림 4)에서 분산 유도 원자력 및 cytoskeletal deformations의 결과, 전체 세포를 통해 전달됩니다. 반면, 방해 nucleo - cytoskeletal 커플링 (또는 변경 cytoskeletal 조직)와 섬유아 세포는 그림 4에 표시된 응용 프로그램의 현장 근처화된 변위, 그리고 더 멀리서만 약간의 유도 deformations를 표시합니다. microneedle 삽입 사이트 (오렌지 박스)에 비교 cytoskeletal 변형 응용 프로그램은 모두 제어 섬유아 세포 (mCherry 혼자)과 방해 nucleo - cytoskeletal 커플링 (DN KASH)와 섬유아 세포에 대한 관찰이다. 그러나, 다른 지역에서 유도된 핵 및 cytoskeletal 변위 (즉, 파란색, 노란색 및 빨간색 상자) 컨트롤 셀 (mCherry 혼자서) (그림 4)에 비해 중단 nucleo - cytoskeleton 커플링 (DN KASH)와 섬유아 세포에서 상당히 작은되었습니다. 따라서 멀리 변형 응용 프로그램 사이트에서 cytoskeletal 및 핵 변위 감소, 그 cytoskeleton과 핵 사이에 강제로 전송이 방해되었다 나타냅니다.
중요한 것은 우리는 GFP 또는 mCherry 굴지 및 GFP - vimentin과 transfected하고 찬란 Mitotracker 녹색 또는 빨간색으로 표시 마우스 배아 섬유아 세포에서 microneedle 조작을 실시하여 mitochondria 적합 cytoskeletal 마커는 것을 확인했습니다. Cytoskeletal 변위 매핑은 mitochondria와 굴지이나 vimentin cytoskeleton의 형광 신호로부터 독립적으로 계산되었다. 평균 절대 변위가 떨어진 변형 응용 프로그램 사이트에서 증가 거리에서 뚜렷한 cytoskeletal 지역에 대한 계산했다. 사면과 R - 제곱 값은 mitochondria에서 각각 굴지이나 vimentin에서 얻은 측정 사이의 선형 회귀에서 계산되었다. 굴지의 경우 경사가 0.99이고 R 2 값은 0.986되었다; vimentin에 대한, 경사가 1.04이고 R2 값은 mitochondrial 변위가 cytoskeletal deformations에 대한 신뢰성있는 지표 역할을 것을 확인, 0.971했다.
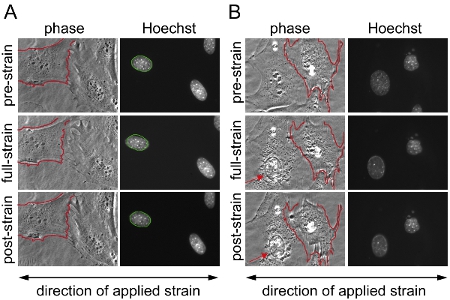
그림 1. 마우스 배아 섬유아 세포 (MEFs)에 기판의 변형 응용 프로그램을 만듭니다. 실리콘 막에 별개의 두 영역에 걸쳐 마우스 배아 섬유아 세포는 20% uniaxial 변형 응용 프로그램의 과정과 전후의 위상 콘트라스트 및 형광 현미경과 몇 군데 있었다. (A) 손상이나 분리와 부분적으로 변형 응용 프로그램을하는 동안 분리 / 취소 세포 (B) 예를 들어없이 변형 응용 프로그램을 살아남은 세포에서 유효 핵을 가진 성공적인 실험의 예;에 묘사된 전지의 결과는 (B) 제외 분석. 오른쪽에있는 세포가 변형 응용 프로그램 중 일부와 retracts 분리 상태에서 (B), 왼쪽에있는 세포는, cytoskeletal 손상 핵 붕괴 (화살표)의 흔적을 보여줍니다. 이것은 과도한 변형 응용 프로그램의 표시 수 있습니다. 더 비교에서 (A)와 (B) unstretched 세포 점막 중 하나의 테두리가 빨간색으로 명시된 및 스트레인 신청시 후 동일한 세포에 겹쳐있다. 에서는 (A) unstretched 핵의 경계는 녹색으로 설명하고 스트레인 신청시 후 같은 핵에 겹쳐있다.
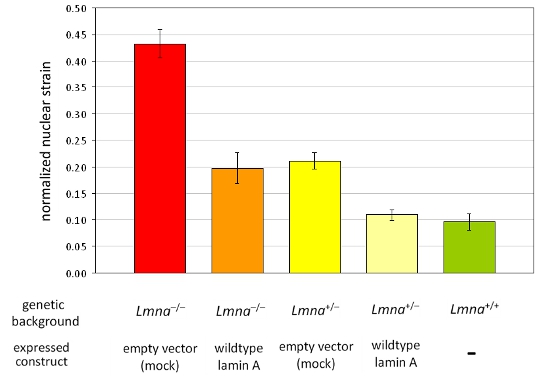
그림 2. 다른 MEF 세포 라인의 패널에 표준 핵 변형의 분석 Lmna의 MEFs -. / -과 Lmna는 + / - 유전 배경 ectopically 중 빈 벡터 또는 야생 형 lamin A가 분석되었습니다 표현. 로 반영됩니다 야생 타입 littermates (Lmna + / +), lamin의 손실에서 MEFs에 비해 완전히 야생 형 lamin A의 reintroduction하여 복원할 수 있습니다 감소 핵 강성에 A / C 표현 결과는 특히, 핵 강성을 감소 정규 핵 변형의 증가 값. 오차 막대는 표준 오류를 나타냅니다.

그림 3. 세포 강제 전송을 측정하는 Microneedle 조작 분석. 위상 대비 (A, B)와 형광 (C, D) 핵 얼룩 (파란색)으로 표시 fibroblast의 이미지 및 mitochondrial 얼룩 (녹색) MitoTracker. microneedle은 핵 (A 및 C)에서 정의된 거리에 cytoskeleton에 삽입 후 셀 주변 (B, D)으로 이전하였습니다. Cytoskeletal과 핵 변위는 맞춤 작성된 교차 상관 알고리즘을 사용하여 추적 찬란 표시 핵 및 mitochondria에 의해 계량되었습니다. 형광 이미지 시리즈에서 계산된 최종 cytoskeletal의 (E) 변위지도 (녹색) deformations, 화살표의 길이가 더 visibi에 대한 2X로 확대됩니다lity. 스케일 바, 10 μm의.
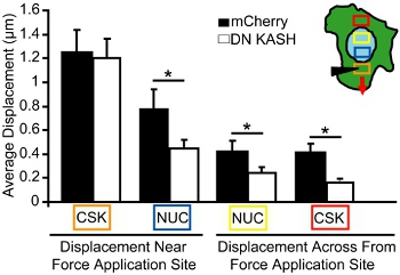
그림 4. microneedle 조작하는 동안 세포 강제로 전송 분석. 유색 상자에 해당하는 지역 (A에 삽입)로 측정, microneedle 조작 중에 cytoskeletal 및 핵 변위를 유도. 오렌지 상자가 부담 응용 프로그램 사이트입니다. 유도 cytoskeleton (오렌지 박스)에 유사한 변형 응용 프로그램에도 불구하고 핵 및 cytoskeletal 변위 (즉, 파란색, 노란색 및 빨간색 상자)을 방해 nucleo - cytoskeletal 커플링 (DN KASH)가 제어에 비해과 (마우스 배아 섬유아 세포에서 현저하게 작은되었습니다 mCherry 혼자) 세포.
토론
기판의 변형 분석
스트레인 응용 프로그램이 성공적으로 기계적 스트레스를 받게 세포에서 유도된 핵 deformations을 공부하고 핵 강성 특정 핵 봉투 단백질의 기여를 조사하기 위해 우리와 다른 그룹에 의해 사용되고 있습니다. 4-8이 기법의 장점은 뭔가가 프로브 기계적 특성을 자신의 정상 세포와 cytoskeletal 환경에서 그 핵 생활 기판 변형 응용 프로그램과 같은 계약 근?...
공개
관심 없음 충돌 선언하지 않습니다.
감사의 말
이 작품은 건강 (R01 HL082792 및 R01 NS059348) 및 Brigham 및 여자의 병원 순환기 리더십 그룹 수상의 국립 연구소에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | |
| Fibronectin | Millipore | FC010 | |
| MitoTracker 레드 FM 그린 FM | Invitrogen | M22425 및 M - 7514 | |
| Hoechst 33342 | Invitrogen | H3570 | |
| 행크의 버퍼 소금 염분 | Invitrogen | 14,185 | |
| 페놀 무료, DMEM | Invitrogen | 21,063 | |
| 태아 소 혈청 | Aleken 체액 | FBSS500 | |
| 페니실린 / 스트렙토 마이신 | 시그마 | P0781 - 100ML | |
| 필라멘트와 Borosilicate 유리 | 셔터 악기 | BF100 - 78-10 | |
| "/ 광택 이외의 철근 실리콘 판금, 0.005를 광택 | 전문 제조 주식 회사 | ||
| Dulbecco의 인산은 염분 버퍼 | Invitrogen | 14,200 | |
| 35mm 유리 바닥 문화 요리 (FluoroDish) | 세계 정밀 계측기, INC | FD35 - 100 | |
| Braycote 804 진공 그리스 | SPI 공급 | 05133A - AB |
참고문헌
- Friedl, P., Wolf, K., Lammerding, J. Nuclear mechanics during cell migration. Curr Opin Cell Biol. 23, 55-64 (2011).
- Mejat, A., Misteli, T. LINC complexes in health and disease. Nucleus. 1, 40-52 (2010).
- Worman, H. J., Fong, L. G., Muchir, A., Young, S. G. Laminopathies and the long strange trip from basic cell biology to therapy. J Clin Invest. 119, 1825-1836 (2009).
- Caille, N., Tardy, Y., Meister, J. J. Assessment of strain field in endothelial cells subjected to uniaxial deformation of their substrate. Ann Biomed Eng. 26, 409-416 (1998).
- Lammerding, J. Lamins A and C but not lamin B1 regulate nuclear mechanics. J Biol Chem. 281, 25768-25780 (2006).
- Lammerding, J. Abnormal nuclear shape and impaired mechanotransduction in emerin-deficient cells. J Cell Biol. 170, 781-791 (2005).
- Lammerding, J. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. J Clin Invest. 113, 370-378 (2004).
- Verstraeten, V. L., Ji, J. Y., Cummings, K. S., Lee, R. T., Lammerding, J. Increased mechanosensitivity and nuclear stiffness in Hutchinson-Gilford progeria cells: effects of farnesyltransferase inhibitors. Aging Cell. 7, 383-393 (2008).
- Brooks, S. V., Zerba, E., Faulkner, J. A. Injury to muscle fibres after single stretches of passive and maximally stimulated muscles in mice. J Physiol. 488, 459-469 (1995).
- Maniotis, A. J., Chen, C. S., Ingber, D. E. Demonstration of mechanical connections between integrins, cytoskeletal filaments, and nucleoplasm that stabilize nuclear structure. Proc Natl Acad Sci. 94, 849-854 (1997).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유