JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Rhizotomy 후 도설 루트 Axons의 라이브 영상
요약
생체내에 이미징 프로토콜 등의 루트 호감 다음과 같은 기본 감각 axons를 모니터가 설명되어 있습니다. 절차는 넓은 필드 형광 현미경 및 thy1 - YFP 유전자 변형 생쥐를 활용하고, CNS의 인터페이스와 PNS와 축삭의 상호 작용에서 4cm 이상의 축삭 재생의 반복 영상을 허용합니다.
초록
척추 루트 부상에 의해 부상을 기본 감각 axons 만성 통증과 영구 감각 상실로 이어지는, 척수로 재생하기 위해 실패합니다. 척수로 등의 루트 (DR) axons의 재생은 지느러미 루트 항목 영역 (DREZ), CNS와 PNS 사이의 인터페이스에 방지합니다. 신경 손상과 관련된 복잡한 변화가 사후 분석에서 유추되어 있기 때문에 DREZ에서 중생을 방지 분자 및 세포 사건에 대한 우리의 이해는 부분적으로 완전하지 않습니다. 같은 축삭 재생과 같은 동적 세포 공정, 최상의 각 생활 동물의 여러 관찰과 실시간 이벤트를 캡처하는 기술을 연구하고 있습니다. 순차적으로 생체내에서 뉴런을 모니터링하는 우리의 능력은 광학 마우스 트렌스 제닉의 혁명적인 혁신을 대폭 때문에 증가했다. thy1 - GFP 형질 전환 마우스의 몇 라인은, 뉴런의 일부가 유전자 뚜렷한 형광 색상으로 표시하는 개별 뉴런은 생체내 1 군데로 허용합니다. 이 생쥐는 근육 2-4과 5-7 두뇌의 생체내 이미징에 대해 광범위하게 사용되고 있고, 정적 분석을 확인할 수 없었다는 것을 생리적 메커니즘에 새로운 통찰력을 제공하고 있습니다. 생활 척수에서 뉴런의 이미징 연구는 최근에 시작했다. Lichtman와 그의 동료는 먼저 넓은 필드 현미경 8,9와 부상 등의 열 (DC) axons를 추적하여 가능성을 보여주었다. 깊이 위치 직류 axons의 생체내 이미징에서 다중 광자, microglia 및 혈관도 10 성취되었습니다. 지난 몇 년 동안, 우리는 넓은 분야 현미경과 thy1 - YFP 마우스의 H 라인을 사용하여 DR의 axons의 재생을 모니터 생체내 이미징에서 신청 개척했습니다. 이러한 연구는 DR의 axons은 척수 11 시간 재생 방해하는 이유에 대해 소설 가설 우리를 이끌고있다.
thy1 - YFP 마우스의 H 라인에서 뚜렷한 YFP + axons은 피상적으로 여러 axons 동시에 모니터링할 수 있도록하는, 위치가 결정됩니다. 우리는 DREZ에 도착 DR의 axons가 더 경추 척수에 비해 요추에 몇 군데 있다고 배웠습니다. 현재 보고서에서 우리는 재생 DR의 axons의 성공적인 장기 반복 영상을 확인하는 데 유용 발견되는 몇 가지 전략을 설명합니다. 이들은 반복 삽관법 및 호흡 중단을 제거하는 방법을 포함, 수술 - 관련 스트레스와 흉터 형성을 최소화하고, phototoxicity없이 높은 해상도에서 안정적인 이미지를 획득.
프로토콜
1. 현미경 설정하고 이미지 준비
- 우리의 이미지가 빠른 셔터 및 Metamorph 소프트웨어에 의해 제어 냉각 CCD 카메라와 Leica MZ16 형광 stereomicroscope 구성되어 설정할 수 있습니다.
- thermostatically 제어 난방 패드를 준비하고 ° C 동물의 체온을 유지하는 동안, 그리고 수술에 따라 32.5 출력을 조정할 수 있습니다.
- 32.5 ° C로 수술 중 척수의 관개를 위해 사전에 따뜻한 살균 링어의 솔루션이나 인공 뇌척수 (ACSF).
- xylazine (8 MG / kg)과 케타민 (120 MG / kg) 칵테일의 intraperitoneal 주사와 함께 동물을 마취.
- 작은 동물 가위로 상위 다시 면도하고 목화 - 스쳐 면봉으로 면도 영역 제모 로션의 작은 방울을 확산. 분 후, 70 % 에탄올 젖었 거즈 스폰지를 사용하여 적용 로션을 제거합니다.
2. Laminectomy 및 L5 등의 루트 외과 노출
- 온수 (32.5 ° C) 패드에있는 동물을 놓고 70 %의 에탄올 젖었을 면봉으로 피부를 소독.
- 뒷면의 피부에 - stereomicroscope에서 명시야 조명에서 정중선 절개 (3 - cm 2)를 수행합니다. 필요한 경우, 출혈을 멈추게하기 위해 솜 밀고 면봉을 사용합니다.
- 기본 요추를 노출하는 척추 근육을 반영합니다.
- 마우스 오른쪽 단추로 양면 헤미 - laminectomy 작은 rongeurs를 사용하여 L3 - S1 척수 세그먼트를 쉽게받을 수 있습니다. 허리와 성례의 척수의 4-6 세그먼트를 노출 부분 laminectomy은 L2 척추 (2 rostrally 엉덩이의 장골의 크레스트의 수준에서 L5 척추의 오른쪽 지느러미 부분 (L5 DRG의 위치)을 제거하여 만들어집니다 마지막 늑골에 척추 꼬리). 따뜻한 무균 링어의 솔루션으로 구멍을 Perfuse.
- 척추 열을 버리고 지원 방석 (압연 코튼 거즈)에 동물을 놓습니다. 노출된 영역을 넓혀 철회의 갈고리를 사용합니다.
- 이 지점 (약 30 분 정도 마취의 첫 번째 IP 분사 이후에 보충 (0.5X)이 동물이 완전히 anesthetized 유지하기 위해서는 subcutaneously 주입해야합니다. 또는, 가스 마취 (0.5L/min 산소에 isoflurane 2-4% 1) 한 시간 이상 영상 세션 동안 반복 anesthetization 사용할 수 있습니다.
3. Rhizotomy / 도설 루트 호감
- YFP가 axons (+) 표시 시각화하는 형광 여기로 전환합니다.
- 하위 Q (26ga.) 바늘의 팁을 사용하여 L5 등의 루트 (DR)를 overlying 두라의 작은 절개를 수행합니다. 링어의 솔루션을 반복 Perfuse과 목화 - 스쳐 면봉로 부드럽게 닦아주십시오.
- 심하게 상처받을 수있는 사이트를 확인하고 subdurally (더몬트 # 5) 벌금 포셉의 한쪽을 삽입합니다.
- 10 초 동안 L5 루트의 중간 부분을 잡고 부드럽게 그러나 단호하게 포셉를 닫은 다음 부드럽게 포셉를 놓습니다.
- 생리학 솔루션으로 반복 세척하고 면봉 솜 밀고로 부드럽게 닦아주십시오.
4. 이미지 수집 및 수술 절차
- 전 바로 낮은 높은 배율 모두에서 호감 후 호감 사이트 및 DREZ을 포함한 전체 노출 영역의 여러 이미지를 구합니다.
- 이미지가 하나의 스냅샷으로 또는 30 이내에 취득한 10-20 프레임의 여러 스트림으로 하나 찾았습니다 - 40 - MS 노출 시간. 포커스에있는 이미지는 다음을 선택하고, 개요 몽타주는 나중에 포토샵을 사용하여 만들어집니다.
- 흉터 형성을 최소화하기 위해 단단히 노출된 척수의 상단에, 인공 두라 다음 얇은 합성 매트릭스 막 (Biobrane)의 조각을 적용합니다. 그들은 척수에 자기편 수 있도록 노출된 척수 윈도우에 정확하게 맞게 조각을 절단해야합니다.
- 무균 5-0 봉합과 근육을 닫고 상처에 클립으로 정중선 절개를 닫습니다.
- 링어의 솔루션 (0.5 - ML 0.3 대 subcutaneously)을 주사하고, 수술 후 진통제 (0.05 밀리그램 / kg) 2 일 subcutaneously 매 12 H로 Buprenorphine을 관리할 수 있습니다.
- 손난로 (34 ° -35 ° C)까지 복구에 쓰레기야.
5. 반복 이미지
- 동물을 마취하고 상처 클립과 봉합을 제거하십시오.
- 인공 두라 얇은 합성 매트릭스 막 패치를 제거하고 나중에 재사용을위한 링어의 솔루션을 포함하는 멸균 튜브에 보관하십시오.
- 부드럽게 서브 Q 바늘과 훌륭한 포셉의 구부러진 끝과의 축적 결합 조직의 흉터를 제거합니다. 따뜻한 링어의 솔루션을 자주 Perfuse.
- 호감 사이트 및 DREZ 등 수술 필드를 다시 노출, 이전 세션에 몇 군데 YFP + axons를 변경하고, 제 4에 설명되어있는 절차를 반복하십시오.
6. 대표 결과 :
우리는 그들이 절개 부상 후 재생 않았 반면, 거의 모든 YFP의 이상 axons가의 사이트를 통해 성장, 그 관찰했습니다호감 후 3 일까지 상해 (그림 1) 11. 일반적으로, 호감 후 다음날, 우리는 근위 스텀프 axons 및 조각 / axons이 적절하게 손상되었다는 확인 호감으로 말초 같은 axons의 변성의 죽음 - 다시 퇴화 관찰 (예 : 그림 1, 3 일 및 5) . 몇 가지 추가적인 기준은 unambiguously 겪었던 또는 부상에서 회복했다 axons에서 재생의 axons을 구분 적용됩니다. 이들은 다음을 포함 : (1) 재생의 axons은 YFP의 비 형광 부분의 확장 + 근위 및 말초 변성 (때문에 호감 사이트를 충진 형광등 세포질로 레이블이 지정되지 않은 격차의 축소에 반대로 인해 호감 사이트에서 축삭을 보여 axons은 부상을) 살아있다면 (2) 재생의 axons은 덜 밝은 형광등, 그리고 부상에서 살아남은 axons보다 기복이 훨씬 얇은되며 (3) 재생의 neurites는 얇고 axons의 degenerating 형광등 조각보다 dimly 형광등하는 통하여 (4) axons을 이겨낸 또는 살려주와는 대조적으로, 재생의 axons이 DREZ에서 중단,, 그들은 확장 (5) axons을 이겨낸 또는 살려주와는 대조적으로, 재생의 axons은 Ranvier의 노드를 전시하지 않습니다. 그림 1은 즉시 호감 이후 네 표면 YFP의 이상 axons (; 색 화살표 A1)을 보여줍니다. 사흘 호감 후, 네 명 모두 axons은 호감 사이트 (A2)을 통해 성장 한 neurite을 확장. 호감 후 5 일, neurites 안정 유지하고 이러한 또는 다른 근위 axons (A3)에서 추가적인 성장이 없습니다.
degenerating 축삭 (즉, endoneurial 튜브)의 많은 두꺼운하고 밝은 형광등 조각을 통해 길쭉한 호감 사이트를 교차하고, 재생의 neurites (2 약 3mm / 일) 호감 후 사일 빠르면 DREZ에서 11 도착. 이러한 axons 및 팁 두 주 (그림 2)에 대한 모든 두세 일 반복 영상들은 앞으로 성장하거나 철회하지 않았다고 발표했지만 고정되어 있었다. 유일한 눈에 띄는 변화는 일부 axons의 정보와 샤프트의 팽창했다. 이러한 관찰 따라서 DREZ에서 재생 axons의 놀라울 정도로 신속하고 만성 고정을 보여줍니다.
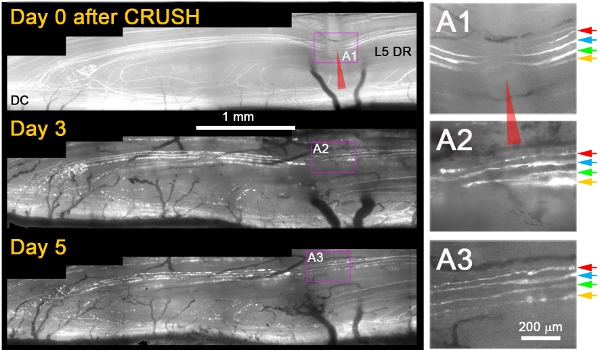
그림 1 : 5 일 이상 등의 루트 짝사랑의 사이트에서 L5 DR YFP + axons의 반복 영상. L5 루트의 중간 부분이 심하게 상처 (적색 화살촉)와 일 0, 3, 호감 후 5 군데되었습니다. 호감의 영역은 오른쪽 패널 (A1 - A3)에 확대됩니다.

그림 2 :. axons의 반복 영상은 L5 루트 짝사랑 이후 20 일 동안 DREZ에 도착 일 4 세 axons (색 화살표)는 DREZ에 도착했다. 이 axons의 도움말을 동일한 위치에 남아 일 7, 9, 13, 15, 20 이후 이미징 세션에 비슷한 외관을 가지고. 다른 축삭 도움말 및 랜드마크 (별표)에 상대 축삭 팁의 위치는 이미지 세션 사이 축삭의 운동성를 결정하는 데 사용되었습니다.
Access restricted. Please log in or start a trial to view this content.
토론
직접 살아있는 생쥐의 영상 DR 재생, 특히 그것이 이후 이미지 세션에 여러 침략 수술 및 마취 절차에 의해 다음 넓은 영역 축삭의 성장을 모니터링하는 상당한 등의 laminectomy을 필요로하기 때문에 도전이다. 몇몇 전략은 이러한 과제를 극복하기 위해 도움이되었습니다. 첫째, 성공적인 이미지는 마취와 출혈의 기간을 최소화하여 마우스 사망률 (약 25 %) 감소 필요하고, 세심한 수술 치료로. 사망률...
Access restricted. Please log in or start a trial to view this content.
공개
관심 없음 충돌 선언하지 않습니다.
감사의 말
우리는 의견과 편집에 도움 박사 앨런 Tessler 감사합니다. 이 작품은 NIH NS062320에 의해 지원되었다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 |
|---|---|---|---|
| (2~4개월 나이, 성별)를 H 라인 thy1 - YFP | 잭슨 연구소 (바 하버, ME) | 003782 | |
| Xylazine (AnaSed 분사, 살균 용액) | 로이드 연구소 (셰난도아, LA) | 4811 | 8 MG / kg |
| 케타민을 (케타민을 염산염 사출, USP) | Hospira 주식 회사 (레이크 포레스트, IL) | 2051 | 120 MG / kg |
| Buprenorphine (주사용 Buprenex) (0.05 밀리그램 / kg) | 레키트 Benckiser 제약 주식 회사 (리치몬드, VA) | 7571 | |
| 작은 동물 머리 가위 | 오스터 전문 (맥민빌, TN) | 76059-030 | |
| 제모 로션 | 처치 & 드와이트 공동 (프린스톤, NJ) | 베이비 오일과 나이르 | |
| 거즈 스폰지 | 피셔 과학 (피츠버그, PA) | 22-362-173 | |
| 커튼 - 날붙이 면봉 | 피셔 과학 (피츠버그, PA) | 14-960 - 분기 | |
| 1 ML 주사기 | 백톤, 딕슨과 회사 프랭클린 레이크스, NJ) | 309602 | |
| 피하 (서브 Q) 바늘, 26ga. | 백톤, 딕슨과 회사 (프랭클린 레이크스, NJ) | 305115 | |
| 스프링 가위와 집게 | 파인 과학 도구 (포스터 시티, CA) | ||
| 2.5 - mm 곡선 rongeurs | 파인 과학 도구 (포스터 시티, CA) | 16221-14 | |
| Lactated 링어의 사출 USP | B. 브라운 의료 주식 회사 (어바인, CA) | BBR - L7502 | |
| 멸균 생리 식염수 | APP 제약 (샴버그, IL) | 918610 | |
| 박막 합성 행렬 막 (Biobrane) | Bertek 제약 (모건, WV) | 62794-096-251 | |
| 인공 두라 | 고어 MVP 두라의 대체, WL 고어와 동료 (플라그 스 타프, AZ)을 배제 | 1MVP40 | |
| 5-0 실크 봉합 | Ethicon, 주식 회사 (서머빌, NJ) | K - 580 | |
| 상처 클립 | 퍼펙트 - ETS 브루노 (Burnea, 프랑스) | A75 | |
| 형광 stereomicroscope | Leica 마이크로 시스템즈 (Wetzlar, 독일) | MZ16 | |
| CCD 카메라 | 하마 마츠 (브리지, NJ) | 오르카 - Rx2 | |
| 온도 컨트롤러 | 세계 정밀 계측기 (사라소타, FL) | ATC 1000 | |
| Metamorph 소프트웨어 | 분자 장치 (서니 베일, CA) | ||
| 포토샵 | 어도비 시스템즈, 산호세, CA |
참고문헌
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Lichtman, J. W., Sanes, J. R. Watching the neuromuscular junction. J Neurocytol. 32, 767-775 (2003).
- Bishop, D. L., Misgeld, T., Walsh, M. K., Gan, W. B., Lichtman, J. W. Axon branch removal at developing synapses by axosome shedding. Neuron. 44, 651-661 (2004).
- Balice-Gordon, R. J., Lichtman, J. W. in vivo visualization of the growth of pre- and postsynaptic elements of neuromuscular junctions in the mouse. J Neurosci. 10, 894-908 (1990).
- Trachtenberg, J. T. Long-term in vivo imaging of experience-dependent synaptic plasticity in adult cortex. Nature. 420, 788-794 (2002).
- Pan, F., Gan, W. B. Two-photon imaging of dendritic spine development in the mouse cortex. Dev Neurobiol. 68, 771-778 (2008).
- Grutzendler, J., Gan, W. B. Two-photon imaging of synaptic plasticity and pathology in the living mouse brain. NeuroRx. 3, 489-496 (2006).
- Kerschensteiner, M., Schwab, M. E., Lichtman, J. W., Misgeld, T. in vivo imaging of axonal degeneration and regeneration in the injured spinal cord. Nat Med. 11, 572-577 (2005).
- Misgeld, T., Nikic, I., Kerschensteiner, M. in vivo imaging of single axons in the mouse spinal cord. Nat Protoc. 2, 263-268 (2007).
- Davalos, D. Stable in vivo imaging of densely populated glia, axons and blood vessels in the mouse spinal cord using two-photon microscopy. J Neurosci Methods. 169, 1-7 (2008).
- Maio, D. D. i in vivo imaging of dorsal root regeneration: Rapid immobilization and presynaptic differentiation at the CNS/PNS border. Journal of Neuroscience. 31, 4569-4582 (2011).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유