JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
이미징 G - 단백질 결합 수용체 (GPCR) - 중재 신호 행사 그 제어 Chemotaxis Dictyostelium Discoideum
요약
여기, 우리는 chemotaxis를 조사에 대한 자세한 라이브 셀 이미징 방법을 설명합니다. 우리는 마이 그 레이션 세포에서 이벤트를 신호의 spatiotemporal 역학을 모니터 형광 현미경 방법을 제시한다. 신호 이벤트의 측정은 더욱 GPCR - 신호 네트워크 chemoattractants 및 제어 진핵 세포의 방향 이주 감지 기울기를 달성 방법을 이해하기 위해 우리를 허용합니다.
초록
대부분의 진핵세포 세포는 자신의 환경에서 화학적 신호의 기울기를 감지하고 이에 따라 1 마이그레이션할 수 있습니다. 이 가이드 셀 마이 그 레이션은 이러한 세포의 연결 2, 3의 면역 세포와 patterning의 인신 매매는 그들의 기능을 수행하는 다양한 세포에 필수적인 것입니다 chemotaxis로라고합니다. G - 단백질 결합 수용체의 큰 가족 (GPCRs)는 생체내 4 셀 마이 그 레이션을 직접하기 위해 chemokines로 알려진 변수 작은 펩티드를 감지합니다. chemotaxis 연구의 최종 목표는 GPCR 기계 감각의 케모카인 그라디언트와 컨트롤 chemotaxis에 선도적인 이벤트를 신호 방법을 이해하는 것입니다. 이를 위해, 우리는 실시간으로, chemoattractant의 그라데이션에 chemoattractants, 세포 운동의 spatiotemporal 농도를 모니터링하는 이미징 기술을 사용, GPCR은 heterotrimeric G - 단백질의 활성화를 중재하고, 5-8 진핵 세포의 chemotaxis에 관련된 세포내 신호 이벤트 . 간단한 진핵 생물, Dictyostelium의 discoideum은 leukocytes의 것과 유사 chemotaxic 동작을 표시하고, D. discoideum는 진핵세포 chemotaxis를 공부에 대한 핵심적인 모델 시스템입니다. 자유 생활 amoebae, D.으로 discoideum 세포가 풍부한 매체 나눕니다. 기아되면 세포들은 multicullular 구조를 형성 CAMP - 중재 chemotaxis를 통해 집계되는 발달 프로그램을 입력합니다. 캠프 chemotaxis에 관련된 대부분의 구성 요소 D.으로 확인되었습니다 discoideum. GPCR에 캠프의 바인딩 (cAR1)는 Gγ 및 Gβγ의 subunits 7, 9, 10로 heterotrimeric의 분리 G - 단백질을 유도. Gβγ subunits는 회전 활성화의 PI3K에서, 세포막 11-13에 PIP 3에 PIP 2 변환 RAS를 활성화해야합니다. PIP 3 따라서 멤브레인 14, 15 이러한 단백질을 모집, pleckstrin의 상동 (PH) 도메인과 단백질에 대한 구속력이 사이트의 역할을합니다. cAR1 수용체의 활성화는 또한 PIP 2 16, 17 PIP 3 dephosphorylates PTEN의 멤브레인 연결을 제어합니다. 분자 메커니즘은 evolutionarily 같은 neutrophils 18 인간 세포의 케모카인 GPCR - 중재 chemotaxis에 보존되어있다. 우리는 D.의 chemotaxis를 공부에 대한 다음과 같은 방법을 제시 discoideum 세포. 1. chemotactic 컴포넌트 세포의 준비. 2. 캠프 기울기에 세포의 영상이 chemotaxis. 3. 한 살 세포에서 G - 단백질 heterotrimeric의 GPCR 유도된 활성화를 모니터링. 4. 실시간으로 한 라이브 세포 이미징 chemoattractant - 트리거 다이나믹 PIP 3 응답. 우리 개발한 이미징 방법은 인간 leukocytes의 chemotaxis을 연구에 적용할 수 있습니다.
프로토콜
1. Dictyostelium의 discoideum의 chemotactic 관할 세포의 준비
- chemoattractant 캠프 22 떨고 문화 D3 - T 리치 미디어의 성장 수확 전지 ° C.에 chemotactic 아르 D.의 discoideum 세포를 생성하려면
- (DB 버퍼 5 MM 나 2 HPO 4, 5 MM KH 2 PO 4, 2 MM MgCl 2, 0.1 MM CaCl 2 포함) 이외의 영양 발달 버퍼에 두 번 세포를 씻으십시오.
- 2x10 7 셀 / ML의 밀도에 DB 버퍼의 세포를 다시 일시 중지합니다.
- 한 시간 만이라도 22 100 RPM ° C에서 250 ML 플라스크 10 ML 세포를 흔들어.
- 75 NM 캠프의 최종 농도, 캠프 pulsing 치료로 지정된 프로세스를 달성 6 시간 이상 매 6 분마다 10 ML 세포에 7.5 μm의 캠프 주식 100 μl를 제공합니다. 캠프 pulsing 처리, D.의 5~6시간 후 discoideum 전지 캠프 기울기 방향으로 능력 chemotactic된다.
- 5 분 200g에서 원심 분리하여 세포를 수집하고 DB 버퍼로 resuspend 셀 2.5 MM의 카페인을 포함, 22에서 200 rpm으로 흔들 ° C를 20 분에 대한 chemotactic 상황에 셀 basolate 수 있습니다.
2. 가시와 manipulatable chemoattractant 기울기의 이미징 chemotaxing 세포
- 1 μm의 캠프 및 DB 버퍼에 0.1μg/μl에서 알렉사 594의 신선한 30 μl 솔루션 Backfill은 micropipette.
- micropipette 홀더에 Femtotip를 첨부하고 압력 공급 장치로 튜브, Eppendorf FemtoJet 시스템을 연결합니다.
- 안정적인 경사도를 확립하기 위해 지속적으로 압력을 제공하기 위해 micromanipulator를 전동 micromanipulator (Eppendorf TransferMan NK2)로 micropipette 어셈블리를 연결합니다.
- 공촛점 현미경에 기름 40X 렌즈를 통해 DB 버퍼 6 ML 가득한 한 잘 LabTek 챔버를 마운트하고 볼 분야에 밝은 필드 광학, 센터 Femtotip을 사용합니다.
- 압력 공급 장치의 전원을 켜고 캠프 / 알렉사 594 혼합물의 그라디언트를 확립 70 고전력 증폭기에 대한 보상 압력 (PC)를 설정합니다.
- 캠프와 543 nm의 레이저 라인을 사용하여 여기 알렉사 594 형광 원하는 농도의 혼합 모니터링하여 캠프 그라데이션을 시각화.
- 원하는 위치로 micropipette를 놓고 1 순위, 위치 2, 및 세포를 노출하기 위해 경사도를 조작하는 3 순위로 설정하는 micromanipulator의 자동 위치 기능을 사용하십시오.
3. 고정되어 nonpolarized 전지 시스템 야영 기울기 감지에 관여 영상 신호 이벤트를 용이하게
- 카페인 치료 후, 3 분 500g에 세포 원심 분리기의 나누어지는를 제거합니다.
- 버퍼를 제거하고 2.5 MM의 카페인을 포함하는 신선한 DB 버퍼와 5x10 5 셀 / ML로 세포를 희석.
- 4 잘 챔버 각각 잘 수있는 단일 잘 챔버 또는 0.4 ML에 세포 현탁액 1 ML을 적용합니다.
- 10 분 동안 신중하게 무소속의 세포를 제거하고 동일한 볼륨 대체 버퍼를 피펫 세포가 준수하도록 허용합니다.
- 현미경 원하는 세포를 찾아 이미지를 시작합니다.
- 꾸준한 그라데이션에 노출 세포의 구성 요소를 신호의 역학을 모니터하기위한 실험은 실험하기 전에 10 분 5.0 μm의 (최종 농도) Latrunculin B와 세포를 치료.
4. 동시 모니터링 heterotrimeric G 단백질 활성화 및 PIP 3 생산
- CAMP 세포 공동 표현 GαCFP 및 YFPGβ을 (G 세포)와 세포 PIP 3 표시기 PH - GFP (PH 세포)가 7 표현.을 개발 pulsing
- 1시 1분 비율 및 플레이트들을 한 잘 또는 4 - 음 실에서 함께 세포의 이러한 두 종류를 섞습니다.
- 작성하고 10 나노미터 넓이로 464에서 624 nm의에 대한 스펙트럼 범위 내에서 람다 스택 수집 모드를 사용하여 방출 지문 참조 곡선 CFP, YFP와 GFP를 저장합니다.
- G 세포와 464에서 10 nm의 증가와 544 nm의에 대한 스펙트럼 범위 내에서 동일한 람다 스택 수집 모드를 사용하여 PH 세포에서 PIP 3 제작에 동시에 이미지 G 단백질 활성화.
- G.에서 개별 채널에 CFP와 YFP 강도를 분리 수학적 람다 스택의 각 형광단의 기여를 계산에 저장 CFPand YFP 및 방출 지문을 사용하여 자이스 혈구 510META 소프트웨어의 선형 Unmixing 기능을 적용
- 같은 전략을 통해 수학적 PH 세포에 GFP 강도를 계산에 저장 GFP 배경 방출 지문을 사용하여 선형 Unmixing 기능을 적용할 수 있습니다.
5. 대표 결과 :
- D.의 훌륭한 모델 시스템 GPCR 중재 chemotaxis에 대한 discoideum. 사회 아메바, D. discoideum는 수명주기 동안 인상적인 chemotaxis를 전시하고 있습니다. 의 유전자 및 생화 학적 이점으로 인해, D. D는 강력한 s을 (를) 제공ystem는 chemotaxis를 연구하기 위해 서요.
- 가시와 manipulatable chemoattract 필즈 세포의 Chemotaxis. 여기, 우리는 처음 10 μg / ML 혼합 2 μm의 캠프의 희석 시리즈 캠프 농도와 형광 염료 알렉사 594의 강도 사이의 선형 관계를 얻을 수있는 간단한 방법을 보여 알렉사 594 (그림 2A). 다음, 우리는 알렉사 594 (그림 그림. 2B)의 강도에 의해 그라디언트의 캠프 농도의 양적 측정을 수립, 또한, 그라디언트를 시각화하는 쉬운 방법을 제공합니다.
- 세포 운동성가. 전지 분극 및 방향 감지와 uncoupled 굴지의 중합 억제제는 기존의 형태학의 극성을 제거하고 방향 감지의 세포 '능력 (그림 3A)를 유지하면서 또한 세포의 움직임을 방지합니다. 표시 및 manipulatable 캠프 자극의 고용 예를 균일하게 적용 stimulations하거나 그라데이션을 위해 입력을 보장합니다. 이 방법은 그라디언트 감지 기기의 주요 신호 구성 요소 CAMP 유발 재배포의 정량 분석이 가능합니다. 이러한 신호 구성 요소의 측정 spatiotemporal 역학은 우리가 그라디언트 (그림 3B)에 편광 생화 학적 반응을 생성하는 동안 신호 네트워크가 균일한 stimulations에 적응을 실현 방법을 이해하실 수 있습니다.
- 안정된 구배에 노출시 신호 네트워크를 chemosensing의 속도론의 체계적 측정. 방향 - 감지은 세포가 처음 그라디언트가 발생할 때 각 구성 요소는 세포 분극의 설립에 기여하는 방법 구성 요소를 이해하기 위해 신호의 역학 / 속도론을 측정하는 중요한 그것입니다. 높은 템포 - 공간 해상도 라이브 셀 이미징의 응용, 우리는 먼저 꾸준한 캠프 기울기 (그림 4A - C)에 노출된 세포의 biphasic PIP3 생산을 보여줍니다. 라이브 셀 이미징을 적용, 우리는 체계적으로의 역학을 측정해야 방향 감지 PIP3 제작 (그림 4D, E)에 캠프 자극에서 특정 신호를 네트워크를.
- 균일하게 적용 캠프 자극에 동시 모니터링 heterotrimeric G 단백질 활성화 및 PIP 세 생산. 포스터 공명 에너지 전송 (약식은 무서워) 캠프 자극시 heterotrimeric G 단백질 활성화 (분리)를 모니터링하는 효율적인 방법을 제공합니다. 여기, 우리는 (그림 5 변화와 PIP의 멤브레인 translocation 각각 3 프로브, G 및 PH 세포에서 PH - GFP를 걱정 모니터링하여 heterotrimeric G 단백질 활성화 및 PIP 세 생산의 동시 측정을위한 편리한 쉽게 채택할 시스템을 설명 ). 어떤이 일시적 PIP 세 생산을 실행하는 동안 균일하게 적용 캠프 자극이 지속 G 단백질 활성화를 트리거합니다.
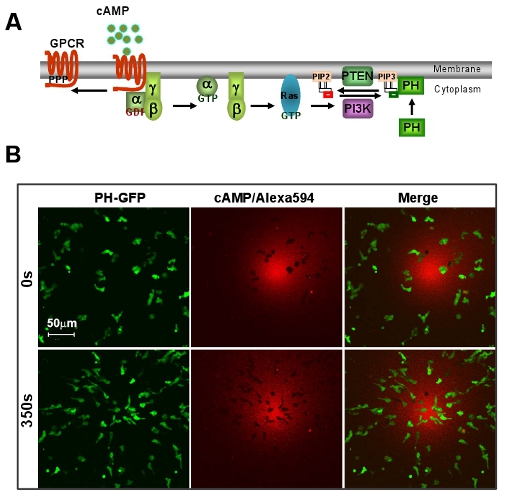
그림 1 : D.의 훌륭한 모델 시스템 GPCR의 중재를 chemotaxis에 대한 discoideum. A. 제도 방향 감지의 간단한 신호 경로를 보여줍니다. B. 캠프 그라디언트가 D.의 빠른 chemotaxis를 유도 discoideum 세포. 세포는 PIP 3 프로브, PH - GFP (녹색)을 표현한다. 그라데이션 (레드) 594 알렉사에 의해 시각입니다. 스케일 바 = 50μm.
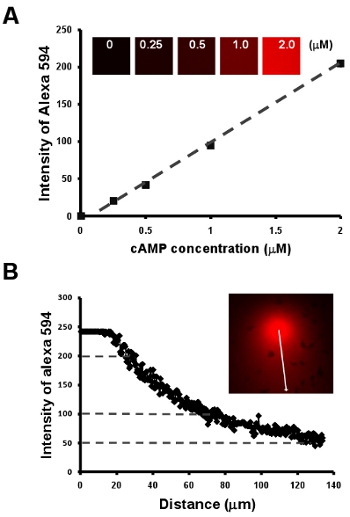
그림 2 : 가시와 manipulatable chemoattract 필즈 세포의 Chemotaxis. A. 그래프는 10 μg / ML 알렉사 594 혼합 2 μm의 캠프의 희석 시리즈 캠프 농도와 형광 염료 알렉사 594의 강도 사이의 선형 관계를 보여줍니다. 선형 관계에 의해 그라디언트의 캠프 농도 B. 양적 측정 A에서 형광 염료 알렉사 594의 캠프 농도와 강도의

그림 3 : 세포 운동성가 세포 분극 및 방향 감지와 uncoupled 있습니다. A. 이미지 굴지 중합 억제제 Latrunculin B의 치료에 의해 고정되어 세포가 방향 감지의 기능을 유지할 것으로 나타났습니다. 세포는 PIP 3 프로브, PH - GFP (녹색)을 표현한다. 그라데이션 (레드) 594 알렉사에 의해 시각입니다. B. Manipulatable 캠프 자극과 고정되어 전지 시스템은 방향 감지의 핵심 질문을 해결하실 수 있습니다. 스케일 바 = 10μm.

그림 4 : 지속적인 그라디언트에 노출시 신호 네트워크를 chemosensing의 속도론의 체계적 측정. A. 몽타쥬는 꾸준한 캠프 기울기 (적색)에 노출된 세포의 biphasic PIP 3 제작 (녹색). B. 이미지 C. C로 표시 PIP 세 생산의 속도론의 측정에 대한 관심 영역 (ROIs)를 보여줍니다 보여줍니다 . 동력학 O꾸준한 그라데이션에 노출 세포의 F PIP 세 생산. D. 제도 PIP 3 제작 캠프 자극의 방향 감지의 신호 네트워크를 보여줍니다. 안정된 구배에 노출시 그들의 운동은 E에서 동일한 색상 고체 라인에 표시됩니다.

그림 5 : GPCR 신호 네트워크의 동시 모니터링 멀티 이벤트. A. 제도 변화와 각각 PIP3 프로브, G 및 PH 세포에서 PH - GFP의 멤브레인 translocation을 걱정 모니터링하여 heterotrimeric G 단백질 활성화 및 PIP 세 생산의 동시 측정을 보여줍니다. G와 PH 세포의 무지개 이미지 B. 장면 보여줍니다 어떤이 과도 PIP3 생산을 실행하는 동안 균일하게 적용 캠프 자극은 주변 세포에 영구 G 단백질 활성화를 트리거 것을. 시간 점 4.9s, 10.2s 및 20.4s에 대한 전 (개로) 및 자극 후 수 있습니다. G 단백질 활성화하고 균일하게 적용 캠프 자극시 PIP3 생산 C. 속도론가.
토론
세포의 chemotactic 관할 단계에 도달하는 과정
야생 유형 D. discoideum 세포, 그건 소요 약 5 세포가 잘 편광 세포 형태학 및 신속한 세포 마이 그 레이션 (그림 1)을 표시하는 동안 잘 chemotactic 관할 무대로 그들을 유도하기 위해 상온에서 개발을 pulsing ~ 6 시간. 이러한 pulsing, 온도 및 다른 유전 배경에 대한 캠프 농도 등 여러 가지 요인은, chemotactic 유능한 단계에 도달하는 과정...
공개
관심 없음 충돌 선언하지 않습니다.
감사의 말
이 작품은 NIAID, NIH에서 교내 기금에 의해 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 |
|---|---|---|---|
| D3 - T 성장 미디어 | KD 의료 | ||
| 카페인 | 시그마 | ||
| Latrunculin B | 분자 프로브 | ||
| 알렉사 594 | 분자 프로브 | ||
| CAMP | 시그마 | ||
| ChronTrol XT 프로그램 타이머 | ChronTrol 법인 | ||
| Miniplus 세 연동 펌프 | Gilbson | ||
| 플랫폼 로터리 흔드는 | |||
| FemtoJet microcapillary 압력 공급 장치 | Eppendorf | ||
| 단일, 4 잘 연구실 - 테크 II coverglass 챔버 | Nalge Nunc 인터내셔널 | ||
| LSM 510 META 또는 동급 형광 현미경 | 자이스 혈구 | 40X 1.3 NA 또는 60X 1.4 NA 오일 DIC 계획 - Neofluar 목표 렌즈 | |
| 올림푸스 X81 또는 동급 | 하늘 | 100X 1.47 NA TIRF 객관적인 렌즈를 필요 |
참고문헌
- Lijima, M., Huang, Y. E., Devreotes, P. Temporal and spatial regulation of chemotaxis. Dev Cell. 3, 469-469 (2002).
- Murphy, P. M. The molecular biology of leukocyte chemoattractant receptors. Annu Rev Immunol. 12, 593-593 (1994).
- Devreotes, P. N. G protein-linked signaling pathways control the developmental program of Dictyostelium. Neuron. 12, 235-235 (1994).
- Jin, T., Xu, X., Hereld, D. Chemotaxis, chemokine receptors and human disease. Cytokine. 44, 1-1 (2008).
- Meier-Schellersheim, M. Key role of local regulation in chemosensing revealed by a new molecular interaction-based modeling method. PLoS Comput Biol. 2, e82-e82 (2006).
- Xu, X. Coupling mechanism of a GPCR and a heterotrimeric G protein during chemoattractant gradient sensing in Dictyostelium. Sci Signal. 3, 71-71 (2010).
- Xu, X., Meier-Schellersheim, M., Jiao, X., Nelson, L. E., Jin, T. Quantitative imaging of single live cells reveals spatiotemporal dynamics of multistep signaling events of chemoattractant gradient sensing in Dictyostelium. Mol Biol Cell. 16, ra71-ra71 (2005).
- Xu, X., Meier-Schellersheim, M., Yan, J., Jin, T. Locally controlled inhibitory mechanisms are involved in eukaryotic GPCR-mediated chemosensing. J. Cell Biol. 178, 141-141 (2007).
- Jin, T., Zhang, N., Long, Y., Parent, C. A., Devreotes, P. N. Localization of the G protein betagamma complex in living cells during chemotaxis. Science. 287, 1034-1034 (2000).
- Janetopoulos, C., Jin, T., Devreotes, P. Receptor-mediated activation of heterotrimeric G-proteins in living cells. Science. 291, 2408-2408 (2001).
- Funamoto, S., Milan, K., Meili, R., Firtel, R. A. Role of phosphatidylinositol 3' kinase and a downstream pleckstrin homology domain-containing protein in controlling chemotaxis in dictyostelium. J. Cell Biol. 153, 795-795 (2001).
- Li, Z. Roles of PLC-beta2 and -beta3 and PI3Kgamma in chemoattractant-mediated signal transduction. Science. 287, 1046-1046 (2000).
- Sasaki, A. T., Chun, C., Takeda, K., Firtel, R. A. Localized Ras signaling at the leading edge regulates PI3K, cell polarity, and directional cell movement. J. Cell Biol. 167, 505-505 (2004).
- Meili, R. Chemoattractant-mediated transient activation and membrane localization of Akt/PKB is required for efficient chemotaxis to cAMP in Dictyostelium. EMBO J. 18, 2092-2092 .
- Parent, C. A., Blacklock, B. J., Froehlich, W. M., Murphy, D. B., Devreotes, P. N. G protein signaling events are activated at the leading edge of chemotactic cells. Cell. 95, 81-81 (1998).
- Funamoto, S., Meili, R., Lee, S., Parry, L., Firtel, R. A. Spatial and temporal regulation of 3-phosphoinositides by PI 3-kinase and PTEN mediates chemotaxis. Cell. 109, 611-611 (2002).
- Iijima, M., Devreotes, P. Tumor suppressor PTEN mediates sensing of chemoattractant gradients. Cell. 109, 599-599 (2002).
- Haastert, P. J. V. a. n., Devreotes, P. N. Chemotaxis: signalling the way forward. Nat Rev Mol Cell Biol. 5, 626-626 (2004).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유