Method Article
GFP - 굴지 표현 라이브 내피 세포 굴지의 Cytoskeleton 연구
요약
GFP - 굴지 표현 라이브 내피 세포의 미세 영상은 cytoskeletal 구조에서 동적 변화 특성화 수 있습니다. 고정 표본을 사용하는 기술과는 달리,이 방법은 전에 동일한 세포에있는 굴지의 cytoskeleton의 시간적 변화에 대한 자세한 평가, 동안 다양한 물리적, 약리, 또는 염증성 자극 후를 제공합니다.
초록
microvascular 내피는 유체와 solutes에 선택적으로 투과 장벽으로 중요한 역할을합니다. 내피 세포 사이의 접착제 분기점은 내피의 투과성을 조절하고, 많은 연구가 junctional 무결성 1-5 결정하기 위해 굴지의 cytoskeleton의 중요한 기여를 표명했습니다. 피질 굴지 벨트는 안정적인 분기점 1, 2, 4, 5의 유지에 중요한 것으로 생각됩니다. 반대로, 굴지의 스트레스 섬유 분기점 2-5 약화 내피 세포 내에서 구심력 장력을 생성하는 생각입니다. 대부분이 이론은 내피 세포가 내피 투과성을 증가하는 것으로 알려져 염증 중재자로 치료 후 세포를 고정하고 현미경 관찰을위한 F - 굴지 분류하는 연구를 기반으로하고 있습니다. 에서 수정된 세포의 이미지만을 스냅샷을 제공하기 때문에 그러나 이러한 연구는 굴지의 cytoskeleton의 역할이 매우 제한된 이해를 제공합니다굴지의 구조 5 역학에 대한 정보와 시간.
라이브 세포 이미징은 내피 장벽 무결성을 결정하는 메커니즘의 연구에 굴지의 cytoskeleton의 동적 특성의 결합을 허용합니다. 이 방법의 가장 큰 장점은 내피 세포에서 굴지의 구조에 대한 다양한 염증성 자극의 영향이 고정 표본을 관찰하는 경우에 발생할 수있는 잠재적인 편견을 제거하기 전에 살아있는 세포의 동일한 세트에서 치료 후 평가 될 수있다는 것이다. 인간 제대 정맥 내피 세포 (HUVEC)는 플라스미드 GFP - β - 굴지로 transfected 유리 coverslips에 합류하기 위해 성장하고 있습니다. 합류 HUVEC에서 GFP - 굴지의 시간 저속 이미지는 내피 장벽 무결성 시간 종속적인 변화를 이끌어내는 염증 중재자의 추가 전후 캡처됩니다. 이러한 연구는 endothelia에 기여하는 굴지의 cytoskeleton의 변화 유체 순서의 시각적 관찰을 활성화내 장벽 파괴 및 복원.
우리의 결과는 지속적으로 내피 세포의 지방, 굴지 풍부한 lamellipodia 형성과 매출을 보여줍니다. 굴지의 스트레스 섬유의 형성과 움직임도 볼 수 있습니다. 염증성 자극 치료 전후 지역 lamellipodia의 형성과 매상의 주파수 분석은 kymograph 분석하여 문서화 수 있습니다. 이러한 연구는 내피 장벽의 무결성의 유지를위한 중요한 이전에 정체 불명의 분자 메커니즘을 발견하는 데 사용할 수있는 내피 세포에있는 굴지의 cytoskeleton의 동적 특성에 대한 중요한 정보를 제공합니다.
프로토콜
1. GFP - 굴지와 HUVEC의 Transfection
- 다양한 방법 HUVEC을 transfect하는 데 사용할 수 있습니다. 우리 연구실은 Nucleofector 시스템 (Lonza, 바젤 스위스)가 아래에 설명된 사용합니다. 일반적으로 세포 생존과 transfection 효율을 개선하기 위해 신속하게 작동합니다. 각 transfection 두 유리 coverslips (코닝 제 1, 22 X 50mm)에 놓는 것입니다 5 × 10 5 HUVEC이 필요합니다. Nucleofector은 플라스미드 DNA를 transfect에 electroporation 화학 시약을 결합하고, 일반적으로> 50 % 표현 효율을 실현하고 있습니다. 화학 transfection의 시약은 다른 방법입니다. 한 그룹이 성공적으로 GenePORTER 시약 6을 사용 GFP - 굴지와 소 내피 세포를 transfected 있습니다. 우리가 사용하는 Nucleofector 프로토콜은 아래 설명되어 있습니다.
- Presterilized cultureware 또는 일반 coverslips는 챔버 유형에 따라 사용할 수 있습니다. 유리 coverslips 들어, 10cm 문화 판에 그들을 배치하여 생물 학적 안전 후드의 소독2 분 70 %의 에탄올의 약 5 ML을 포함. 별도의 문화 판의 측면에 대해 그들을 기대고하여 살균 포셉 건조 공기를 집어.
- 일단 건조, 자체 10cm 문화 플레이트의 각 coverslip을 넣으십시오. coverslip의 중앙에 따뜻한 젤라틴 용액의 구슬 300 μL (0.9 % NaCl의 1.5 %)를 피펫하고 5 분. 약자 후 대기음 수 있습니다. 가장자리를 건드리지 않고, 중앙에서이 매트릭스 코팅을 유지, 세포 밀도가 높은 씨앗을 품고되며 빠르게 합류를 달성할 수 있도록합니다.
- EGM2MV 미디어 (Lonza) 500 μL로 transfection 당 1.5 ML의 microfuge 튜브를 준비하고 ° C 5 % CO 2 배양기 37 따로 설정할 수 있습니다.
- 0.25 % 트립신 - EDTA (에틸렌 다이아 민 테트라 초산)와 HUVEC를 분리하고 15 ML 원뿔 튜브에 수집합니다. 세포를 세어보세요. 5 × 10 5 세포는 각 transfection 필요합니다. transfe의 수를 곱한 5 × 10 5 세포를 포함합니다 펠렛을 얻는 세포 현탁액 볼륨을 조정ctions을 수행할 수 있습니다.
- 상온에서 3 분 5,000 RPM에서 임상 원심 분리기에 세포 현탁액을 원심 분리기. 가능한 많은 미디어를 제거하는 틸팅 튜브로 뜨는을 기음.
- HUVEC 또는 기본 내피 세포 Nucleofector 키트 (Lonza) 중 하나에서 기본 Nucleofector 솔루션으로 펠렛을 Resuspend. 5 × 10 5 세포 당 100 μL를 사용합니다. 때문에이 솔루션의 독성에, 이것은 세포가이 솔루션에 정지하는 동안 신속하게 작업하는 것이 중요합니다.
- transfection 예제 플라스미드 GFP - β - 굴지 벡터를 (Nucleofector 정지의 100 μL 당 0.2-2 μg) 추가합니다. transfection 당 5 × 10 5 세포 당 GFP - 굴지 플라스미드 DNA의 0.2-2 μg.
- Nucleofector Cuvette에 세포 현탁액을 100 μL를 전송합니다. cuvette을 차지하고 있으며 탭 세포 현탁액을 보장하기 위해 시대의 몇 가지는 아래로 모든 방법입니다.
- Nucleofector II 장치 cuvette 슬롯에 cuvette을 놓고 D를 실행esired electroporation 프로그램입니다. 우리는 HUVEC을위한 프로그램 - 034을 사용합니다.
- 생물 학적 안전 후드에 cuvette를 반환합니다. 후드에 EGM2MV 500 μL를 포함하는 37 ° C 배양기에서 microfuge 튜브 중 하나를 가져와. Nucleofector 키트에서 제공하는 전송 pipettes 중 하나를 사용하여 부드럽게 cuvette에 세포 현탁액에 미디어의 따뜻한 500 μL를 추가합니다. microfuge 튜브 15 분 인큐베이터에있는 곳으로 cuvette을 다시의 내용을 모두 전송합니다. 세포가 복구할 수 있습니다.
- 더 많은 세포가 transfected 수있다면 필요에 따라 반복 9.11 단계를 반복합니다.
- transfected HUVEC 정지 600 μL를 포함하는 하나의 microfuge 튜브는 두 coverslips에 씨앗을하실 수 있습니다. 후드 아래와 1000 μL micropipette으로 부드럽게 직접 젤라틴 코팅 coverslip에 정지 300 μL을 배치하여 최대 피펫 아래로 한 번 중지를 믹스하고,. 정지는 coverslip의 가장자리를 만지게하지 마십시오. 37 ° C / 5% CO 2의 장소 인큐베이터 1-4 H에 대한 셀 첨부 파일을 허용합니다.
- 1-4 H 후, 그들은 coverslip에 첨부 확인 transfected 세포를 검사합니다. 그렇다면 EGM2MV 미디어 10 ML을 추가하고 37 판으로 돌아갑니다 ° C / 5% CO 2 배양기. GFP - 굴지의 표현은 일반적으로 4-8시간 이내에 볼 수 있습니다. 실험은 대개 24 ~ 48 H. 내에서 수행됩니다
2. 라이브 세포 이미징 챔버를 설정 및 무대 히터
- 우리의 연구의 대부분을 위해, 우리는 중력 흐름 시스템에 의해 먹이 PH - 1 무대 히터에 배치 워너 인스 트루먼 트의 오픈 다이아몬드 목욕 (RC22)을 사용하고 있습니다. 그러나, 몇 가지 옵션이 유리 바닥 문화 요리, 오픈 대 폐쇄 챔버, 다양한 microincubator / 객관적인 히터의 조합과 대형 배양기 시스템을 수용 실 포함한 라이브 세포 이미징 단계, 사용할 수 있습니다. 궁극적으로, 챔버 선택 테스트 에이전트 또는 약물을 추가하는 목욕에 액세스 할 필요를 포함하여 요인 whe에 따라 달라집니다거기에 매체는 정적이나 흐름에 따라 수 있으며, 실험의 길이됩니다. 또한, 때로는 온도 불안정과 같은 요인 초점 드리프트를 일으킬 수 있으며, 안정적인 욕조와 객관적인 온도를 유지할 수 제어 시스템에 의해 최소화 수 있습니다.
- 실험을 위해 나누어지는 충분 매체. 알부민 생리 식염수의 우리 나누어지는 50 ML (APSS, 표 1) 각 시간 동안의 실험은 지난 것입니다.
- 어느 펌프 또는 중력 - 흐름 시스템은 실로 매체를 전달하는 데 사용할 수 있습니다. 우리 시스템, 우리는 인라인 히터 (워너 인스 트루먼 트의 모델 SH - 27A)에 연결된 정맥 흐름 라인에서 만들어진 간단한 중력 흐름 시스템에 APSS를 추가합니다. 우리는 약 40 ML / H.에서 흐름을 적용
- 우리와 같은 오픈 목욕 챔버가 사용되는 경우, 다이아몬드 목욕의 아래쪽과 솜 밀고 작은 주걱으로 바깥 가장자리에 진공 그리스를 적용합니다. 다음, 우리는 인큐베이터에서 한 셀 덮인 coverslip을하고, 부드럽게 집게를 사용하여 coverslip을 리프트. Gently는 세포 - 대상 측면이 젖었 유지하면서 초과 미디어를 흡수하는 kimwipe로 뒷면을 터치. 세포가 얼굴, 챔버를 형성 coverslip 위에 다이아몬드 목욕을 놓으십시오.
- 빨리 무대 히터에 챔버를 배치하고 챔버를 통해 클램프를 손으로 조입니다. 이 단계에서 주요 관심사는 세포가 건조 가능성이다. 그러므로 그것을 신속하게 작업하는 것이 중요하고 완료되면 즉시 피펫 ~ 밖으로 건조로부터 세포를 방지하기 위해 챔버에 중간 1 ML.
- 우리 챔버는 세포를 통해 매체의 지속적인 흐름을 허용합니다. 그냥 흐름을 켜기 전에, 그것은 여분의 문화 매체 (APSS)의 출구를 허용하도록 챔버에 미치는 홀더에 진공 호스를 연결하는 것이 중요합니다. 인라인 히터 및 목욕 히터도이 시점 (37 ° C)이 설정되어 있어야합니다. 우리 또한이 시스템은 욕조의 가장자리에 배치해야 온도를 모니터링하는 서미 스터 프로브를 가지고 있습니다.
- 조심스럽게 공동의 아래쪽을 닦아나머지 EGM2MV 미디어와 소금 상승을 제거하는 70 % EtOH로 적셔 kimwipe로 verslip. 마른 kimwipe이나 렌즈 종이 두 번째 시간을 닦아주십시오.
- 챔버가 설정되고 나면, 흐름에, 그리고 온도 37 ° C 안정, 세포 적어도 30 분 실험을 시작하기 전에 조정 및 안정화 수 있습니다.
- 기다리는 동안, 살아있는 세포 이미징 현미경 (램프, 필터 휠 컨트롤러, 카메라, 컴퓨터)의 모든 구성 요소에 설정합니다.
3. 라이브 세포 이미징 현미경으로 데이터의 취득
- 다양한 라이브 셀 현미경 시스템을 사용할 수 있습니다. 우리 시스템은 다음과 같은 구성 요소와 니콘 이클립스 TE - 2000U입니다
- 셔터 인 스트 루먼트 람다 LS 300 W 크세논 램프
- SmartShutter과 S492 필터와 셔터 인 스트 루먼트 람다 10-3 여기 필터 휠 (D350과 S572 자극하는 필터는 UV 및 RFP 응용 프로그램에도 사용할 수 있습니다)
- 이색성 2002bs 방출기 (니콘 61002m)
- CI 계획 형석 10X DLL 목표, NA 0.30 (니콘 MRH10100)
- 계획 형석 ELWD 40X DM 목적, NA 0.60 (니콘 MRH08420)
- 계획 APO VC 100X 오일 목표, NA 1.40 (니콘 MRD01901)
- Photometrics CoolSNAP HQ2 카메라, 1,392 X 1,040 이미징 배열 6.45 X 6.45 μm의 픽셀
(Roper 과학) - 우리는 또한 이미지 수집에 사용할 수있는 두 소프트웨어 패키지를했습니다. 니콘 요소 - AR 3.0 및 Metamorph 6.1.
- 세포를보고 연구를위한 적절한 장소를 찾는 후, 거친 초점 손잡이를 잠금 있도록 소프트웨어를 수집 설정을 확인 :
- 필터 휠은 S492 필터 (우리 구성 "FITC"표시)에 대한 설정
- 인수 소프트웨어의 목적은 원하는 배율을 (우리의 현미경은 전동지만, 이것이 μm의 / 픽셀 비율을 설정하지 않습니다) 일치하도록 설정됩니다. 또한 현미경의 optivar 렌즈는 1.0X 배율로 설정되어 있는지 확인합니다. optiv 설정1.5X로 AR 신호 강도를 잃는 희생하지만, 배율을 증가시킬 수 있습니다.
사용되는 배율은 연구의 목적을 따라 달라집니다. 최고의 세부 사항을 위해, 높은 수치 조리개와 100X의 목표는 최고의 공간 해상도와 신호의 전송을 제공합니다. 우리의 현미경은 또한 여분의 거리를 필요로하는 다른 응용 프로그램을위한 긴 작동 거리 40X 목적으로 갖추고 있습니다. 우리는 동시에 여러 개의 세포를 관찰하고자하는 경우 그러나,이 목적은 유용 될 수 있으며, 공간 해상도 및 신호 강도를 잃을 비용 그러나, organelle 크기의 구조를 볼 수 잘 동작합니다. 신호 강도가 종점이다, 또는 같은 고급 이미징 기술에 대한 형광 현미경을 작은 반점이있는 모든 연구, 100X 목적을 권장합니다. - 카메라 노출 시간은 0.5-2 s의 사이에 설정됩니다 이것은 세포에있는 GFP - 굴지의 강도에 따라 달라집니다. 우리는 일반적으로 BL을 피하기 위해 가장 낮은 가능한 노출 시간을 사용GFP - 굴지 및 세포 독성의 잠재 eaching.
- 최고의 해상도를 달성하기 위해, Binning는 1 X 1로 설정하고 1 확보해야합니다. 어떤 경우에는 우리가 노출 시간을 줄이기 위해 X 2 2 binning 설정, 그러나 이것은 우리가 시간 경과 연구에 움직이는 물체에 만들 수있는 측정의 정밀도를 줄일 수 있습니다.
- 시간 경과 설정을 구성합니다 :
- 캡처한 이미지를 저장하고 파일 이름을 입력하는 폴더를 선택합니다.
- 실험에 대한 이미지와 간격 기간 횟수를 설정합니다. 우리는 일반적으로 이미지와 기간에 대해 최대 2 H 사이의 15의 1 분 간격을 사용합니다.
- 활성 셔터가 인수 사이의 폐쇄로 설정되었는지 확인합니다.
- 시간 저속 이미지 획득을 시작하기 전에, 방 조명을 끄고 설정을 확인하는 하나의 이미지를 캡처합니다.
- 또한 brightfield 이미지를 캡처합니다. 콘덴서가 적절한 단계 또는 DIC 필터로 설정되어 있는지 확인하십시오. 를 켜고할로겐 램프 및 이미지를 수집합니다. 할로겐 램프를 끄십시오.
- 시간 경과 이미징에 대해 "FITC"설정으로 되돌리기 및 테스트 이미지를 캡처합니다.
- 시간 경과 시리즈를 캡처합니다.
실험을 진행하는 동안, 그들이 얻은대로 이미지를 모니터하는 것이 중요합니다. 어떤 경우에서는 챔버 내의 온도의 작은 변화는 초점 드리프트가 발생할 수 있습니다. 이것은 그 흐름이 셀을 통해 안정되도록 유입 및 진공 라인을 최적화함으로써 피할 수 있습니다. 또한, 현미경 실에서 트래픽을 최소화하고, 멀리 떨어진 현미경에서 천장 환기구에서 초안을 리디렉션하는 것이 도움이 될 수 있습니다. 우리의 경험에서 잘하였습니다 대안 37 전체 무대와 목표를 묶으 ° C / 5퍼센트 CO 2 배양기의 챔버를 사용하는 것입니다. 이러한 제공 하룻밤 이상 모니터링 세포의 장점,하지만 세포에 대한 액세스가 제한됩니다.
필요한 경우, 시간 경과 수집을 일시 중지하고 이미지를 집중할. 에 가능한 한 빨리 집중할를 수행 이미지 사이의 시간 간격을 변경하지 마십시오. - 전형적인 프로토콜 추가 이미지 수집 0.5 4 시간 뒤에 테스트 에이전트를 추가하기 전에 기본적인 이미지의 20-30분 구성됩니다. 실험의 길이가 가장 짧은 노출 시간이 가능한 선택하는 것이 중요합니다 이유 시간 동안 GFP의 photobleaching에 의해 제한될 수 있습니다. 그것은 또한 더 연구가 필요한 경우 30-60 s의 시간 저속 이미지 사이의 간격을 변경하는 것이 바람직하다 수 있습니다.
4. 데이터 분석
- 여러 소프트웨어 패키지는 우리가 일반적으로 우리 실험실이나 가정에서 어떤 컴퓨터에 분석을 활성화 NIH ImageJ를 사용하여 Google 이미지 분석을 수행하는 등 NIS 요소, Metamorph, Slidebook 등 이미지 세트를 분석하는 데 사용할 수 있습니다. 우리가 사용하는 버전은 다음과 같습니다
MBF ImageJ ( http://www.macbiophotonics.ca/imagej/ )
피지 (I "대상 ="_blank "> http://pacific.mpi-cbg.de/wiki/index.php/Fiji). - ImageJ는 등 많은 역동적인 프로세스를 분석하는 데 사용할 수 있습니다 :
- lamellipodia의 라고나의 주파수
- 거리, 시간 및 라고나의 속도
- 시간이 지남에 따라 굴지 섬유 운동
- ImageJ에서 이미지 설정은 슬라이스 번호 / 총 조각을 열 때 파일 이름과 함께, 창의 왼쪽 상단 모서리에 표시되며, 픽셀, 파일 형식, 크기의 숫자. 바닥에 Z 스크롤바 시간에 해당합니다. 또한, 이미지 위에 포인터를 유혹하면 X, Y, 그리고 ImageJ 툴바의 하단에 Z 픽셀 위치를 표시합니다.
- Lamellipodia의 융기는 시간이 지남에 따라 새로운 라고나의 숫자를 결정하여 공부하실 수 있습니다. 이것은 전체 셀 경계 또는 선택된 영역에 대해 수행할 수 있습니다. 이러한 유형의 분석은 또한 위상 대비 또는 DIC 현미경과 nonconfluent, untransfected 셀에 수행할 수 있습니다. 그러나, GFP - 굴지 표현 세포를 사용하면 포함된 GFP - 굴지 부족한 세포가 서로 인접 특히 때 합류 monolayers의 분석을 수 있습니다.
- Lamellipodia의 돌출부 거리, 지속성 (시간), 그리고 속도가 kymograph (라인 스캔) 분석에 의해 평가하실 수 있습니다. 세포의 가장자리 (아무 인접 셀 또는 인접한 셀 GFP - 굴지을 표현하지 않는가없는 경우이 가장 쉽습니다)에 직각 라인을 그립니다. ImageJ에서 눌러 "/"D를 대표하는 X - 축과 kymograph를 생성합니다istance 및 Y 축 나타내는 시간 (15의 픽셀 당 1 분 위의 시간 간격 지침에 따라). 라인은 튀어나온 lamellipodia과 (ImageJ에서 M을 눌러) 측정 상자 크기를 통해 그려질 수 있습니다. 거리, 시간, 속도는 다음 계산하실 수 있습니다.
- 스트레스 섬유의 움직임도 이와 유사한 방식으로 kymograph 분석하여 측정할 수 있습니다.
5. 대표 결과 :
우리 transfection 프로토콜로, 우리는 일반적으로 transfected HUVEC의 50 % 이상에서 GFP - 굴지의 표현을보고하고, 종종 coverslip에 영역을 찾을 수있는 영역을 표현하는 GFP - 굴지의 HUVEC의> 90%. GFP - 굴지 표현 subconfluent HUVEC와 라이브 세포 이미징 실험 예제는 영화 하나에 표시됩니다. 이 특정 실험 들어, 이미지는 분당 한 인수되었다. HUVEC에서 동영상, GFP - 굴지에서 볼 수 있듯이 filamentous 구조체뿐만 아니라, 세포질 전반에 걸쳐 볼 수 있습니다ures과 지역 lamellipodia 관련 셀 가장자리 튀어나온. 영화도 겉보기는 GFP - 굴지의 표현이 세포 사이에 균일되지 않는 것입니다. 연구 선택한 세포는 일반적으로 filamentous 굴지을 포함한 다양한 구조를 시각화하는만큼 GFP - 굴지 선물을했습니다. 이러한 세포는 G - 굴지의 현재의 높은 금액에서 F - 굴지 구조를 구분하기 위해 일반적으로 어렵습니다 때문에 GFP - 굴지의 매우 높은 수준을 표현하는 세포 연구를위한 문제가 될 수 있습니다.
영화 2 GFP - 굴지 표현 합류 HUVEC의 동작의 예를 보여줍니다. subconflent HUVEC 마찬가지로, 세포의 경계를 따라 활성 lamellipodia 형성 및 회전율은 분명했다. 그러나 이러한 lamellipodia은 종종 덜 효율적인 돌출부 7을 나타내는 멤브레인 주름로 상승했다. 이것은 아마도 근처 하층을 차단 인접 세포의 존재 때문입니다. 굴지 피질 섬유 및 스트레스 섬유는 영화 1과 2에서도 볼 수 있습니다. 비록 우리가 O 셀bserved이 고정 유지, 스트레스 섬유 세포 가장자리 근처에 형성과 그들이, 9 8 분해 셀 센터 향해 옆으로 이동, 마이 그 레이션 세포의 가로 아크 섬유 비슷합니다. 이러한 세포에서 관찰 추가 역동적인 기능은 이전에 굴지 구름 열 이름이 집중적으로 확장 굴지 링 구조의 형성되었습니다.
셀 라고나의 거리, 끈기, 그리고 속도가 이러한 시간 저속 이미지에서 계량하는 방법의 예입니다 kymograph 분석을 사용하는 것은 그림 1에 표시됩니다 설정합니다. 그림 1A에서 단일 픽셀 라인은 kymograph의 세대 (그림 1B)에 대한 세포 가장자리에 거의 직각 그린 것입니다. 이 kymograph에서 라인에 의해 정의된 지역은 수직으로 배치되고 시간이 경과 전역에서 이미지가 가로 정렬됩니다. 왼쪽에서 kymograph에 오른쪽으로 보면서, 라고나할까요은 세포의 가장자리에 상승 움직임으로 표시됩니다. 그림 1C에서 라인 한모금되었습니다이러한 라고나할까요 중 하나의 가장자리에 erimposed, 그 라인과 관련된 픽셀 데이터는 패널의 하단에있는 검색 결과 창에 수집되었으며 표시됩니다. 이 분석은 돌출부 역학의 부량을 허용하고, 또한 세포의이 지역에있는 돌출부 주파수를 (라고나할까요 / 시간의 수) 예상하는 데 사용할 수 있습니다.
스트레스 섬유 운동의 분석 예제는 그림 2에 표시됩니다. 대부분의 스트레스 섬유 우리는 세포 주변 근처에 형성 관찰하고 결국 해체 어디에, 세포 센터쪽으로 옮겼습니다. 이것은 또한 kymograph 분석하여 계량하실 수 있습니다. 라인은 셀 가장자리와 스트레스 섬유 (그림 2A)와 kymograph가 (그림 2B) 생성하기 위해 수직 그린 것입니다. 스트레스 섬유 kymograph의 세포질 영역에서 지속적인 라인이 종종 오른쪽 (셀 센터 방향)로 이동하고 나타납니다. 때로는 섬유 원래 kymograph에 표시하기 어려운 있으며, 이러한 경우에 우리이미지 (그림 2C)를 선명하게하기 위해 확대해 마스크 필터를 사용합니다. 라인은 스트레스 섬유에 그려진되고 픽셀 데이터는 측정 기능 (그림 2D)를 사용 수집하고 있습니다. 이 데이터를 수집하는 다른 방법은 섬유 (그림 2E) 관찰되었다 그 기간 동안의 평균 기울기를 얻기 위해 식별 스트레스 섬유의 끝까지 처음부터 라인을 그릴 것입니다. 이 분석은 스트레스 섬유 측면 운동의 부량 수 있도록하고 또한 세포의이 지역에서 관찰 스트레스 섬유의 개수를 계량하는 데 사용할 수 있습니다.
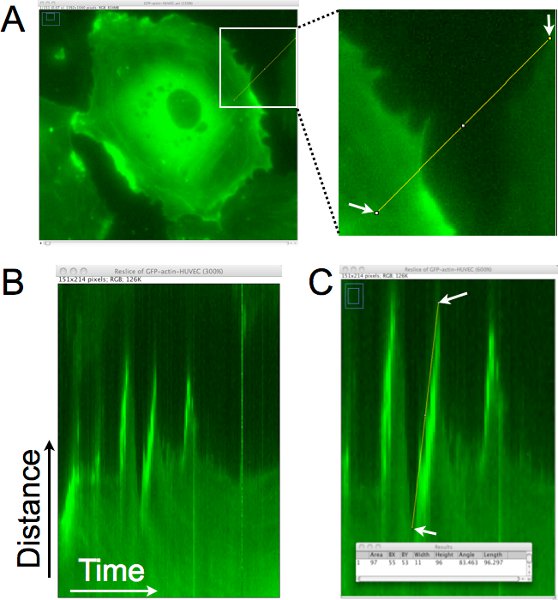
그림 1. 세포의 가장자리 Kymograph 분석 돌출부 거리, 지속성, 지역 lamellipodia의 속도를 결정합니다.가. 하나의 픽셀 라인은 세포의 가장자리에 거의 직각 그린 것입니다. 이 지역은 시간이 지남에 따라이 지역의 몽타주를 생성하는 설정 시간 경과의 각 이미지에서 추출됩니다. B는. 일 년E가 kymograph을 결과 x 축은 왼쪽에서 오른쪽으로 이동, 시간을 나타내고 y 축은 거리를 보여줍니다. 시간이 지남에 따라 세포의 가장자리에 운동이 kymograph에서 평가할 수 있으며, lamellipodia는 셀 가장자리가 rightward 이동, 위쪽으로가는 지역을 확인할 수 있습니다. C는. 라인은 lamellipodium하여 돌출부가 확인되었습니다 세포 가장자리에 그려져있다. 그려진 라인에 대한 경계 사각형의 크기는 다음 (겹쳐 창에 표시)을 찾았습니다. 너비는 돌출부 시간이나 지속성을 계산하는 데 사용됩니다. 높이는 돌출부 거리를 계산하는 데 사용됩니다. 융기 속도는 너비로 높이를 나누어 계산됩니다. 이 예제에서는 상승 거리는 96 픽셀 X 0.16125 μm의 / 픽셀 = 15.5 μm의었고, 시간이 X 1 / 픽셀 = 11 분 min. 11 픽셀했다. 속도는 15.5 μm/11 분으로 계산되었다. = 1.4 μm의 / 분.

F굴지의 스트레스 섬유의 움직임 igure 2. Kymograph 분석.. 하나의 픽셀 라인 kymograph를 생성하는 세포의 가장자리에 수직 그립니다. B는. 마찬가지로 그림에 표시됩니다. 1, 결과 kymograph에서 x 축은 시간과 Y 축 거리를 나타냅니다. 스트레스 섬유는 종종 아래쪽으로가는 세포의 지속적인 라인으로, 오른쪽 (화살표) C로 관찰됩니다. 더 스트레스 섬유를 시각화하는, 얼굴을 확대해 필터를 사용할 수 있습니다. 이 예제에서는 3 픽셀 0.60의 마스크 중량의 반경이 사용되었습니다. D는. 단일 픽셀 라인 다음 확인 응력 섬유를 통해 그린, 그리고 데이터가 수집됩니다. 이 패널 세 라인이 그려진 후 "삭제"를 각각 측정 후 해당 지역의 영구적인 주석 (화이트 라인)을 만들어 누르면있었습니다. E가. 스트레스 섬유의 평균 거리, 시간, 속도가 필요한 경우 또는, 라인의 시작과 마무리 포인트 (노란색 라인)에서 그린, 그리고 데이터 수(결과 창에서 강조 표시) 취득 수 있습니다 R. 이 예를 들어, 성능은 37 프레임이 스트레스 섬유 × 1 프레임 / 분에 만들어졌다. = 37 분. 거리는이 기간되었습니다 75 프레임 X 0.16125 μm의 / 픽셀 = 12.1 μm의 이상의 여행. 스트레스 섬유의 결과 측면 속도는 12.1 μm/37min = 0.33 μm의 / 분습니다. 속도에 대한 긍정적인 가치는 주변쪽으로 이동 섬유에 대한 세포 센터, 부정적인 방향으로 이동 섬유에 대한 할당됩니다.
GFP - 굴지 표현 라이브 HUVEC의 영화 1. 시간 경과 영상. 이미지 사이의 간격은 1 분입니다. 지역 lamellipodia는 세포의 전체 경계를 따라 돌출. 또한, 가로 아크 스트레스 섬유 세포의 중앙쪽으로 옆으로 옮겼습니다. 트롬빈은 (1 U / ML) 욕조에 추가되었을 때, 세포가 약간 계약과 lamellipodia의 바깥쪽 라고나할까요은 약 10 분 일시 중지되었습니다. 세포가 계약 후 lamellipodia 형성 및 회전율은 이력서 D.이 영화를보고하려면 여기를 클릭하십시오.
영화 2. 트롬빈 치료 전후, GFP - 굴지 표현 합류 HUVEC. 초 : 경과 시간은 분으로 오른쪽 하단 모서리에 표시됩니다. 이미지 사이의 간격은 30 S. 있습니다 트롬빈 (1 U / ML) 45 분 이후에 추가되었습니다. 기준 기간. , 굴지 구름 (화살표, 1시 59분부터 21시 29분까지)과 트롬빈이 추가 후 widens tricellular 교차로에서 격차 - 주석 행사는 지역 lamellipodia 형성 및 매출액 (37:29 셀 가장자리 근처에 화살촉, 0시 59분) 포함 (화살표, 62:30 - 70:00). 가로 아크 스트레스 섬유는 세포의 여러 가지도 분명 있습니다. 세포는 많은 멤브레인에 상승을주는 것이 주름과 자신의 경계를 따라 지역 lamellipodia의 적극적인 형성과 매출액을 표시합니다. 트롬빈은 lamellipodia 형성 및 회전율의 정지가 발생하고, 세포 사이에 작은 간격의 짧은 모양.https://www.jove.com/files/ftp_upload/3187/Movie2-confluentHUVEC.avi은 "> 영화를보고하려면 여기를 클릭하십시오.
토론
라이브 내피 세포에 GFP - 굴지의 영상은 염증성 자극에 대한 응답으로 굴지의 cytoskeleton의 역학에 대한 자세한 분석을 수 있습니다. 이 방법은 또한 전단 응력 11과 같은 물리적 세력에 대응 cytoskeleton의 리모델링을 보여주는 이전 연구 결과에 기초하여 유용할 수 있습니다. 또한,이 방법은 마이 그 레이션, 유사 분열, 세포 분기점 및 junctional 성숙의 형성, 그리고 장벽 기능의 유지 보수 등 다양한 내피 세포 활동에 굴지 cytoskeletal 역학의 공헌에 대한 자세한 평가를하실 수 있습니다.
표시된 데이터의 내피 굴지의 cytoskeleton의 동작은 트롬빈 치료 전후에 볼 수 있습니다. 모든 내피 세포의 가장자리를 따라 로컬 lamellipodia은 성형과 nonconfluent과 합류 모두 세포 monolayers에 시간이 지남에 따라 regressing 관찰되었다. 트롬빈과 치료는 간단히 lamellipodia 양식을 중단ation과 매상. 트롬빈은 트롬빈이 내피 세포의 12-14 굴지 스트레스 섬유 형성 및 증가 구심 긴장 개발을 일으키는 이전 리포트와 계약에, 세포가 약간 계약에 발생했습니다. 그러나, 이와 같은 라이브 세포 이미징 연구에서 스트레스 섬유의 출처는 현재 확인할 수 있습니다. HUVEC에서 스트레스 섬유의 대부분은 세포 주변에서 발생한 및 세포 8, 9를 마이 그 레이션에 가로 아크 섬유를 닮은. 고정 세포를 사용하여 이상이 방법의 또 다른 장점은 스트레스 섬유의 수를 실험 그룹간에 선택 바이어스를 제거, 트롬빈 치료 전후 각 세포에 계량 수있다는 것입니다.
이 프로토콜을 통해 우리는 셀 가장자리와 굴지의 스트레스 섬유의 역동적인 움직임을 평가합니다. photobleaching 후 내피 세포와 같은 형광 복구와 같은 고급 기술에 굴지의 모노머의 역학을 이해 (FRAP) 또는 형광는 마이크로을 작은 반점하기복사 (FSM)는 16 일 15 적용할 수 있습니다. 또한, 때문에 microvascular 내피 세포는 microvascular 장벽 기능의 더 나은 모델을 효과적으로 논리적인 미래 방향을 나타냅니다 microvascular 내피 세포에 GFP - 굴지 표현 transfection 프로토콜의 최적화를 대표하는 수도 있습니다.
요약, GFP - 굴지 표현 라이브 내피 세포의 이미징은 내피 세포 굴지의 cytoskeleton은 자극에 다양한 종류의에 응답하는 방법을 결정하는 강력한 도구를 나타냅니다. 단단히 합류 내피 monolayers를 사용하는 연구는 굴지 풍부한 lamellipodia와 내피 장벽 기능에 가로 아크 스트레스 섬유와 같은 역동적인 구조의 역할을 결정하는 데 도움이됩니다. 또한, GFP - 굴지 또는 기타 subcellular 구조의 시각화 수 있도록 다른 융합 단백질을 표현하는 내피 세포의 라이브 세포 이미징은 신호 및 구조 메커니즘을 이해하는 데 필요한 자세한 spatiotemporal 정보를 제공합니다 것이 Determine 장벽의 무결성.
공개
관심 없음 충돌 선언하지 않습니다.
감사의 말
GFP - β - 굴지 플라스미드는 넉넉한 박사 웨인 오어 병리의 LSUHSC - S 부서에 의해 제공되었고, 박사 베키 Worthylake, 약리학의 LSUHSC - NO학과 실험실에서 증폭되었다. 이 작품은 국립 보건원 (P20 RR - 018766)와 미국 심장 협회 (05835386N)에서 부여에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 1. 닮은 5 배 증권 | |||
| 화학 | 회사 | 카탈로그 번호 | 양 |
| 나트륨 염화물 | EMD | SX0420 - 3 | 35g |
| 염화칼륨 | JT 베이커 | 3040 | 1.75 g |
| 염화칼슘 | 시그마 | C - 3881 | 1.47 g |
| 마그네슘 황산 | 시그마 | M - 9397 | 1.44 g |
| 무균 필터링 물 | N / A | N / A | 1 L에 지참 |
| 4 autoclaved 병 및 상점으로 살균 필터 ° C | |||
| 2. 맙스 버퍼 | |||
| 화학 | 회사 | 카탈로그 번호 | 양 |
| 맙스 | 시그마 | M3183 | 125.6 g |
| 무균 필터링 물 | N / A | N / A | 1 L에 지참 |
| 4 autoclaved 병 및 상점으로 살균 필터 ° C | |||
| 3. 알부민 생리 식염수 (APSS) | |||
| 화학 | 회사 | 카탈로그 번호 | 양 |
| 닮은 주식 (5 배) | N / A | N / A | 200 ML |
| 맙스 버퍼 | N / A | N / A | 5 ML |
| 인산 나트륨 | 시그마 | S - 9638 | 0.168 g |
| 나트륨 Pyruvate | 시그마 | P5280 | 0.22 g |
| EDTA (에틸렌 다이아 민 테트라 초산) 나트륨 소금 | 시그마 | ED2SS | 0.0074 g |
| 포도당 | 시그마 | G7528 | 0.901 g |
| 알부민, 소의 | USB | 10,856 | 10g |
| 무균 필터링 물 | N / A | N / A | 1 L에 지참 |
| 37 7.4로 산도를 조절 ° C, 4 autoclaved 병 및 저장에 다음 살균 필터 ° C. | |||
| 4. 0.9 %의 염분 | |||
| 화학 | 회사 | 카탈로그 번호 | 양 |
| 나트륨 염화물 | EMD | SX0420 - 3 | 9g |
| 무균 필터링 물 | N / A | N / A | 1 L에 지참 |
| 4 autoclaved 병 및 상점으로 살균 필터 ° C | |||
| 5. 1.5 % 다행 솔루션 | |||
| 돼지의 피부에서 젤라틴 | 시그마 | G2500 | 15g |
| 0.9 %의 염분 | N / A | N / A | 1 L에 지참 |
| 37에 대한 해결책을 따뜻하게 ° C 충분히 젤라틴 디졸브 수 있습니다. 동안 4 autoclaved 병 및 저장에 여전히 따뜻하고, 살균 필터 ° C | |||
참고문헌
- Spindler, V., Schlegel, N., Waschke, J. Role of GTPases in control of microvascular permeability. Cardiovasc. Res. 87, 243-253 (2010).
- Wojciak-Stothard, B., Ridley, A. J. Rho GTPases and the regulation of endothelial permeability. Vascul. Pharmacol. 39, 187-199 (2002).
- Yuan, S. Y. Signal transduction pathways in enhanced microvascular permeability. Microcirculation. 7, 395-403 (2000).
- Birukov, K. G. Small GTPases in mechanosensitive regulation of endothelial barrier. Microvasc. Res. 77, 46-52 (2009).
- Duran, W. N., Sanchez, F. A., Breslin, J. W. Microcirculatory Exchange Function. Handbook of Physiology: Microcirculation. Tuma, R. F., Duran, W. N., Ley, K. , 2nd Edition, Elsevier. San Diego. 81-124 (2008).
- Hu, Y. L., Chien, S. Dynamic motion of paxillin on actin filaments in living endothelial cells. Biochem. Biophys. Res. Commun. 357, 871-876 (2007).
- Borm, B., Requardt, R. P., Herzog, V., Kirfel, G. Membrane ruffles in cell migration: indicators of inefficient lamellipodia adhesion and compartments of actin filament reorganization. Exp. Cell. Res. 302, 83-95 (2005).
- Hotulainen, P., Lappalainen, P. Stress fibers are generated by two distinct actin assembly mechanisms in motile cells. J. Cell. Biol. 173, 383-394 (2006).
- Pellegrin, S., Mellor, H. Actin stress fibres. J. Cell. Sci. 120, 3491-3499 (2007).
- Ballestrem, C., Wehrle-Haller, B., Imhof, B. A. Actin dynamics in living mammalian cells. J. Cell. Sci. 111, 1649-1658 (1998).
- Helmke, B. P., Rosen, A. B., Davies, P. F. Mapping mechanical strain of an endogenous cytoskeletal network in living endothelial cells. Biophys. J. 84, 2691-2699 (2003).
- Birukova, A. A., Smurova, K., Birukov, K. G., Kaibuchi, K., Garcia, J. G., Verin, A. D. Role of Rho GTPases in thrombin-induced lung vascular endothelial cells barrier dysfunction. Microvasc. Res. 67, 64-77 (2004).
- van Nieuw Amerongen, G. P., van Delft, S., Vermeer, M. A., Collard, J. G., van Hinsbergh, V. W. Activation of RhoA by thrombin in endothelial hyperpermeability: role of Rho kinase and protein tyrosine kinases. Circ. Res. 87, 335-340 (2000).
- Moy, A. B., Blackwell, K., Kamath, A. Differential effects of histamine and thrombin on endothelial barrier function through actin-myosin tension. Am J Physiol Heart Circ Physiol. 282, H21-H29 (2002).
- Wittman, T., Littlefield, R., Waterman-Storer, C. Fluorescent speckle microscopy of cytoskeletal dynamics in living cells. Live Cell Imaging: A Laboratory Manual. Goldman, R. D., Spector, D. L. , Cold Spring Harbor Laboratory Press. 184-204 (2005).
- Rabut, G., Ellenberg, J. Photobleaching techniques to study mobility and molecular dynamics of proteins in live cells: FRAP, iFRAP, and FLIP. Live Cell Imaging: A Laboratory Manual. Goldman, R. D., Spector, D. L. , Cold Spring Harbor Laboratory Press. 101-126 (2005).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유