Method Article
FSL은 구조 : 생물 학적 마커의 범위와 셀 / Virion 표면을 수정하기위한 간단한 방법을 자신의 생존에 영향을주지 않고
요약
기능 - 스페이서 - 지질 (FSL) 구조는 살아있는 세포와 virions의 표면 특성은 활력의 손실없이 수정할 수 있도록. 방법은 세포 / virion 및 자발하고 안정적인 표면 설립 발생과 FSL 구조 솔루션의 단순한 접촉을 필요로합니다.
초록
수정 / 생물 학적 표면을 시각화하고 체외에서 범위 및 생체내 환경에서 수정된 세포 / virion을 연구하는 기능은 특정 분자 또는 전체 개체의 기능에 대한 통찰력을 확보하는 것이 필수적입니다. 생물 학적 표면 수정 연구는 일반적으로 유기체의 유전자 공학이나 세포 표면에 화학 1,2 moieties의 공유 결합 첨부 제한됩니다. 그러나 이러한 전통적인 기술은 화학 reactants에 세포를 노출하거나, 그들은 중요한 조작 그들이 성가신 만들고, 원하는 결과를 달성하기 위해 필요하고, 그들은 또한 실수로 수정된 세포의 생존 / 기능에 영향을 미칠 수 있습니다. harmlessly 세포의 표면을 수정하는 간단한 방법이 필요합니다.
최근에 새로운 기술, KODE 기술은 세 가지 요소로 구성된 새로운 구조의 다양한 발표했다 : 기능성 머리 그룹 (F), 스페이서 (S)과 지질 꼬리 (L)을하고 함수 스페이서 - 지질 또는 FSL로 알려져 있습니다 constructs3. 스페이서 (S)는 물에 dispersible있는 구조를 제공하기 위해 선택되어, 아직 자발적으로 그리고 안정 막에 통합됩니다.
FSL은 (F) 지금까지 혈액형 관련 determinants, sialic 지방산, hyaluronan 다당류, fluorophores, 비오틴, radiolabels 및 펩티드 3-12의 범위를 포함 saccharides의 범위를 포함 기능 moieties을 구축. FSL 구조는 세포 접착 / 상호 작용 / 분리 / 고정을 수정 품질 제어 시스템 및 진단 패널을 만들 수정 배아, 마리의 정자 수야, zebrafish, 상피 / 자궁 내막 세포, 적혈구, 그리고 virions에 사용하고, 체외에서에 대한되었습니다 전지 / virions 3-12의 생체내 이미징.
세포 / virions을 수정하는 과정은 일반적인 매우 간단합니다. 가장 일반적인 절차는 FSL은 37 1-2시간에 대한 구조 ° 4-10 C를위한 솔루션으로 세포의 배양 (지질 무료 미디어)입니다. 부화 동안 FSL은 세포막에 통합 자발적 구성하고, 프로세스가 완료됩니다. 워싱은 선택 사항입니다. virions는 kodevirions 10아르 동안 FSL 구조에 의해 수정된 세포는 kodecytes 6-9로 알려져 있습니다.
직접 혼합 및 kodecytes / kodevirions가 실험 동물 모델 7,8,10에 사용 되었기 때문입니다 FSL은 구조. 모든 kodecytes / kodevirions은 F 잔기 7,8,10,11의 새로운 기능을 확보하면서 자신의 정상적인 활력과 기능을 유지하기 위해 나타납니다.
biocompatible 미디어, 세포 점막에 자발적인 설립하고, 명백한 낮은 독성에 dispersibility의 조합, FSL은 세포 virions 연구에 대한 가치있는 연구 도구를 구성합니다.
프로토콜
다음 프로토콜은 생물 세포막에 FSL 구조의 삽입 (그림 1)에 대한 일반적인 절차를 설명합니다. 단순화하기 위해 프로토콜은 100 % 농도에있어 세포 (kodecytes)을 참조합니다. 그러나, 장기 세포가 virions (kodevirions) 또는 유기체 또는 세포 구조와 희석제 그들의 농도와 호환하는 것은 중요하지 않습니다, 그것은 테스트, 컨트롤 및 실험 사이에 항상 일관성이 제공됩니다. 적혈구와 포장 세포 볼륨은 일반적으로 80 %지만, virions, 배아 및 기타 세포와 함께 일반적으로 1 % 미만이다. 방법은 매우 강력하고 그 변화의 모든 사용하는 경우 수정 세포막을 생산되지만, 상세 검색은 특정 응용 프로그램에 필요한 수정의 정도를 최적화하고 표준화해야합니다.
1. FSL의 준비 구성
- 제품 약병에 희석제의 1.0mL (또는 제품 삽입에 지정된)의 추가로 FSL 건설 주식 솔루션 첫번째 reconstitute에게 건조 FSL 제품 (표 1)을 준비하십시오. 간단히 (30 초) sonicate. 이것은 100 μL 멸균 용기에 aliquoted과 ° C 최대 1 주일 정도, 또는 최대 3 개월까지 냉동 2-8에 저장할 수 있습니다 1mg/mL 솔루션을 준비합니다.
- 작업 준비 FSL은 micelles을 균질로 (30 초) 주식 솔루션을 간단히 sonicate 사용하기 직전, 삽입에 대한 솔루션을 구축. 원하는 경우 범위 또는 필요한 농도 버퍼에 FSL 구조를 (선호 lipids 또는 높은 소수성 물질을 포함하지 않음) 희석.
참고 :
- FSL 구조는 일반적으로 지질이 포함된 미디어의 세포에 삽입되지만 일반적으로 많이 50X 높은 FSL 작업 농도로 PBS 또는 다른 지질 무료 미디어 경우보다 필요합니다.
- 작동 범위 dilutions는 응용 프로그램의 검출 방법 감도, FSL 구조의 유형과 필요한 변경의 정도에 따라 달라집니다. 일반적으로 희석의 범위는 10-500 탄수화물 FSL 구조를위한 희석제의 ML 당 FSL의 μg과 100-100 등 fluorophores 및 비오틴과 같은 다른 FSL 구조에 대한 μg / ML 사이 여야합니다.
- 여러 FSL 구조를 포함하는 삽입 diluents을 준비하는 경우, 단순히 자신의 정상 작동 농도에서 같은 희석제 함께 구조를 추가합니다. 한 구조가 다른보다 훨씬 높은 농도의 경우, 농도의 일부 조정 (증가)이 낮은 구성에 필요한 수 있습니다. 또는 구조가 낮은 다음, 가장 높은 농도가 처음 건설과 선호, 순차적으로 추가할 수 있습니다.
- 1000 μg / ML 위 FSL 구조의 농도는 세포 막에 지방질의 상당 금액을 소개 수 있으며, 세포의 모양을 변경하거나 용해에 더 취약해질 수 있습니다.
- FSL 구조 작업 솔루션은 2-8 ° C에서 저장하고 몇 일 이내에 사용해야합니다.
- FSL 구조는 물에 희석 수 있지만 안정성을 감소하고 시간 이내에 사용해야합니다. 패키지 삽입 reconstitution의 희석제로 물을 지정하면 유리병에있는 제품도 소금을 (같은 패키지 삽입에 지정)가 포함됩니다.
2. 세포막에 FSL 건설 (들)의 삽입
- 우선 원심 분리하여 언바운드 lipids의 FSL 수정 무료로 세포를 씻어하고 씻어 솔루션으로 PBS 또는 지질 무료 셀 미디어를 사용합니다.
- 전지 팩 또는 희석제 100 μL에 일시 중지합니다.
- 동시적으로 양성이지만 관련 FSL 구축과 수정을 모두 수정되지 않은 세포 (PBS보다는 FSL 솔루션 incubated) 및 / 또는 세포해야 컨트롤이 준비합니다.
- 세포에 FSL 솔루션 (1 개 이상의 FSL 구조를 포함)의 적절한 희석 100 μL를 추가하고 37 1~2시간에 대한 품어 ° C. 유사한 결과가 25에서 6 시간 배양하여 얻을 수있는 4 ° C 또는 야간 (18 시간) ° C - 무거운 셀 suspensions를 사용하는 경우 혼합이 몇 시간마다을 권장합니다.
- 어떤 무료 FSL 구조를 제거하고 적절한 정지를 준비하는 PBS 또는 미디어 (선택 사항)을 두 번 씻으십시오.
참고 :
- 세포를 중지하는 데 사용 희석제는 세포 배양 매체, PBS, 세포 스토리지 솔루션 등 수 있지만 선호 lipids (예 : 소태아 혈청)이나 세제 (예 : 트윈)하지 않고 있습니다.
- 다른 볼륨 (100 μL 이상) 비율 (1:1 셀 / FSL 솔루션보다) 또는 시간과 온도의 배양 조건이 재현할 결과를 얻을하는 데 사용되는 동일한 비율, 집중력, 볼륨을 제공 사용할 수 있습니다.
3. 처리 및 시각화
- FSL 수정 프로세스가 완료되면 kodecytes는 지질 무료로 미디어에 4-8 ° C에서 보관하거나 사용할 수 있습니다.
- Kodecytes 및 kodevirions는 일반적으로 수정되지 않은 세포 / virions 같은 동작하고 handl 수 있습니다에드와 정상적인 테스트 시스템 (현미경, 혈청학, 유동세포계측법 등)의 조회. 그들은 일반적으로 용매 / 세제 / 세포막의 지질 구조를 elute 수 lipids의 소지를 없애기 위해를 제외하고 특별한 요구 사항이 없습니다.
참고 :
- 세포의 생활에 지질 무료로 미디어에 저장되어있는 경우에는 구조와 같은 붉은 세포와 같은 비활성 세포의 막에 남아 있습니다. 적극적인 세포막과 세포의 구조는 세포막 활동에 의존 속도, internalized 및 대사 것입니다.
- 죽은 세포는 일반적으로 FSL 구조의 높은 수준이 포함됩니다, 이것은 가능한 세포에서 nonviable 세포를 구분하는 데 사용할 수 있습니다.
- kodecytes는 지방질에서 (또는 생체내에 사용) 저장되어있다면 미디어 / 등 혈청 / 혈장 구성으로 환경이 서서히 온도 및 지질 농도 / 조성에 따라, 시간 또는 일 동안 멤브레인에서 elute 것입 포함.
4. 대표 결과 :
- 다음과 같은 대표적인 결과에 따라 (표 1) 사용하는 건축, 그 삽입 농도 및 탐지 시스템 (S)의 상대 감도 및 특이성. 일반적으로 모든 FSL 구조 1 시간 후 세포에 삽입합니다하지만 최적의 조건은 각 상황에 설립해야합니다.
- FSL 구조는 라이브 세포의 다양한 3-9,11,14의 외부 레이블을 사용할 수 있습니다. 그림에 표시된 예제의 다른 단계에서 2 배아는 (그들은 연약한 세포 있으므로)이 사용되었다지만, 다른 세포 (그림 3) 또는 싸여 virions (그림 4)도 표시됩니다. FSL - 비오틴 및 기타 FSL 구성 요소들이 존재 (그림 5)를 보이기 위해 보조 탐지 시스템 (일반적으로 아비딘 / 항체 / lectins)의 사용을 요구하는 반면 FSL - 플루오레신는 표면의 직접 라벨 (그림 2-4)를 허용 .
- 인간이나 동물의 혈액 특이성 그룹 마커 붉은 세포가 4-9 (그림 6)를 포함한 세포에 부착하실 수 있습니다. FSL의 금액 kodecyte에서 구성으로 제어하고 4-6 재현할이며, 항체 quantitation에 대한 kodecytes는 (표 2 및 그림 6) 만들 수 있습니다. 세포의 실제 소스는 중요하지 않다, 그들은 어떤 종류가, 또는 항체의 원본과 같은 원산지, 따라서 유일한 호환되지 않는 항원에 확보하면 FSL 7,8 (그림 6)에 의해 도입되는 것입니다 수 있습니다.
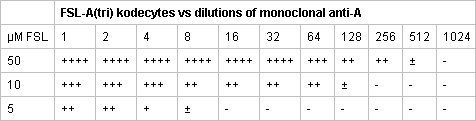
표 2. 세 가지 FSL - A (트라이) 레드 셀 kodecytes 대표 serological 반응 단클론 항 - A의 dilutions에 대한 테스트. 그룹 O 붉은 세포의 동일한 볼륨 incubated FSL - A (트라이)의 50 μm의 솔루션은 단클론 항 - A의 1:512 희석에 의해 감지 수있는 강력한 항원 양성 세포를 생산. 5 - 10 배 낮은 FSL - A가 (트라이) 솔루션은 적은 혈액형 항원 표현과 kodecytes을 생산.

그림 1. FSL 구조 개요. 꽃 FSL 구성 요소와 마찬가지로 세 가지 주요 구성 요소로 구성되어 있습니다. FSL 구조의 경우 기능적 머리 (F)는 서로 다른 생물 학적 기능 그룹의 다양한, 멀리 멤브레인에서 F의 간격을 유도 물 dispersibility를 개선하고 혈청 반응하도록 설계 스페이서 (S), 수 diacyl 지질 허용하면서 구조가 저절로 표면에 통합합니다. (I) 혈액형 GB 3 (또는 P K)와 FSL - GB3는 에피토프의 Galα4Galβ4Glcβ을 trisaccharide. (II) FSL - A (트라이) 혈액형 trisaccharide 에피토프 GalNAcα3 (Fucα2) Galβ와 함께. (III) FSL - 플루오레신. (IV) 단일 비오틴의 F의 잔기와 FSL - 비오틴. 구조 IV의 공백이 carboxymethylglycine - adipate 기반하는 동안 I - III의 구조의 기능 그룹 dioleoylphosphatidylethanolamine의 활성화 adipate 유도체 (마약)에 복합 있습니다.
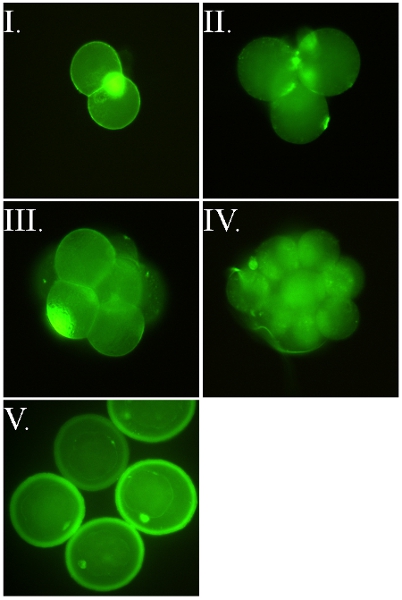
그림 2. FSL - 플루오레신는 murine 배아를 표시. 모든 이미지는 조나 pellucida (ZP)는 (예 : FSL 구조 안에 배아를 레이블 ZP 통과) 손상되었을 때 라벨이 붙지만 사는 배아들 중입니다. 이미지 I - IV는 FSL - 플루오레신과 산성 tyrodes 포스트 라벨 자신의 ZP에서 발표 ZP없이 배아들 중입니다. 동일한 얼룩에 관계없이 배아는 FSL은 ZP 그대로 또는 ZP 무료로 수정된 여부에 발생합니다. 배아는 직접이 2 시간 37 혈청 무료 세포 배양 매체 ° C의 방법으로, FSL - 플루오레신으로 표시 씻은 후 형광 현미경 아래에서 볼 수 있습니다. (I) ZP 무료로 두 개의 세포 murine 배아는 또한 고전적인 강렬한 북극 신체 얼룩을 보여주는. (II - III) ZP 무료 안경 셀 및 8 셀 murine 배아, 아웃하는 세포의 모두보기 그림자 염색법초점 IDE 현미경의 비행기. (IV) ZP 무료 16 세포 murine 배아. 배아와 조나 모두 표시 아르 (V) ZP 그대로 murine blastocyst의 배아 (D4 - D5).

그림 3. FSL - 플루오레신 및 zebrafish 14. (I) Microangiography는 52 HPF 시간 (게시물 수정) zebrafish의 유충에 직접 FSL - 플루오레신과 순환에 주입. zebrafish의 vasculature이 물들어있다. (II) FSL - 플루오레신 불일치 Zebrafish의 신장 조직 세포 (ZK kodecytes)가 예 생체내을 만든 52 HPF받는 Zebrafish의 순환에 마이크로 주입. ZK의 kodecytes의 생체내 관측에의 이미지로 2 시간 이후 주사에게되었다 시간 경과 현미경과 형광 아래 vasculature. 그림은 큰 천천히 이동하거나 고정되어 셀 (오렌지 화살표로 표시)와 빠르게 움직이는 세포 (- 녹색 화살표로 표시 움직임으로 인해 흐릿한 이미지)와 하나의 비디오 프레임입니다. 라벨은 행동과 biodistribution ZK의 kodecytes의 생체내 관찰에서 실시간으로 허용합니다. (III) FSL - 플루오레신의 사정 이해는 최대 5 일 동안 미디어를 포함하는 FSL - 플루오레신에 zebrafish 배아를 immersing로 달성했습니다. 워싱이 더 FSL 구조를 (최소한 6시간이 필요하지만, 몇 일 수있다)가 포함된없는 미디어로 배아를 전송하여 달성되었다. 인접 형광 이미지 (IIIb)에 해당하는 FSL - 플루오레신 취급 zebrafish의 (IIIa) 명시야 현미경. fluoresence은 우선적으로 창자에 위치했다. 아무 얼룩은 치료 제어 배아 (아이바 및 IVb)에서 관찰되지 않았습니다.

virions 10 VSV 및 H1N1의 그림 4. FSL - 플루오레신 라벨. (I) 소낭성의 구염 바이러스 (VSV)가 직접 37 10 μg / ML 2 H에 대한 FSL - 플루오레신으로 표시했습니다 ° C, 4 % paraformaldehyde 후 유동세포계측법로 고정하여 따라갔다. VSV kodevirion 게시물 FSL 라벨링에 대한 정화가 필요 없었습니다. (II) 인간의 A / 푸에르 Rico/8/1934 (H1N1)에 감염된 돼지 고환 세포의 유동세포계측법는 FSL - 플루오레신을 사용하여 레이블 kodevirions. 감염되지 않은 세포가 검은 라인으로 볼 수있는 반면 형광 셀 (빨간색 선)의 ST 전지 결과 H1N1 kodevirion의 융합.
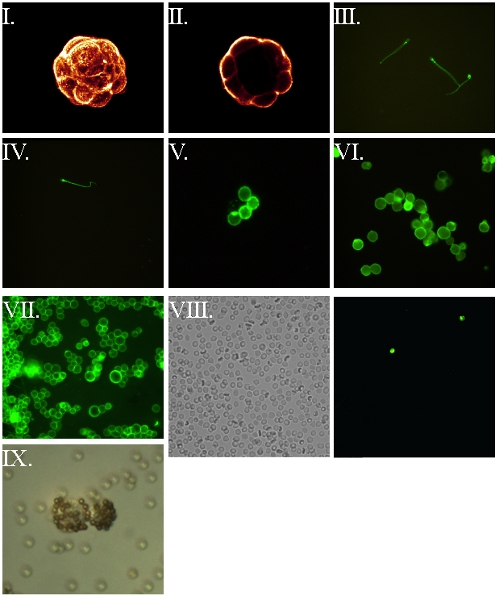
그림 5. 표시된 아비딘 7,8 통해 FSL - 비오틴 표시 전지 및 그 이후의 시각화. 모든 세포 먼저, 37 1 H ° C에 대한 FSL - 비오틴으로 표시 다음 아비딘 표시 형광단, 형광 현미경을위한 마운트 세탁 및 젖은 채 반응 세탁했다. (I)는 murine 배아 blastocyst의 공촛점 이미지를 편집한 것들이야. 위의 이미지에서 배 (胚) (II) 중앙 공촛점 조각. (III) 운동성이있는 인간 마리의 정자 수야 라이브 - 흐리게 그들의 운동의 결과로 발생합니다. (IV) 고정 (4 % paraformaldehyde 포스트 삽입) 인간 마리의 정자 수야. (V) 인간 적혈구. (VI) 고정 (4 % paraformaldehyde의 사전 삽입) RL95 자궁 내막 암종 인간. (VII) 떼어낸 RL95 자궁 내막 암종 인간의 세포 라인. (VIII) 비오틴 RBC는 (VIIIb)는 현장에있는 두 kodecytes을 식별, 형광 아래의 조회와 동일한 입력란이있는 동안 2 시간 (VIIIa) 가벼운 현미경 아래에서 볼 수있는 필드를 나타내는와 kodecytes의 정맥 주입을 게시 찍은 혈액 샘플에서 관찰 kodecytes - -보기. 레이블이 지정되지 않은 세포에 kodecytes의 비율을 계산하는 것은 생존의 지표로 사용할 수 있습니다. (IX) 인간 자궁 내막 비오틴의 kodecytes가 avidinylated 구슬에 바인딩하여 시각 살고 있습니다.

그림 6. serologic 프로파일에 대한 혈액 그룹 마커를 추가 FSL - 탄수화물. (I) 인간의 붉은 세포 Galili의 kodecytes는 FSL - Galili 일련의 농도 (500 μg / ML)로 만든 인간 혈청 dilutions에 대해 테스트되었습니다. 인간의 붉은 세포가 자연스럽게 xenoantigen Galili의 항원과 함께 발생하지 않습니다. 이러한 kodecytes는 혈청에서 항체의 양적 수준을 사용할 수 있습니다. 이 예제에서는 기증자는 1시 32분의 방지 Galili titre을 가지고 결정했다. (II) 항체를 감지하는 FSL의 감소 수준 ( "항원 titres"), 최적의 항원 수준 kodecytes를 작성하여 (르이 예제의) 확인할 수 있습니다. 세포는 항체 수준이 특정 titre을 초과하면 긍정적인 결과만을 제공하기 위해 만들 수 있습니다. 긍정적인 결과를 제공하는 데 필요한 FSL의 항원의 수준은 항체의 품질과 레벨이 감지되는에 따라 달라집니다. 탄수화물의 항원에 대한, 100 μg / ML의 FSL 솔루션은 일반적으로 강한 긍정적인 반응하게됩니다. (III) 인간 집단 O 붉은 세포는 개미의 특정 수준을 가지고 수정된igen는 (kodecytes 표준화), 그리고 정확하고 reproducibly 인간 혈청에 반대를 quantitate하는 데 사용됩니다. 이 예제에서는 안티 - A 그룹 O 혈청 검사에서 titre가 1시 32분이고 kodecytes이 기증자 자신의 붉은 세포에서 준비되었다. (IV) 혈액형은 A와 동시에 하나의 그룹 O 붉은 세포 샘플에 삽입 B 항원이 약한 B 약한 kodecytes를 생성하는 데 사용됩니다. 이러한 kodecytes은 ABO 품질 관리 목적으로 사용할 수 있습니다. 이 결과는 백신 및 안티 - B 시약에 대한 테스트 및 약한 반응을 예상 제공하는 특별히 공식화 약한 B 약한 kodecyte의 분석을 보여줍니다.
토론
FSL 구조와 수정 세포 virions은 매우 단순하고 강력한 기법 3-11입니다. 설명하고 FSL은 수정되지 않은 세포에서 수정된 세포와 virions을 구축 구분하기 위해, 그들은 각각 kodecytes와 kodevirions 60-10을 칭했다 있지만, 도입 기능 그룹들은 막에 존재하는 표시 수있는 경우. kodecytes가 FSL 구조의 서로 다른 농도로 만든 경우, 그들은, 예를 들어 15 μg / ML kodecytes, 또는 하나 이상의 FSL은 다음 사용하는 경우 결합된 용어 그들을 만드는 데 사용 FSL 구축 솔루션의 농도에 의해 참조될 수 A + 비오틴 kodecytes 7,8 예를 들어. 다른 세포 설명에있는 세포 유형을 포함하여 비교하는 경우 권장합니다, 예를 들어 붉은 세포 비오틴의 kodecytes이나 자궁 내막 비오틴의 kodecytes 7,8.
삽입의 과정 (서로 다른 속도로 불구하고) 매우 강력하고 삽입 있지만 것은 4 넓은 온도 범위에서 발생합니다 - 37 ° C와 시간 분 이내에 연락 시간, 온도, FSL 농도 (중 재현할 삽입 엄격한 통제를 얻기 위해 ) 희석액 제제를 포함하고, 낮은 정도의 세포 농도가 필요합니다. 지금까지, 모든 FSL 구조가 동일한 기술 4-11하여 세포를 수정하는 데 사용할 수 있지만 그것은 특정 조건이 세포 / 수정할 수로 virions의 작업 흐름 및 / 또는 최적의 처리 요구 사항에 더 유리한 것으로 예상된다 . 원하는 효과를 얻을 수있는 정확한 FSL 농도는 사용자 4에 의해 결정되어야합니다. 결과 FSL 수정된 세포를 만들 / virions는 일반적으로 생물 학적 또는 분석 시스템 4-11에서 수정되지 않은 셀 / virion 같은 방식으로 사용할 수 있습니다. FSL 구조 때 지질 솔루션 7,8 접촉 천천히 수정 표면에서 elute, 아니면 적극적으로 세포 11 시까지 소비로, 이러한 문제는 시간의 기간 동안 얻은 신호 또는 활동의 수준과 관련하여 고려되어야합니다. 삽입은 정착액은 지질 - eluting 용제를 포함하지 않고 기능 그룹 정착액과 호환되는 이후 Kodecytes (예 : 글루 타 알데히드 / 포르말린) 해결할 수 있습니다. 또는 고정 세포 FSL 구성 요소와 수정할 수 있습니다.
셀 및 virion 표면의 수정 이외에 FSL 구조는 순환 세포의 생체내 수정 7 일으키는 실험 동물의 순환에 직접 주입 수 있으며 바이러스 12, 독소, 12 항체 7 억제합니다. FLS 구조는 liposomes을 장식하는 데 사용되었습니다 그들이 고정 종이 표면 13로 인쇄할 수 있으며, 다음 진단 assays에서 사용할 수 있습니다.
쉽게 FSL 구조의 증가 범위 살 세포를 수정하는 기능은 유용한 연구와 세포 표면 생물학 연구를위한 개발 도구로 증명한다.
공개
데보라 A. 공백과 스티븐 M. 헨리는 KODE 생명 공학의 직원과 주주 아르 KODE 기술의 특허 소유자 제한. 댄 베쓰이 비디오 문서의 생산을 후원했다 시그마 - 알드리치의 직원입니다.
감사의 말
저자는 비디오를 발표를위한 시그마 - 알드리치에서 댄 베스 감사합니다. 우리는 또한 돈 브랜치, Evgenii Cherny, 스콧 Chesla, 엘리자베스 Hadac, 아만다 해리슨, 데이 미언 힛코트, 애니카 Hult, 추안 - 칭 LAN, 수잔나 매킨토시, Sarvani Komarraju, 엘레나 Korchagina, 캐롤라인 올리버 마틴 올슨, 스티븐 파커, 이고르 Rodinov을 감사 그 결과 설계, FSL 구조의 합성 및 생물 학적 활동을 결정하기 위해 공헌 알렉산더 Tuzikov하고, 엘리너 윌리엄스.
자료

1. 상용 FSL의 구조는이 문서에서 설명하는 표.
참고문헌
- Waehler, R., Russell, S. J., Curiel, D. T. Engineering targeted viral vectors for gene therapy. Nat. Rev. Genet. 8, 573-587 (2007).
- Strable, E., Finn, M. G. Chemical modification of viruses and virus-like particles. Curr. Top. Microbiol. Immunol. 327, 1-21 (2009).
- Henry, S., Bovin, N. The development of synthetic peptidolipids, glycolipids and other lipid-linked structures to create designer red cells. Transfusion. 48, Suppl 2S. 194A-194A (2008).
- Frame, T., Carroll, T., Korchagina, E., Bovin, N., Henry, S. Synthetic glycolipid modification of red blood cell membranes. Transfusion. 47, 876-882 (2007).
- Hult, A. K., Frame, T., Henry, S., Olsson, M. L. Flow cytometry evaluation of red blood cells transformed with variable amounts of synthetic A and B glycolipids. Vox Sang. 95, Suppl 1. 180-180 (2008).
- Henry, S. Modification of red blood cells for laboratory quality control use. Curr. Opin. Hematol. 16, 467-472 (2009).
- Oliver, C., Blake, D., Henry, S. In vivo neutralization of anti-A and successful transfusion of A antigen incompatible red cells in an animal model. Transfusion. , Forthcoming (2011).
- Oliver, C., Blake, D., Henry, S. Modeling transfusion reactions and predicting in vivo cell survival with kodecytes. Transfusion. , Forthcoming (2011).
- Heathcote, D., Carroll, T., Wang, J. J., Flower, R., Rodionov, I., Tuzikov, A., Bovin, N., Henry, S. Novel antibody screening cells, MUT+Mur kodecytes, created by attaching peptides onto erythrocytes. Transfusion. 50, 635-641 (2010).
- Hadac, E. M., Federspiel, M. J., Chernyy, E., Tuzikovb, A., Korchagina, E., Bovin, N. V., Russell, S. J., Henry, S. M. Fluorescein and radiolabeled Function-Spacer-Lipid constructs allow for simple in vitro and in vivo bioimaging of enveloped virions. J Virol Meth. 10, Forthcoming (2011).
- Blake, D., Lan, A., Love, D., Bovin, N., Henry, S. Fluorophore-kodecytes - fluorescent function-spacer-lipid (FSL) modified cells for in vitro and in vivo analyses. FEBS J.. 277, Suppl 1. 199-199 (2010).
- Harrison, A. L., Olsson, M. L., Brad Jones, R., Ramkumar, S., Sakac, D., Binnington, B., Henry, S., Lingwood, C. A., Branch, D. R. A synthetic globotriaosylceramide analogue inhibits HIV-1 infection in vitro by two mechanisms. Glycobiology. 27, 515-524 (2010).
- Barr, K., Diegel, O., Parker, S., Bovin, N., Henry, S. Function-Spacer-Lipid (FSL) constructs enable inkjet printing of blood group antigens. FEBS J. 277, Suppl 1. 235-235 (2010).
- Lan, C. -C. Modeling inflammatory bowel disease [dissertation]. , University of Auckland. Auckland. (1988).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유