JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
RNAi - 중재 유전자 최저 및
요약
이 프로토콜에서 우리는 함께 RNAi - 중재 유전자 입을를 결합 생체내에서 이뇨 분석은 모기 유체 배설에 있습니다.
초록
이 비디오 프로토콜은 곤충에서 특정 유전자를 분해하고 배설 률을 측정하는 소설 bioassay를 수행하기위한 효과적인 기법을 보여줍니다. 이 방법은 곤충의 이뇨 과정의 이해를 얻는 데 사용하며 단일 혈액 식사에서 액체의 엄청난 양의 걸릴 수있는 혈액 먹이를 arthropods의 이뇨의 연구에 특히 유용합니다.
생체내의 이뇨 분석에서와 결합된 이러한 RNAi - 중재 유전자 최저는 Aedes aegypti 모기 이뇨 1 aquaporin 유전자의 RNAi-매개 최저의 효과를 연구하기 위해 한센병 연구소에 의해 개발되었다.
프로토콜은 두 부분의 설정은 다음과 같습니다 첫 번째 데모는 간단한 모기 분사 장치를 구성하는 방법과 RNAi - 중재 유전자 최저에 대한 모기의 흉부에 dsRNA를 준비하고 주입하는 방법을 보여줍니다. 두 번째 데모를 결정하는 방법을 보여줍니다생체내의 bioassay에를 사용하여 모기의 배설 속도.
프로토콜
부 전 - 성인 Aedes aegypti 모기에 RNAi - 중재 유전자 최저. 실험 개요는 그림 1을 참조하십시오.
1. dsRNA 합성
- 관심과 제어 dsRNAs의 유전자에 대한 구체적인 dsRNAs을 합성. 주 : 우리는 3 '특정 cDNA 2 월말과 5 부착된 T7 뇌관 시퀀스로'에서 끝 (5'-TAA 전술 GAC TCA CTA 위치한 300-500 기본 쌍의 범위에서 PCR 단편을 위해 개발 primers를 추천 TAG GG-3 '). 파편의 특이 사항은 BLASTN 분석 3 확인하여야한다.
- dsRNA를 합성하기위한 전사 반응을 T7 RNA 중합 효소를 활용 Ambion Megascript T7 높은 항복 전사 키트 (Ambion, 시약 표)를 사용합니다. 참고 : 유사한 시약 및 키트 다른 곳에서 사용할 수 있습니다.
- dsRNA를 정화하려면 Megascript 키트와 지침에 따라 염화 리튬으로 침전.
- purificat 후이온, 멸균 물 속에서 dsRNA 펠릿를 해산. microinjection에 대한 적절한 점도를 보장하기 위해 dsRNA 농도 2 μg / μl를 초과해서는 안됩니다.
2. 사출 준비
- 간단한 마이크로 주입기는 튜브, 가위, 금속 바늘, 1 ML의 주사기, 그리고 한 ML 플라스틱 피펫 팁을 (그림 2 참조)을 사용하여 건설 수 있습니다. 튜브는 길이 ~ 40cm로 절단한다. 또한, 자동화된 마이크로 주입기는 그러한 Drummond Nanojet II 4로 사용될 수 있습니다.
- 이 ML 눈금 표시에서 주사기의 팁 (바늘 허브)를 잘라 플런저에서 고무 플런저 헤드를 제거합니다.
- 고무 플런저 머리와 장소 다시 바늘 허브의 고무 플런저 머리에 금속 바늘을 사용하여 펀치 구멍.
- 튜브의 한쪽 끝을에 바늘 허브를 놓고 마우스 피스 (또는 10 ML 싸이로 사용됩니다 다른 쪽 끝을에서 1 ML 플라스틱 피펫 팁을 배치ringe)는 주사에 필요한 공기 압력을 생성하는 데 사용할 수 있습니다.
- 고무 플런저 머리에있는 구멍에 유리 모세관 바늘을 놓고 너비는 액체를 통해 흐를만큼 큰 수 있도록 바늘의 팁을 끊다. 참고 : 바늘 끝의 최적 크기는 경험적으로 결정되어야한다 - 바늘 너비가 너무 작은 경우 바늘의 너비 이것이 외상과 높은 모기 사망률집니다 너무 큰 경우, 그것은 침투하기가 불가능합니다 모기 외골격.
- 준비된 dsRNA 샘플에서 잠수함 주입 바늘과 마우스 피스 (또는 주사기)로 액체를 빨아하여 주사 바늘로 액체 샘플을 그립니다. 참고 :이 단계는 (아래) 생체내의 이뇨 분석 프로토콜에서 사용되는 PBS 버퍼를 비롯하여 모기에 주입되는 모든 액체 시약에 대해 동일합니다.
3. 모기를 수집하고 마취
- Collec수거 유리병에 배터리 구동 흡인기로 하지마 모기. 수거 유리병 이상의 모자를 놓고 모기를 마취하기 위해 깨끗한 CO 2 패드에 병을 놓습니다. 참고 : 또한 모기가 얼음위에 anesthetized 될 수 있습니다.
4. 모기 분사
- 수거 유리병을 열고 직접 CO 2 패드에 모기를 넣고 모기가 anesthetized 때까지 기다립니다.
- 모든 남성 폐기하십시오.
- 주사를 더욱 쉽게 액세스할 수 있도록 측면에 모기를 줄입니다.
- 부상을 피하기 위해 다리 또는 날개에 의한 모기를 잡아. 당신은 또한 훌륭한 화필이나 모기를 조작하기 위해 깃털을 사용할 수 있습니다.
- 첫 모기를 주입하기 위해 준비가되면 부드럽게 포셉와 흉부의 한쪽을 지원하며 흉부 반대편 (그림 2)로 바늘의 끝부분을 삽입합니다. 그것은 표피의 얇은 부분에 주입하고 바늘을 밀어 피하는 것이 좋습니다흉부에 깊이를 O.
- 바늘이 곳에되면 모기에 액체를 폭파. 원하는 금액은 바늘의 액체 초승달 모양을 모니터에 따라 결정됩니다. 특정 볼륨에 필요한 mm의 갯수는 유리 모세관 바늘 (πr 2 시인데)의 실린더 부피를 계산하여 결정하실 수 있습니다. 일반적으로 주사에 사용되는 dsRNA의 효과적인 금액은 1 μg이다.
- 액체는 모기에 주입되면 바늘을 조심스럽게를 철회. 흉부의 외부에 대형 액체 비말 형태 않으면 모기는 폐기되어야합니다. 그리곤, 다음날 모기와 함께이 과정을 반복합니다.
5. 모기 복구 및 저장
- 주입 후 저장 용기에 모기를 놓습니다. 예를 들어, 한 파인트 왁스는 메쉬가 마분지 뚜껑으로 안전 커버와 골판지 컵 (수프 컵) 정렬했습니다. 뚜껑이 노출되는 덮고 메쉬에 맞을 부분이 있습니다. 일단 모든 MOsquitoes가 컨테이너에 배치되며, 인큐베이션위한 환경 제어 챔버에 컨테이너를 놓고 같은 메쉬 커버의 상단에 배치 20 % 자당 젖었 면화 공 같은 음식 소스와 모기를 제공하고 있습니다. 생체내의 이뇨 분석에를 수행하기 전에, 각 모기의 수화 상태를 표준화하기 위해 12 시간 동안 물 소스의 dsRNA-주입 모기를 빼앗다.
- dsRNA - 중재 유전자 최저의 효율이 변수가 될 수 있습니다. 유전자 입을은 주입 후 1 하루를 시작할 수 있으며 주사 후 4 육일까지 지속될 수 있습니다. 최대 유전자 최저를 달성하기위한 최적의 시간은 사용하는 모든 유전자에 대해 경험적으로 결정되어야한다. 우리가 진행하기 전에 일반적으로, 우리는 dsRNA 주입 후 삼일 정도 기다리십시오.
파트 II - 생체내의 이뇨 분석에서는 Aedes aegypti 모기 성인에서
참고 :이 프로토콜은 작성자에 의해 개발되었으며황열병의 모기의 aquaporin 단백질의 RNAi - 중재 최저 사용은 aegypti 1 Aedes. 개별 모기 사이의 다양성을 방지하려면 모기는 그룹에서 분석되어야한다. 기술적인 이유로 치료를 당 5 모기 그룹을 권장합니다 - 모기가 주사 후에 소변 나물을 시작하기 전에 첫 번째 체중 측정을 수행하는 시간을 제한 금액이 있습니다.
6. 모기를 수집하고 마취
- 모기를 수집하기 전에 분석 정밀 밸런스를 사용하는 모자와 빈 컬렉션 유리병의 무게를 기록합니다. 이 유리병은 모든 후속 측정에 사용됩니다.
- 흡인기로 무게 수집 유리병에 5 암컷 모기를 수집합니다. 수거 유리병 위에 뚜껑을 놓고하고 모기를 마취하는 데 몇 초 동안 CO 2 패드에 앉자.
7. 초기 무게 측정
- T를 타고정밀 밸런스에 모자와 모기를 포함하는 컬렉션 유리병을 배치하여 5 모기 그는 초기 체중 측정.
- 모기의 무게와 뚜껑으로 수집 병을 복용하고 뚜껑이있는 빈 컬렉션 유리병의 무게를 빼는 방법으로 다섯 모기 그룹의 무게를 계산합니다.
- 수거 유리병을 열고 모기의 무게를 기록 후 직접 CO 2 패드에 모기를 놓습니다. 모기가 무게를 측정하는 동안 깨어하기 시작한다면, 그것을 열고 패드에 모기를 삽입하기 전에 몇 초 동안 CO 2 패드에 유리병을 설정합니다.
8. 사출 준비
- RNAi - 중재 유전자 최저 프로토콜에 주어진 지시에 따라 마이크로 주입기를 설정합니다.
- 마이크로 분사기의 유리 모세관 바늘을 놓고 바늘의 팁을 끊다 때문에 너비가 liq 충분히 크다을 통해 흐를하는 UID.
- 잠수함 PBS 버퍼에 바늘과 주사 바늘로 버퍼를 그려,이 프로토콜에 사용할 원하는 금액은 각 모기에 대한 PBS의 1.25 μl입니다. 참고 :이 금액은 여성 모기 오에 의해 함락되는 혈장의 평균 금액을 모방한 것이었 지요.
9. 모기 분사
- 마이크로 주입기로 쉽게 접근할 수 있도록 모기를 줄입니다.
- 바늘이 곳에되면 모기에 PBS 버퍼를 날려요.
- 액체는 모기에 주입되면, 비말은 흉부의 외부에 형성하고 있습니다. 이러한 비말은 신중하게 다음 단계 전에 제거되어야한다.
- 다음은 모기와 함께 사출 과정을 반복합니다. 경험을 바탕으로 모기 생존율은 주사 후 거의 100 %가 될 것입니다.
10. 무게 모기
- 주사 후에는 부드럽게 수집 유리병에 모기 배치그리고 모자. 정밀 밸런스에 모자와 모기를 포함하는 컬렉션 유리병을 배치하여 5 모기의 첫 번째 체중 측정을 가져가라.
- 뚜껑과 모기와 수집 유리병의 무게를 복용하여 5 모기 그룹의 무게를 계산하고 뚜껑이있는 빈 컬렉션 유리병의 무게를 뺍니다. 참고 : 모기가 CO 2 마취 패드에서 제거 후 2 분 이내에 소변을 만들어내는 시작할 것이다, 그래서 그들이 나물을 시작하기 전에 체중 측정을하는 것이 중요합니다.
- 그들은 소변을 만들어내는 시작됩니다 작은 용기에 모기를 놓습니다.
11. 두 번째 이후 무게 측정
참고 : 모기의 무게 측정이 30 분 간격으로 복용해야하지만, 이것은 배설 속도에 따라 짧은 이상 간격을 조정할 수 있습니다.
- 30 분 후에, grou를 수집뚜껑과 같은 컬렉션 유리병에 흡인기 5 모기 P. 정밀 밸런스에 모자와 모기를 포함하는 컬렉션 유리병을 배치하여 모기의 다음 체중 측정을 가져가라.
- 측정 후, 다음 30 분 동안 동일한 지주 용기에 모기를 놓습니다.
- 시간을 원하는 금액에 대해이 과정을 반복합니다.
12. 결정 모기 배설 속도
- 5 모기의 그룹으로 주입되었다 액체의 총 금액이 즉시 주사 후 체중에서 모기의 초기 무게를 빼는 방법으로 계산 할 수 있습니다.
- 특정 시점에서 모기의 그룹에 의해 배설되었다 소변의 양은 특정 시점에서 모기의 무게에서 모기의 초기 무게를 빼는 방법으로 계산 할 수 있습니다.
- 특정 시점에서 배설 율은 divi하여 계산할 수액체 주입 (표 1)의 총 금액하여이 시점에서 배설 소변 딩 금액입니다.
13. 대표 결과
유전자 최저 RNAi - 중재 및 생체내의 이뇨 분석에서이 Aedes aegypti 모기 이뇨의 aquaporins의 효과를 연구하기 위해 한센 실험실에서 사용되었습니다. Aedes aegypti Malpighian tubules로 표현되는 세 aquaporins는 모기 1 제어할 비해 배설 속도에 상당한 효과를 무너 뜨 렸어되었다. 그림 4는 이뇨 분석은 Aedes aegypti 및 Culex quinquefasciatus 사이에 배설 률을 비교하는 데 사용되었습니다 실험의 대표적인 결과를 보여줍니다 서로 다른 온도에서.
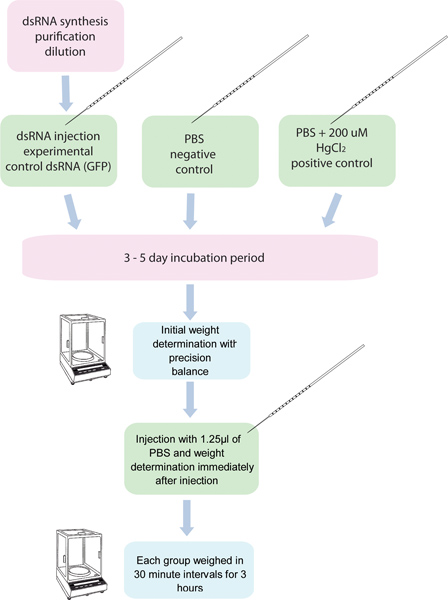
1 그림. 10 모기 EA의 RNAi / 이뇨 분석의 흐름도 5. 그룹채널은 특정 유전자에 대한 dsRNA을 주사하고 십 모기 오천 그룹은 통제 dsRNA로 주입된다. PBS 200 μm의 HgCl 2 주입 모기의 또 다른 그룹은 긍정적인 컨트롤로 사용됩니다. 이 모기는 주입하기 전에, 3 시간 삼십분 간격의 주입 후에 무게가있다.
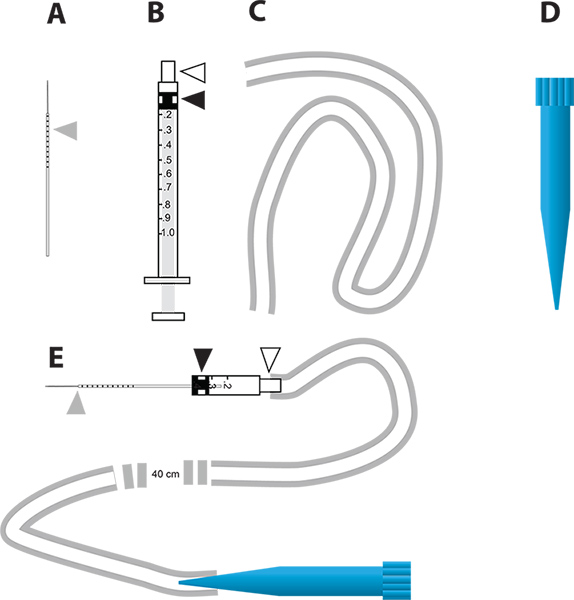
그림 2. RNAi - 중재 유전자 최저 및 생체내의 이뇨 분석의 간단한 미세 주입 장치. A. 유리 모세관 바늘은 주사에 사용. 회색 삼각형은 모기에 액체 주입의 양을 표시하는 바늘에 그려진 mm 단위로 나타냅니다. B. 한 ML의 주사기는 마이크로 주입기을 만드는 데 사용. 흰색 삼각형 바늘 허브를 대표하고 검정색 삼각형은 주사기의 플런저에 연결된 고무 플런저 머리를 나타냅니다. C. 관은에 마우스 피스를 장착하는 데 사용주입기. microinjection 장치의 마우스 피스로 사용됩니다 D. 한 ML 일회용 피펫 팁 (파란색 팁). E. AD 부품을 통합 microinjection 장치. 큰 그림을 보려면 여기를 누르십시오 .
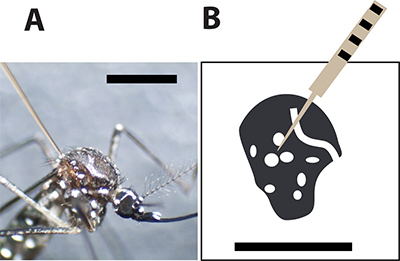
그림 3. 최적 모기 주입 사이트. A. 여성 Aedes aegypti 모기는 흉부에 큰 비늘 사이에 유리 모세관 바늘로 주입. 검은 막대는 크기 비교를위한 1mm를 나타냅니다. 암컷 모기 흉부의 그림 B.와 흰 반점은 모기 외골격의 하얀 비늘을 나타냅니다. 주사 바늘은 피어스 반점 사이에 모기가 주사하는 동안 사망률을 최소화해야합니다.
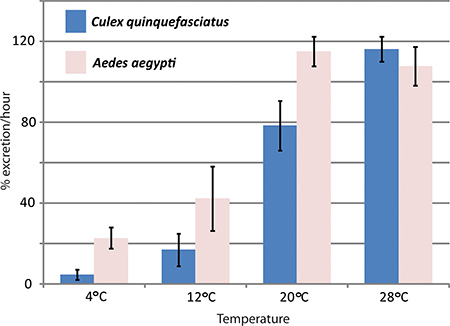
4 그림. 온도의 영향Culex quinquefasciatus 및 Aedes aegypti의 이뇨에 진짜야가. 이뇨 분석은 서로 다른 온도에서, 모기, Aedes aegypti 및 Culex quinquefasciatus의 두 종족으로 수행되었다. 주사 후 첫 시간 동안 배설 율은 퍼센트에 있습니다.
| 그룹 | 타라 (G) | 주입하지 (G) | 주입 후 (G) | 1 시간 게시물 주입 (G) | 평균 중량 (MG) | 양을 주입 (μl) | 금액 배설 (μl) | % 배설 |
| 일 | 7.5938 | 7.6057 | 7.6104 | 7.6096 | 2.38 | 0.94 | 0.16 | 17.0 |
| 2 | 7.8252 | 7.8349 | 7.8415 | 7.8403 | 1.94 | 1.32 | 0.24 | 18.2 |
| 3 | 7.8896 | 7.9026 | 7.9077 | 7.906 | 2.6 | 1.02 | 0.34 | 33.3 |
생체내의 이뇨 분석 결과 표 1. Aedes aegypti 4.에서 Aedes aegypti 모기 암컷으로 수행한 생체내의 이뇨 분석에서 ° C.의 원시 데이터
토론
사용되는 RNAi 프로토콜은 캘리 포니 아주 리버 사이드 6,7 대학에서 알렉산더 Raikhel의 연구실에서 개발 Garver 및 Dimopoulos 사에 의해 출판 프로토콜과 비슷했습니다. 이 비디오 프로토콜에 표시된 실험적 접근 방법은 생체내 환경에의 곤충 이뇨에 관련된 유전자를 연구하는 데 사용할 수 있습니다. 곤충, Malpighian의 tubules의 배설 기관은 이뇨를위한 '단순'모델 시스템으로...
공개
우리는 공개 할게 없다.
감사의 말
저자는이 프로토콜의 그녀 비판적 의견 빅토리아 카펜터 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 시약이나 장비의 명칭 | 회사 | 카탈로그 번호 | 댓글 |
| MEGAscript T7 고수익 키트 | Ambion 주식 회사 | AM1334 | |
| PBS 버퍼 | 시그마 - 올드 리치 | P4417 | |
| 플라스틱 튜브 | 지역 업체 | PVC | |
| 한 ML 플라스틱 피펫 팁 | VWR | 83007-376 | 블루 팁 |
| 한 ML의 주사기 | Becton, 디킨스와 회사 | 309,602 | |
| 가위 | 지역 업체 | ||
| 금속 바늘 | 캐롤라이나 체액 | 654,307 | 크기 5 |
| 패드 들아 | Genesee 과학 | 789,060 | |
| 배터리 구동 흡인기 W / 컬렉션 유리병 | UPMA 실험실 | IPMM 2000 | |
| 파인 팁 포셉 | 세계 정밀 계측기 | 14,095 | |
| 유리 모세관 바늘 | 세계 정밀 계측기 | 1B200-6 | |
| 스테레오 해부 현미경 | Leica 마이크로 시스템즈 | S6D | |
| 분석 정밀도의 균형 | Mettler 톨레도 | AB54S | |
| 자당 | 시그마 - 올드 리치 | 84,097 | |
| 1 파인트들이 줄지어 종이 컵 닦았단 | 지역 업체 | 제조 수프 컵 | |
| 메쉬 네트 | 지역 업체 | 플라스틱 플라이 거즈 |
참고문헌
- Drake, L. L., et al. The Aquaporin gene family of the yellow fever mosquito, Aedes aegypti. PloS one. 5, e15578 (2010).
- Shepard, A. R., Jacobson, N., Clark, A. F. Importance of quantitative PCR primer location for short interfering RNA efficacy determination. Analytical biochemistry. 344, 287-288 (2005).
- Altschul, S. F., et al. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. Nucleic acids research. 25, 3389-3402 (1997).
- Garver, L., Dimopoulos, G. Protocol for RNAi Assays in Adult Mosquitoes (A. gambiae). J. Vis. Exp. (5), e230 (2007).
- Clements, A. N. Volume 1 Development, Nutrition, and Reproduction. The Biology of Mosquitoes. 2, (1992).
- Hansen, I. A., Attardo, G. M., Park, J. H., Peng, Q., Raikhel, A. S. Target of rapamycin-mediated amino acid signaling in mosquito anautogeny. Proceedings of the National Academy of Sciences of the United States of America. 101, 10626-10631 (2004).
- Hansen, I. A., Attardo, G. M., Roy, S. G., Raikhel, A. S. Target of rapamycin-dependent activation of S6 kinase is a central step in the transduction of nutritional signals during egg development in a mosquito. The Journal of biological chemistry. 280, 20565-20572 (2005).
- Pannabecker, T. Physiology of the Malpighian Tubule. Annual review of entomology. 40, 493-510 (1995).
- Dow, J. New insights into Malpighian tubule function from functional genomics. Comp Biochem Phys A. 150, S135 (2008).
- Dow, J. A. T. Insights into the Malpighian tubule from functional genomics. Journal of Experimental Biology. 212, 435-445 (2009).
- Lawson, D., et al. VectorBase: a data resource for invertebrate vector genomics. Nucleic acids research. 37, 583-587 (2009).
- Beyenbach, K. W. Transport mechanisms of diuresis in Malpighian tubules of insects. J. Exp. Biol. 206 (Pt 21), 3845-3856 (2003).
- Coast, G. M. Continuous recording of excretory water loss from Musca domestica using a flow-through humidity meter: hormonal control of diuresis. Journal of insect physiology. 50, 455-468 (2004).
- Kersch, C. N., Pietrantonio, P. V. Mosquito Aedes aegypti (L.) leucokinin receptor is critical for in vivo fluid excretion post blood feeding. FEBS letters. 585, 3507-3512 (2011).
- Hays, A. R., Raikhel, A. S. A novel protein produced by the vitellogenic fat body and accumulated in mosquito oocytes. Development Genes and Evolution. 199, 114-121 (1990).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유