JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
행동 신경 과학에 대한 설치류 Stereotaxic 수술과 동물 복지 성과 향상
요약
설치류에 Stereotaxic 수술은 약물이나 동물을 행동 깨어 전기 자극과 녹음의 타겟 관리를위한 수 있습니다. 이 비디오 프레 젠 테이션에서 우리는이 오랜 절차를 성공적으로 향상되는 생존율 감소 수술 후 체중 감소 최근 절차 개선을 설명합니다.
초록
특정 뇌 영역에 캐뉼러의 주입을위한 Stereotaxic 수술은 많은 수십 년 동안 정신, 행동 동물 로컬 조작 신경 전달 물질과 신호 경로의 영향을 조사하기 위해 매우 성공적인 실험 기법을했습니다. 또한, electrophysiological 자극 및 기록 연구에 대한 전극의 stereotaxic 이식은 동물 행동에 neuroplasticity 및 뇌 네트워크의 현재 이해를 수단되었습니다. 설치류 동물 1-4, 대중 인식에 관한 동물 복지 문제와 엄격한 법률 (예 : 실험실 동물의 사용 5 2010 년 유럽 연합 지침)에 수술 기법을 최적화하는 방법에 대한 늘어나는 지식은 우리가 특히 존경, 이러한 수술 절차를 수정하라는 메시지가 나타납니다 수술하는 동안 산소 보완을위한 새로운 절차와 혈액 산소와 심장 박동 수준의 지속적인 모니터링을 구현뿐만 아니라수술 후 관리를위한 표준 프로토콜을 소개합니다. 우리의 관찰이 수정이 증가 생존 속도와 수술 후 동물의 일반적인 상태 (예 적은 체중 감소와보다 적극적인 동물)의 개선 결과 것으로 나타났습니다. 이 비디오 프레 젠 테이션은 우리의 몇 가지 수정에 특별한 관심과 stereotaxic 수술의 종류에 관련된 일반적인 절차를 보여줍니다. 우리는 쥐가 이러한 수술 절차를 설명되지만, 그것은 stereotaxic기구 6 특수 어댑터를 사용하여 마우스 또는 기타 작은 실험실 동물에서 수술이 유형을 수행할 수도 있습니다.
프로토콜
참고 : 살균 기술이 모든 절차를 수행하는 동안 고용해야합니다. 수술시 사용됩니다 모든 악기와 자료 (솜 밀고 면봉, 거즈 등) autoclaving 소독을해야합니다. 외과 마스크, 헤어 모자와 멸균 장갑을 착용하여야한다. 작업 공간과 stereotaxic기구는 깨끗이 청소하고, 70 % 에탄올 용액과 함께 소독해야합니다.
1. 사전 수술 절차
- stereotaxic기구와 필요한 모든 자료를 설정합니다. 미리 따뜻한 손난로.
- 의 지원에 정맥을 놓고 그것이 바로 있는지 확인하십시오.
- 가스 시스템을 켜십시오 - 주변 공기와 산소 (총 흐름 30~35% 산소한다)의 혼합.
- 쥐 무게와 마취를 관리할 수 있습니다. 우리는 subcutaneously 주입 케타민을 (37.5 밀리그램 / kg)과 dexmedetomidine (0.25 밀리그램 / kg)의 혼합물을 사용하고 있습니다. 다른 마취 프로토콜 들어, Flecknell 4 Hellebreker를 참조하십시오의 외. 7.
- 쥐 의식을 잃은 후, 단지 전기 면도기와 눈 사이에에 귀를에서가는 머리 영역을 면도.
- 공기 튜브 앞에는 코와 함께 가열 패드에 쥐 놓으십시오. 쥐가 충분한 혈액 산소 수준을 (<90 %를 드롭하지 말아야)가되도록 산소 농도계를 사용합니다. 장비의 적절한 사용을 위해 제조 업체의 지침을 따르십시오.
- 탈수를 피하기 위해 두 각막에 아이 크림을 (Duratears Z, Alcon) 적용됩니다.
- 그것이 적절하게 anesthetized 있는지 확인하기 위해 쥐의 반사 (반사 또는 꼬리 앞꿈치 핀치 반사 등 Walantus 외. 8 증명)를 확인합니다. 쥐이 강한 반사를 보여 지속되면 마취의 보완이 필요 수 있습니다.
- 동물의 앞에있는 공기 튜브를 더 발가락 - 핀치 반사가 표시되지 않은 경우, stereotaxic 장치에 쥐 장소는 양쪽에 동일한 독서를 보여줍 있도록 귀 막대를 조정하고 다시 장소코 막대로 고정하여. 쥐이 90 % 이상의 혈액 산소 수준을 보여주는 경우에 다시 확인하십시오. 그렇지 않다면, 가까이 코를에 데리고, 중 튜브를 조정하거나, 산소의 흐름을 향상시킬 수 있습니다. 수술을 통해 혈액 산소 수준과 심장 박동을 모니터링합니다.
- 지속적인 직장 온도계 (우선적으로 가열 패드에 연결된)와 쥐의 온도를 모니터링하고 수술의 시작과 끝 부분에 값을 기록합니다. 가열 패드를 조정하거나 38.5-37.5의 체온을 유지하기 위해 담요를 사용 ° C.
2. 외과
- 진통제를 주사. 우리는 carprofen (subcutaneously 4.0-5.0 MG / kg)의 단일 아름다운 요정 수술 관리를 사용하고 있습니다. 다른 진통제 프로토콜, Hellebrekers 외. 7을 참조하십시오.
- t의 음모 지역을 청소그 중심에서 세 살균제 (예 : chlorhexidine 0.5 %)과 시간 및 지역 지역 마취 및 vasoconstriction에 대한 lidocaine (20 MG / ML)과 아드레날린 (5 밀리그램 / ML)의 혼합물을 주입이 (방지하기 위해 머리 둘레 피부 과도한 출혈).
- 귀 뒤쪽까지 눈 사이에서가는 두피의 중간선에 2.5 cm의 앞쪽에 - 후부 절개를합니다. 피부를 꼬집어하고 절개 뜨고 4-6 불독 클램프를 사용하십시오. 주걱 및 / 또는 무명 면봉과 두개골 표면을 노출 영역을 깨끗하게하는 결합하는 조직을 제거합니다.
- , 첫 번째 람다를 찾아 정확히이 위치를 통해 가이드 정맥을 배치, 두개골을 감동 : 머리가 수준 있는지 확인하십시오. dorso - 복부 좌표를 기록합니다. 다음 두개골을 감동 정확히 Bregma을 통해 안내 정맥을 배치하며, dorso - 복부 좌표를 기록합니다. 이 두 좌표는 동일해야합니다. 차이가> 0.3 mm있다면, 그것을 해결하기 위해 코 막대를 조정합니다.
- M멸균 핸드 드릴 (반구 중 하나에있는 정맥의 위치와 contralateral 북반구에있는 정맥의 위치에 후부 다른 5mm로 앞쪽에 한 약 5mm)를 사용하여 두개골 나사를 고정을위한 착륙이 작은 구멍. 그들은 밀접하게 완전히 두개골에 삽입되지 않고, 고정되기 전까지는이 구멍 두개의 살균 나사를 삽입합니다.
- 가이드 정맥이 Bregma에 정확히 배치로, 앞쪽에 - 후부와 측면 좌표를 기록합니다. 각각의 뇌 영역에 대한 가이드 정맥 배치의 정확한 위치는 stereotaxic 아틀라스 9-11의 도움과 함께, 추가 또는 Bregma 값에서 빼는 방법으로 계산하실 수 있습니다.
- 약간 두개골을 감동 그 정확한 위치에 안내 정맥을 놓습니다. dorso - 복부 좌표를 기록합니다. 양자 정맥 배치를위한, 다른 북반구에있는 정맥의 위치 다음에 찾아서 다시 dorso - 복부 좌표를 기록합니다. 두 좌표 (또는 <0.3 mm 차이가) 동일해야합니다.
- 멸균 연필로 두개골에있는 정맥 위치를 마크하고, 핸드 맹연습을하는 것으로, 크기와 가이드 정맥의 도움으로 정확한 위치를 확인, 버 구멍을합니다. 구멍이 만들어진 후, 부드럽게 정맥의 탁 트인 삽입 수 있도록 meninges을 주먹으로 멸균 바늘을 사용합니다.
- 첫 번째 구멍에 정맥을 놓고 그것이 최종 복부 좌표에 도달할 때까지 신중하게 그것을 낮춥니다. 치과 시멘트를 준비하고 넉넉한 정맥 문제를 해결하기 위해 정맥과 하나 또는 둘 다 나사 주위를 적용해야합니다. 시멘트가 완전히 마른 때까지 기다리십시오. 그 후, 조심스럽게 dorso - 복부 바 위쪽으로 회전하여 정맥 지원을 제거합니다.
- 지원으로 두 번째 정맥을 놓고 다른 북반구에있는 정맥의 위치로 이동합니다. 구멍에 정맥을 놓고 이전 단계를 반복합니다. 나사와 시멘트로 cannulas의 큰 표면을 커버하고, 시멘트가 건조되기 전에는 피부로부터 잉여를 제거합니다.
- 주입 따뜻한 (~ 37 ° C) rehydration을 보장하기 위해 무균 식염수 (~ 10 ML / kg, SC).
- 시멘트가 완전히 건조되면 정맥 지원을 제거하고 방해를 방지하기 위해 각 정맥에 살균 핀을 넣으십시오.
- 무균 식염수에 상처 영역을 청소하고 전면과 상처의 뒷면을 봉합.
- 의 코 앞에있는 가스 튜브를 교체, stereotaxic 장치에서 동물을 제거합니다. 산소 포화도 수준과 체온을 지속적으로 모니터.
- dexmedetomidine과 주사용 마취제를 사용하는 경우, 그 길항제 atipamezole를 주입 (0.25 MG / kg, SC)와 동물 (약 5 분)가 떴습 때까지 기다리십시오.
- 복구 케이지로 쥐를 놓습니다. 저체온증을 방지하려면 동식물 사육장 룸에 반환하기 전에 적어도 한 시간 동안 동물을 볼 수있는 장소에서 28 ° C에서 또는 가열 패드에 인큐베이터에 케이지를 놓습니다.
3. 포스트 외과 치료
- 동안 수술 후 첫 4 일간, 무게와 실험 일지 또는 "동물 복지 일기"에 동물의 상태에 관한 다른 관찰 일상적인 기록을 유지하여 쥐의 복구를 모니터링합니다.
- 체중이나 웰빙 것은 받아야합니다 감소 특별한주의의 다른 증상의 상처, 손실의 질병, 감염의 명백한 징후를 보여 동물 : 포스트 수술 통증, 분말 식품과 물을 혼합을 최소화하기 위해 진통제의 여분 복용량을 예 표준 밥 이외에 쥐의 식욕, 및 / 또는 rehydration을 지원하기 위해 염분을 피하 주사를 자극합니다.
- 쥐이 개입 이후 어떠한 개선이나 체중의 손실을 표시하지 않는 경우 희생은 마취의 과다 (인간 엔드 포인트)와 동물 (미리 수술 무게에 비해)> 15 %.
- 쥐은 일반적으로 행동 실험을 개시하기 전에 적어도 7 일 동안 복구해야합니다.
4. 대표 결과
특히 산소의 보완과 혈액 산소 수준, 심장 박동과 체온의 지속적인 모니터링과 관련하여 우리가 수술에 대한 다양한 수정이, 동물의 생존을 향상하고 수술 후 그 일반적인 조건을 개선 여부를 확인하려면 jove_content ">, 우리가 비교 동물 우리가 표준 프로토콜로 운영하는 24 동료 (20 쥐들이 각)의 비 생존율 이러한 수정을 실시 후 수술을 받았습니다 (20 쥐를 각각의 구성된)합니다. 20 동료가 아닌 생존 비율은 그림 1A에 나와있는 그 이외의 생존율이 크게 수정된 프로토콜 (P <0.05, 맨 - 휘트니 U 테스트, 두 꼬리)로 운영되었습니다 동료의 예제에서 감소되었다. 또한, 같은 그림 1B, 사후 수술 체중 감량에게에 표시됩니다 수정된 프로토콜과 운영 쥐들이 또한 상당히으로 표준 절차 (POST 수술 일 1 운영 쥐를의에 비해 감소했습니다 : P <0.05, 이후 수술 일 2 : P <0.01, 이후 수술 3 일 : P = 0.17, 학생 T - 테스트).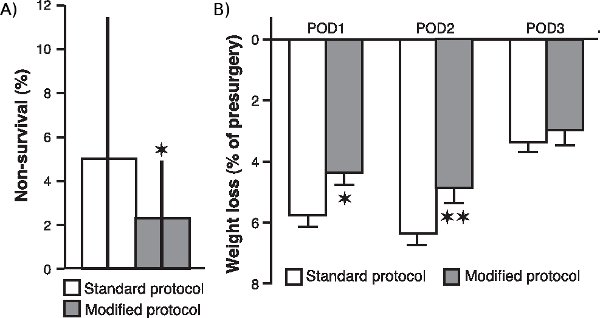
그림 1. 비 생존 속도와 수술 후 체중 감소에 대한 외과 변경의 효력. 표준 프로토콜로 운영 쥐를의에 비해 수정된 프로토콜과 운영 쥐를 (A.)이 아닌 생존 속도. 아닌 생존 요금은 (평균 ± interquartile 범위) 수술을 생존 아니 20 쥐의 일대 당 쥐의 비율로 계산되었다. * P <0.05, 맨 - 휘트니 U 시험이 꼬리 (표준 프로토콜에 대한 수정된 프로토콜과 24 동료에 대한 n은 = 20 동료). 첫 번째 (POD1), 초 (POD2) 및 세 번째 (POD3) 포스트 수술 하루 동안 (B.) 체중 감소 (미리 수술 무게의 백분율로 ± SEM을 의미). * P <0.05, ** P <0.01, 학생 T - 테스트 (N 그룹당 = 60).
토론
이 비디오 프레 젠 테이션의 주된 목적은 stereotaxic 수술의 기본 원칙과 행동 neuroscientists에 익숙해하는 것입니다. 이미 stereotaxic 수술을 수행하는 연구자도이 동영상의 혜택을 자신의 실험실에서 사용하기 위해 절차 개선의 일부를 고려해 볼 수 있습니다. 수술 기법 1-3 최적화에 대해 계속 증가하는 지식, 인간과 동물용 의약품 4,12, 공공 인식에 관한 동물 복지 문제와 엄격한 법률 ...
공개
저자는 공개 아무것도 없어.
감사의 말
저자는 비디오에 사용되는 도면에 대한 박사 피터 Gerrits 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | ||
| 알코올 70% | VWR | ||
| Antisedan (atipamezole) | 오리온 | ||
| 황산 아트로 핀 0,5 | Pharmachemie BV | ||
| 불독 haemostatic 클램프 | Aesculap | ||
| Cannulas | 구성 요소 공급 (주) | ||
| Chlorhexidine 0.5 % | AppepPharma | ||
| 분말을 청소 | Alconox | ||
| 코튼 스틱 | 하트만 BV | ||
| Dexdomitor (dexmedetomidine) | 오리온 | ||
| 훈련 | Dremel 8000 | ||
| Duratears Z | Alcon | ||
| Durogrip Naaldvoerder 대화 130mm | Aesculap | ||
| Durotip Fijne schaar ret.sp / 일 110mm | Aesculap | ||
| 쇠그물 | Medicomp (5x5) | ||
| 생리대 | 하버드 장치 | ||
| 곤충 핀 (stylets) | Entosphinx (체코 Republik) | ||
| 케타민을 10 % (케타민을) | Alfasan | ||
| 마이크로 halsted 스트레이트 팁 | Aesculap - 수의사 | ||
| Molinea | 하트만 BV | ||
| NaCl 0,9 % | 벡스터 | ||
| 바늘 (25G) | Terumo | ||
| 산소 농도계 | Edan 인 스트 루먼트 주식 회사 | ||
| Pentobarbital | UMCG의 약국 | ||
| Rimadyl | 화이자 | ||
| 메스 블레이드 번호 23 | 스완 모튼 | ||
| Scalpelholder의 NR. 네 133mm | Aesculap | ||
| 스크류 드라이버 | 기존의 하드웨어 스토어 | ||
| 쾌속 심플 (치과 시멘트) | Kemdent | ||
| 두개골 나사 | 구성 요소 공급 (주) | ||
| 주걱 | VWR | ||
| Spongestan 특수 | 존슨 앤 존슨 | ||
| Stereotacts | Kopf 인 스트 루먼트 | ||
| 외과 포셉 100mm | Aesculap | ||
| 봉합 재료 Safil 5 / 0 | Aesculap | ||
| 주사기 10 ML | Omnifix | ||
| 주사기 1ml | Terumo | ||
| 주사기 5ml | Omnifix | ||
| Xylocaine (lidocaine / 아드레날린) | Astra Zeneca |
참고문헌
- Russell, W. M. S., Burch, R. L. . The Principles of Humane Experimental Technique. , (1959).
- Richardson, C. A., Flecknell, P. A. Anaesthesia and post-operative analgesia following experimental surgery in laboratory rodents: are we making progress?. Altern. Lab Anim. 33, 119-127 (2005).
- Stokes, E. L., Flecknell, P. A., Richardson, C. A. Reported analgesic and anaesthetic administration to rodents undergoing experimental surgical procedures. Lab Anim. 43, 149-154 (2009).
- Flecknell, P. A. . Laboratory Animal Anaesthesia - A Practical Introduction for Research Workers and Technicians. , (2009).
- . DIRECTIVE 2010/63/EU OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL of 22 September 2010 on the protection of animals used for scientific purposes. Official Journal of the European Union. , (2010).
- Geiger, B. M., Frank, L. E., Caldera-Siu, A. D., Pothos, E. N. Survivable Stereotaxic Surgery in Rodents. J. Vis. Exp. (20), e880-e880 (2008).
- Hellebrekers, L. J., Booij, L. H. D. J., Flecknell, P. A., Van Zutphen, L. F. M., Baumans, V., Beynen, A. C. Anaesthesia, analgesia and euthanasia. Principles of Laboratory Animal Science. , 277-311 (2001).
- Walantus, W., Elias, L., Kriegstein, A. In utero intraventricular injection and electroporation of E16 rat embryos. J. Vis. Exp. (6), e236-e236 (2007).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (1986).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (2007).
- Swanson, L. W. . Brain Maps: Structure of the Rat Brain. , (1992).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유