JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
체외 Mesothelial 정리 분석에서는 그것이 난소 암 전이의 초기 단계 모델
요약
여기에 설명된 mesothelial 통관 분석은 fluorescently 표시된 셀 및 촬영된 비디오 현미경 시각화하고 양적 난소암 다세포 spheroids 및 mesothelial 세포 monolayers의 상호 작용을 측정하기 위해 활용합니다. 이 분석은 난소 암 전이의 초기 단계를 모델.
초록
난소암은 미국 1의 암 관련 사망의 다섯 번째 주요 원인이다. 치료에 긍정적인 초기 대응에도 불구하고 난소암과 여성의 70~90% 새로운 metastases을 개발하며, 재발은 종종 두 치명적이다. 그것은 중급과 늦은 무대 난소암 더 나은 치료법을 개발하기 위해 보조 metastases가 발생하는지 이해하기 위해, 따라서 필요합니다. 악성 세포가 일차 종양이 사이트에서 분리 및 복막 캐비티 전체에 보급하면 난소암의 전이가 발생합니다. 전파 세포가 복막 구멍 3 (그림 1, 영화 1) 내의 장기에 다세포 클러스터, 또는 spheroids 역시 남아 맨몸으로, 아니면 임플란트를 형성할 수 있습니다.
복막 캐비티 내의 장기의 모든 mesothelial 세포를 4-6 (그림 2) 단일, 연속, 레이어로 채워져 있습니다. 그러나 mesothelial 세포 수렁에서 결석입니다같은 excised 인간 종양 조직 섹션 3,5-7 (그림 2)의 전자 현미경 연구에 의해 밝혀 복막 종양 유출. 이것은 mesothelial 세포를 알 수없는 프로세스에 의해 종양이 대량 수렁에서 제외됩니다 것을 제안합니다.
체외 실험에서 이전은 기본 난소암 세포 8 mesothelial 세포보다는 세포외 기질에 더 효율적으로 첨부하고, 더 최근의 연구는 그 기본 복막 mesothelial 세포가 실제로 난소암 세포 부착 및 침입 (같은 접착 및 침략에 비해에 장벽을 제공 보여주 것을 증명 ) mesothelial 세포에 9,10을 취재되지 않은 기판에. 이것은 mesothelial 세포가 난소 암 전이에 대한 장벽 역할을하는 것이 좋습니다 것이다. 난소암 세포가이 장벽을 위반하고있다 mesothelium를 제외하는 세포와 분자 메커니즘은 최근까지 알려지지 않았다.
여기 일을 설명시험 관내 분석을위한 전자 방법론 해당 모델 생체내 (그림 3, 영화 2) 난소암 세포 spheroids과 mesothelial 세포 사이의 상호 작용. 우리의 프로토콜은 mesothelial monolayers 8-16과 난소 종양 세포의 상호 작용 분석을위한 앞에서 설명한 방법에서 적응되었고, 먼저 난소 종양 세포의 배제를 추진 마이 오신과 견인 힘을 인테 종속 활성화를 활용 보여주는 리포트에서 설명되었다 종양 회전 타원체 17 세 이하의 mesothelial 세포. 이 모델은 상호 작용의 공간적 및 시간적 정보를 제공하고, 실시간으로 두 세포 인구를 모니터링하는 데 시간이 경과 형광 현미경을 이용합니다. mesothelial 세포가 녹색 형광 단백질 (GFP)을 표현하는 동안 난소 암 세포는 빨간 형광 단백질 (RFP)를 표현. RFP-표현하는 난소암 세포 spheroids하면 GFP-표현 mesothelial 단일층에 첨부해 주시기 바랍니다. spheroids 확산은 침공, 그리고옆으로 단일층에 구멍을 만드는 mesothelial 세포를 강제로. 이 구멍은 GFP 이미지의 부정적인 공간 (블랙)와 같은 시각이다. 구멍의 지역 그리고 양적 통제와 난소암 및 / 또는 mesothelial 세포 실험 집단 간의 클리어런스 활동의 차이를 분석하는 측정 수 있습니다. 이 분석은 난소암 세포 (조건 회 회전 타원체 X 20-30 spheroids 당 100 세포)만이 소수의 필요 때문에 귀중한 일차 종양 세포 샘플을 사용하여이 분석을 수행 가능합니다 이상입니다. 또한이 분석은 쉽게 높은 처리량 검사에 대해 적용할 수 있습니다.
프로토콜
1. 난소암 세포 회전 타원체 형성
- RFP-표현하는 난소암 세포는 10 %베이스 중간 (199과 MCDB105의 50:50 혼합물 10 % inactivated 태아 소 혈청과 1% 펜 strep를 포함하는 사용자 정의 세포 배양 매체)에서 배양해 있습니다. 레이블이 지정되지 않은 난소암 세포에 RFP를 표현하기 위해 플라스미드 포함된 RFP와 세포를 transfect 및 RFP를 표현하는 세포를 위해 선택합니다. 또는 바이러스성 벡터는 transiently 형광 단백질을 표현하는 데 사용할 수있는, 또는 세포에 빨간색 형광 세포 추적기 염료 (Invitrogen)로 사전 품어 될 수 있습니다.
- 이전 난소암의 spheroids의 형성에, 그것은 낮은 접착 96 잘 둥근 바닥 문화 요리를 준비할 필요가 있습니다. , 낮은 접착 배양 접시를 생산하기 위해서 30μl 폴리-HEMA 용액 (1 ML 95% EtOH에서 6mg polyhydroxyethylmethacrylate)는 96 잘 코닝 세포 배양 접시의 각도에 추가됩니다. 96 잘 플레이트는 ° C 비 humidified 인큐베이터는 에탄올, 내가 증발시키는 37에 incubated 있습니다각도에 폴리-HEMA의 영화를 eaving. 이 폴리 - HEMA 영화는 세포 현탁액 18 년 성장 강요, 우물의 바닥에 부착로부터 세포를 방지할 수 있습니다. [또는 초저 첨부 파일 문화 플레이트 (코닝)는 폴리-HEMA 코팅 요리 대신 사용할 수 있습니다.]
- 낮은 접착 배양 접시를 준비 후, 난소암 세포, 펠릿 3 분 동안 900 RCF의 탁상 원심 분리기 (Heraeus)의 세포가 뜨는을 대기음와 10 %의 기본 매체에서 다시 중단 한 접시를 trypsinize.
- hemocytometer를 사용하여 세포를 세어보세요.
- 10 %의 기본 중의 50μl 당 100 세포가있다는 것을 이러한 세포의 농도를 조정합니다.
- 96 잘 폴리 - HEMA 코팅 문화 요리의 각도에 균일하게 정지 희석 세포 현탁액의 50μl를 추가합니다.
- 16시간위한 37 ° C 세포 문화 인큐베이터 (시간이 금액은 그것을 위해 걸리는 시간의 양에 따라 증가하거나 감소해야합니다에서 96 잘 접시를 품어각도에 하나의 다세포 회전 타원체를 형성, 함께 클러스터에 난소암 세포를 허용하도록 다세포 spheroids하거나 원하는 실험 조건)을 형성하는 특정 세포 라인. 일부 종양 세포는이 기간 동안 apoptosis을 받다 수 있으니 사전 apoptosis의 유도에 시간을 선택하는 것이 중요합니다.
2. Mesothelial 세포 단일층 형성
- 세포 배양 후드에서 미리 코팅 접시의 각도에 5μg fibronectin / ML PBS 솔루션의 2mL를 추가하고 30 분간 실온에서 잠복기에 의한 fibronectin과 6 잘 유리 바닥 MatTek 요리의 우물. MatTek 요리의 유리 바닥의 광학 품질은 고해상도 현미경 이미징을위한 수 있습니다.
- GFP-표현 mesothelial 세포는 10 %의 기본 매체에서 배양해 있습니다. mesothelial 세포 판을 Trypsinize, 3 분 동안 900RPM에서 탁상 원심 분리기 (Heraeus)에 다운 스핀 뜨는을 대기음, 10 %의 자료 매체에 다시 일시 중지합니다.여기서 사용 mesothelial 세포들이 취득 당시 이미 GFP를 표현했지만 레이블이 지정되지 않은 mesothelial 세포 cDNA 플라스미드 함유 GFP와 transfecting, 또는 녹색 형광 세포 추적기 염료 (Invitrogen)에 전지를 preincubating에서 생산 할 수 있습니다.
- 30 분 fibronectin 보육 (단계 2.1) 후, 2mL PBS로 MatTek 요리의 우물을 씻는다.
- 6 잘 MatTek 요리의 각 우물에 잘 당 PBS 및 플레이트 6 x10 5 mesothelial 세포를 기음. mesothelial 세포 접시에 연결하고 단일층를 형성하도록하여 야간 37 ° C 세포 문화 인큐베이터에서 MatTek 요리를 품다.
3. Mesothelial 세포 정리 분석
- 96 잘 폴리 - HEMA 코팅 접시에서 난소 암 spheroids를 수집 pipet을 사용하십시오.
- mesothelial 세포 단일층를 포함하는 6 자 MatTek 요리는 잘 하나에서 매체를 기음. 2mL PBS로 한 번 씻는다. 96 잘 P로부터 spheroids 모든 추가MatTek 요리 (몇 군데되지 않습니다 접시 부분에 spheroids 착륙 계정에 몇 군데 실거 spheroids의 ~ 3 배 번호)을 잘 하나 늦었어.
- 최소한 8 시간의 기간 동안 촬영된 영상을 수행할 수 거꾸로 widefield 형광 현미경의 무대에 MatTek 요리를 놓습니다. 한 실험에 여러 회전 타원체 윤일 이벤트와 함께 접시에있는 이미지를 여러 위치로 전동식 스테이지를 사용하십시오. 우리는 통합된 완벽한 초점 시스템과 낮은 [20x-0.75 수치 조리개 (NA)] 배율 / 없음 차동 간섭 대비 (DIC) 광학과 니콘 티-E 바뀌 동력 Widefield 형광 시간 경과 현미경을 사용하여 0.52 NA와 니콘의 할로겐 transilluminator 긴 작동 거리 (LWD) 콘덴서, 니콘 빠르고 (<100 밀리초 스위칭 시간) 여진과 방사 필터 (GFP 예 40분의 480, 엠 50분의 525, RFP-mCherry 예 50분의 575 엠 50분의 640), 셔터 빠르게 전송 그리고 epifluorescence 빛의 경로 스마트 종료ters, 니콘 선형 인코딩된 동력 스테이지, 하마 오카-AG는 전하 결합 소자 (CCD) 카메라, 온도 및 CO 2 제어의 맞춤식 현미경 보육 챔버, 니콘 NIS-요소 AR 소프트웨어 버전 3을 냉각하고, TMC 진동 절연 테이블.
- 난소암 세포 spheroids은 접시의 바닥에 정착하고 mesothelial 세포 단일층에 연결됩니다. 8 시간 GFP, RFP 및 20 단계 이미지 + 회전 타원체 / 단일층 상호 작용을, 10 분마다를 수집합니다.
- RFP-표현하는 난소암 세포 spheroids은 단일층에 구멍을 만드는 GFP-표현 mesothelial 세포 단일층로 침공합니다. 8시간 후에는 요소 소프트웨어 (또는 이미지 J 같은 다른 적합한 소프트웨어)를 사용하여 GFP 이미지의 검은 구멍을 추적하여 구멍의 크기를 측정합니다. 시간 제로 해당 RFP 이미지의 회전 타원체의 크기로 8 시에 구멍 크기를 나누어 초기 회전 타원체 크기로 구멍 크기를 정상화. 이 예에서는충분한, 구멍의 크기는 한 번만 측정되었지만, 그것은 더 윤달의 역학을 이해하는 데 8 시간 실험을하는 동안 여러 번 측정할 수있다.
4. 대표 결과
이 예제에서, 우리는 OVCA433 spheroids를 제어하는 talin-1의 감쇠 표현을 가지고 OVCA433 난소암 세포 spheroids의 mesothelial 통관 능력을 비교했다. 각 그룹에서 OVCA433 spheroids는 ZT mesothelial 세포 monolayers을 포함 MatTek 요리가 추가되었습니다. 각 그룹에서 여섯 spheroids은 8 시간 동안 매 10 분 (그림 4, 영화 3, 영화 4) 몇 군데 있었다. 확산 spheroids하여 단일층에서 생산되는 구멍 측정되었으며 각 그룹에서 6 순위는 평균되었다. talin 한 최저의 spheroids 만든 평균 통관 영역 제어 spheroids 만든 평균 면적보다 훨씬 작은 것을 그림 4는 쇼, talin는 O에 의해 mesothelial 통관을 위해 필요하다고 제안VCA433 난소 암 spheroids.
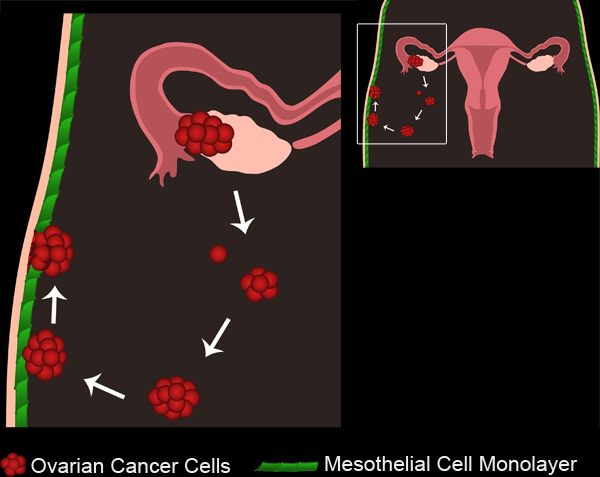
그림 1. 난소 암 전이. 기본 난소 종양은 난소 표면 상피 또는 나팔관에서 두 개발할 수 있습니다. 종양 세포 / 클러스터는 일차 종양에서 끊다과 복막 구멍에 수집합니다. 종양 세포는 다음 다세포 spheroids을 형성 종합 수 있습니다. Spheroids 후 복막 캐비티에 즐비한 mesothelial 세포 monolayers에 첨부합니다. mesothelial 세포 spheroids은 기본 지하 막에 액세스할 수 있도록 첨부된 난소암의 회전 타원체 수렁에서 제외됩니다.
영화 1. 난소 암 전이 있습니다. 동영상을 보려면 여기를 클릭하십시오 .
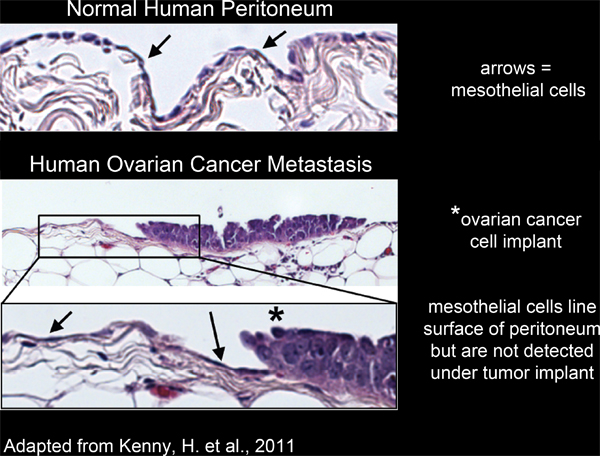
그림 2. Mesothelial 세포 라인 인간 복막 조직의 표면과 난소암 세포를 이식 수렁에서 제외됩니다.
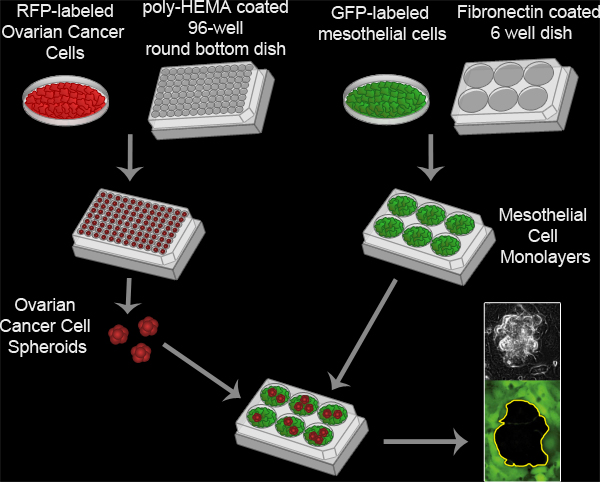
그림 3. Mesothelial 정리 분석. 난소 암 spheroids는 100을 잠복기에 의해 형성되는 RFP-표현 16시간위한 37 ° C에서 폴리 - HEMA 코팅 96 잘 둥근 바닥 배양 접시에 잘마다 난소암 세포를. 폴리-HEMA는 세포 현탁액에 남아 당 잘 단일 클러스터를 형성하기 위해 서로에 충실 수 있도록 문화 접시에 부착로부터 세포를 방지할 수 있습니다. Mesothelial 세포 monolayers는 fibronectin 코팅 여섯 잘 MatTek 요리에 잘 당 6x10 5 mesothelial 세포를 도금 및 16 시간 동안 37 ° C에서 번호판을 잠복기에 의해 준비가되어 있습니다. spheroids 그런 다음 mesothelial 단일층로 MatTek 요리로 전송되고 두 세포 집단은 니콘 티-E 나를 사용하여 8 시간 10 분 간격으로 몇 군데있다nverted 동력 Widefield 형광 촬영된 현미경과 요소 소프트웨어.
영화 2. Mesothelial 정리 분석가. 동영상을 보려면 여기를 클릭하십시오 .
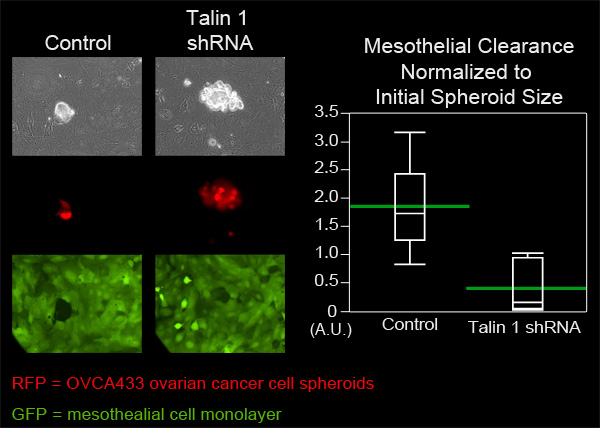
OVCA433 spheroids의 talin 한 표현의 그림 4. 감쇄량은 mesothelial 통관 능력을 감소시킵니다. 과 및 talin 1 감쇠 표현없이 OVCA433 spheroids (빨간색)은에 연결하고 ZT mesothelial 단일층 (녹색)으로 나눠야 허용되었다. 두 세포 집단은 니콘 티-E 바뀌 동력 Widefield 형광 촬영된 현미경과 요소 소프트웨어를 사용하여 8 시간 10 분 간격으로 몇 군데 있었다. 그래프는 talin 한 감쇠를 보여줍니다크게 mesothelial 세포 통관 (수단에 녹색 막대로 Quantile 플롯)을 낮춥니다.
동영상 3. 제어 mesothelial 단일층 (녹색)에 침입하는 OVCA433 spheroids이 (빨간색). 동영상을 보려면 여기를 클릭하십시오 .
OVCA433 spheroids의 talin 한 표현 (빨간색)의 영화 4. 감쇄량은 (녹색) 통관 능력을 mesothelial 낮춥니다. 동영상을 보려면 여기를 클릭하십시오 .
토론
여기에 제시된 "Mesothelial 정리 분석은"훌륭한 공간과 시간적 자세히, 난소암 다세포 spheroids 및 mesothelial 세포 monolayers의 상호 작용을 모니터링하기 위해 촬영된 현미경을 사용합니다. 이전에는 8-14 몇몇 그룹은 난소암 세포가 부착하고 mesothelial 세포 monolayers에 침공 표시하도록 끝점 assays를 사용했다. 이 분석은 독특한 점에서이 두 세포 인구의 역학은 검정에 걸쳐 모니터링할 수 있...
공개
우리는 공개 할게 없다.
감사의 말
우리는 하버드 의과 대학에서 니콘 이미징 센터, 특별히 제니퍼 워터스, 라라 Petrak과 웬디의 연어, 훈련과 timelapse의 현미경의 사용을 감사드립니다. 우리는 또한 가치있는 토론을 위해 로자 잉과 Achim Besser 감사드립니다. 이 작품은 NIH 그랜트 5,695,837 (M. Iwanicki까지) 및 JSB에 GM064346에 의해 지원되었다; 박사 미리암과 셀던 G. Adelson 의학 연구 재단 (JSB까지)에서 교부금에 의해.
자료
| Name | Company | Catalog Number | Comments |
| 시약 | 회사 | 카탈로그 번호 | 댓글 |
| OVCA433 난소 암 세포 | 박사 데니스 Slamon의 선물 | ||
| Mesothelial 셀을 ZT | 박사 탄의 선물 Ince | ||
| 중형 199 | Gibco | 19,950 | |
| MCDB105 | 세포 응용 주식 회사 | 117-500 | |
| FBS-더위 inactivated | Gibco | 10,082 | |
| 펜-Strep | Gibco | 15,070 | |
| 96 잘 접시 | 코닝 Costar | 3799 | |
| Polyhydroxyethylmethacrylate (폴리-HEMA) | 시그마 알드리치 | 192066-25G | 폴리 - HEMA 솔루션을 95 % EtOH의 1ml에 6mg 폴리 - HEMA 분말을 용해 |
| EtOH | Pharmco-aaper | 111ACS200 | DH 2 0에서 95 %까지 희석 |
| 세포 배양 후드 | Nuaire | NU-425-300 | |
| 조직 문화의 인큐베이터 | 써모 과학 | 3110 | |
| 폴리 - HEMA 플레이트위한 인큐베이터 | Labline 악기 | 제국 III 305 | |
| 탁상 원심 분리기 | Heraeus | 75003429 / 01 | |
| 6 잘 유리 바닥 요리 | MatTek 사. | P06G-1.5-20-F | |
| Fibronectin | 시그마 | F1141-1MG | |
| PBS | Cellgro | 21-040 - 이력서 | |
| Timelapse 현미경 : | |||
| 현미경 | 니콘 | 통합된 완벽한 초점 시스템과 티-E 바뀌 동력 형광 촬영된 현미경 | |
| 렌즈 | 니콘 | 20X-0.75 수치 apeture | |
| 할로겐 transilluminator | 니콘 | 0.52 없음 긴 작동 거리 응축기 | |
| 여진과 방사 필터 | 니콘 주택 채도 단일 패스 필터 | GFP 예 40분의 480, 엠 50분의 525 RFP-mCherry 예 50분의 575 엠 50분의 640 | |
| 전송 및 광 경로를 Epifluoresce | 셔터 | 스마트 셔터 | |
| 선형 인코딩 동력 무대 | 니콘 | ||
| 냉각 충전 - 결합 장치 카메라 | 하마 마츠 | 오카-AG | |
| 온도 및 CO 2 제어 현미경 보육 챔버 | 주문품의 | ||
| 진동 절연 표 | TMC | ||
| 국정원 - 요소 소프트웨어 | 니콘 | 버전 3 |
참고문헌
- Jemal, A. . CA Cancer J. Clin. 59, 225-249 (2009).
- Ries, L. G., Melbert, D., Krapcho, M., Stinchcomb, D. G., Howlader, N., Horner, M. J., Mariotto, A., Miller, B. A. . SEER Cancer Statistics Review, 1975-2005. , (2007).
- Burleson, K. M. Ovarian carcinoma ascites spheroids adhere to extracellular matrix components and mesothelial cell monolayers. Gynecol. Oncol. 93, 170-181 (2004).
- Birbeck, M. S., Wheatley, D. N. An Electron Microscopic Study of the Invasion of Ascites Tumor Cells into the Abdominal Wall. Cancer Res. 25, 490-497 (1965).
- Witz, C. A., Monotoya-Rodriguez, I. A., Schenken, R. S. Whole explants of peritoneum and endometrium: a novel model of the early endometriosis lesion. Fertil. Steril. 71, 56-60 (1999).
- Zhang, X. Y. Characteristics and growth patterns of human peritoneal mesothelial cells: comparison between advanced epithelial ovarian cancer and non-ovarian cancer sources. J. Soc. Gynecol. Investig. 6, 333-340 (1999).
- Kenny, H. A., Nieman, K. M., Mitra, A. K., Lengyel, E. The First Line of Intra-abdominal Metastatic Attack: Breaching the Mesothelial Cell Layer. Cancer Discovery. 1, 100-102 (2011).
- Niedbala, M. J., Crickard, K., Bernacki, R. J. Interactions of human ovarian tumor cells with human mesothelial cells grown on extracellular matrix. An in vitro model system for studying tumor cell adhesion and invasion. Exp. Cell. Res. 160, 499-513 (1985).
- Kenny, H. A., Krausz, T., Yamada, S. D., Lengyel, E. Use of a novel 3D culture model to elucidate the role of mesothelial cells, fibroblasts and extra-cellular matrices on adhesion and invasion of ovarian cancer cells to the omentum. Int. J. Cancer. 121, 1463-1472 (2007).
- Ksiazek, K. Senescent peritoneal mesothelial cells promote ovarian cancer cell adhesion: the role of oxidative stress-induced fibronectin. Am. J. Pathol. 174, 1230-1240 (2009).
- Burleson, K. M., Boente, M. P., Pambuccian, S. E., Skubitz, A. P. Disaggregation and invasion of ovarian carcinoma ascites spheroids. J. Transl. Med. 4, 6-6 (2006).
- Heyman, L. Vitronectin and its receptors partly mediate adhesion of ovarian cancer cells to peritoneal mesothelium in vitro. Tumour. Biol. 29, 231-244 (2008).
- Heyman, L. Mesothelial vitronectin stimulates migration of ovarian cancer cells. Cell. Biol. Int. 34, 493-502 .
- Lessan, K., Aguiar, D. J., Oegema, T., Siebenson, L., Skubitz, A. P. CD44 and beta1 integrin mediate ovarian carcinoma cell adhesion to peritoneal mesothelial cells. Am. J. Pathol. 154, 1525-1537 (1999).
- Leroy-Dudal, J., Heyman, L., Gauduchon, P., Carreiras, F. Adhesion of human ovarian adenocarcinoma IGROV1 cells to endothelial cells is partly mediated by the alphav integrins-vitronectin adhesive system and induces an alteration of endothelial integrity. Cell. Biol. Int. 29, 482-488 (2005).
- Leroy-Dudal, J. Transmigration of human ovarian adenocarcinoma cells through endothelial extracellular matrix involves alphav integrins and the participation of MMP2. Int. J. Cancer. 114, 531-543 (2005).
- Iwanicki, M. Ovarian cancer spheroids use myosin-generated force to clear the mesothelium. Cancer Discovery. 1, 144-157 (2011).
- Folkman, J., Moscona, A. Role of cell shape in growth control. Nature. 273, 345-349 (1978).
- Gregoire, L., Munkarah, A., Rabah, R., Morris, R. T., Lancaster, W. D. Organotypic culture of human ovarian surface epithelial cells: a potential model for ovarian carcinogenesis. In Vitro Cell Dev. Biol. Anim. 34, 636-639 (1998).
- Roberts, P. C. Sequential molecular and cellular events during neoplastic progression: a mouse syngeneic ovarian cancer model. Neoplasia. 7, 944-956 (2005).
- Okada, T., Okuno, H., Mitsui, Y. A novel in vitro assay system for transendothelial tumor cell invasion: significance of E-selectin and alpha 3 integrin in the transendothelial invasion by HT1080 fibrosarcoma cells. Clin. Exp. Metastasis. 12, 305-314 (1994).
- Zervantonakis, I. K., Kothapalli, C. R., Chung, S., Sudo, R., Kamm, R. D. Microfluidic devices for studying heterotypic cell-cell interactions and tissue specimen cultures under controlled microenvironments. Biomicrofluidics. 5, 13406-1310 (2011).
- Brandt, B. 3D-extravasation model -- selection of highly motile and metastatic cancer cells. Semin. Cancer Biol. 15, 387-395 (2005).
- Condeelis, J., Segall, J. E. Intravital imaging of cell movement in tumours. Nat. Rev. Cancer. 3, 921-930 (2003).
- Dai, J., Ting-Beall, H. P., Hochmuth, R. M., Sheetz, M. P., Titus, M. A. Myosin I contributes to the generation of resting cortical tension. Biophys. J. 77, 1168-1176 (1999).
- Laferriere, J., Houle, F., Taher, M. M., Valerie, K., Huot, J. Transendothelial migration of colon carcinoma cells requires expression of E-selectin by endothelial cells and activation of stress-activated protein kinase-2 (SAPK2/p38) in the tumor cells. J. Biol. Chem. 276, 33762-33772 (2001).
- Dong, C., Slattery, M. J., Rank, B. M., You, J. In vitro characterization and micromechanics of tumor cell chemotactic protrusion, locomotion, and extravasation. Ann. Biomed. Eng. 30, 344-355 (2002).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유