JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
쥐 배아 신경 세포의 분리 및 문화 : 빠른 프로토콜
요약
우리는 쥐 배아에서 hippocampal과 대뇌 피질의 신경 세포를 분리하고 문화에 빠른 방법을 설명합니다. 이 프로토콜은 우리가 거의 순수의 연결을 문화가 요구되는 실험을 수행할 수 있습니다.
초록
우리는 E15-17 쥐의 배아에서 hippocampal 또는 대뇌 피질의 뉴런을 해리와 문화에 빠른 방법을 설명합니다. 절차는 마우스와 인간의 기본 뉴런과 신경 progenitors의 분리에 성공적으로 적용할 수 있습니다. Dissociated 뉴런은 몇 주간에 혈청이없는 배지에 보관됩니다. 이러한 문화는 nucleofection, immunocytochemistry, 핵산 준비뿐만 아니라, 전기 생리학을 위해 사용될 수 있습니다. 이전의 연결을 문화도 좋은 효율 lentiviral 형질 도입에 의한 속도와, 덜 효율적으로 인산 칼슘이나 lipofectamine과 같은 지질 기반 방법과 함께 transfected 수 있습니다.
프로토콜
1. 폴리-D-라이신 (PDL) : 준비
- 1 MG / ML의 주식 솔루션을 얻기 위해 PDL의 5 MG로 멸균 ddH 2 O 5 ML을 추가합니다.
- 여러 차례 pipetting하여 주식 솔루션을 섞는다.
- 즉시 사용하거나 2-8로 폴리-D-라이신 솔루션을 저장할 ° C.
2. 폴리-D-라이신 (PDL) : 코팅 플라스틱 세포 배양 접시
- 멸균 ddH 2 O을 갖춘 10 μg / ML의 최종 농도로 PDL 주식 솔루션을 희석.
- 문화 표면적 (60 밀리미터 접시 3 ML)를 커버하는 60 밀리미터 접시에 피펫 충분 솔루션입니다.
- 문화 표면에도 코팅을 보장하기 위해 부드럽게 신난다.
- 하룻밤 실온 (RT)에 코팅 번호판을 품어.
- 다음날, 보통 절개의 날, 흡인에 의해 폴리-D-라이신 솔루션을 제거하고 멸균 ddH 2 O를 3 ML로 간단히 씻어 이 단계를 반복합니다. 두 번째 세척 후 흡인에 의해 완전히 물을 제거합니다.
- 플레이트는 최대 3 주가에 대해 4 ° C에 저장할 수 있습니다.
3. 폴리-D-라이신 (PDL)과 Laminin : 유리의 준비 및 코팅 투 챔버 슬라이드
- 각각 10, 5 μg / ML의 최종 농도로 멸균 ddH 2 O의 혼합 PDL (1 밀리그램 / ML)과 laminin (1 밀리그램 / ML) 증권 솔루션.
- 유리의 우물 두 챔버 슬라이드 문화 표면적 (이 아니라 유리 두 챔버 슬라이드의 각도 1 ML)을 충당할로 피펫 충분한 솔루션입니다.
- 문화 표면에도 코팅을 보장하기 위해 부드럽게 신난다.
- 하룻밤 RT에서 코팅 번호판을 품어.
- 다음 날에는 열망을 통해 폴리-D-라이신-Laminin 코팅 용액을 제거하고 멸균 ddH 2 O에 1 ML로 두 번 간단히 씻고 두 번째 세척 후 흡인에 의해 완전히 물을 제거합니다.
- 상공 회의소 슬라이드는 최대 3 주가에 대해 4 ° C에 저장할 수 있습니다.
참고 : 모든 유리 챔버 슬라이드가 따라와에게 입혀져 수g이 프로토콜. 각 슬라이드 컨트롤을 테스트 실험적인 설정을 (예를 들어 치료 비교 치료, untransfected 대 transfected) 제공하기 때문에 우리는 종종 두 챔버 슬라이드를 사용합니다.
4. 의 연결을 해부와 문화
- 37 ° C의 물을 욕조에 다음과 같은 시약을 따뜻하게 :
- 원래 100 ML 병에 TrypLE 익스프레스.
- Neurobasal/B27 완전한 매체 (표 I 참조). 예열 볼륨 (10 60mm 도금 요리 등 30 ML) 도금이 될 접시의 수에 따라 달라집니다.
- 네 60mm 배양 접시 15 ML BD 팔콘 높은 선명도의 폴리 프로필렌 원뿔 튜브 13 ML에서 차가운 최대 절전 E 솔루션 3 ML을 추가합니다.
- 세 100mm 문화 요리 각 차가운 해부 매체 (표 II, 박사 Olimpia Meucci, 개인 통신 참조) 25-30 ML을 추가합니다. 매체의 큰 볼륨을 포함하는이 번호판은 즉시 그 후 배아를 씻어 사용됩니다amniotic 주머 니나 (단계 4.7 및 4.8)에서 제거.
- 실험실 동물의 동물 애호 관리 및 사용에 대한 보건 서비스 정책에 따라 그리고 institutionally 승인된 동물 보호 아래에서 CO 2가 E17 초과 임신 쥐를 안락사와 프로토콜을 사용합니다.
- 70 % EtOH로 낮은 복부를 뿌려서 자궁과 태아를 노출 가위로 피부와 근육을 통해 medially 했네요.
- 모든 fetuses를 제거하고 차가운 해부 매체 (25-30 ML 단계 4.3 참조) 초과를 포함하는 무균 100 mm 접시에 그들을 배치.
- amniotic SAC에서 가위의 작은 쌍을 사용하여 배아를 잘라 차가운 해부 매체를 포함하는 두 번째 100 mm 접시에 그들을 배치.
- 5-10초 대한 부드럽게 틸팅 100-mm 요리하여 실온에서 배아 씻으십시오. 그 다음 해부 매체를 포함하는 세 번째 100mm 접시에 씻어서 배아를 전송합니다. 과도한 중간의 두 세차장은 일반적으로 혈액의 모든 흔적을 제거하기에 충분합니다. 다만, NECessary, 차가운 해부 매체 25-30 ML을 포함하는 새로운 100 mm 접시를 사용하여 한 번 더 씻는다.
- stereomicroscope과 곡선 포셉 사용하여 피부와 두개골을 철수하여 각 쥐의 배아의 두뇌를 추출합니다. 감기 최대 절전 엑스타 60 mm 요리 (일반적으로, 요리 당 더이상 5 달러 뇌를 포함) 얼음이 번호판을 보관 중 하나로 전체 두뇌를 놓습니다.
- 한 번에 한 접시를 타고, 해부 현미경, 반구를 분리하고 midbrain과 meninges 제거 대뇌 cortices을 분리할.
- 옵션 : 중간선을 따라 커팅 두뇌가 hippocampi를 추출하고, hippocampal 신경 세포를 분리하려면 아래 절차를 따르십시오.
- 모든 해부가 완료될 때까지 얼음 대뇌 cortices를 남겨 추위 최대 절전 E. 13 ML을 포함하는 15 ML 맑은 원뿔 튜브의 모든 해부 cortices를 수집합니다. 그들의 작은 크기로 인해 해부 hippocampi 대신 15 ML 튜브의 1.5 ML Eppendorf 튜브에 수집 할 수 있습니다. 또는이 단계 cortices에서 원하는 경우hippocampi가 1 ML을 포함 cryotube의 유리병에 삽입하실 수 있습니다 최대 절전 E + 2% B27 + Gentamicin (50 μg / ml) 쇼핑은 2-4 cortices이나 유리병 당 2-4 hippocampi의 비례 + Fungizone (250 NG / ML). 뇌 조직은 한 개 주 (이후 시간은 아직 테스트되지 않은)에 대해 어두운 4 ° C에 저장할 수 있습니다. 필요한 경우, 최대 절전 E를 포함하는 15 ML 관으로 뇌 조직을 전송하고 뉴런을 분리하기 위해 아래의 프로토콜을 따르도록 미세 집게를 사용합니다.
- 조직 문화 후드에 튜브를 전송합니다. cortices는 튜브의 바닥에 정착 후 신중하게 뜨는을 제거하도록 허용합니다.
- , 15 ML 원뿔 튜브에 신선한 최대 절전 전자 13 ML 추가 cortices는 튜브의 아래쪽에 정착 허용하고 신중하게 뜨는을 제거합니다. 이 2 단계로 여러 번 반복하고 마지막 세척 후 신중하게 모든 미디어를 제거합니다.
- 따뜻한 TR의; 효소 1-2 ML을 (hippocampi 절연을위한 더 적은을 사용 cortices의 숫자에 따라 다름) 추가하여 대뇌 cortices을 소화ypLE 익스프레스. Parafilm와 튜브의 뚜껑을 밀봉하고 10 분간 37 ° C의 물을 욕조에 튜브는 역부족.
- 뚜껑을 열기 전에 70 %의 에탄올과 함께 튜브를 뿌려서 cortices는 튜브의 아래쪽에 정착하고 뜨는을 제거하도록 허용 최대 절전 E. 10 ML을 추가합니다. 이 단계에게 TrypLE Express를 씻어 세 번 반복합니다. 마지막 단계에서 신중하게 모든 미디어를 제거합니다.
- 부드럽게 (4-5 회) 불타는 광택 유리 파스퇴르을 (직경 약 1 ㎜)를 사용 Neurobasal/B27 전체 매체 중 2 ML에서 cortices를 씹다. 거품을 피하기 위해주의하십시오.
- 직경이 작은 유리 멸균 파스퇴르 피펫 (즉, 직경 1/2-3/4 mm 약 피펫)와 다른 4-5 번 반복합니다. 파스퇴르 피펫에게 이것보다 더 작은을 사용하지 마십시오 아니면 세포를 파괴하는 것입니다.
- 정착 (해당되는 경우, 일반적으로 거의)는 조직의 나머지 조각이 소요됩니다.
- 조직의 정착 조각 남겨두고, 새로운 15 ML 관에 상단 단일 세포 현탁액을 전송합니다. 모피Neurobasal/B27 완전한 매체로 10-12 ML에 세포 현탁액을 희석 군터.
- 잘 섞어서 1.5 ML Eppendorf 튜브에 50x 카운팅 솔루션 (표 III 참조) 490 μl에 세포 현탁액의 10 μl를 추가하여 계산을위한 세포를 희석.
- 5.0 × 10 4 / cm 2의 밀도에서 PDL-코팅 차량 번호판 플레이트 세포. nucleofection가 수행되어야하는 경우, 우리는 더 높은 농도 (8-10 × 10 4 / cm 2)에 세포를 도금하는 것이 좋습니다.
- 약 13 X 10 6 뉴런은 각 E17 태아에서 파생됩니다로서 일반적으로, 우리는 실험마다 9-10 fetuses 해부. 더 많은 배아가 필요한 경우, 모든 절차가 2 시간 이상 지속 있지 않은지 확인하십시오.
- 원하는 경우, 24 시간 격리 후, 사이 토신-β-D-arabinofuranoside (AraC) 10 μm의는 glial 확산을 방지하기 위해, 각 요리에 추가할 수 있습니다. Neurobasal/B27 매체가 glial 증식을 억제 이후 그러나,이 단계는 필요하지 않습니다같은 제조 업체의 권고 당 (Invitrogen / Gibco).
- 정확한 시간은 원하는 분화 단계에 따라 달라집니다 있지만 뉴런은 체외에서 4~5일 후 실험에 사용될 수 있습니다. 우리는 생존에 큰 감소 (그림 1)없이 최대 4 주를위한 교양 뉴런 있습니다.
- 확장 culturing 들어, 신선한 Neurobasal/B27 완전한 매체로 매주 culturing 매체를 교체하십시오.
5. 대표 결과
유리 챔버 슬라이드에서 배양해 신경 세포는 immunocytochemistry를 받게됩니다. 그림 1은 문화의 수술 5 일 후에 고정하고의 연결 프로세스를 보여 방지 MAP-2 항체와 immunolabeled 대뇌 피질의 신경 세포의 전형적인 이미지를 보여줍니다.
그림 2는 문화 3 주 후에 쥐 hippocampal 신경 세포의 대표 이미지를 보여줍니다. 완전히 차별화된 세포의 연결 형태는 MAP-2에 의해 강조되는 전mmunolabeling (MAP-2의 연결 마커, 마우스 단클론 항체 클론 AP-20, 텍사스 진, 얼바인, 캘리포니아) 이전에 1에서 설명하는 것처럼 표준 절차에 따라. 이미지 EXI 아쿠아 카메라 (Qimaging), 동력 Z 축 및 SlideBook5 수집 / deconvolution 소프트웨어 (지능형 이미징 이노베이션, 주식, 덴버, CO)가 장착된 니콘 이클립스 E400 직립 형광 현미경으로 시각했다. 각 그림의 입체 영상 시리즈는 한 2 차원 사진에 deconvoluted와 해상도를 높이기 위해 근처 최대한의 강도로 신호를 차단 조정하여 해결이되었습니다.
그림 3의 연결을 문화의 순도를 보여줍니다. 단백질 lysates은 DIV7 쥐의 연결을 문화 (CTX)에서와 인간 glioblastoma (GBM)의 사례에서 얻을되었다. 예상했던대로의 연결 lysate는 단백질의 연결 MAP-2 및 astrocytic 마커 GFAP에 대한 부정에 대한 강한 긍정이다; GBM 단백질 lysate는 부정적인 F 동안또는 GFAP에 대한 MAP-2 및 양성.
우리의 프로토콜에 우리가 매체를 해부하고 rinsing 등 몇 년 동안 최대 절전 모드 E를 사용하고 있습니다만, 최근에 우리는 더 이상 사용하기 위해 뇌 조직을 보존하기 위해 그것을 추가하고 매우 실용적인 사용을 살펴 보았다. 그림 4는 시험 관내 5 (DIV5)의 일 설명 배아에서 원래 절개 후에 최대 절전 E + B27에 1 주일 동안 4 ° C에 보관 cortices 격리 쥐의 대뇌 피질 뉴런의 문화. 뉴런는 이전에 설명한대로 PDL과 laminin과 코팅 유리 두 챔버 슬라이드를 도금했다. 획득한 이미지가 SlideBook5 수집 / 위에서 설명한대로 deconvolution 소프트웨어 (그림 2)를 사용 deconvoluted되었습니다.

그림 1. pmaxGFP (Amaxa, Lonza, Walkersville, MD)와 nucleofected 및지도 immunolabeled 대뇌 피질의 신경 세포 대표 이미지-2 항체, 빨간색 인치 원본 배율 100x.
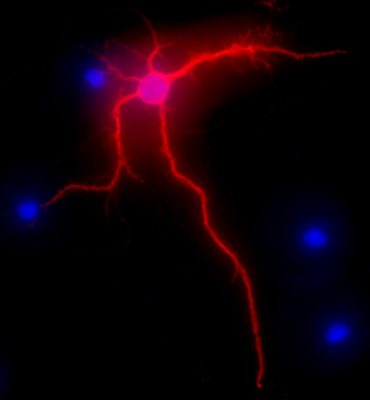
그림 2. 문화 3 주 후에 hippocampal 뉴런 중에 빨간색으로, MAP-2 immunolabeling을 보여주는 대표 이미지입니다. DAPI의 염색법은 파란색으로, 세포의 핵을 보여줍니다. 원본 배율 40x.

의 연결을 세포 배양의 순도를 보여주는 그림 3. 서양 얼룩. 쥐의 연결과 인간 GBM 단백질 lysates의 30 μg는 전기 영동에 의해 분리 및 표준 절차 1을 다음과 서양 얼룩 분석에 노출되었다. 안티 - MAP-2가 세포 시그널링 (덴버스, MA)에서 polyclonal 토끼, 안티 GFAP 항체는 Chemicon (Millipore, Billerica, MA)에서 단클론 마우스이었고, 마우스 단클론 항 GRB2 항체는 BD의 형질 도입 연구소 (에서왔다 스파크, MD). GRB2은 하중 제어로 사용되었다.

그림 4. 대표 체외 5 일 사진 (DIV5)에 남아 cortices에서 얻은 쥐의 대뇌 피질의 뉴런 최대 절전 E 그들의 절개 후 일주일 동안 ° C에서 4 번 + B27. 유리 두 챔버 슬라이드에서 배양해 신경 세포의) 위상 대조. 원본 배율 20X. B) Immunofluorescence 녹색에의 연결 과정에 MAP-2의 표현을 보여주는, 문화가 astrocytic 마커 GFAP에 대해 부정적이었다. DAPI의 염색법은 파란색으로, 세포의 핵을 나타냅니다. 원본 배율 40x.
토론
쥐 hippocampal과 대뇌 피질 뉴런의 해부 · 문화의 방법은 여기에서 설명한 화학적으로 정의된 매체 (그림 3) 재배 거의 순수의 연결 문화권을 사용하여 실험을 수행할 수 있습니다. 혈청 프리 미디어 culturing 거의 순수 뉴런에 대한 프로토콜 이전에 2,3,4를 설명되어 있지만, 우리의 방법으로 만들어진 중요한 변화가 없습니다. 기존의 프로토콜과는 다른 (즉 은행 외.) 5, 우...
공개
관심의 어떠한 충돌 선언 없습니다.
감사의 말
우리는 편집 지원 Jonna 엘리스 감사드립니다. 정신 건강의 국립 연구소에서 : 설명이 프로젝트는 보너스 번호 R01MH079751 (F. Peruzzi PI)에 의해 지원되었다. 내용은 전적으로 저자의 책임이며 반드시 정신 건강의 국립 연구소 또는 국립 보건원의 공식 견해를 대변하지 않습니다.
자료
| Name | Company | Catalog Number | Comments |
| 시약 | 집중 | ||
| Neurobasal | 98% | ||
| B27 | 2퍼센트 | ||
| Glutamax | 0.5 MM |
표 I. Neurobasal/B27 완료 매체.
| 시약 | 집중 |
| 포도당 | 16 MM |
| 자당 | 22 MM |
| HEPES | 10 MM |
| NaCl | 160 MM |
| KCl | 5 MM |
| 나 2 HPO 4 | 1 ㎜ |
| KH 2 PO 2 | 0.22 MM |
| Gentamicin | 50 μg / ML |
| Fungizone | 250 NG / ML |
| 산도 | 7.4 |
| Osmolarity | 320-330 mOsm |
표 II. 해부 매체.
| 시약 | 볼륨 (μl) |
| Neurobasal/B27 완료 매체 | 240 |
| Trypan 블루는 0.4 %를 청바지 | 250 |
| 합계 | 490 |
표 III. 솔루션을 계산 50x.
표 IV. 특정 시약.
| 시약 | 회사 | 고양이. 번호 |
| 최대 절전 E | Brainbits | 767,171 |
| Neurobasal | Gibco, Invitrogen | 21103-049 |
| B27 | Gibco, Invitrogen | 17504-044 |
| Fungizone | Gibco, Invitrogen | 15290-018 |
| Gentamicin 황산 | 시그마 알드리치 | G1264 |
| Glutamax 200 MM | Gibco, Invitrogen | 35,050 |
| TrypLE 익스프레스 W / O 페놀 레드 | Gibco, Invitrogen | 12,604 |
| 사이 토신-β-D-arabinofuranoside 하이드로 클로라이드 | 시그마 알드리치 | C6645 |
| 폴리-D-라이신 | 시그마 알드리치 | P6407 |
| Laminin 1 MG / ML | Millipore | CC095 |
| HEPES | 시그마 알드리치 | H3375 |
| Trypan 블루는 0.4 %를 청바지 | Gibco, Invitrogen | 15,250 |
| 장비 | 회사 | 고양이. 번호 |
| 스테레오 현미경 | 올림포스 산 | SZ61 |
| 대형 집게 | FST | 11022-14 |
| 미세 스쳐 포셉 | 모리아 | MC40B |
| 마이크로 미세 스쳐 포셉 | 모리아 | MC31 |
| 면도칼 같은 날카로운 가위 | Roboz | RS-6820 |
| 마이크로 분석 해 봅시다 가위 | FST | 91460-11 |
| 마이크로 곡선 가위 분석 해 봅시다 | FST | 14067-11 |
| 유리 2 챔버 슬라이드 | 실험실 - 테크 | 154,461 |
| 60mm 요리 | BD 팔콘 | 353,002 |
| 100mm 요리 | 코닝 | 430,167 |
| 15 ML 튜브 | BD 팔콘 | 352,099 |
| 1.5 ML cryo-튜브 약병 | Nunc | 375,353 |
표 V. 특정 장비.
참고문헌
- Aprea, S. Tubulin-mediated binding of human immunodeficiency virus-1 Tat to the cytoskeleton causes proteasomal-dependent degradation of microtubule-associated protein 2 and neuronal damage. J. Neurosci. 26, 4054-4062 (2006).
- Kivell, B. M., McDonald, F. J., Miller, J. H. Serum-free culture of rat post-natal and fetal brainstem neurons. Brain Res. Dev. Brain Res. 120, 199-210 (2000).
- Kivell, B. M., McDonald, F. J., Miller, J. H. Method for serum-free culture of late fetal and early postnatal rat brainstem neurons. Brain Res. Brain Res. Protoc. 6, 91-99 (2001).
- Brewer, G. J. Serum-free B27/neurobasal medium supports differentiated growth of neurons from the striatum, substantia nigra, septum, cerebral cortex, cerebellum, and dentate gyrus. J. Neurosci. Res. 42, 674-683 (1995).
- Banker, G., Goslin, K. . Culturing nerve cells. , (1998).
- Eletto, D. Inhibition of SNAP25 expression by HIV-1 Tat involves the activity of mir-128a. J. Cell Physiol. 216, 764-770 (2008).
- Gualco, E. IGF-IR-dependent expression of Survivin is required for T-antigen-mediated protection from apoptosis and proliferation of neural progenitors. Cell Death Differ. 17, 439-451 (2010).
- Gage, F. H. Survival and differentiation of adult neuronal progenitor cells transplanted to the adult brain. Proc. Natl. Acad. Sci. U.S.A. 92, 11879-11883 (1995).
- Keyser, D. O., Pellmar, T. C. Synaptic transmission in the hippocampus: critical role for glial cells. Glia. 10, 237-243 (1994).
- Pfrieger, F. W., Barres, B. A. Synaptic efficacy enhanced by glial cells in vitro. Science. 277, 1684-1687 (1997).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유