JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
T Lymphocytes쪽으로 유도 Pluripotent 줄기 세포의 분화 감독
요약
유도된 pluripotent 줄기 (IPS) 세포로부터 T lymphocytes의 생성은 T 세포 기반 immunotherapy에 대한 배아 줄기 세포를 사용하는 대체 방식을 제공합니다. 방법 중 하나를 이용하여 알게됩니다 체외에서 또는 생체내에서 유도 시스템, IPS 전지는 종래와 항원에 특정한 모두 T의 lymphocytes로 차별하실 수 있습니다.
초록
항원에 특정한 CD8 + 세포 독성 T의 lymphocytes (CTLs)의 입양 셀 전송 (ACT)는 malignancies 1 다양한 유망한 치료법입니다. CTLs은 악성 세포를 죽이는 T 세포 수용체 (TCR) 및 릴리스 cytotoxins뿐만 아니라 크린 시토킨과 종양 항원을 상호 작용하여 악성 세포를 인식할 수 있습니다. 이러한 CTLs가 높은 proliferative 잠재력을 가지고 있기 때문에 그것은, 덜 차별 및 중앙 메모리 같은 (반응성이 매우 높은 되나) CTLs 행동 기반 immunotherapy에 대한 최적의 인구가있는 것으로 알려져 더욱 차별화된 세포보다 apoptosis에 적은 경향이 있으며이 생체 항상성 크린 시토킨 2-7에 대응하기 위해 높은 능력. 그러나 환자로부터 그런 CTLs의 높은 숫자를 얻기의 어려움으로 인해, 성공적인 ACT 기반 요법에 대한 반응성이 매우 높은 자세 특정 CTLs을 생성하기 위해 새로운 접근 방법을 찾기 위해 긴급 필요가있다.
자체 재생 줄기의 TCR의 형질 도입면역 reconstitution에 대한 세포는 질병 8-10의 치료에 대한 치료 가능성을 가지고 있습니다. 그러나, 환자의 배아 줄기 세포 (ESCs)을 구하는 접근 가능하지 않습니다. 치료 목적으로 조혈 줄기 세포의 사용 (HSCs)가 널리 클리닉 11-13으로 적용되었지만, HSCs는 차별화 및 proliferative 용량을 감소하고, HSCs은 체외의 세포 배양 14-16로의 확장하기가 어렵습니다. 최근 IPS 세포 기술과 유전자 전달을위한 체외 시스템의 개발은 어떤 수술 방법이없는 환자에서 IPS 세포를 생성할 수 있습니다. 또한, ESCs처럼, IPS 세포는 체외에서 무기한 proliferative 용량을 가지고 있고 조혈 세포로 차별화하는 표시되었습니다. 따라서 IPS 세포는 ESCs이나 HSCs에 비해 ACT 기반 immunotherapy에 사용될 수있는 큰 잠재력을 지니고 있습니다.
여기서는 T lympho의 생성을위한 방법을 제시체외에서의 IPS 세포에서 cytes 및 암 면역 감시를 홍보를위한 IPS 세포의 항원에 특정한 CTLs의 생체내 프로그래밍 인치 노치 리간드와 체외에서의 자극은 IPS 세포에서 T 세포 분화를 몰고, 그리고 종양의 성장을 방지 생체내에서 항원에 특정한 T 세포로 차별 IPS 세포의 TCR 유전자 형질 도입 결과. 따라서, 우리는 IPS 세포에서 항원에 특정한 T 세포 분화를 보여줍니다. 우리의 연구는 ACT 기반 요법에 대한 항원에 특정한 CTLs 창출을위한 잠재적으로보다 효율적인 접근 방식을 제공하고 질병에 대한 치료 전략의 개발을 용이하게합니다.
프로토콜
1. 세포 배양
- 문화 (irSNL76 / 7) SNL76 / 7 조사 피더 세포의 준비.
SNL76 / 7 세포는 일반적으로 10% 태아 소 혈청 (FBS) Dulbecco의 수정일 독수리 중간 (DMEM) 매체에 보관됩니다.- 액체 질소에서 SNL76 / 7 세포를 복구하기 전에 30 분 보육, 문화 접시 또는 플라스크는 37에서 0.1 % 젤라틴 용액 ° C로 코팅됩니다.
- SNL76 / 7 세포 confluency 도달하면 세포가 떨어져 trypsinized 5 분 대한 400g에 centrifuged 신선한 매체 resuspended됩니다.
- Resuspended SNL76 / 7 세포는 5,000 래드의 복용으로 60 공동의 irradiator에 반구됩니다.
대체 접근 방식은, SNL76 / 7 세포를 마우스 배아의 섬유아 세포 (MEF)과 mitomycin-불활 성화에 의해 대체될 수있는 것은 방사선을 대체할 수 있습니다. - 조사 후, 전지은 5 분 400g에 centrifuged 것이며로 10% 디메틸 sulfoxide (DMSO) FBS 동결 버퍼 나누어지는에 resuspendedcryovials 및 향후 사용을위한 액체 질소에 보존하고있다.
- 시험 관내 분화에 대한 OP9-DL1 세포의 준비.
OP9-DL1 전지는 일반적으로 20% FBS α-최소한의 필수적인 매체 (α-MEM) 미디어에서 유지됩니다. 그들이 confluency 세포에 도달하면 1시 5분 희석으로 분할됩니다. - E.G7 thymoma 세포의 준비.
E.G7 thymoma 세포는 일반적으로 10% FBS 로즈웰 파크 기념 연구소 매체 (RPMI) -1640 매체에 유지됩니다. 그들이 confluency에 도달하면 세포 1시 10분 희석으로 분할됩니다. - IPS 및 TCR-transduced IPS 세포의 일반 유지 보수.
- 문화 요리는 irSNL76 / 7 피더 세포에게 미리 복구 또는 IPS 세포의 분할 중 하루를 퍼뜨리고하기 전에 30 분 37 ° C에서 0.1 % 젤라틴 용액으로 코팅됩니다.
- IPS 세포 분할 경우, 전지은 5 분 400g에 centrifuged, 오프 trypsinized됩니다 15 % FBS DMEM 미디어 resuspended.
- Trypsinized IPS세포는 37에서 30 분간 신선한 문화 접시에 incubated됩니다 ° C 배양기 차별화된 세포 및 잔류 피더 세포를 제외할 신선한 irSNL76 / 7 피더 세포 precoated 접시에 퍼뜨리고 전에.
- 부화 후 4 × 10 6 세포 100mm 문화 접시에 놓는 것입니다.
2. 체외 프로그래밍에서
- 시험 관내 coculture 시스템합니다.
- 주 0, 5x10 4 IPS 세포를 20 % FBS α-MEM 미디어에 합류 OP9-DL1 세포 단일층를 포함하는 100mm 문화 접시에 놓는 것입니다.
- 3 일 때, 문화 미디어는 신선한 것들로 변경됩니다.
- ° C 배양기 37 30 분 동안 신선한 100mm 문화 접시에 잠복기 전에 5 일째에 세포 해제 trypsinized되며 5 분 동안 400g에 centrifuged.
- 떠다니는 세포를 수집하여 계산되며, 5x10 5 세포는 신선한 문화로 전송됩니다20% FBS α-MEM 미디어에 합류 OP9-DL1 세포 단일층를 포함하는 음식. 시토킨는 mFlt-3L (최종 농도 : 5 NG / ML) 문화에 추가됩니다.
- 일 8 시에 느슨하게 연결된 전지는 부드럽게 아래로 피펫됩니다.
- 부분적으로 차별 IPS 세포의 최대한의 복구를 얻기 위해 10 ML PBS 한 번만 더 함께 OP9-DL1 먹이 레이어를 씻으십시오.
- coculture에서 세포를 수확 후에 전지은 5 분 400g에 centrifuged되며에서 resuspended 20% FBS mFlt-3L (5 NG / ML) 및 MIL-7 (1 NG / ML)로 보완 α-MEM 미디어.에게
- 세포가 합류 OP9-DL1 전지로 코팅 6 - 잘 배양 접시로 전송됩니다. 일반적으로 100 밀리미터 문화 요리에서 발견한 IPS 세포는 6 잘 접시의 잘 하나에 전송됩니다.
- 10 일째부터, 문화 미디어 (격일로 변경됩니다 20% FBS α-MEM 미디어 supplementemFlt-3L (5 NG / ML) 및 MIL-7 (1 NG / ML))와 D.
- 문화 번호판 OP9-DL1 세포가 피더 세포의 성장에 따라 4-6일으로 변경됩니다 피더로 코팅.
- 부분적으로 차별 IPS 세포의 생체내 성숙합니다.
- 30 분간 37 ° C에서 coculture의 날 22 일, IPS 세포는 떨어져 trypsinized됩니다 5 분 동안 400g에 centrifuged하고 신선한 문화 접시에 incubated.
- 떠다니는 세포는 생쥐에게 폐 색전증을 일으킬 수 세포 대단히 짧은 시간을 제외 ~ 70 μm의 나일론 스트레이너 통과 수집 차가운 PBS로 세 번 씻어됩니다.
- 전지는 1.5x10 7 셀 / ML의 농도로 PBS에 resuspended됩니다.
- 세포 주입하기 전에 빙판에 유지됩니다.
- 꼬리 정맥을 통해 IV 주입하기 전에, 마우스들은 꼬리 정맥을 치료하는데 적외선 불빛 아래에 배치됩니다.
- 정맥 D 이후ilatation, 200 μl 세포 현탁액 또는 3x10 6 전지 adoptively 꼬리 정맥을 통해 B6.129S7-Rag1 tm1Mom / J-마우스 옛 사주로 전송됩니다. 3 주는 부분적으로 차별 IPS 세포의 생체내 성숙에 사용할 수 있습니다.
- 평가.
- 차별화된 세포와 세포 회복 속도 형태학의 변경됩니다. 그림 1.
- OP9-DL1 세포와 coculture의 다른 일에서 살아있는 세포 그림은 기존의 현미경으로 수행됩니다.
- 세포 회복 률은 문화에서 수확한 세포의 수에 따라 계산됩니다.
- 표면 마커의 변화 흐름 cytometric 분석. 그림 2A.
- coculture의 다른 일에 세포 trypsinization하여 문화에서 제거되며 세포 표면 염색법으로 진행하기 전에 차가운 PBS로 씻어.
- 지혜를 더럽히는 것 전에H 다른 fluorochrome 복합 항체가 세포는 20 분 동안 4 ° C에서 FC 차단 24G2에 의해 차단됩니다.
- 4 더럽히는 것 이십분 후 ° C, 세포 흐름 cytometric 시험 전에 차가운 PBS로 세 번 씻어됩니다.
- 체외 차별화된 IPS 세포 인치 그림 2B의 활성화.
- 활성 분석 전 어느 날, precoat 안티 인 경우에는 3 번 CD (최종 농도 : 4 μg / ML, PBS)을 가진 24 잘 번호판 4시 ° C에서 하룻밤.
- coculture의 날이 22 일, IPS 세포는 파생된 T 세포는 문화에서 수확되며 플레이트 코팅 안티 인 경우에는 3 번 CD 및 용해 방지 CD28의 항체 (최종 농도 : 4 μg / ML)로 자극하기 전에 차가운 PBS로 씻어.
- 부화는 37 년에 실시됩니다 그때 ° C에서 40 시간 동안 5퍼센트 CO 2 배양기와 다른 4 시간 동안은 문화에 추가됩니다 Befeldin.
- coculture의 끝에서 세포하겠다 될 것입니다기득권, 씻어하고 위에서 설명한 FC의 차단에 의해 차단되었습니다. 차단된 세포 fluorochrome 복합 항체를 사용하여 CD8 및 TCR Vβ 체인과 같은 표면 마커에 대해 물들일 것이다.
- 세포 표면 염색법 후, 세포는 4 %의 포름 알데히드를 사용하여 고정되며 Biolegend의 Permeabilizing 키트를 사용하여 permeabilized.
- permeabilization 후, IL-2와 IFN-γ와 같은 세포내 분자 fluorochrome 복합 항체를 사용하여 물들일 것이다.
- 최종 흐름 cytometric 시험하기 전에, 전지는 과도한 항체를 제외하도록 차가운 PBS로 세 번 씻어됩니다.
- 쥐 - 신문 - /의 성숙.
- 생체내 개발, 헝겊-/ 3 주 후에 - 마우스가 희생될 것이며, 비장과 림프절 마우스에서 제거됩니다.
- 단일 세포는 기계적 분해를 통해 처리됩니다. 적혈구는 ACK 용해 버퍼와를 사용하여 lysed됩니다mononucleocytes를 모으고 차가운 PBS로 두 번 씻어됩니다.
- 세차 후, 세포는 20 분 동안 4 ° C에서 FC 차단 24G2으로 차단되며, 차단의 끝부분에, 세포는 다른 fluorochrome 복합 안티 인 경우에는 3 번 CD, 안티 CD4, 안티 CD8 및 안티 TCRβ 항체에 물들일 것이다 4 ° C에서 20 분.
- 염색법의 끝에서 세포 흐름 cytometric 시험 전에 차가운 PBS로 세 번 씻어됩니다.
- 차별화된 세포와 세포 회복 속도 형태학의 변경됩니다. 그림 1.
3. 생체내 프로그래밍에서
- retroviral 구조의 생성.
- MSCV-IRES-DsRED (MiDR) 벡터는 DsRED 유전자와 GFP 유전자를 대체하여 MSCV-IRES-GFP 벡터를 기반으로 구성되어 있습니다.
- OT-I T 세포 수용체 유전자는 OT-I/MiDR가 건설하게 MiDR 벡터로 subcloned있다.
- Retroviral 형질 도입과 셀 정렬.
- 작은지면, E, 포장 세포 ARe는 다음과 형질 도입을 위해 사용됩니다 pseudovirus를 생성하는 데 사용됩니다.
- 3x10 6 작은지면-E 세포는 transfection 이전 100 밀리미터 문화 접시 하루에 놓는됩니다.
- 일 0에서 작은지면-E 세포로 transfected됩니다 OT - 내가 GeneJamma의 transfection 시약을 사용하여 플라스미드 MiDR.
- 제 1 일 일, 1x10 6 IPS 세포는 0.1 % 젤라틴 precoated 24 - 잘 접시의 잘 하나에 놓는 것입니다.
- 일 2 일, pseudovirus은 함유 작은지면, E, 문화 뜨는을 잠재적인 오염 물질을 제외하도록 필터를 0.4 μm의를 통해 수집하여 전달됩니다.
- 형질 도입은 5 μg / ML의 polybrene의 면전에서 1 시간 1,400 rpm으로 32 ° C 원심 분리기의 조건 하에서 수행됩니다.
- 원심 기반 형질 도입 후, 세포는 32 ° C, 밤 동안 5% CO 2 배양기에 배치됩니다.
- 3 일에, 오늘날이 tra를 반복위에서 설명한대로 nsduction 절차. 6 - 잘 판은 나중에 사용할 수 irSNL76 / 7 피더 세포로 precoated됩니다.
- 일 4 일, IPS 세포는 5 분 400g에 centrifuged 및 precoated irSNL76 / 7 피더 세포에 놓는, 오프 trypsinized됩니다 transduced.
- confluency에서 세포가 떨어져 trypsinized 5 분 동안 400g에 centrifuged과 셀 정렬을위한 처리됩니다. GFP 및 DsRED 이중 긍정 세포 MoFlo 세포 분류기 따라 정렬됩니다. 정렬 세포는 나중에 사용하기 위해 irSNL76 / 7 피더 세포에 배양해됩니다.
- 작은지면, E, 포장 세포 ARe는 다음과 형질 도입을 위해 사용됩니다 pseudovirus를 생성하는 데 사용됩니다.
- 입양 전송 및 종양 도전.
OT - 나 TCR은 위에서 설명한대로 IPS (OT-I/iPS) 세포는 일반적으로 irSNL76 / 7 피더 세포에서 유지됩니다 transduced.- 입양 송금 당일 OT-I/iPS 세포가 떨어져 trypsinized하고 5 분 동안 400g에 centrifuged 신선한 매체 resuspended.
- 삼십분은 37의 신선한 문화 접시에있는 인큐베이션는 ° C 배양기는 차별화된 세포를 제거하는 데 필요합니다및 잔여 피더 세포.
- 부화의 끝에서 떠있는 세포 5 분 동안 400g에서 수집하여 centrifuged됩니다.
- 세포 펠렛은 세 번 차가운 PBS로 씻어되며, 세포는 세포 대단히 짧은 시간 (2X 여과)을 제외하는 방법에는 다음 두 세차장의 사이에 70 μm의 나일론 스트레이너를 통해 전달됩니다.
- 1.5x10 7 셀 / ML의 농도로 세척 후 세포가 계산되며 차가운 PBS로 resuspended.
- 세포 주입하기 전에 빙판에 유지됩니다.
- 입양 전송의 경우, 4-6 주 된 여성 C57BL/6J 마우스가 사용됩니다. 꼬리 정맥을 통해 IV 주입하기 전에, 마우스들은 꼬리 정맥을 치료하는데 적외선 불빛 아래에 배치됩니다.
- 정맥 팽창 후, 200 μl 세포 현탁액 또는 3x10 6 전지 adoptively 꼬리 정맥을 통해 전송됩니다. OT - 나 TCR의 생체내 성숙에 IPS 세포를 transduced위한 6 주이 허용됩니다.
- IV 주입 여섯 주가 지난 후, 4x10 6 E.G7 thymoma 전지는 intraperitoneally을 주사한다.
- E.G7 thymoma 전지는 문화에서 수확하고 PBS로 세 번 씻어됩니다.
- 세차의 끝에서 세포는 8x10과 7 셀 / ML의 농도에 차가운 PBS에 보류됩니다.
- 50 μl 세포 현탁액 또는 4x10 6 전지는 복막 캐비티에 주입됩니다.
- 평가.
- 시험 관내에는 OT-I TCR의 특성화는 IPS 세포를 transduced.
- DsRED의 형광 현미경 검사는 GFP 이중 긍정 세포는 고정되지 않은 살아있는 세포와 함께 기존의 형광 현미경으로 수행됩니다.
- 유전자 통합 및 표현은 PCR 및 RT-PCR 분석을 모두에 의해 분석됩니다.
- 세포의 DNA 또는 RNA는 Qiagen의 DNA 이상을 사용하여 샘플을 별도로 격리됩니다RNA 분리 키트.
- PCR 및 RT-PCR은 특히 TCR Vβ5 체인의 recombined VDJ 영역을 인식 primers를 사용하여 수행됩니다.
- T 세포 발달과 성숙. 그림 3A.
- 주 2에서는 4와 6 포스트 셀 전송, 동물이 희생되며, 비장, 림프절은 동물에서 제거됩니다.
- 단일 세포 현탁액은 기계적 고장을 통해 이루어집니다. 적혈구를 모으고 차가운 PBS로 두 번 씻어됩니다 ACK 용해 버퍼와 mononucleocytes를 사용하여 lysed됩니다.
- 세차 후, 세포는 20 분 동안 4 ° C에서 FC 차단 24G2으로 차단되며, 차단의 끝부분에, 세포는 20 분 동안 4 가지 fluorochrome 복합 항체 ° C로 aliquotted 및 물들일 것이다.
- 염색법의 끝에서 세포 흐름 cytometer에로드하기 전에 차가운 PBS로 세 번 씻어됩니다.
- 펩타이드의 자극. 그림 3B.
- 종양 도전의 날이 50 일, 동물 희생되며, 비장, 림프절은 동물에서 제거됩니다.
- 단일 세포 현탁액은 기계적 고장을 통해 이루어집니다. 적혈구를 모으고 차가운 PBS로 두 번 씻어됩니다 ACK 용해 버퍼와 mononucleocytes를 사용하여 lysed됩니다.
- CD8 + T 세포가 Miltenyi Biotec의 CD8 + T 세포 격리 키트를 사용하여 격리됩니다. 절연 CD8 + T 세포는 1시 10분의 비율로 순진 C57BL/6J 마우스 격리 및 0.5 μmol / ML의 OVA 40시간 위해 257-264 펩타이드와 펄스 조사 splenocytes과 혼합됩니다. 이후 Brefeldin는 또 다른 4 시간 동안은 문화에 추가됩니다.
- coculture의 끝에서 전지는 위에서 설명한대로 씻어과 FC의 차단에 의해 차단, 수확됩니다.
- 차단된 세포 표면 먹잇감을 물들일 것이다fluorochrome 복합 항체를 사용하여 CD8 및 TCR Vβ5 체인 등 ERS.
- 세포 표면 염색법 후, 세포는 4 %의 포름 알데히드를 사용하여 고정되며 세포 permeabilization 키트를 사용하여 permeabilized.
- permeabilization 후, IL-2와 IFN-γ와 같은 세포내 분자 fluorochrome 복합 항체를 사용하여 물들일 것이다.
- 최종 흐름 cytometric 시험하기 전에, 전지는 과도한 항체를 제외하도록 차가운 PBS로 세 번 씻어됩니다.
- 생체내에서 분석을 죽이고. 그림 3C 있습니다.
- 나이브 C57BL/6J 마우스에서 Splenocytes은 격리와 대상 세포로 carboxyfluorescein succinimidyl 에스테르 (CFSE)이 표시됩니다.
- 세포는 5 μmol / ML의 CFSE (CFSE의 하이 세포가) 10 μg / ML의 OVA 257-264 펩타이드와 0.5 μmol / ML의 CFSE (CFSE 싸다 세포) 펄스되지 않습니다으로 표시 전지와 펄스 수로 분류.
- 2.5x10 6 CFSE에 하이 셀 플러스 2.5x10 6 CFSE 싸다, 세포의 혼합물은 adoptively 지정된 수신자로 IV 주입으로 전송됩니다.
- 16시간 후, 그 생쥐에서 splenocytes는 격리되며 CFSE +는 세포가 유동세포계측법에 의해 분석됩니다.
- Intraperitoneal 종양 세포 개수. 그림 4.
종양 도전 하루에 30에서 생쥐가 희생되고 복막 캐비티의 세척은 차가운 PBS를 사용하여 수행됩니다. 복막 세척은 종양 세포가 계산됩니다 회수. - 종양은 T 세포에게 신분증을 침투. 그림 5.
- 종양 도전의 후반 단계에서는 생쥐가 희생되고 종양이 다른 그룹에서 복막 캐비티에서 제거됩니다.
- 종양이 조각으로 절단됩니다; 한 조각은 cryovial 투입 즉시 드라이 아이스에 배치되며, 나머지 절반은 위해 문제가 해결될 것입니다maldehyde와 세번째 조각은 나중에 사용할 에어컨 RPMI-1640 미디어에 보존됩니다.
- H & E 염색법은 포름 알데히드 고정과 파라핀의 싼 샘플에서 일반적인 프로토콜에 따라 수행됩니다.
- Immunofluorescent 염색법은 cryopreserved 샘플에서 수행됩니다.
- 티슈는 사용하기 전에 -20 ° C에서 sectioned 및 보존됩니다.
- 조직 섹션 공기 15 분 십오분 차가운 아세톤 고정하기 전에 건조 될 것입니다.
- 고정 후, 섹션 5 분 PBS 세척하기 전에 다른 15 분 동안 건조 공기가 될 수있을 것입니다.
- 습한 실내에서 세차, 장소 슬라이드 후 및 비 특정 바인딩을 차단하는 30 분간 PBS에서 30 μl 3% BSA와 조직 부분을 차지하고 있습니다.
- 블로킹이 끝나면 버퍼를 차단 해제 얼룩과 3 % BSA에 희석 PE-안티 TCR Vα2 항체와 FITC-반 OVA 항체의 50 μl 혼합과 조직 부분을 커버PBS 인치
- 2 시간 촉촉한 챔버와 인큐베이션의 끝에 알을 품다, 슬라이드는 차가운 PBS로 세 번 씻어하고 형광 현미경 검사하기 전에 수용성 장착 미디어와 함께 장착됩니다.
- T 세포를 침투 종양의 흐름 cytometric 분석.
- 종양이 단일 세포 현탁액와 적혈구가 ACK 용해 완충액으로 lysed 예정으로 숙청 되야합니다.
- 세정 차단 후 세포는 특히 CD8, TCR Vα2 및 세포 표면에 표현 TCR V β5 분자를 인식할 다른 fluorochrome 복합 항체로 분류됩니다.
- 마우스 생존. 그림 6.
종양 도전 후, 마우스의 생존을 신중하게 모니터링됩니다.
- 시험 관내에는 OT-I TCR의 특성화는 IPS 세포를 transduced.
4. 대표 결과
인 경우에는 3 번 CD와 TCRβ는 T의 표식으로 사용됩니다세포. 노치 리간드 DL1과 IPS 세포의 자극이 T 세포 분화에 기여할 수 있는지 여부를 확인하기 위해, 우리는 IPS 세포 파생 세포에서 인 경우에는 3 번 CD의 표현과 TCRβ +를 평가하고, CD4 및 CD8의 자세한 분석 표현 인 경우에는 3 번 CD에 들어 게이팅 + 및 TCRβ + 인구. CD8 + 싱글 긍정 (SP) T 세포는 체외에서 IPS 세포에서 생성되었다 - 현재 일 22 인 경우에는 3 번 CD + TCRβ + CD4에 여기에 표시됩니다. 또한, IPS 세포 파생 SP 세포가 IL-2을 만들 수있었습니다 IFN-γ IPS는 휴대 파생 제안, 플레이트 코팅 안티 인 경우에는 3 번 CD 및 용해 방지 CD28의 항체 (그림 2)에 의해 체외로 자극했을 때 T 세포는 기능입니다.
받는 마우스로 입양 전송 후, TCR의 대다수는 IPS 세포는 CD8로 차별을 받았습니다 + SE에 의해 펩타이드 자극에 체외 반응을 CTLs을 유전자 transducedIL-2와 IFN-γ (그림 3).를 creting 가장 중요한 것은의 입양 전송 IPS 세포는 종양 도전 (그림 5-6)에서 종양 조직 및 보호 동물로 OVA, 반응 CTLs의 침투를 유발 TCR은 - transduced. 따라서 TCR 유전자가 - transduced IPS 세포는 생체내의 기능성 항원에 특정한 CTLs로 구분하실 수 있습니다.

그림 1. IPS 세포 분화의 형태론. 여러가지 일에 마우스 IPS 세포 20 % FCS와 5 NG / ML mFlt3L 1 NG / ML MIL-7의 앞에서 2.2 G / L 나트륨 중탄산염로 보충 α-MEM 매체에 OP9-DL1 세포와 공동 배양해되었습니다 .
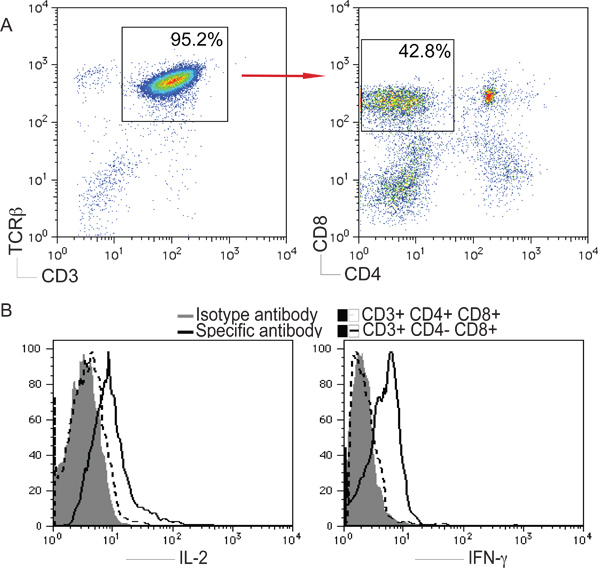
IPS 세포에서 그림 2. T 세포 분화. 마우스 IPS 세포는 그림 1에서 설명한 OP9-DL1 세포와 공동 배양해되었다. 수비에찬성 22, IPS 세포 파생 세포 격리되고 분석되었다. ) CD4 + CD8 - 또는 CD4 - CD8 인 경우에는 3 번 CD +와 TCRβ + 인구의 게이팅 후 + 세포. B) 세포 5퍼센트 CO 2에서 37 ° C에서 5 시간 동안 플레이트 코팅 안티 인 경우에는 3 번 CD 및 용해 방지 CD28의 항체로 자극했다. CD8 + T 세포 - IL-2와 IFN-γ는 라이브 CD4의 게이팅 후, 세포 염색법에 의해 분석되었다.
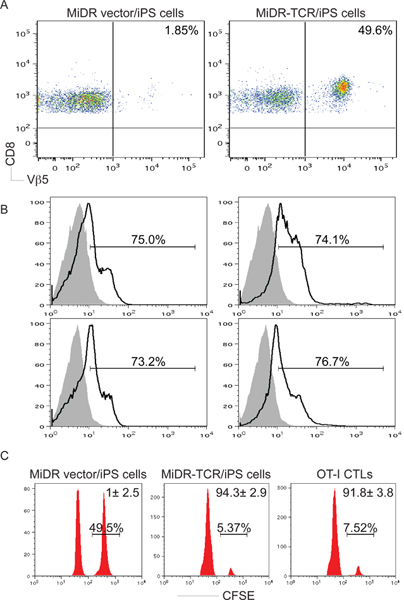
그림 3. 생체내의 IPS 세포의 항원에 특정한 CD8 + T 세포 개발. OT-I TCR 유전자 transduced IPS 세포는 C57BL / 6 마우스에 주사를 주입했다. 6~10주 후, OVA에 특정한 CD8 + Vβ5 + T 세포 개발이 결정되었다. ) CD8 + Vβ5 풀링된 LNs 및 비장에서 + T 세포는 C에 게이팅 후 유동세포계측법에 의해 분석되었다D8 이상의 인구. B) IL-2와 IFN-γ 생산 (진한 라인, 음영 영역 isotype 컨트롤을 나타냅니다)가 CD8 + Vβ5 + 인구의 게이팅 후 세포내 시토킨 염색법에 의해 결정됩니다. C) 생체내 확산 / 세포 독성 분석합니다. CFSE 하이 (오른쪽 봉우리)과 CFSE에 싸다 (왼쪽 봉우리)의 타겟 세포는 각각 OVA 257-264 펩타이드 및 제어 펄스되었으며, 생쥐에 주입했다 십주 OT-I CTL 전송 후 IPS 세포 전송 또는 한 날 이후.

OT - 나 TCR의 그림 4. 입양 전송 IPS 세포가 종양 성장을 억제 유전자 transduced. OT-I TCR 유전자 transduced IPS 세포는 adoptively C57BL / 6 마우스로 전송되었습니다. 쥐 중 한 그룹은 OT-I TC에서 OVA, 반응 CD8 + T 세포를 주사 맞은R 유전자 변형 마우스와 마우스 중 한 그룹에는 셀 전송 없었다. 육주 중 후 또는 셀 전송 후 그 다음날, 마우스는 E. G7 종양 세포와 도전의 대상이되었다. 하루에 30에서 복막에 고인 종양 세포 열거했다.
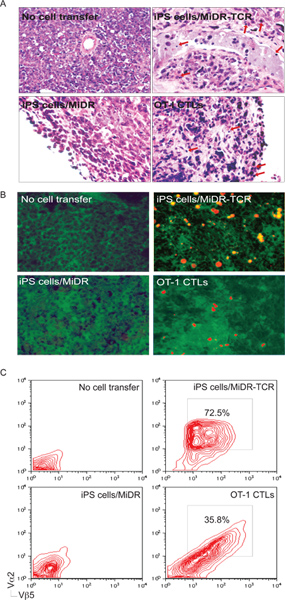
그림 5. IPS는 셀 - 파생 항원에 특정한 CTLs은 종양 조직으로 침투. 종양 도전도 내일 30-35 일, 종양 조직은 종양 반응 T 세포 침투에 대해 검사되었습니다. ) H & E 염색법. 염증성 세포가 종양 조직 (↓)에 침입. B) Immunohistological 염색법. OVA 특정 Vα2 + CTLs (빨간색)은 OVA - 표현 종양 조직 (녹색)에 침입. C) 종양 조직에서 단일 세포 현탁액은 Vα2 표현에 대해 분석했다 + 유동세포계측법하여, CD8 + 인구의 게이팅 후 + 및 Vβ5.

그림 OT - 나 TCR 6. 입양 전송 유전자 transduced IPS 세포를 마우스의 생존을 부양하고 있습니다. OVA TCR IPS 세포는 adoptively 그림에 설명된대로 E. G7 종양 세포와 도전의 대상이되었다 C57BL / 6 마우스로 전송된 유전자는 - transduced. 4. 일 50에서 마우스의 생존은 카플란 - 마이어 생존 곡선 (N = 6)에 의해 표시되었다.
토론
ACT 기반 요법의 경우 생체내 다시 주입에 대한 반응성이 매우 높은 자세에 특정한 T 세포의 다수의 체외 발생에는 최적의 접근 방식이다. 우리의 체외 방식은 IPS 세포, IPS 세포 파생 세포, 특히 네 번째 주일 만에, 4 주 후에 죽고 다수의 기능성 T 세포의 증가를 제공하더라도. 우리는 노치에서 생존 신호 DL1뿐 아니라 IL-7과 FLt3L은 IPS 세포 파생 전구 T 세포의 생존을 유...
공개
관심의 어떠한 충돌 선언 없습니다.
감사의 말
우리는 제공해 주셔서 박사 신야 야마 나카을 (교토 대학교) 감사 IPS를 MEF-잉-20D-17 세포주, OT1-2A을 지원하기위한 박사 다리오 Vignali (세인트 주드 어린이 연구 병원) • pMig II 만들어낸 박사 후안 카를로스 OP9-DL1 셀 라인을 지원하기위한 Zuniga-Pflucker (면역학학과, 토론토 대학), 그리고 본 연구의 디자인을 도와 주셔서 박사 켄트 전자 Vrana (약리학학과, 의학 펜은 주립 대학교 대학). 이 프로젝트는 국립 암 연구소 Barsumian 신뢰와 흑색증 학술 진흥 재단 (J. 노래)에서 부여 번호 K18CA151798과 보조금 하에서 자금 지원을하고 있습니다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | |
| C57BL/6J 마우스 | 잭슨 연구소 | 000,664 | |
| B6.129S7-Rag1 tm1Mom / J | 잭슨 연구소 | 002,216 | |
| 반 (反) 인 경우에는 3 번 CD (2C11) 항체 | BD PharMingen | 553,058 | |
| 안티 CD28 (37.51) 항체 | BD PharMingen | 553,295 | |
| 반 (反) 인 경우에는 3 번 CD (17A2) 항체 | BioLegend | 100,202 | |
| 안티 CD4 (GK1.5) 항체 | BioLegend | 100,417 | |
| 안티 CD8 (53-6.7) 항체 | BioLegend | 100,714 | |
| 안티 CD25 (3C7) 항체 | BioLegend | 101,912 | |
| TI-CD44 (1M7) 항체 | BioLegend | 103,012 | |
| 반 (反) CD117 (2B8) 항체 | BioLegend | 105,812 | |
| 안티 - TCR-β (H57597) 항체 | BioLegend | 109,220 | |
| 안티 - IL-2 (JES6-5H4) 항체 | BioLegend | 503,810 | |
| 안티 IFN-γ (XMG1.2) 항체 | BioLegend | 505,822 | |
| DMEM | Invitrogen | ABCD1234 | |
| α-MEM | Invitrogen | A10490-01 | |
| FBS | HyClone | SH3007.01 | |
| 를 Brefeldin | 시그마 | B7651 | |
| Polybrene | 시그마 | 107,689 | |
| GeneJammer | 통합 과학 | 204,130 | |
| RNA 키트 | Qiagen | 74,104 | |
| DNA 검사 키트 | Qiagen | 69,504 | |
| CD8 절연 키트 | Miltenyi Biotec | 130-095-236 | |
| ACK 용해 완충액 | Lonza | 10-548E | |
| mFlt-3L | PeproTech | 250 31L | |
| MIL-7 | PeproTech | 217-17 | |
| 젤라틴 | 시그마 | G9391 | |
| FITC-안티 OVA 항체 | 록클랜드 Immunochemicals | 200-4233 | |
| Permeabilization 버퍼 | Biolegend | 421,002 | |
| BSA | 시그마 | A7906 | |
| 포름 알데히드 | 시그마 | F8775 | |
| 0.4 μm의 필터 | MIllipore | ||
| Moflo 세포 분류기 | 타케의 Cytomation | ||
| Calibur 흐름 Cytometer | BD | ||
| LSR II 흐름 Cytometer | BD | ||
| 마우스 restrainer | Braintree 과학 |
참고문헌
- Brenner, M. K., Heslop, H. E. Adoptive T cell therapy of cancer. Curr. Opin. Immunol. 22, 251-257 (2010).
- Hataye, J., Moon, J. J., Khoruts, A., Reilly, C., Jenkins, M. K. Naive and memory CD4+ T cell survival controlled by clonal abundance. Science. 312, 114-116 (2006).
- Seki, Y. IL-7/STAT5 cytokine signaling pathway is essential but insufficient for maintenance of naive CD4 T cell survival in peripheral lymphoid organs. J. Immunol. 178, 262-270 (2007).
- Stemberger, C. A single naive CD8+ T cell precursor can develop into diverse effector and memory subsets. Immunity. 27, 985-997 (2007).
- Siewert, C. Experience-driven development: effector/memory-like alphaE+Foxp3+ regulatory T cells originate from both naive T cells and naturally occurring naive-like regulatory T cells. J. Immunol. 180, 146-155 (2008).
- Wang, L. X., Plautz, G. E. Tumor-primed, in vitro-activated CD4+ effector T cells establish long-term memory without exogenous cytokine support or ongoing antigen exposure. J. Immunol. 184, 5612-5618 (2010).
- Hinrichs, C. S. Human effector CD8+ T cells derived from naive rather than memory subsets possess superior traits for adoptive immunotherapy. Blood. 117, 808-814 (2011).
- Alajez, N. M., Schmielau, J., Alter, M. D., Cascio, M., Finn, O. J. Therapeutic potential of a tumor-specific, MHC-unrestricted T-cell receptor expressed on effector cells of the innate and the adaptive immune system through bone marrow transduction and immune reconstitution. Blood. 105, 4583-4589 (2005).
- Yang, L., Baltimore, D. Long-term in vivo provision of antigen-specific T cell immunity by programming hematopoietic stem cells. Proc. Natl. Acad. Sci. U.S.A. 102, 4518-4523 (2005).
- Zhao, Y. Extrathymic generation of tumor-specific T cells from genetically engineered human hematopoietic stem cells via Notch signaling. Cancer Res. 67, 2425-2429 (2007).
- Boztug, K., Med, N. .. E. n. g. l. .. J. .. Stem-cell gene therapy for the Wiskott-Aldrich syndrome. N. Engl. J. Med. 363, 1918-1927 (2010).
- Peerani, R., Zandstra, P. W. Enabling stem cell therapies through synthetic stem cell-niche engineering. J. Clin. Invest. 120, 60-70 (2010).
- Mendez-Ferrer, S. Mesenchymal and haematopoietic stem cells form a unique bone marrow niche. Nature. 466, 829-834 (2010).
- Daley, G. Q. Towards the generation of patient-specific pluripotent stem cells for combined gene and cell therapy of hematologic disorders. Hematology Am. Soc. Hematol. Educ. Program. , 17-22 (2007).
- Boitano, A. E. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells. Science. 329, 1345-1348 (2010).
- Himburg, H. A. Pleiotrophin regulates the expansion and regeneration of hematopoietic stem cells. Nat. Med. 16, 475-482 (2010).
- Tanigaki, K., Honjo, T. Regulation of lymphocyte development by Notch signaling. Nature immunology. 8, 451-456 (2007).
- Zhao, T., Zhang, Z. N., Rong, Z., Xu, Y. Immunogenicity of induced pluripotent stem cells. Nature. 474, 212-215 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유