JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
단일 셀 및 단일 스파이크 해상도 suprathreshold 신경 활동의 광 기록
요약
대뇌 피질의 기능이 뉴런의 인구의 수준에 발생하기 때문에 척추 중추 신경계의 기능을 이해하는 것은 많은 뉴런의 녹음이 필요합니다. 다음은 단일 셀 및 단일 스파이크 해상도로 suprathreshold 신경 활동을 기록 할 수있는 광학 방법을 설명, 랜덤 액세스 검사는 디더링. 까지의 높은 시간적 해상도 100 뉴런이 방법을 기록 체세포 형광 칼슘 신호. 최고 확률이 알고리즘은 체세포의 형광 칼슘 신호의 기본 suprathreshold 신경 활동을 deconvolves. 이 방법은 안정적으로 높은 검출 효율과 잘못된 반응의 낮은 속도로 스파이크를 감지하고 신경 인구를 공부하는 데 사용할 수 있습니다 체외에서와 생체 내.
초록
척추 중추 신경계의 정보 신호는 종종 뉴런이 아닌 개별 뉴런의 인구에 의해 수행됩니다. 또한 suprathreshold의 난리 활동의 전파는 뉴런의 인구를 포함합니다. 대뇌 피질의 기능을 해결 경험적 연구는 직접 따라서 고해상도로 뉴런의 인구에서 녹음이 필요합니다. 여기 광학 방법 및 최대 단일 셀 및 단일 스파이크 해상도 100 뉴런에서까지 신경 활동을 기록 할 수있는 deconvolution 알고리즘을 설명합니다. 이 방법은 대뇌 피질의 뉴런의 suprathreshold 전기 스파이크 (활동 전위)와 관련된 세포 체세포의 칼슘 농도의 일시적 증가 감지에 의존하고 있습니다. 광학 녹음의 높은 시간적 해상도는 음향 광학 편 향기 (AODs) 1을 사용하여 빠른 랜덤 액세스 스캐닝 기술에 의해 달성된다. 불투명 뇌 소유의 높은 공간 해상도의 칼슘에 민감한 염료 결과의 2 광자 여기2 고소 해요. 형광 칼슘 녹음에서 스파이크의 재건은 최고 가능성 방법에 의해 달성된다. 동시 electrophysiological 및 광학 녹음은 우리의 방법은 안정적으로 스파이크를 (> 97% 스파이크 검출 효율) 검색을 나타냅니다, 허위 긍정적 인 스파이크 감지 (<0.003 스파이크 / s)로, 높은 시간적 정밀 (MS 3) 3의 낮은 속도가 있습니다. 스파이크 검출이 광학 방식은 체외과 생체 3,4에 anesthetized 동물의 신경 활동을 기록하는 데 사용할 수 있습니다.
프로토콜
1. 광 설치 (그림 1)
- 두 광자 여기 들어 femtosecond 펄스와 적외선 펄스 레이저 시스템이 사용됩니다. 높은 레이저 출력 전력은 (> 2W 890 nm의 파장에서 경우에 따라) 시스템의 광학 구성 요소가 도입 된 대형 손실을 상쇄하기 위해 필요합니다.
- 이 프리즘으로 구성된 prechirper 시스템은 AODs 1 소개 시간적 분산을 보상하기 전에 음향 광학 편 향기 (AODs)에 레이저 펄스에 부정적인 그룹 속도 분산 (GVD)를 부여.
- 큰 구멍이 두 개 AODs (NA 0.8과 40x 물 침지 목표를위한 10mm)는 2 차원 레이저 빔을 편향.
- 100 숲 / mm와 반사 회절 격자는 짧은 레이저 펄스를 사용하는 경우 AODs 뒤 13cm가 AODs에 의해 도입 된 공간 분산을 보상하기 위해 배치됩니다.
- 레이저 빔이 수직 microsco의 카메라 포트에 두 릴레이 윤곽을 지향하는PE.
- 창포는 광학 부품의 정렬을 위해 정기적으로 게재됩니다.
- 목표 앞의 이색 beamsplitter는 표본에 적외선 여기 빛을 전송하고 검출기로 시료의 형광 빛을 반영합니다.
- 에피네프린과 transfluorescence 감지기 (photomultipliers, PMTs)는 객관적으로 형광 신호를 수집하고 - 해당되는 경우 - 콘덴서를 통해.
- 컬러 유리 필터 (BG-39, 3~5mm)은 감지기에 도달 여기 빛을 방지하기 위해 검출기 앞에 위치하게된다.
- AOD 편향 각도는 결과적으로 전압 제어 발진기를 구동 디지털 - 아날로그 컨버터 보드 (156.25 kHz에서 클럭 속도),가 장착 된 컴퓨터에 의해 제어됩니다.
- photomultipliers에서 신호에 저장되기 전에 로우 패스 버터 필터 (100 kHz에서의 컷 - 오프 주파수)를 통해 릴레이와 아날로그 디지털 컨버터 (156.25 kHz에서 클럭 속도)에 의해 디지털화되어분석을 위해 컴퓨터.
- 정렬 및 전기 노이즈뿐만 아니라 함께하고 표시없이 photomultipliers 낮은과 높은 게인에서 레이저 빛과없는 형광 신호의 분포를 기록하여 테스트됩니다. 스캐너가 올바르게 설정과 높은 게인에서와 표시기과 형광 신호의 분포의 폭이 형광 신호의 다른 배포판 (그림 2)의 폭보다 훨씬 큰 경우 차폐되어 있습니다.
2. 실험 절차
- 디더링 랜덤 액세스 검색 칼슘이 세포 증가의 감지에 의존하고 있습니다. 뉴런의 큰 숫자는 신경 조직을 5로 칼슘 표시기의 에스테르 양식 (예를 들어, 오레곤 그린 488 Bapta-1 AM)의 bolus 주사를 사용하는 물들 일 수 있습니다.
- 각 뉴런 소마의 여러 위치는 ( "디더링", 4 위치, 각 위치에 대한 6.4 μs 전자에 = 25.6 μs 녹음 시간, 짧은 시간 동안 각각 기록됩니다각주기에서 ACH 신경, 그림. 3C). 관심 뉴런을 선택하려면 256x256 픽셀로 구성된 풀 프레임 (그림 3A) 획득됩니다. 기록 할 각 뉴런 소마의 중심이 이미지에서 수동으로 선택됩니다. 제어 소프트웨어가 자동으로이 센터 주변 2 μm 거리에서 세 가지 문제점을 추가합니다.
- 각 사이클에서 형광 신호가 40 뉴런 (그림 3B)의 각에서 기록됩니다. 이 과정은 한 기록 (오초 녹음이 = 3,255 사이클, 1 사이클 = 1.536 밀리 초)의 전체 기간 동안 반복됩니다.
3. 스파이크 감지 효율성을 극대화하는 온라인 소프트웨어 도구
- 형광 체세포의 칼슘 신호의 스파이크 감지 체세포 형광 칼슘 신호의 높은 신호 대 잡음 (S / N) 비율에 의존하고 있습니다. S / N 고는 여기 강도를 높임으로써 달성 될 수있다. 여기 강도 그러나, 단 한 photodamage의 특정 제한으로 증가 할 수 있습니다. 스파이크 감지는 매우 작은 windo 내에서 높은형광 신호가 높은 S / N하지만이 여기 농도의 w 만있는 매우 작은 photodamage 3을 관찰하고 있습니다. 기록 된 신호는 우리가 광자 속도 (방정식 3.2 참조) 및 온라인 분석을 사용하여 기본 형광의 감소를 모니터링 녹음하는 동안 높은 스파이크 감지의 창 내에되도록하기 위해.
- 뉴런 당 대략 광자 요금은 기준 노이즈의 짧은 시간 창 (100-200 MS)에서 계산됩니다. 광자의 수 (N λ)와 광자 속도 (λ = N λ / Δt)이 다음과 같은 식으로 상대 형광 변화의 분포를 (σ) 맞는하여 형광 값에서 계산됩니다 :
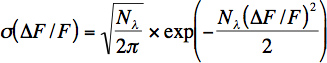
이 방정식은 상대적으로 형광 변화에 변수의 변화와 광자 샷 노이즈에 대한 푸 아송 분포를 나타냅니다 : ΔF / F = (G * N λ (t)-G * N & 램BDA,, 0) / G * N λ, G는 광전자 증의 누적 이득과 다른 모든 전자 부품을 나타냅니다 0. 광자 샷 소음과 더불어 소음의 다른 소스 (운동 유물)가 있기 때문에이 수식이 제대로 생체 녹음에 대한 감지 광자의 수를 확인하지 않습니다. 그럼에도 불구하고이 방정식은 소음을 추정하기 위해 생체 녹음에 유용합니다.
- 기본 형광은 같은 시간 창에서 계산 시간이나 시험의 함수로 도시된다. 기준의 평균 감소가이 제한을 초과 할 때 스파이크 검색이 빠르게 거부하기 때문에 레이저 파워를 조정하여 0.0002 / s의 아래 보관됩니다.
- 뉴런의 somata 위치마다 10-20 분 다시 전체 프레임 이미지를 획득하여 확인합니다. 필요한 경우, 녹음 위치는 조정됩니다. 위치는 한 번에, 또는 개별 뉴런의 모든 뉴런에 조정할 수 있습니다.
4. ReconstructioN 형광 신호 (deconvolution)에서 스파이크 타이밍의
- 칼슘 과도의 부패가 길어서 시간에 자주 summate 신경 활동에서 발생하는 형광 신호 (수백 밀리 초). deconvolution 방법은 형광 신호의 스파이크와 스파이크 타이밍을 reconstructs.
- 기록 된 형광 신호를 근간 가능성이 가장 높은 스파이크 열차를 확인하려면 다른 모델 비교됩니다. 여기 우리는 모델을 결정하기 위해 유전자 알고리즘을 사용 - 그리고 스파이크 열차와 스파이크 타이밍 때문에 - 최대 가능성이 있습니다.
- 뉴런의 inhomogeneous 인구에서 스파이크-evoked 칼슘 신호는 뉴런 사이에 다를 수 있습니다. 데이터의 혼자 가잖 분석 설정을 위해이 계정으로 뉴런에서 뉴런의 스파이크-evoked 칼슘 신호의 변화를 소요하는 알고리즘을 설계했습니다.
- 거짓 긍정적 인 탐지 많은 수의를 피하려면이 m의 상수를 허용 진폭 및 붕괴 시간을 수축하는 데 유용합니다스파이크 - evoked 칼슘 신호의 odel. 단일 스파이크 evoked 칼슘 과도의 상수 진폭 및 부패 시간의 공동 분배 동시 electrophysiological 및 광학 녹음을 사용하여 동일한 실험 조건에서 뉴런의 같은 종류의 실험 별도의 세트에 기록됩니다.
- 느린 기준 변경에 대한 설명과 deconvolving의 전산 비용을 절감하기 위해 더 이상 녹음 1~5초의 여러 짧은 흔적으로 나누어집니다.
- 각 뉴런 각 녹화를 들어, deconvolution 알고리즘은 모델의 큰 번호 (최대 1,000,000 다른 모델 이상) 테스트 할 수 있습니다. deconvolution의 속도를 높이기 위해 하나의 실험은 병렬 10 개 컴퓨터에에 deconvolved 있습니다.
- deconvolution 후, 스파이크 데이터 분석 검사합니다. 아름다운 요정 - 자극 시간 히스토그램, 스파이크 확률, 그리고 발사 속도는 (뉴런 당 평균 스파이크) 자동화 된 방식으로 계산됩니다.
5.대표 결과
기록 된 형광 체세포의 칼슘 신호의 높은 신호 대 노이즈 비에 성공 스파이크 감지 한겁니다. 단순히 높은 여기 속도 (높은 레이저 전원)를 사용하여 생물학적 물질 (photodamage)에 photoeffects의 부정적인 영향이 발생할 수 있습니다. 디더링 랜덤 액세스 스캐닝 photodamage에서 기준 형광의 감소로 명부와 스파이크-evoked 칼슘 형광 신호의 감소. 스파이크 - evoked 신호의 감소가 빠르게 스파이크를 감지 할 수있는 오류가 발생할 수 있습니다. 형광 신호의 스파이크 감지가 높은 여기 강도 만 매우 작은 창이 있습니다. 높은 끝에이 창은 낮은 끝에있는 형광 신호가 낮은 신호 대 잡음 비율을 가지고 photodamage에 의해 제한됩니다. 급성 조각의 대뇌 피질의 뉴런에 우리는 슬라이스 표면 아래 약 100 μm에서 녹음 할 때 400,000-1,500,000에 대한 광자 / s의 광자 속도의 결과로 레이저 전원을 사용합니다. 높은을 사용하는 경우화성 표시기는 - 여기 오레곤 그린 488 BAPTA - 1 -이 신호는 개별 스파이크를 감지하기에 충분한 것입니다. 그림. 3E는 매우 낮은 여기 속도, 검색 창에서 녹화 중 하나를 예를 들어, 매우 높은 여기 속도로 하나를 기록 형광 신호의 예를 보여줍니다.
단일 셀 및 단일 스파이크 해상도 신경 활동을 기록하기 위해 다른 기술에 비해 랜덤 액세스 검색이 동일한 지역 인구의 뉴런의 큰 숫자에서 기록 할 수 디더링 및 tetrode / multielectrode 녹음에 비해 예를 들어, 이하 침입입니다 . 따라서 디더링 랜덤 액세스 검사는 suprathreshold 활동 6 (그림 4A), 뉴런 (대뇌 피질의 소성)의 인구의 신경 활동의 변화에 의해 신호를 상호 정보를 측정하는 여러 뉴런의 신경 활동을 기록하고, suprathreshold 활동 전파하는 데 사용할 수 있습니다 뉴런 14 인구 (그림 4B)를 통해
ALT = "그림 1"SRC = "/ files/ftp_upload/4052/4052fig1.jpg"/>
그림 1. 디더링 - 랜덤 액세스 검사 설정의 광학 설계.
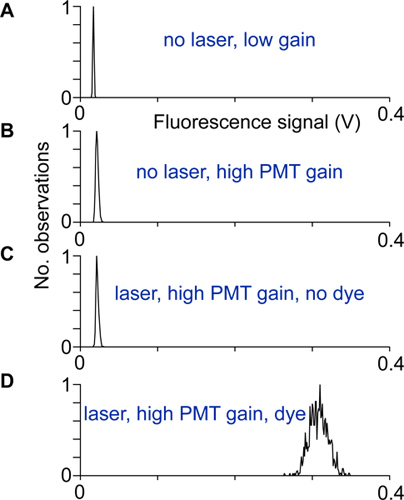
그림 2 정렬 및 테스트 :. 다른 상황에서 기록 된 형광 신호를 분배. A) 높은 PMT 증가,하지만 레이저 광에서 레이저 광과 낮은 광전자 증 증가, B) 아니오, 배포 때문에 광전자 증 어두운 전류의 넓은 없습니다. C)에서 레이저로 높은 PMT 증가로 기록. B에 표시의 배포판이 배포 사이의 차이는 여기 빛이 PMT 검출기에 도달 나타냅니다. D) 형광 신호의 분포는 신경 somata에서 높은 게인에서 기록했다. 다른 잡음 소스가 기여하지 않으면,이 분포 샷 노이즈 광자에서만 발생합니다.
. JPG "/>
그림 3 디더링 원칙 중 하나 사이클의 신경 세포의 somata 위치를 검색하고 선택 A) 전체 프레임 형광 이미지, B) 스캔 경로, C)이 그림,. 각 소마 (원) 여러 장소에서는 다음에 빔을 이동하기 전에 기록됩니다 두 D / A 채널의 출력 소마, D) 그림. 각 뉴런 소마를 들어, 형광 신호는 각 소마의 4 가지 명소 (S1-S4)에서 기록됩니다. 각 지점의 위치는 그 x와 y 위치에 의해 주어진다. x와 모든 장소와 모든 뉴런에 Y 위치는 순차적 방식으로 디지털 - 아날로그 변환기로 전송됩니다. 빔은 두 뉴런의 somata 사이에 이동하는 동안 신호가 (빈) 취득하지 않습니다. E 형광 신호의) 예. 각 예제는합니다 (electrophysiological 셀 - 첨부 된 기록으로 측정) 한 스파이크에 대한 응답을 보여줍니다합니다.
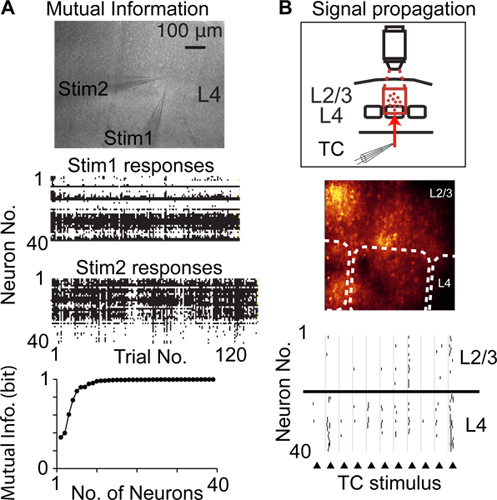
그림 4. corti 유학칼 기능은 디더링 랜덤 액세스 검색을 사용합니다. A) 뉴런의 인구에 의해 신호를 상호 정보를 측정. 위의 이미지는 급성 뇌 조각과 레이어 4 (L4)에서 동일한 대뇌 피질의 열에서 배치 두 자극의 피펫의 현미경 사진을 보여줍니다. 센터 그래프는 자극의 각 반복에 대해 신경 반응을 보여줍니다. 낮은 그래프는 뉴런의 기록 인구에 의해 신호 섀넌의 상호 정보를 보여줍니다. 대뇌 피질의 뉴런의 인구 사이 suprathreshold 솟고 활동의 B) 측정 전파 (신호 전파). 상단 그래프는 실험 디자인을 보여줍니다, 중심 이미지는 형광 이미지를 보여줍니다, 점선은 배럴 국경을 나타냅니다, 낮은 그래프 thalamocortical 섬유 (삼각형)의 전기 자극에 대한 응답으로 검색 스파이크를 보여줍니다.
토론
디더링 랜덤 액세스 검사는 간접적으로 신경 세포의 somata의 각 스파이크와 관련된 세포 체세포 칼슘의 증가에서 suprathreshold 솟고 활동을 감지합니다. 세포 내 칼슘의 증가는 형광 칼슘 염료에 의해 감지됩니다. 디더링 랜덤 액세스 검색의 한계는 칼슘 형광 신호의 제한된 신호 대 잡음 비율에서 크게 발생한다. 신호 대 잡음 비율이 높은 여기 요금을 사용하실 수 없습니다 photodamage에 의해 제한 차...
공개
관심 없음 충돌이 선언 없습니다.
감사의 말
우리는 매우 원고를 읽기 위해 박사 랜디 Chitwood 감사드립니다. 이 작품은 관청 재단과 HJK 할 수있는 알프레드 P. 슬로안 재단 보조금에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 코멘트 (선택 사항) |
| 광학 구성 요소는 레이저부터, 순서대로 나열되어 있습니다 | |||
| 타이탄 : 사파이어 레이저 | 일관된 주식회사 | 카멜레온 울트라 2 | 높은 전력 출력을 권장 (900 나노 미터에서> 2W) |
| 비 염색성의 렌즈 F = 30mm | 토르 실험실 | AC254-030-B | 650-1050 nm의에 대한 반사 방지 (AR) 코팅 |
| 비 염색성의 렌즈 F = 100mm | 토르 실험실 | AC254-100-B | AR 650-1050 nm의 |
| 렌즈 F = 75mm | 토르 실험실 | LA1608-B | AR 650-1050 nm의 |
| 렌즈 F = 175mm | 토르 실험실 | LA1229-B | AR 650-1050 nm의 |
| 비 염색성의 렌즈 F = 300mm | 토르 실험실 | AC254-300-B | AR 650-1050 nm의 |
| 비 염색성의 렌즈 F = 100mm | 토르 실험실 | AC254-100-B | AR 650-1050 nm의 |
| 비 염색성의 렌즈 F = 100mm | 토르 실험실 | AC254-100-B | AR 650-1050 nm의 |
| 음향 광학 편 향기 | Intraaction 사 | ATD 6510CD2 | |
| 반사 회절 격자 | 뉴 포트 (Newport) | 53-011R | 65 MHz의 대역폭 45 mrad의 스캔 각도 AODs 100 홈 / mm |
| 21.6 mm Brewster 프리즘 | 람다 리서치 옵틱스 주식회사 | IBP21.6SF10 | |
| 컬러 유리 | SCHOTT | BG-39 | |
| 이색 성 거울 | 크로마 기술 주식회사 | Z532RDC | |
| 광전자 증 모듈 | 하마 마츠 | H9305-03 | |
| DAC-ADC 보드 | 내쇼날 인스트루먼트 | PCI-6115 | |
| 오레곤 그린 488 Bapta - 오전 1시 | Invitrogen | O-6807 |
참고문헌
- Iyer, V., Hoogland, T. M., Saggau, P. Fast functional imaging of single neurons using random-access multiphoton (RAMP) microscopy. J. Neurophysiol. 95, 535-545 (2006).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248, 73 (1990).
- Ranganathan, G. N., Koester, H. J. Optical recording of neuronal spiking activity from unbiased populations of neurons with high spike detection efficiency and high temporal precision. J. Neurophysiol. 104, 1812-1824 (2010).
- Grewe, B. F., Langer, D., Kasper, H., Kampa, B. M., Helmchen, F. High-speed in vivo calcium imaging reveals neuronal network activity with near-millisecond precision. Nat. Methods. 7, 399-405 (2010).
- Stosiek, C., Garaschuk, O., Holthoff, K., Konnerth, A. In vivo two-photon calcium imaging of neuronal networks. Proc. Natl. Acad. Sci. U.S.A. 100, 7319-7324 (2003).
- Pita-Almenar, J. D., Ranganathan, G. N., Koester, H. J. Impact of cortical plasticity on information signaled by populations of neurons in the cerebral cortex. J. Neurophysiol. 106, 1118-1124 (2011).
- Kerr, J. N., Greenberg, D., Helmchen, F. Imaging input and output of neocortical networks in vivo. Proc. Natl. Acad. Sci. U.S.A. 102, 14063-14068 (2005).
- Lin, B. J., Chen, T. W., Schild, D. Cell type-specific relationships between spiking and [Ca2+]i in neurons of the Xenopus tadpole olfactory bulb. J. Physiol. 582, 163-175 (2007).
- Zeng, S., Lv, X., Zhan, C., Chen, W. R. Simultaneous compensation for spatial and temporal dispersion of acousto-optical deflectors for two-dimensional scanning with a single prism. Opt. Lett. 31, 1091-1093 (2006).
- Otsu, Y., Bormuth, V., Wong, J., Mathieu, B. Optical monitoring of neuronal activity at high frame rate with a digital random-access multiphoton (RAMP) microscope. J. Neurosci. Methods. 173, 259-270 (2008).
- Vogelstein, J. T., Watson, B. O., Packer, A. M., Yuste, R. Spike inference from calcium imaging using sequential Monte Carlo methods. Biophys. J. 97, 636-655 (2009).
- Yaksi, E., Friedrich, R. W. Reconstruction of firing rate changes across neuronal populations by temporally deconvolved Ca2+ imaging. Nat. Methods. 3, 377-383 (2006).
- Hendel, T., Mank, M., Schnell, B., Griesbeck, O. Fluorescence changes of genetic calcium indicators and OGB-1 correlated with neural activity and calcium in vivo and in vitro. J. Neurosci. 28, 7399-7411 (2008).
- Ranganathan, G. N., Koester, H. J. Correlations decrease with propagation of spiking activity in the mouse barrel cortex. Front Neural Circuits. 5, 8 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유