Method Article
멀티 플렉스 항체 검사 방법을 사용하여 Luminex xMAP 분석에 캡처 엘리사의 전환
요약
엘리사 쉽게 Luminex xMAP 분석으로 변환될 수 있으며, 멀티플렉싱, 여러 항체의 장점을 통해 분석 비용을 줄이는 한편, 증가 감도 및 다이나믹 레인지 결과, 최적 항체 쌍을 식별하는 동시에 상영 할 수 있습니다.
초록
효소 결합 면역 분석 (엘리사)는 오랫동안 생명 과학 연구 및 임상 진단 모두에 대한 생물 학적 시료에 대한 관심 analytes의 검출하기위한 중요한 도구가되었습니다. 그러나 엘리사는 제한 사항이 있습니다. 그것은 일반적으로 96 - 웰 microplate에서 수행되며, 우물은 관심 항원을 포착하기 위해 시료의 비교적 큰 금액을 요구, 캡처 항체로 코팅됩니다. 우물의 넓은 표면적과 캡쳐 항체의 소수성 바인딩도 아닌 특정 바인딩과 증가 배경으로 이어질 수 있습니다. 또한 대부분의 ELISAs는 합리적인 감도를 달성하기 위해서는 신호의 효소 - 매개 증폭에 의존. 이러한 증폭은 항상 선형 아니며 수 있으므로 스큐 결과입니다.
지난 15 년 동안 새로운 기술은 비슷한 우와 함께하는가 엘리사의 혜택을 제공뿐만 아니라, 높은 처리량, 향상된 유연성, 감소 샘플 볼륨, 그리고 낮은 비용을 가능하게 떠오르고rkflow 1, 2. Luminex xMAP 기술 monoplex과 단백질과 핵산 응용 3-5 모두에 적용할 수있는 멀티 플렉스 assays를 모두 가능하게 microsphere (구슬) 배열 플랫폼입니다. 구슬은 엘리사에 비해 덜 캡처 항체와 작은 샘플 볼륨을 필요로하는, covalently 작은 표면적에 고정화 캡처 항체를 가지고 있고, 이외의 구체적인 구속력이 크게 줄어 듭니다. 같은 뇌척수, 활액 액체 등 6 등 제한 샘플 작업시 작은 샘플 볼륨이 중요하다. 분석을 다중화하는 것은 더 이상 하나의 샘플에서 여러 결과를함으로써, 샘플 볼륨 요구 사항을 줄여줍니다.
Luminex에 의한 최근의 향상된 기능은 다음과 같습니다 : 새로운 MAGPIX 시스템, 작고, 저렴, 쉽게 - 사용하기 분석기, 낮은 농도 마그네틱 MagPlex Microspheres 고가의 필터 플레이트에 대한 필요성을 제거하고 더 나은 분석 개발에 적합 근무 농도에 와서낮은 처리량 어플 리케이션 및 xMAP 항체 커플링 (ABC) 키트, 프로토콜, 시약 및 관심 캡처 항체에 구슬을 커플링에 필요한 소모품을 포함합니다. (키트 내용의 자세한 목록은 자료 섹션을 참조하십시오.)
본 실험에서는 xMAP 플랫폼 TNF-알파 시토킨위한 사전 최적화된 엘리사 분석을 변환하고 두 가지 방법 7-11의 성능을 비교합니다. TNF-알파는 면역 장애 환자에서 염증 반응의 측정에 사용되는 biomarker입니다.
우리는 네 가지 microsphere 세트 또는 지역 네 가지 후보 캡처 항체를 결합하여 시작합니다. 함께 혼합하면 이들 4 세트는 최고의 항체 쌍, 저장 시약, 샘플 및 시간을 결정하는 4 개의 별도의 탐지 항체를 가진 네 명의 후보 중 동시 테스트하실 수 있습니다. 두 xMAP의 assays 그런 다음 두 가장 최적 항체 쌍과 건설과 그 성과가있다신호 강도, 동적 범위 및 감도에 관해서 원래 엘리사 분석의 비교.
프로토콜
I. 시약 준비
- 항체의 선택 및 준비
- 실험에 사용되는 항체를 식별합니다.
- 네 캡처 항체 : 단클론 또는 polyclonal 중 인간 TNF-알파, 특정, 모두 같은 호스트 종.
- 네 검출 항체 : 인간 biotinylated 중 수정되지 않은 TNF-알파, 또는 PE-복합을위한 구체적.
- 한 확인 항체 : PE-복합 및 캡처 항체의 호스트 수종에 대해 특정.
- 제조 업체가 권장 작업 농도에 Reconstitute 모든 항체가.
- 저농도 MagPlex microsphere (구슬) 세트 또는 지역 네 가지 튜브를 선택하고, 예를 들어, Luminex 부품 번호 MC10012-ID, MC10013-ID, MC10014-ID 및 MC10015-ID.
- 실험에 사용되는 항체를 식별합니다.
- xMAP 항체 (ABC) 커플링 키트를 사용하여 MagPlex Microspheres에 항체가 결합
다시전체 커플링 절차 ABC 키트 사용자 매뉴얼 (파트 # 89-00002-00-319)에 하기까지. (참고 : 가능한 감광성의 microspheres은 빛으로부터 보호되어야합니다.)- 커플링 반응에 대해 선택한 구슬 지역 번호를 가진 실내 온도 및 레이블 네 반응 튜브에 ABC 키트의 시약을 가져와. 네 개의 레이블 반응 튜브에 MagPlex 구슬의 네 병 (1 ML 각 또는 2.5 X 10 6 구슬)의 내용을 전송합니다.
- 같은 ABC 키트 설명서에 설명된 활성화 버퍼, 500 μL에 두 구슬 세트의 각 씻으십시오.
- ABC 키트 설명서의 절차에 따라 활성화 버퍼, Sulfo-보건국 10 μL 및 EDC 시약 10 μL의 480 μL와 각각의 비드 세트를 활성화하고, 20 분 동안 품어. (참고 :. EDC 시약이 단계에 즉시 이전 활성화 버퍼 250 μL로 재구성해야 함)
- thr 총 이제 "활성화"microspheres로 이전 세탁 단계를 반복활성화 버퍼 500 μL와 EE 시간은 같은 ABC 키트 설명서에 설명되어.
- 각자 솔루션, 활성화 버퍼에 캡처 항체의 각 함유 7.5 μg (즉, 3 μg / 만 microspheres)를 준비합니다.
- 즉시 와동, 각각의 반응 튜브 각 튜브를이 네 캡처 항체 솔루션을 추가하고 회전에서 두 시간 동안 알을 품다.
- 지금은 ABC 키트에 포함된 워시 버퍼 500 μL로 세 번 총 "결합"microspheres와 이전 세탁 단계를 반복합니다.
- 최종 세척 단계 후 밀리리터 당 5,000,000 항체 결합 구슬의 최종 주식 농도를 제공하는 각 반응 관 500 μL 워시 버퍼를 추가합니다. 와동과 microspheres를 분산하기 위해 반응 튜브를 sonicate.
참고 : 부분적으로 DI 물을 가득 초음파 세척기의 폐쇄 microsphere의 병을 잠수함이 잠수하면 모든 세척 단계를위한 효과적인 sonication을 제공합니다. (전자 재료 표를 참조quipment 세부 사항.) - 2-8에 결합 비즈를 저장 ° C와 필요까지 빛으로부터 보호되고 있습니다.
- 결합 Microspheres의 열거
- 셀 카운터 또는 hemacytometer를 사용하여 결합 반응 후에 회수 microspheres의 개수를 세어보세요. 이렇게 적합한 방법은 계산 악기의 사용자 설명서를 참조하십시오. 커플링 반응의 복구는 90 % 이상 일반적이다.
- 커플링 확인
- 커플링 반응 확인은 분석 완충액 100 구슬 / μL의 최종 농도 (1 % BSA와 PBS)와 각 집합에 결합된 구슬 주식의 테스트 솔루션을 준비하여 성공했습니다. 분석 완충액 4 μg / ML에서 phycoerythrin-(PE-)라고 표시된 안티 종 IgG 확인 항체의 dilutions을 준비합니다.
- 16 위 총 왕복 하단 96 - 웰 플레이트 네 가지 웰스으로 각 테스트 솔루션의 나누어지는 50 μL. 그렇다면 50 μ 추가배경 및 8 나머지 우물에 희석 확인 항체의 50 μL를 측정하는 우물 중 여덟으로 분석 완충액의 L,.
- 멀티 채널 pipettor로 여러 번 아래로 pipetting 및하여 부드럽게 반응을 섞는다. 커버 플레이트와 플레이트 흔드는에 실온에서 30 분간 부화.
- 솔루션의 아웃 구슬을 잡아 1-2분위한 자성 판 분리기에서 접시를 놓습니다. 그런 다음, 폐기물 소켓을 통해, 구분자에있는 동안 강제로 반전 판에 의해 액체를 제거합니다.
- 분석 완충액 100 μL를 추가하고 자석 플레이트 분리기를 사용하여 유사한 방식으로 접시에서 뜨는을 제거하여 두 번 각각 잘 씻으십시오.
- 부드럽게 멀티 채널 pipettor로 다섯 번이나 아래로 pipetting 및하여 분석 완충액 100 μL의 구슬을 Resuspend.
- 같은 MAGPIX의 악기와 같은 Luminex xMAP 악기에 분석. 이 반응의 형광 신호의 강도가 directl입니다Y, 구슬의 표면에 단백질의 양에 비례 구슬에 결합 단백질의 상대적 양을 신속한 평가를 제공합니다.
- 탐지를 위해 수정되지 않은 항체에 비오틴을 커플링
- 수정되지 않은 탐지 항체를 사용하는 경우, 써모 피셔 EZ-링크 Sulfo-NHS-LC-비오틴 시약 (Cat. 번호 PI-21335)과 패키지 삽입에서 설명한 절차와 이러한 항체를 biotinylate. 그들이 xMAP 분석기로 검출 수 있도록 일단 biotinylated, 검출 항체는 이후 분석에서 streptavidin phycoerythrin (SA-PE) (단계 III.6.)으로 표시됩니다.
II. 분석 설정
- xMAP 검정과 가장 효과를 결정하는 1 % BSA (분석 완충액. 자료 테이블을 참조)과 PBS의 0.96 ML 각 10 μL를 추가하여 네 가지 구슬 세트의 초기 혼합물을 준비합니다.
- dil에 의해 감지 항체 솔루션을 준비1 μg / 분석 완충액의 ML에 각각 uting.
- 분석 완충액에서 PG / ML 2000에 R & D 시스템 TNF-α 단백질 표준을 준비합니다.
- 8 μg / 분석 완충액의 ML에 Streptavidin-rPhycoerythrin (SA-PE)을 (@ 1 밀리그램 / ML 제공) 희석.
III. 항체 검사
- 심사 분석을위한 Costar 왕복 하단 96 - 웰 플레이트의 16 우물 각 항체 결합 microsphere 혼합물의 50 μL를 추가합니다.
- 배경을 측정하기 위하여, 16 위 8로 분석 완충액 50 μL를 추가합니다.
- 응답을 측정하기 위하여, 다른 8 우물에 R & D 시스템 TNF-α 표준 (@ 2,000 PG / ML) 50 μL를 추가합니다.
- 검정 접시 흔드는에 떨고있는 동안, 빛으로부터 보호 상온,에 하나의 시간 동안 알을 품다.
- 검정 접시 SHA에 떨고있는 동안, 네 우물 (두 배경으로 두 응답)에 네 개의 감지 항체의 각 50 μL를 추가하고 빛으로부터 보호 실온에서 30 분 동안 품어ker.
- 모든 우물에 SA-PE 시약 50 μL를 추가하고 분석 플레이트 흔드는에 떨고있는 동안, 빛으로부터 보호, 실온에서 15 분 알을 품다.
- 일분 자성 판 분리기에 플레이트를 삽입하고 강제로 반전 판에 의해 액체를 제거합니다.
- 16 우물 각각에 100 μL 분석 완충액을 추가, 일분 자성 판 분리기에 플레이트를 삽입 후 한동안 분리를 강제로 반전 판에 의해 액체를 제거합니다.
- 16 우물 각 분석 완충액 100 μL를 추가하고 Luminex MAGPIX 악기로 접시를 읽어, 제대로 작동하는 사용자의 설명서를 참조.
- 원하는 신호 강도를 만족하는 항체 쌍을 선택합니다.
IV. xMAP 기능 분석
- 최고의 캡쳐 항체를 선택한 후, 분석 완충액을 갖춘 10 ML에 해당 항체 결합 비드 주식 100 μL를 (단계 IB8에서) 희석.
- 50 μL를 추가하십시오이 Costar 둥근 바닥 96 - 웰 플레이트의 78 우물에 희석 비즈. (78 우물 곱하기 2는 플레이트가 = 156 우물) 각 플레이트는 다른 탐지 항체의 성능을 평가하는 데 사용됩니다.
- 8000에서 시작하여 12 점 표준 곡선을 준비한다 4에 PG / ML 및 종료 R & D 시스템 TNF-α 표준 PG / ML,.에게 78 우물 / 접시의 총, 배경으로 분석 완충액 각각 50 μL 6 명이 50 μL 접시 각 각 희석의 복제, 플러스 여섯 웰스를 추가합니다.
- 검정 접시 흔드는에 떨고있는 동안, 빛으로부터 보호 상온,에 하나의 시간 동안 번호판을 품어.
- 첫 번째 접시의 모든 78 우물에 처음으로 검출 항체의 50 μL를 추가합니다. 두 번째 접시에 두 번째 검출 항체에 대해 반복합니다.
- 검정 접시에 뿌리를 흔들어하면서 빛으로부터 보호 상온,에서 30 분 동안 접시를 품어.
- 각 판의 모든 우물에 SA-PE 시약의 50 μL를 추가합니다.
- 알을 품다검정 접시에 뿌리를 흔들어 동안 실온에서 15 분동안 두 접시는 빛으로부터 보호되고 있습니다.
- 일분 자석 플레이트 구분에 접시를 놓고, 그때 잠시 분리를 강제로 반전 판에 의해 액체를 제거합니다.
- 접시에 78 우물 각 분석 완충액 100 μL를 추가, 일분 자성 플레이트 구분에 접시를 삽입 후 강제로 반전 판에 의해 액체를 제거합니다.
- 접시에 78 우물 각 분석 완충액 100 μL를 추가하고 제대로 작동하는 사용자의 설명서를 참조, MAGPIX 악기를 분석합니다.
V. 엘리사 분석
- R & D 시스템 휴먼 TNF-α/TNFSF1A DuoSet 엘리사 키트 (R & D 파트 # DY210)에 포함된 지침에 따라 R & D 키트와 함께 제공된 표준에 의해 생성된 응답을 측정합니다. R & D 시스템 캡처 및 검출 개미를 대체, 엘리사 분석 더 세 번 반복다른 업체의 항체와 ibodies. 단순, 페어 공급 업체에 의해 항체 (예 : Millipore 검출 항체와 Millipore 캡처 항체, Abcam 검출 항체와 Abcam 캡처 항체 등)하십시오.
- 세 TNF-α 단백질 기준의 각과 같은 엘리사 형식에서 요구하는, 독립적으로 각각 쌍을을 평가해보십시오.
VI. 대표 결과
이 프로토콜은 빠르게 분석을 최적화하는 기술의 다양한 기능을 활용하면서 전형적인 엘리사가 xMAP 플랫폼으로 변환할 수있는 방법을 보여줍니다. 이 예제에 사용된 엘리사는 인간 종양의 괴사 팩터 - 알파 (TNF-α) R & D 시스템에서 DuoSet 엘리사 키트 (R & D 파트 # DY210)였다.
키트에 제공된 항체 쌍 이외에 다른 소스 (재료 표 참조)에서 세 가지 다른 항체 쌍은 xMAP 플랫폼을 사용하여 동시에 평가되었다. 정항체의 UR은 캡처 항체로 지정되었으며 MagPlex 낮은 농도 Microspheres로 결합되었다. 나머지 네 가지 항체가 검출 항체로 지정되었다, 비오틴 결합으로 구입되었으며 의정서에 설명된대로 네 번째는 biotinylated되었다 셋 중.
본 연구에 대한 항체는 가용성과 공급 업체를 기반으로 선정되었습니다. 그러나, 실질적인 환경에서, 항체는 개별 사용자의 선호도와 그 항체와 과거 실적 경험을 바탕으로 선정하여야한다. 본 실험은 캡처 항체 대 검출 항체로서 항체의 적합성을 테스트하지 않지만,이 프로토콜은 쉽게 목적으로 수정할 수 있습니다.
Luminex xMAP의 assays는 TNF-α 항체 결합 MagPlex microspheres의 4 세트를 결합하여, 혼합물로 네 명 모두 캡쳐 항체를 평가하는 멀티 플렉스로 수행되었다. 캡처 항체는 네 가지 각각으로 평가되었다개별적으로 biotinylated 검출 항체, 네 개의 캡처 항체의 각과 하나가 검출 항체의 상호 작용이 동시에 결정될 수있다는 등. 병렬로 진행 포 같은 assays는 네 명 모두 캡쳐 항체와 네 명 모두 검출 항체의 상호 작용을 결정. 그림 1은 이러한 심사 assays에서 비교 데이터를 보여줍니다.
결과는 R & D 시스템 DuoSet에서 항체 쌍은 6183 언 형광 강도 (MFI) 단위에서 발생하는 반응과 함께 최선을 수행한 지적했다. 또한 R & D 시스템 캡처 항체와 결합하면 Millipore (R & D 항체 쌍 응답의 86 %)과 Abcam (67 %)에서 검출 항체가 xMAP 분석에 적절한 응답을 제공하는 것으로 관찰되었다. Abcam, Millipore와 Novus에서 캡처 항체는 xMAP 분석에 덜 바람직한 응답을 생산.
그것은주의하는 것이 중요하다, 그 pur본 연구의 포즈는 특정 항체 또는 벤더 간의 차이가 있지만 단지와 비슷한 조건 하에서 사용 실적에 주목할만한 차이가있다는 것을 설명하고, xMAP 플랫폼이 이러한 차이를 평가의 효율적인 수단을 제공할 수있는 위해를 강조하는 데 필요하지 않습니다.
R & D 시스템 DuoSet 프로토콜은 엘리사 형식으로 네 개의 항체 쌍을 비교하는 데 사용되었다. R & D 시스템 프로토콜은 그것이 광범위하게 오늘날 사용되는 전형적인 엘리사 프로토콜의 반영이기 때문에 모든 항체 쌍 함께 사용하며 xMAP 기술로 사용되는 프로토콜에 대한 유사했다. 엘리사 검사 R & D 시스템에서 항체 쌍 다시 최상의 결과를 (그림 2) 준 것으로 나타났다. Abcam에서 항체 쌍이 Millipore와 Novus 생산 겸손한 반응에서 응답 및 항체 쌍을 생산 않습니다.
표준 항체 반응에 변화를 평가하기 위해, 네 명 모두 antibodY 쌍은 세 가지 다른 벤더 (자료 테이블을 참조)에서 세 가지 재조합 TNF-α 단백질 수준에서 테스트되었습니다. 세 업체의 재조합 TNF-α 단백질 표준 동등한 결과를 주셨으니 이는 그림 2에 표시 데이터입니다.
R & D 시스템에서 TNF-α 단백질은 엘리사 (표 1)과 xMAP assays (표 2 및 3) 표준 곡선을 생성하는 데 사용되었다. 엘리사 분석은 R & D 시스템 항체 쌍 다 동안 xMAP의 assays는 R & D 시스템 또는 Millipore에서 R & D 시스템 캡처 항체와 검출 항체 중 하나를 활용. R & D 시스템에서 TNF-α 단백질은 8000부터 4 PG / ML에 대한 농도의 범위를 생산할 희석되었다. R & D 시스템에서 전용 항체 쌍은 표 2와 같이 응답> 20,000 MFI 함께 xMAP 분석에서 예상되는 결과를 생산하고그림 3. Millipore에서 검출 항체는 R & D 시스템 탐지 항체 대신 (표 3), R & D 시스템에서 감지 항체로 얻은 응답의 약 30 %였다 응답 (6000 MFI)의 xMAP 분석과 함께 사용되었을 때,로 표시 그림 3.
표 1의 데이터 16-1000 PG / ML의 제조 업체에서 권장하는 TNF-α의 범위를 가지고 엘리사의 표준 곡선을 나타냅니다. 1000에서 OD는 PG / ML이 OD 단위보다 약간 큰했고 분광 광도계 3 OD 위에서 측정할 수 없기 때문에이 범위는 매우 제한되었다. 때문에 분광 광도계와 한계 때문에, 그것은 더 엘리사 분석의 범위를 증가하는 것은 불가능했습니다. 또한, 표 1의 데이터는 R & D 시스템 DuoSet 엘리사 16 PG / ML보다 훨씬 낮은 농도에서 TNF-α를 감지 할 수 없다는 것을 나타냅니다. 한편, xMAP 분석은 measur이 가능합니다R & D 시스템 또는 Millipore 중 하나에서 검출 항체와 결합하여 R & D 시스템에서 캡처 항체와 미만 7.8 PG / ML의 농도에서 ING TNF-α.
(그림 4) 로그 - 로그 스케일로 꾸몄다 때 두 방법의 동적 범위와 감도는 더 삽화가있다. xMAP의 assays에서 엘리사 응답과 응답의 기울기 사이의 명확한 구별은 더 이상 낮은 농도 모두에서 엘리사와 TNF-α의 검출을위한 더 많은 제한 기능을 나타내는 것으로 볼 수있다.
두 기능 TNF-α xMAP의 assays에 대한 검색 (LOD)의 제한은 배경 이상의 관찰 응답 레벨 (MFI), 플러스 세번의 표준 편차 (SD)과 함께 가장 낮은 TNF-α 농도를 파악하여 approximated되었다. 통계적 의미를 달성하기 위해, 여섯 xMAP와 엘리사 두 방법에 대한 SD를 결정하는 데 사용되었습니다 복제합니다. ThesLOD의 전자 견적 결과는 낙관적와 정상적인 작동 조건에서만 두세가 사용됩니다 복제 것을 이해 '베스트 케이스 "시나리오를 제공하기위한 것입니다. 표 2에서는이 기준에 부합하는, R & D 시스템 쌍, 3.91에서 최저 TNF-α 농도를 사용할 때 PG / ML은 배경 + 3SD의 반응보다 큰 66 MFI의 반응을 생산 것을 관찰할 수있다 . Millipore 검출 항체가 R & D 시스템 캡처 항체 (표 3)와 함께 사용되었을 때, 감지 한계 이하 7.81 PG / ML했습니다. 이 경우, 2 최저 TNF-α 농도는 17 MFI의 허용 가능한 응답을 생산, 최저 TNF-α 농도의 반응보다 큰 플러스 세번의 표준 편차. (10 MFI + 3 (2.4) = 16.29 MFI) 마찬가지로, R & D 시스템 DuoSet 엘리사에 대한 검색의 한도는 63 PG / ML 31 PG / ML (표 1) 사이의 것으로 추정되었다.
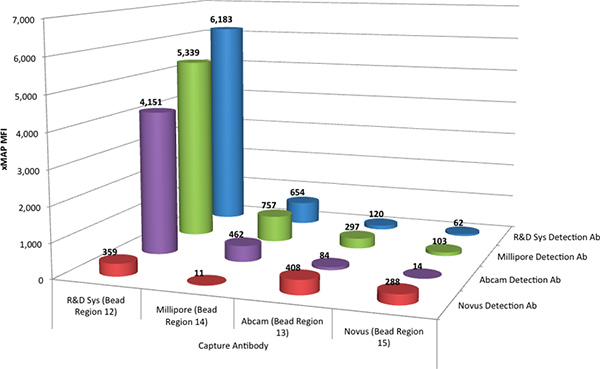
그림 1. 네 개의 캡처 항체의 모든 가능한 조합에 대한 R & D 시스템 표준 (@ 2,000 PG / ML) (네 가지 microsphere 영역 결합)과 네 개의 검출 항체의 평균 형광 강도 (MFI)가. 큰를 보려면 여기를 클릭하십시오 생각 .
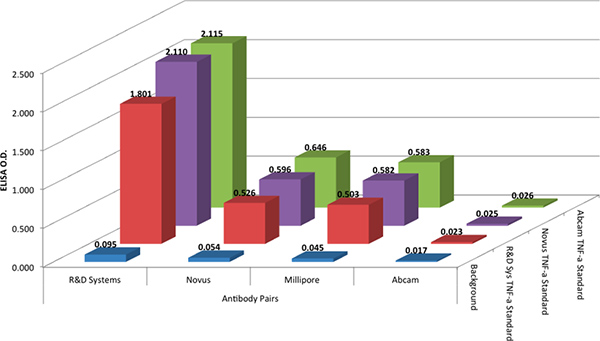
그림 2. 네 캡처 및 탐지 항체 페어 조합에 대한 세 가지 다른 재조합 기준 (@ 1,000 PG / ML)의 광학 밀도 (OD). 캡처 및 검출 항체가 임의로 단순화를 위해 공급 업체에 의해 이점했다하면. 큰 그림을 보려면 여기를 누르십시오 .
| PG / ML | OD | 표준 데브 | 3 SD |
| 1000 | 2.084 | 0.035 | 2.187 |
| 500 | 1.328 | 0.038 | 1.441 |
| 250 | 0.787 | 0.025 | 0.863 |
| 125 | 0.476 | 0.026 | 0.554 |
| 63 | 0.304 | 0.023 | 0.374 |
| 31.3 | 0.212 | 0.025 | 0.287 |
| 15.6 | 0.167 | 0.026 | 0.244 |
| 0 | 0.118 | 0.021 | 0.182 |
표 1 표준 곡선으로 사용하기위한 R & D 시스템 DuoSet 패키지 삽입에 의해 지정된 2 배 희석 계열의 광학 밀도 (OD);. 31.3 사이의 표준 편차 (SD) 및 검출의 추정 한계 (LOD)를 포함 PG / ML 63 PG / ML.
| R & D 시스템 캡처 및 탐지 항체 | |||
| PG / ML | MFI | 표준 데브 | 3 SD |
| 8000 | 20,320 | 463 | 21,707 |
| 4000 | 15,594 | 223 | 16,263 |
| 2000 | 11,098 | 79 | 11,336 |
| 1000 | 6985 | 160 | 7465 |
| 500 | 4149 | 80 | 4390 |
| 250 | 2233 | 30.0 | 2323 |
| 125 | 1199 | 43.8 | 1330 |
| 63 | 636 | 14.0 | 678 |
| 31.3 | 340 | 12.9 | 379 |
| 15.6 | 183 | 5.9 | 201 |
| 7.8 | 103 | 2.2 | 109 |
| 3.9 | 66 | 2.4 | 73 |
| 0 | 11 | 0.8 | 13.8 |
표 2 R & D 시스템 DuoSet 포함된 항체 쌍을 사용하여 xMAP 기술에 의해 측정 표준 희석 시리즈의 평균 형광 강도 (MFI);. 표준 편차 (SD) 및 검출의 예상 한계 (LOD) 미만의 3.91를 포함하여 PG / ML.
| Millipore 감지 AB와 R & D 시스템 캡처 AB | |||
| PG / ML | MFI | 표준 데브 | 3 SD |
| 8000 | 5800 | 143 | 6229 |
| 4000 | 3881 | 120 | 4242 |
| 2000 | 2176 | 73 | 2396 |
| 1000 | 1138 | 32.1 | 1234 |
| 500 | 578 | 31.3 | 671 |
| 250 | 289 | 6.2 | 307 |
| 125 | 142 | 3.1 | 151 |
| 63 | 75 | 5.3 | 91 |
| 31.3 | 44 | 3.3 | 54 |
| 15.6 | 28 | 2.6 | 35.5 |
| 7.8 | 17 | 1.5 | 21.2 |
| 3.9 | 10 | 2.0 | 16.3 |
| 0 | 7 | 1.4 | 11.4 |
표 3 R & D 시스템 캡처 항체와 EMD Millipore 탐지 항체를 사용하여 xMAP 기술에 의해 측정 표준 희석 시리즈의 평균 형광 강도 (MFI);. 표준 편차 (SD) 및 검출의 예상 한계 (LOD)를 포함하여, 적은 7.81보다 PG / ML.
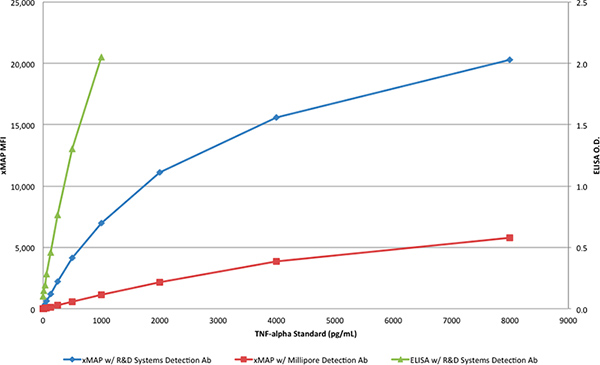
그림 3. 두 xMAP의 assays 및 R & D 시스템 DuoSet 엘리사의 표준 곡선은. 큰 그림을 보려면 여기를 누르십시오 .
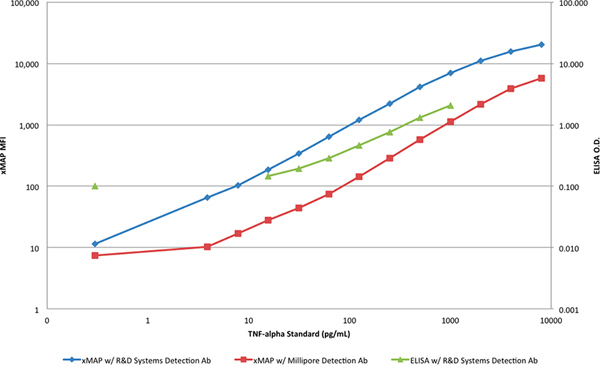
그림 4. xMAP 표준 곡선과 로그 - 로그 스케일의 엘리사 표준 곡선의 비교가. 큰 그림을 보려면 여기를 누르십시오 .
토론
Luminex xMAP 플랫폼으로 엘리사 분석의 변환 streptavidin phycoerythrin (SA-PE)과 전형적인 엘리사 키트에 streptavidin 양고추냉이 퍼옥시데이즈 (SA-HRP)를 대체하고, 성능을 최적화하는 것만 큼이나 간단합니다. 최대 땅속에서 xMAP 면역 분석법을 생성하고자하는 사람들을 위해, 이것은 또한 항체 쌍의 빠른, 멀티 플렉스 평가있게 간단한 프로토콜로 수행할 수 있습니다. xMAP 분석을위한 시약 쉽게 부부 지정 캡처 항체에 MagPlex 낮은 농도 microspheres에 xMAP 항체 커플링 키트를 사용하여 작성되었다. 낮은 농도 microspheres의 사용은 높은 농도 microspheres의 동일한 분석 성능을 제공하면서 분석 개발 비용을 줄여줍니다. 결합 MagPlex microspheres를 준비하는 데 필요한 시간의 양은 어느가 22보다 훨씬 빠른, 약 3 시간 - 24 시간 치료 뒤에는 코트 엘리사 플레이트의 우물을 의무코팅 위. xMAP 분석의 성능을 탐지 (<4 PG / ML 대> 31 PG / ML) 및 동적 범위 (<4 PG / ML로> 8000 PG / ML 대 16 한계의 측면에서도 엘리사에게 우수 PG / ML 1000 PG / ML). 플레이트 리더는 분석을위한 동적 범위의 상한선을 제한, 중 3이나 4 OD는 제한된 OD의 범위가 있습니다.
의심의 여지가없이, 모든 항체는 엘리사 형식으로 작동하며 엘리사에 잘 작동하지 않을 모든 항체는 xMAP 분석 형식으로 쉽게 이전할 수 있습니다. xMAP의 assays가 (동시에 실행 IE) 멀티 플렉스 수 있기 때문에 그러나, 그것은 분석을 위해 사용하는 가장 좋은 쌍을 식별하는 동시에 여러 캡처 및 탐지 항체 조합을 평가하는 것이 가능합니다. 이 과정은 상당한 시간과 한 번에 한 쌍의 평가로 제한됩니다 엘리사 개발 절차와 비교 시약을 저장합니다. 두 개 이상의 항체 쌍은 equivalently 수행되어야하고 분석의 다른 매개 변수 수쌍 (예, 가용성, 비용 등)의 적합성을 결정 간주됩니다.
xMAP 분석과 향상된 분석 성능과 유연성뿐만 아니라, 상당한 비용 절감 효과도있다. xMAP 분석을 잘 하나에 사용되는 구슬에 필요한 수량이 약 7.5 NG이지만 항체의 권장 수량은 코트 한 우물 엘리사 플레이트가 400ng이다에 필요합니다. 따라서, 하나 엘리사에 필요한 항체의 양을 잘 xMAP 분석에 사용되는 경우, 50 개 이상의 테스트 결과를 제공합니다. 귀중한 샘플을 포함한 어플 리케이션의 경우, xMAP 또한 상당한 장점이 있습니다. xMAP 분석에 필요한 볼륨 그 중 절반 이하가 될 수 반면 엘리사 권장 시료의 부피는 100 μL입니다.
우수한 동적 범위와 감도와 분석을 생산하면서 요약에 Luminex xMAP 플랫폼으로 엘리사 분석의 변환은, 단순한 효율 및 비용 절감이다.
공개
이 작품은 Luminex 공사에서 제조 설비를 Luminex 공사에서 이루어졌다.
R & D 시스템 및 EMD Millipore는 Luminex Corporation의 전략적 파트너, 멀티 플렉스 xMAP 기반 assays을 개발하고 상용화 허가.
감사의 말
이 작품은 Luminex 공사에 의해 재정 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 설명 | 공급 업체 | 카탈로그 번호 | 댓글 |
| 인간 TNF-α/TNFSF1A DuoSet 엘리사 키트 | R & D 시스템 | DY210 | 단클론 및 비오틴 결합 polyclonal 항체 및 재조합 TNF-α 단백질 표준을 포함 |
| TNF-α에 대한 단클론 항체 | Abcam | Ab18696 | , 클론 CH8820를 항체를 캡처 |
| TNF-α에 대한 단클론 항체 | Abcam | Ab16166 | 비오틴 결합 감지 항체, 클론 AS1 |
| TNF 알파 단백질 | Abcam | Ab9642 | 재조합 TNF-α 단백질 표준 |
| TNF-α에 대한 단클론 항체 | Novus | NBP1-50115 | , 클론 4H31을 항체를 캡처 |
| TNF-α에 대한 단클론 항체 | Novus | NB100-78162 | 비오틴 결합 감지 항체, 클론 MAb11 |
| TNF 알파 단백질 | Novus | NBC1-18460 | 재조합 TNF-α 단백질 표준 |
| TNF-α에 대한 단클론 항체 | EMD Millipore | MAB1141 | 항체를 캡처, 3C7.2을 복제 |
| TNF-α에 대한 Polyclonal 항체 | EMD Millipore | 654,250 | 토끼 polyclonal 감지 항체 |
| Streptavidin-Phycoerythrin | 이끼 | SAPE-001 | Luminex xMAP 분석을위한 형광 기자 시약 |
| MAGPIX W / xPONENT 소프트웨어 | Luminex 공사 | 석사GPIX-XPONENT | Luminex의 악기 |
| xMAP 항체 커플링 (ABC) 키트 | Luminex 공사 | 40-50016 | EDC 시약, Sulfo-보건국 시약, 활성화 버퍼, 세차 버퍼, 1.5 ML 반응 튜브, 그리고 일회용 pipettes 포함 |
| MagPlex Microspheres, 낮은 농도 | Luminex 공사 | MC10012-ID, MC10013-ID, MC10014-ID, MC10015-ID | 낮은 농도 구슬 (@ 2.5 X 10 6 비드 / ML) |
| EZ-링크 Sulfo-NHS-LC-비오틴 | 써모 피셔 | PI-21335 | 수정되지 않은 항체 검출을위한 Biotinylation 키트 |
| Tecan 무한 F200 리더 | Tecan | 엘리사 플레이트 리더 | |
| 인산염은 염분 버퍼 | 시그마 - 올드 리치 | P-3688 | 1퍼센트 PBS-BSA, 분석 완충액 |
| 한 파인트 소형 초음파 청소기, VAC 115 | 콜 - Parmer | WU-08849-00 | 55 kHz에서의 효과적인 운영 주파수를 제작 |
| 마그네틱 튜브 구분 기호 | Luminex 공사 | CN-0288-01 | 커플링 세탁 단계에서 단일 1.5mL 튜브 자성 분리를 위해 |
| 마그네틱 플레이트 구분 기호 | Luminex 공사 | CN-0269-01 | 검정 세척 단계에서 96 - 웰 플레이트 자성 분리를 위해 |
참고문헌
- Fulton, J. R., McDade, R. L., Smith, P. L., Kienker, L. J., Kettman, J. R. Advanced multiplexed analysis with the FlowMetrix system. Clinical Chemistry. 43, 1749-1756 (1997).
- Carson, R. T., Vignali, A. A. Simultaneous quantation of 15 cytokines using a multiplexed flow cytometric assay. J. Immunol. Methods. 227, 41-52 (1999).
- Peck, D., Crawford, E. D., Ross, K. N., Stegmaier, K., Golub, T. R., Lamb, J. A method for high-throughput gene expression signature analysis. Genome Biol. 7, 61 (2006).
- VanDerMeid, K. R., Su, S. P., Krenzer, K. L., Ward, K. W., Zhang, J. Z. A method to extract cytokines and matrix metalloproteinases from Schirmer strips and analyze using Luminex. Mol Vis. 17, 1056-1063 (2011).
- Liu, J., Kibiki, G., Maro, V., Maro, A., Kumburu, H., Swai, N., Taniuchi, M., Gratz, J., Toney, D., Kang, G., Houpt, E. Multiplex reverse transcription PCR Luminex assay for detection and quantitation of viral agents of gastroenteritis. J. Clin. Virol. 50, 308-313 (2011).
- de Jager, W., Prakken, B. J., Bijlsma, J., WJ Kuis, W., Rijkers, G. T. Improved multiplex immunoassay performance in human plasma and synovial fluid following removal of interfering heterophilic antibodies. J. Immunol. Methods. 300, 124-135 (2005).
- Codorean, E., Nichita, C., Albulescu, L., Raducan, E., Popescu, I. D., Lonita, A. C., Albulescu, R. Correlation of xMAP and ELISA cytokine profiles; development and validation for immunotoxicological studies in vitro. Roum. Arch. Microbiol. Immunol. 69, 3-19 (2010).
- de Jager, W., te Velthuis, H., Prakken, B. J., Kuis, W., Rijkers, G. T. Simultaneous detection of 15 human cytokines in a single sample of stimulated peripheral blood mononuclear cells. Clin. Diagn. Lab. Immunol. 10, 133-139 (2003).
- DuPont, N. C., Wang, K. H., Wadhwa, P. D., Culhane, J. F., Nelson, E. L. Validation and comparison of Luminex multiplex cytokine analysis kits with ELISA: Determinations of a panel of nine cytokines in clinical sample culture supernatants. J. Reprod. Immunol. 66, 175-191 (2005).
- Richens, J. L., Urbanowicz, R. A., Metcalf, R., Corne, J., O'Shea, P., Fairclough, L. Quantitative validation and comparison of multiplex cytokine kits. Journal of Biomolecular Screening. 15, 562-568 (2010).
- Rizzi, G., Zhang, Y. J., Latek, R., Weiner, R., Rhyne, P. W. Characterization and development of a Luminex-based assay for the detection of human IL-23. Bioanalysis. 2, 1561-1572 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유