JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
PDZ-의존 CFTR의 Macromolecular 신호 단지의 체외 분석
요약
낭성 섬유증의 transmembrane의 전도성 조정기 (CFTR), 상피 염화물 채널, 각종 단백질과 상호 작용하고 중요한 세포 과정을 조절하는 것으로보고되었습니다; 그들 가운데 CFTR PDZ 모티프-매개 상호 작용이 잘 문서화되었습니다. 이 프로토콜은 우리가 복잡한 신호 PDZ-의존 CFTR의 macromolecular를 조립하기 위해 개발된 방법을 설명합니다 체외에서.
초록
낭성 섬유증의 transmembrane의 전도성 조정기 (CFTR), 주로 상피 세포의 꼭대기의 세포막에있는 염화물 채널, 1-3 transepithelial 유체 항상성에 중요한 역할을 담당하고 있습니다. 낭성 섬유증 (CF) 4 분비 설사 5 : CFTR은 두 가지 주요 질병에 연루되었습니다. CF에서 CFTR 망할 CIA 채널의 합성 또는 기능적 활동이 줄어 듭니다. 이 질환은 미국에서 2500 Caucasians 년 6 약 1에 영향을 미칩니다. 과도한 CFTR 활동도 캠프의 용기 7의 cGMP 생산을 자극 독소 유발 분비 설사 (예 : 콜레라 독소와 열 안정 E. 대장균의 enterotoxin에 의한)의 경우에 연루되었습니다.
증거를 수집하는 것은 CFTR 및 전송기, 이온 채널, 수용체, kinases, phosphatases, 신호 등 다른 단백질의 증가, 간의 물리적 및 기능적 상호 작용의 존재를 제안ING 분자, 그리고 cytoskeletal 요소 및 CFTR와 바인딩 단백질 간의 이러한 상호 작용은 비판적으로 시험 관내 및 생체내 또한 8-19에서 CFTR-매개 transepithelial 이온 전달을 조절에 관여하는 표시되었습니다. 이 프로토콜에서는, 우리는 방법에 초점을 그 단백질 바인딩 모티브를 가지고 CFTR 카르 복실 말단 꼬리 사이의 상호 작용 연구 지원과 [모티프의 PSD95/Dlg1/ZO-1 (PDZ)로 언급] 특정 바인딩 모듈을 포함하는 비계 단백질의 그룹 PDZ 도메인로 지칭. 지금까지 여러 가지 PDZ 비계 단백질 같은 NHERF1 등 다양한 동질성, NHERF2, PDZK1, PDZK2, CAL (CFTR-연관된 리간드), Shank2으로 CFTR의 카르 복실 말단 꼬리에 바인딩하고, 20-27를 파악하는 것으로보고되었습니다. PDZ 비계 단백질에 의해 인식되는 CFTR 사이 PDZ의 모티브는 C 말단 (즉, 인간의 CFTR에있는 1477-DTRL-1480) 20에서 마지막 네 아미노산이다. 흥미롭게도,CFTR은 동질성에게 22 변화와 함께이라도 NHERFs 및 PDZK1 모두 하나 이상의 PDZ 도메인을 바인딩할 수 있습니다. CFTR 구속력와 관련해서이 multivalency는 PDZ 비계 단백질은 세포 16-18에서 선택 / 특정하고 효율적인 신호를위한 복합 신호 CFTR의 macromolecular 형성을 촉진있다는 것을 암시, 기능성 중요한 것으로 표시되었습니다.
여러 생화학 assays는 공부를하기 위해 개발되었습니다 CFTR - 참여 등 공동 immunoprecipitation, 풀다운 분석, 페어 많다는 구속력을 분석, colorimetric 한쌍이 많다는 구속력을 분석하고, macromolecular 복잡한 어셈블리 분석 16-19,28,29 같은 단백질 상호 작용, . 여기 단백질 단백질이나 CFTR 16-19,28,29 관련된 도메인 도메인 상호 작용을 연구하기위한 실험실에 의해 광범위하게 사용되는 체외에서 복잡한 PDZ 모티브 종속적인 CFTR 함유 macromolecular 조립의 세부 절차에 초점.
프로토콜
1. 박테리아의 재조합 태그 퓨전 단백질의 표현과 정제
- CFTR, LPA 2, MRP2, MRP4, β 2 AR, 그리고 NHERFs (전체 길이 또는 PDZ1 또는 PDZ2 도메인을위한 C-꼬리 (C-말단에 PDZ 모티프를 포함하는 마지막 50-100 아미노산)의 정의 영역을 확대 ) PCR 방식에 의한.
- GST-융합 단백질에 대한 pGEX4T-1 벡터 (예 : GST-NHERFs, GST-MRP4 중부 표준시와 같은), MBP-융합 단백질에 대한 pMAL-C2 벡터 (예 : MBP-β 2 아칸소 주 중부 표준시, MBP-CFTR 중부 표준시 등에 PCR 제품을 복제 ), 그리고 그의-S-융합 단백질 (예 : 그의-S-CFTR 중부 표준시로서 그의-S-PDZK1)에 대한 pET30.
- 단백 분해 효소 - 결함 E.로 변환 대장균 변형 (BL21-DE3) 가능한 재조합 단백질 저하를 최소화합니다.
- 적절한 항생제 (예 암피실린 또는 kanamycin 등)가 포함된 Luria-Bertani 매체 (산도 7.0)에서 37 ° C에서 하룻밤 문화를 성장. 1시 10분에서 하룻밤 문화를 희석 37에서 다른 2 시인데위한 성장 ° C. 에0.5-1 M M은 30 ° C.에 다음 4 H 위해 IPTG로 duce 8000에서 원심 분리하여 펠렛은 전지 × g로 10 분 4시 ° C.
- (50 M M 트리스-HCL, 산도 8.0, 1m M EDTA (에틸렌 다이아 민 테트라 초산), 1 M M PMSF, 그리고 10 %의 자당)가 라이 소 자임 (1 밀리그램 / ML), 0.2 % 트리톤 X-100, 및 프로 테아제를 포함하는 자당 버퍼에 전지를 Lyse 에페. 세포 펠렛 문화 1 패에서 발생하는 20 ML을 사용합니다.
- 4 ° C.에서 30 분 로터리 흔드는에 섞어서
- 4 ° C.에 30 분 동안 20,000 × g에서 던가 맑은 뜨는 수집합니다.
- 맑은 뜨는로 다음과 같은 수지 / 아가로 오스 구슬 (자당 버퍼의 50 % 슬러리) 1 ML 추가
- GST 융합 단백질을위한 글루타티온 아가로 오스 비즈.
- 그의-S 융합 단백질에 대한 탈론 구슬.
- MBP 융합 단백질에 대한 아밀로오스 수지.
- 4 4 H를위한 믹스 ° 회전 흔드는에서 C #.
- 2 마일을위한 믹싱, 1X PBS (15 ML)에 resuspending하여 구슬을 씻는다N, 800 회전 × G를 2 분, 그리고 폐기 뜨는 위해. 여섯 번에 대해이 단계를 반복합니다.
- 각각의 용리 완충액 (구슬 1 ML 당 2 ML의 용출 버퍼)를 사용하여 구슬에서 단백질을 Elute.
- GST 융합 단백질에 대한 용출 버퍼 : 25 M M 트리스-HCL (산도 8.0), 140 M M NaCl, 20 M M은 글루타티온 감소.
- 그의 융합 단백질에 대한 용출 버퍼 : 20 M M 트리스-HCL (산도 8.0), 500 M M NaCl, 200 M M 이미다졸.
- MBP 융합 단백질에 대한 용출 버퍼 : 20 M M 트리스-HCL (산도 8.0), 200 M M NaCl, 1 M M EDTA (에틸렌 다이아 민 테트라 초산), 1 M M DTT, 10 M M 말토오스.
- 4에서 1X PBS의 2 패에 대한 eluted 단백질 Dialyze ° C (가능한 단백질 저하를 피하기 위해). PBS 네 번위한 매 4 H를 변경합니다. -80에서 작은 aliquots로 Centricon 필터 (10,000 MW의 컷오프, Millipore)와 저장소를 사용하여 단백질을 집중 ° C.
- Det브래드 포드 방법에 의한 단백질 농도 어민. SDS-PAGE가 표준으로 BSA를 사용하여 단백질 품질을 평가합니다. 단백질의 무결성이 만족되지 않으면 이러한 겔 여과 또는 이온 교환 등의 보조 정화 절차가 사용될 수 있습니다. (예, 우리는 더욱 GST-융합 단백질을 정화하기 위해 G-75 세파 로스 칼럼을 사용했습니다).
2. 세포 배양 및 세포 Lysate 준비
- 문화 아기 햄스터 신장 (BHK) 세포가 그 안정적으로 이상 - 특급 CFTR-wt 및 CFTR-his10 또는 BHK 세포 그 transiently 이상 - 특급 국기-LPA 2 wt 또는 국기-LPA 2 ΔSTL 및 Madin-다비 송곳니 신장 (MDCK 이글의 최소 필수 배지에서 안정적으로 오버 명시 MRP2 (MEM)가 5 % CO 2와 37 10% 소태아 혈청 및 페니실린 / 폴리스티렌 flasks의 스트렙토 마이신 ° C를 포함하는) 세포.
- 문화 인간의 배아 신장 293 (HEK293) 세포를 안정적으로 그 이상 - 특급 CFTR-wt과 Dulbecco에서 CFTR-his10'5 % CO 2와 37 ° C에서 10% 태아 소 혈청 및 페니실린 / 폴리스티렌 flasks의 스트렙토 마이신과 보완의 수정된 이글 배지 (DMEM).
- 사용; - (0.2 % 트리톤-X-100 1m M phenylmethylsulphonyl 플루오르, 1 μg / ML aprotinin, 1 μg / ML 류펩틴, 1 μg / ML의 pepstatin를 포함하는 프로 테아제 저해제의 혼합으로 보충 PBS)가 용해 완충액으로 세포를 Lyse 각각 60 mm 배양 접시, 각각 100 mm 배양 접시 1,000 μL 용해 완충액 500 μL 용해 완충액.
- 세포 ° C 및 4에서 15 분 동안 16,000에서 원심 분리하여 불용성 물질 × g를 제거 ° C. 4에서 20 분 동안 lysates 락앤롤 브래드 포드 분석에 의한 단백질 농도를 확인합니다.
3. CFTR 함유 Macromolecular 단지의 체외 어셈블리에서 (CFTR-PDZK1-MRP4)
- 용해 완충액 200 μL (PBS - 0.2 % 트리톤 X-100 + 프로 테아제 억제제)로, 20 μg 정화 GST-MRP4-C 터미널을 추가50 AA (CT50) 융합 단백질.
- 그의-S-PDZK1 융합 단백질을 정제의 다양한 양의 (0-40 μg)를 추가합니다.
- 22 1-2 용 ° C ~ H의 회전 믹서에 두 단백질을 섞는다.
- 단백질 혼합물에 20 μL 글루타티온 비즈 (50 % 슬러리)를 추가하고, 다른 한 H 위해 믹스로 진행합니다. 이 단계는 한쌍이 많다는 바인딩로 언급됩니다.
- 이 기간 동안 HEK293 세포 lysates을 준비 그 위의 2 단계에서 설명한대로 overexpress 국기-CFTR (wt)).
- 용해 완충액으로 두 번 복잡한 씻으십시오. 각 세차를위한 1 분 동안 800 × g에서 던가 조심스럽게 각 세척 후에 뜨는을 기음. 아래쪽에 비즈를 빨아하지주의하시기 바랍니다.
- 구슬로 위에 준비된 HEK293 세포 lysates을 추가하고 부드럽게 3 시에 (또는 야간)에 대해 4 ° C에 섞는다.
- 비즈에게 단계 3.6)에 설명된대로 용해 완충액으로 광범위하게 세 번 씻는다.
- 30 μL 샘플 버퍼 (5 ×)를 사용하여 단백질을 Elute : 0.6 M 트리스-HCL (산도 6.8), 50 % 글리세롤, 2퍼센트 SDS, 그리고 0.1 % 푸른 bromophenol; 함유 5% β-메르 캅 토 에탄올.
- 5000에 10-15 분, 그리고 스핀에 대한 ° C의 물 목욕 × g 30 s에 대한이 구슬을 침전하는 37에 품어.
- 4-15% 젤로 모든 eluate을로드합니다.
- 30-40 분 정도 SDS-PAGE를 실행합니다.
- 1.5 시간 동안 PVDF 막에 단백질 밴드를 전송합니다.
- 5% 아닌 지방 우유가 포함된 TBS-십대 초반의 멤브레인를 차단하십시오.
- 4에 일차 항체 (예 : 안티 CFTR IgG, R1104 등) 멤브레인 ° C, 하룻밤을 품어.
- 5 분, 여섯 번 TBS-십대 초반으로 막 씻으십시오.
- 24 ° C.에 45 분 동안 이차 항체 (예 : 염소 항 마우스 HRP-복합 2 차 항체 등) 멤브레인을 품어
- 5 분, 여섯 번 TBS-십대 초반으로 막 씻으십시오.
- ECL 통해 단백질 밴드를 시각화.
- 대표 데이터는 그림 1에 표시됩니다.
체외에서 조립되었다 CFTR 함유 macromolecular 신호 단지의 예제는 그림 1에 표시됩니다. macromolecular 복합은 MRP4 C-단자 50 아미노산 (MRP4-CT50), PDZK1, 그리고 장편 CFTR (그림 1, 아래) 사이에 형성되었다. 복잡한 형성은 중간 단백질, PDZK1 (그림 1, 하단) 18의 양의 증가와 함께 복용 - dependently 증가했다.
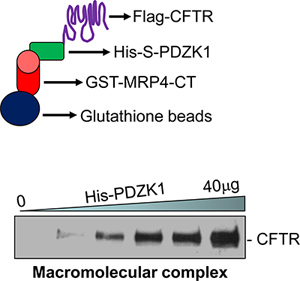
그림 1. macromolecular 복합 분석의 회화 표현 (위). macromolecular 복합는 복용량에 의존 방식으로 (아래) 18 세 단백질 (GST-MRP4-CT50, 그의-S-PDZK1, 그리고 깃발 CFTRwt)와 체외에서 검출되었다.
| CFTR-NHERF1-β 2 AR (ref. 14) | CFTR-NHERF2-LPA 2 (ref. 15) | CFTR-PDZ 단백질-MRP 2 (ref. 17) | CFTR-PDZK1-MRP4 (ref. 16) | |
| 동질 구슬 | 아밀로오스 수지 | S-단백질 아가로 오스 | 아밀로오스 수지 | 글루타티온 아가로 오스 |
| 단백질-1을 정화 | MBP-β 2 아칸소 주 중부 표준시 | 그의-S-CFTR 중부 표준시 | MBP-CFTR 중부 표준시 | GST-MRP4 중부 표준시 |
| 단백질-2 투석을 | GST-NHERF1 | GST-NHERF2 | GST-PDZ 단백질 | 그의-S-PDZK1 |
| (또는 세포 lysates) 단백질-3 투석을 | CFTR-wt 또는 CFTR-his10 (BHK 또는 HEK 세포 lysates) | 플래그-LPA 2 wt 또는 국기-LPA 2-ΔSTL (BHK 세포 lysates) | MRP2 (MDCK 세포 lysates) | 국기-CFTR-wt 또는 CFTR-his10 (또는 세포 lysates)을 정화 |
| 항독소 | 안티 CFTR IgG | 안티 - 플래그 HRP | 안티 MRP2 IgG | 안티 - 플래그 HRP |
체외에서 조립된 다양한 CFTR 함유 macromolecular 컴플렉스의 표 1. 요약.
Access restricted. Please log in or start a trial to view this content.
토론
이 프로토콜에서 우리는 이전에 보고된 16-19,29,30의 체외은 조립 및 정화 단백질 (혹은 단백질 조각) 및 / 또는 세포 lysates를 사용 macromolecular 신호 복잡한을 포함 CFTR의 검출을위한 방법을 보여주었다. 준비 과정에서 최상의 결과들에게 다음과 같은 중요한 사항을 달성하기 위해서는 특별한주의가 필요합니다 :
- 그것은 용출 버퍼의 산도가 단계 1)에서 설명한 GST-융합 단백질...
Access restricted. Please log in or start a trial to view this content.
공개
관심의 어떠한 충돌 선언 없습니다.
감사의 말
우리의 작품은 미국 심장 협회 (대동 동남 제휴) 초급 - 보조금의 0765185B, 엘사 미 Pardee 재단 연구 기금, 그리고 웨인 주립 대학교 교내 시동 펀드, 심장 혈관 연구소 이시스 전략 어워드에서 교부금에 의해 지원되었습니다. 체외 CFTR의 macromolecular 복합 어셈블리에서이 방법은 원래 박사는 AP 통신 Naren (테네시 보건 과학 센터의 대학)에 의해 개척되었다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 |
| pGEX4T-1 벡터 | GE 헬스케어 | 28-9545-49 | 이전 Amersham Biosciences |
| pMAL-C2 벡터 | 뉴잉글랜드 BioLabs | ||
| pET30 벡터 | EMD 화학 | 69077-3 | 이전 Novagen |
| 글루타티온 아가로 오스 비즈 | BD Biosciences | 554,780 | |
| 아밀로오스 수지 | 뉴잉글랜드 BioLabs | E8021S | |
| 탈론 비즈 | Clontech | 635,501 | |
| 감소 글루타티온 | BD Biosciences | 554,782 | |
| 이미다졸 | 어부 | BP305-50 | |
| 말토오스 | 어부 | BP684-500 | |
| S-단백질 아가로 오스 | EMD 화학 | 69704-3 | 이전 Novagen |
| 안티 - 플래그 HRP | 시그마 | A8592 | |
| 안티 CFTR IgG | 맞춤 양복 | R1104 | AA 722-734에서 CFTR 에피토프을 인식 mAb |
| 안티 MRP2 IgG | Chemicon 국제 | MAB4148 | Millipore의 지금 일부분 |
표 2. 특정 시약 및 장비.
참고문헌
- Anderson, M. P. Demonstration that CFTR is a chloride channel by alteration of its anion selectivity. Science. 253, 202-205 (1991).
- Bear, C. E. Purification and functional reconstitution of the cystic fibrosis transmembrane conductance regulator (CFTR. Cell. 68, 809-818 (1992).
- Quinton, P. M. Chloride impermeability in cystic fibrosis. Nature. 301, 421-422 (1983).
- Cheng, S. H. Defective intracellular transport and processing of CFTR is the molecular basis of most cystic fibrosis. Cell. 63, 827-834 (1990).
- Gabriel, S. E., Brigman, K. N., Koller, B. H., Boucher, R. C., Stutts, M. J. Cystic fibrosis heterozygote resistance to cholera toxin in the cystic fibrosis mouse model. Science. 266, 107-109 (1994).
- Li, C., Naren, A. P. CFTR chloride channel in the apical compartments: spatiotemporal coupling to its interacting partners. Integr. Biol (Camb). 2, 161-177 (2010).
- Chao, A. C. Activation of intestinal CFTR Cl- channel by heat-stable enterotoxin and guanylin via cAMP-dependent protein kinase. Embo. J. 13, 1065-1072 (1994).
- Gabriel, S. E., Clarke, L. L., Boucher, R. C., Stutts, M. J. CFTR and outward rectifying chloride channels are distinct proteins with a regulatory relationship. Nature. 363, 263-268 (1993).
- McNicholas, C. M. Sensitivity of a renal K+ channel (ROMK2) to the inhibitory sulfonylurea compound glibenclamide is enhanced by coexpression with the ATP-binding cassette transporter cystic fibrosis transmembrane regulator. Proc. Natl. Acad. Sci. USA. 93, 8083-8088 (1996).
- Schreiber, R., Nitschke, R., Greger, R., Kunzelmann, K. The cystic fibrosis transmembrane conductance regulator activates aquaporin 3 in airway epithelial cells. J. Biol. Chem. 274, 11811-11816 (1999).
- Shumaker, H., Amlal, H., Frizzell, R., Ulrich, C. D. 2nd, Soleimani, M. CFTR drives Na+-nHCO-3 cotransport in pancreatic duct cells: a basis for defective HCO-3 secretion in CF. Am. J. Physiol. 276, 16-25 (1999).
- Ahn, W. Regulatory interaction between the cystic fibrosis transmembrane conductance regulator and HCO3- salvage mechanisms in model systems and the mouse pancreatic duct. J. Biol. Chem. 276, 17236-17243 (2001).
- Sugita, M., Yue, Y., Foskett, J. K. CFTR Cl- channel and CFTR-associated ATP channel: distinct pores regulated by common gates. Embo. J. 17, 898-908 (1998).
- Naren, A. P. Regulation of CFTR chloride channels by syntaxin and Munc18 isoforms. Nature. 390, 302-305 (1997).
- Naren, A. P. Syntaxin 1A is expressed in airway epithelial cells, where it modulates CFTR Cl(-) currents. J. Clin. Invest. 105, 377-386 (2000).
- Naren, A. P. A macromolecular complex of beta 2 adrenergic receptor, CFTR, and ezrin/radixin/moesin-binding phosphoprotein 50 is regulated by PKA. Proc. Natl. Acad. Sci. USA. 100, 342-346 (1073).
- Li, C. Lysophosphatidic acid inhibits cholera toxin-induced secretory diarrhea through CFTR-dependent protein interactions. J. Exp. Med. 202, 975-986 (2005).
- Li, C. Spatiotemporal coupling of cAMP transporter to CFTR chloride channel function in the gut epithelia. Cell. 131, 940-951 (2007).
- Li, C., Schuetz, J. D., Naren, A. P. Tobacco carcinogen NNK transporter MRP2 regulates CFTR function in lung epithelia: implications for lung cancer. Cancer Lett. 292, 246-253 (2010).
- Hall, R. A. A C-terminal motif found in the beta2-adrenergic receptor, P2Y1 receptor and cystic fibrosis transmembrane conductance regulator determines binding to the Na+/H+ exchanger regulatory factor family of PDZ proteins. Proc. Natl. Acad. Sci. U.S.A. 95, 8496-8501 (1998).
- Short, D. B. An apical PDZ protein anchors the cystic fibrosis transmembrane conductance regulator to the cytoskeleton. J. Biol. Chem. 273, 19797-19801 (1998).
- Wang, S., Yue, H., Derin, R. B., Guggino, W. B., Li, M. Accessory protein facilitated CFTR-CFTR interaction, a molecular mechanism to potentiate the chloride channel activity. Cell. 103, 169-179 (2000).
- Sun, F. E3KARP mediates the association of ezrin and protein kinase A with the cystic fibrosis transmembrane conductance regulator in airway cells. J. Biol. Chem. 275, 29539-29546 (2000).
- Cheng, J. A Golgi-associated PDZ domain protein modulates cystic fibrosis transmembrane regulator plasma membrane expression. J. Biol. Chem. 277, 3520-3529 (1074).
- Scott, R. O., Thelin, W. R., Milgram, S. L. A novel PDZ protein regulates the activity of guanylyl cyclase C, the heat-stable enterotoxin receptor. The Journal of biological chemistry. 277, 22934-22941 (1074).
- Lee, J. H. Dynamic regulation of cystic fibrosis transmembrane conductance regulator by competitive interactions of molecular adaptors. The Journal of biological chemistry. 282, 10414-10422 (2007).
- Gee, H. Y., Noh, S. H., Tang, B. L., Kim, K. H., Lee, M. G. Rescue of DeltaF508-CFTR trafficking via a GRASP-dependent unconventional secretion pathway. Cell. 146, 746-760 (2011).
- Naren, A. P. Methods for the study of intermolecular and intramolecular interactions regulating CFTR function. Met. Molecul. Med. 70, 175-186 (2002).
- Li, C., Roy, K., Dandridge, K., Naren, A. P. Molecular assembly of cystic fibrosis transmembrane conductance regulator in plasma membrane. The Journal of biological chemistry. 279, 24673-24684 (2004).
- Li, C., Naren, A. P. Analysis of CFTR Interactome in the Macromolecular Complexes. Met. Molecul. Med. 741, 255-270 (2011).
- Wu, Y. A chemokine receptor CXCR2 macromolecular complex regulates neutrophil functions in inflammatory diseases. J. Biol. Chem. , (2011).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유