JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
태아 쥐의 내장 장기에서 자율 신경 Progenitors의 형광 - 활성 셀 정렬 (FACS) 절연을위한 최적화된 절차
Erratum Notice
요약
태아 마우스 조직에서 신경 능선 - 파생의 연결을 progenitors 정화 최적화된 절차를 설명합니다. 이 방법은 형광 활성화된 셀 정렬 (FACS)에 의해 이산 인구를 분리하기 위해 형광등 기자 대립 유전자로부터 표현의 활용합니다. 기술은 개발 전반에 걸쳐 또는 성인 조직에서 subpopulations의 연결을 분리하여 적용할 수 있습니다.
초록
개발에 신경 능선 (NC) 중 - 파생의 연결을 progenitors은 소장 및 하부 요로 같은 내장 기관의 자율 신경 구를 형성하는 신경 관에서 떨어져 마이 그 레이션. 레이저 캡처 마이크로 절개와 같은 방법을 사용하여 이산 인구의 분리가 어려운 있도록 개발 중에 성숙한 조직에서이 두 세포는 종종 광범위하게 조직 전체에 분산됩니다. 그들은 그러나 티로신 hydroxylase (TH)와 같은 신경 세포에 특정한 유전자의 규제 영역에서 구동 형광등 기자의 표현에 의해 직접적으로 시각이 될 수 있습니다. 우리는 가능한 TH 높은 수율 + 소장하고 분리와 형광 - 활성 셀 정렬 (FACS)를 기반으로 더 낮은 urogenital 요로 (LUT)을 포함하여 태아의 마우스를 내장 조직에서 progenitors의 연결을 위해 최적화된 방법을 설명합니다.
번째 유전자는 catecholamines의 생산을위한 속도 - 제한 효소를 인코딩합니다. 장용의 연결을 progenitors는 TH 두어을 표현하기 시작태아 소장 1과 TH들의 이주를 접근한 것은 또한 성인 골반 신경의 뉴런 2-4 집합에 속해 있습니다. 이 혈통 이러한 LUT의 다른 측면에서 뉴런, 그들의 고립 배포의 첫 번째 모습이 설명되지 않았습니다. TH 표현의 연결을 progenitors은 transgene 구조 TG (TH-EGFP) DJ76Gsat/Mmnc 1 나르는 생쥐에서 EGFP 표현하여 쉽게 시각이 될 수 있습니다. 우리는 0.5 dpc으로 플러그 검출의 아침을 지정, 15.5 일 게시물 성교 (dpc)에서 개발 LUT에서 TH의 배포판 + 세포를 문서화하는 태아 생쥐에서 transgene 표현 몇 군데, 그리고 관찰 그 coalescing에의 연결을 progenitors의 부분 집합 골반 신경 표현 EGFP.
LUT TH +의 연결을 progenitors를 분리하기 위해, 우리는 초기에 태아의 마우스 소장 2-6에서 신경 능선의 줄기 세포를 정화하는 데 사용된 방법을 최적화. 이정표로 삼았죠 NC-파생 인구를 분리하기 위해 이전의 노력유동세포계측법위한 세포 현탁액을 얻을 수 collagenase와 트립신의 칵테일과 소화. 우리 손에 이러한 방법은 상대적으로 낮은 생존과 LUT에서 세포 현탁액을 생산했다. 태아 LUT 조직에의 연결을 progenitors의 이미 낮은 발병률을 감안할 때, 우리는 최종 dissociates의 세포 생존을 증가된다는 등의 분리 방법을 최적화하기 위해 밖으로 설정합니다. 우리는이 스트림 분석을위한 충분한의 연결을 progenitors의 후속 수율과 함께 지속적으로 더 큰 생존 (총 세포의> 70 %) 달성 허용 낮은 압력에서 정렬을 그 잔잔한 Accumax의 분리 (혁신적인 휴대 기술, INC), 수동 필터링 및 흐름을 결정. 우리가 설명하는 방법은 크게 태아 또는 성인 murine 조직 중 하나의 연결에서 인구의 다양한 분리 적용할 수 있습니다.
프로토콜
1. 미디어의 작성 (모든 단계는 조직 문화 후드에서 수행)
- 다음을 결합 : 44 ML의 L-15 중간, 0.5 ML 100X 페니실린 / 스트렙토 마이신 (P / S), 0.5 ML 100 밀리그램 / ML 소 혈청 알부민 (BSA), 0.5 ML 1M HEPES, 5 ML 조직 문화 학년 워터. 추가하기 전에 철저히 BSA 및 P / S를 섞어주십시오. 이 볼륨은 최대의 분리를위한 다섯 가지 조직 유형에 적합해야합니다. 이 미디어는 조직의 효소 분해 후 사용하기 위해 담금질 솔루션을 준비하는 단계 3.4에 사용됩니다.
- 0.22 μm의 Polyethersulfone (PES) 필터하지만 필터 미디어.
- 1X 행크의 균형 소금 솔루션 (HBSS)와 1X 인산을 준비는 조직 배양 등급 물을 사용하여 10X 주식에서 (PBS) 식염수를 버퍼. 0.22 μm의 PES 필터를 통해 필터링합니다. 이 시약의 대형 볼륨이 미리 준비한 4 ° C에서 저장, 필요에 따라 조직 문화 후드에있는 작은 볼륨을 aliquoting 수 있습니다.
- 1X HBSS, (여러 15 ML 원뿔 튜브를 기입당신이 하위 해부 계획 조직의 숫자) 얼음 튜브를 유지 이만한 튜브의 개수입니다.
2. 해부
- 60 ~ 100mm 페트리 접시가 들어있는 얼음 차가운 1X PBS로 제도적 동물 관리 및 사용위원회 승인 프로토콜 및 전송 자궁에 따라 임신 쥐를 안락사 시간이 초과되었습니다.
- 자궁에서 태아를 제거하고 얼음처럼 차가운 1X PBS에서 잘린 의해 안락사. 형광 조명 아래에서 개별적으로 화면 긍정적인 형질과 야생 형 (WT) nontransgenic 풀을 나누어. 해부 전역에 얼음처럼 차가운 1X PBS에서 배아 보관하십시오.
- 해부 현미경, urogenital 요로를 하위는 - 해부. 미세 집게로 forelimb 수준에서 제자리에 배아를 잡아. 그리고 여전히 쌩쌩하게 아래와 거리 등 부분의 본문 벽에서 내부 장기를 당기는 다이어프램의 수준에 포셉을 삽입하여 성기 결절로 간을에서 내장을 제거합니다.
- 또한의 조직을 하위 해부거리 주변 조직 (그림 1)에서 관심. 얼음 차가운 1X HBSS를 포함한 15 ML 원뿔 튜브에 각각 개별적으로 서브를 해부 조직 유형을 놓으십시오. 풀 각 조직 유형에 함께 배아 표현형에 따라 (즉, 모든 GFP + 태아의 소장의 샘플은 하나의 15 ML 원뿔 튜브에서 풀링된됩니다.)
- 병렬에서 유동세포계측법로 보상 제어에 사용할 와일드 타입의 배아에서 비교할 조직 해부.
3. Subdissected 조직의 분리
- 펠렛은 5 분 210 상대 원심력 (rcf), 4 ° C에서 원심 분리하여 조직을 하위 해부. 원심 분리 후, 가능한 한 많은 HBSS로 해제 기음.
- 조직 유형의 교차 오염을 피하기 위해 각 시료 간의 피펫 팁을 변경해야되는 Accumax (혁신적인 휴대 기술, INC)에 조직 펠렛을 Resuspend. Accumax 부가의 양은 조직의 크거나 작은 금액에 대해 확장할 수 있습니다. 일반적으로 1-5 태아의 소장 샘플, Accumax 1 ML을 사용할 것이지만, 더 큰 조직 수영장은 큰 볼륨이 분리를 달성하기 위해 필요합니다.
- 37 ° 고립된 조직 (예 : 13.5 dpc의 소장 20 분, 15.5 dpc의 소장 35 분)의 단계에 따라 20-45 분 C 물 목욕.로 장소 튜브 중간 분해 시간 불구하고, 수동으로 물 목욕 (또는 고체 표면)의 측면으로부터 튜브를 노크하여 그리고 (하나 구식 수은 온도계를 흔들 것처럼) 튜브 "를 flicking"로 조직을 해산. 분해 시간의 끝에 추가 샘플을 해리하는 프로 시저를 여러 번 다운 쉐이크를 반복하십시오. 더 깨지기 쉬운 샘플을 보려면 아래 쉐이크의 vigorousness을 줄이고 대신 해리의 적정 수준을 달성하기 위해 단계 3.5 중에 피펫 가루약을 사용합니다. 14.5 dpc와 15.5 dpc LUT에 대한 일반적인 분해 시간은 각각 35 ~ 45 분입니다.
- 조직은 Accumax에 잠복기되는 동안 담금질 정도 메이크업lutions가 되나은 끄지 및 1시 5분을 끄다. 끄지는 6 ML L-15 미디어로 45 μl 5 밀리그램 / ML DNase I을 추가하여 이루어집니다. 잃게하다 1시 5분 30 ML L-15 미디어로 45 μl 5 밀리그램 / ML DNase I을 추가하여 이루어집니다.
- 해리의 끝에, 얼음에 15 ML 튜브를 이동하고 즉시 각 관 1 ML의 끄지를 추가합니다. 조직도 (그림 2) 거의 완전히 dissociated 때까지 각각의 샘플을 씹다 아래. 여전히 솔루션에서 조직 존재의 작은 덩어리가 될 것입니다. 완전히 동질적인 샘플을 달성하는 것은 쉽게 달성 않으며 가난 세포 생존을 초래할 수 있으므로 바람직도 없습니다.
- 프로토콜의 나머지를 위해 가능 한한 얼음에 샘플을 유지. 끄다 또는 샘플 교차 오염을 피하기 위해 1시 5분를 끄지 최대 pipetting하면 신선한 피펫 팁을 사용해야합니다.
4. 세포 현탁액을 필터링
- 70 % 에탄올에 배어있다 집게를 사용하여 위에 38 μm의 나일론 메쉬 막 평방 3cm (Sefar 미국)를 배치새로운 15 ML 원뿔 튜브의 입. 좁은 구멍 팁을 사용하는 멤브레인 중심으로 pipetting하여 메쉬를 통해 필터 세포. 멤브레인는 필터링하면서 포화되면, 그것을 제거 kimwipe와 튜브의 입을 건조하게하고, 세포 현탁액의 나머지를 필터링 나일론 메쉬의 새로운 조각을 사용합니다. 모든 세포가 필터링되고 나면 튜브를 씻어 남아있는 세포를 필터링 1시 5분를 끄지 한 ML을 사용합니다.
- 필터링하면이 완료, 또는 막힌 멤브레인 교체하면 메쉬의 측면을 올리고 세포의 교수형 방울을 제거하는 튜브의 꼭대기에 걸쳐 멤브레인을 지워 버리고 집게를 사용합니다.
- 210rcf에서 원심 분리하여 펠렛 셀 서스펜션, 5 분 4 ° C에서. 한 ML 잃게하다 1시 5분에 뜨는 및 resuspend 펠렛을 기음.
- 5 ML의 폴리스티렌 튜브에 나일론 메쉬를 통해 필터 세포 현탁액. 한 ML로 15 ML 관을 씻어가 1시 5분 및 필터는 모든 남아있는 세포를 캡처하는 끄다.
5. FACS에 대한 샘플 준비
- 분류와 보상 컨트롤에 대해 동일한 조직을 사용하는 경우, 1 / 10 일 보상 컨트롤에 사용할 새 5 ML의 폴리스티렌 관에 샘플 볼륨의 1 / 20 일까지 양도. 이 부분에 야생 형 조직 샘플을 나누십시오. 후반 7-Aminoactinomycin D를 (7-AAD, "생존 능력이 얼룩 '로 사용되는 살아있는 세포에서 제외 형광등 intercalator) 것이다 동안 한 부분 (7-AAD에만 추가 (만 WT) 야생 형 흠없는됩니다 ). 이러한 각각의 컨트롤 플로우 분류기에서 이산 fluorophores의 방출 사이에 스펙트럼 중복 보상이 가능하도록하기 위해서 필요합니다. 예를 들어, EGFP와 같은 단일 형광 리포터 위해 필요한 컨트롤이 포함됩니다 : 단 흠없는 WT 세포에만 7 AAD (그림 3) 물들일 튜브를 EGFP.
- 5 분 동안 210rcf에서 끄지 1시 5분와 원심 분리기, 4 ° C와 세포 현탁액을 포함하는 모든 5 ML 튜브를 입력합니다. 액체의 약 200 μl를 남기고 뜨는을 기음튜브 인치
- 잃게하다 1시 5분에 7-AAD 1:1000을 희석. 7-AAD에만 보상 제어 및 정렬되는 샘플에 7-AAD 염색법 희석을 추가합니다. 유일한 EGFP 또는 WT에만 보상 컨트롤에 7-AAD 추가하지 마십시오. 의 볼륨 얻은 세포 펠렛의 시작 재료와 크기의 양에 따라 달라집니다 추가할 수 7-AAD. 7-AAD는 적절한 튜브에 추가되었습니다 일단 샘플 정렬 준비가 된 것입니다.
조직 샘플 풀 사이즈 볼륨 관 *에 추가되어야하는 7-AAD 15.5 dpc의 소장 1-5 200 μl 15.5 dpc LUT 1-5 150 μl
미디어의 열망이기 때문에 표 1. 서로 다른 조직 dissociates 각 튜브 * 최종 합계 금액에 추가 7-AAD의 금액 50-100 μl 이르기까지 금액에 따라 다를 것입니다대략적인 프로세스를 N과 펠렛을 피하기 위해 수행했습니다. 최종 볼륨 솔루션 세포 취급을 최소화하는만큼 측정하지 않습니다. - 1.5 ML의 microcentrifuge 튜브에 0.75 ML TRIzol-LS를 추가하여 RNA 분리를위한 세포를 캡처하는 컬렉션 튜브를 준비합니다.
- 이전에 설명한대로 체외 문화에 대한 세포보다는 RNA 분리를 수집, 직접적으로 여섯 잘 조직 배양 플레이트의 자기 갱신 미디어로 정렬 세포는 fibronectin과 코팅 및 미디어로 가득합니다. 2,6,7
6. 유동세포계측법
- 흐름 cytometer에서 다시 오염을 피하기 위해 각 샘플 사이에 플러시해야되고 먼저 보상을 제어 평가합니다. 정렬을위한 전압 / 성문을 설정할 보상 샘플 프로파일을 사용합니다. 원하는 조직에 긍정적인 세포가 제한 수치에 존재하는 경우, 별개의 조직이 형광 강도 및 셀 크기만큼 보상 설정을 확립하는 데 사용할 수 있습니다사이의 샘플 비교입니다.
- 7-AAD의 염료를지고 흠없는 컨트롤 (그림 4)에 GFP 형광의 상대적인 높은 강도를 전시 세포를 수집하는 죽은 세포를 피하기 위해 보상 매개 변수와 게이트를 설정합니다.
- 각 microcentrifuge 튜브로 maximally 25,000 세포를 정렬하십시오. 정렬은 넓은 구멍 노즐과의 연결 전구 생존을 보존하기 위해 낮은 유속 (예 : 17psi, 100 μm의 노즐, 3000 행사 / 초)와 최저 압력에서 수행해야합니다. 종류는 EGFP + 세포를 분리하기 위해서 우리는 EGFP 기자들을 흥분시키기 위해 20mW 488nm 레이저를 사용하여 BD Biosciences FACSAriaII에 우리 isolations을 수행합니다.
- 샘플이 높은 세포 농도를 포함하는 경우 추가로 7-AAD가 정렬되면 높은 캡쳐 효율성을 달성하기 위해 얼룩 1:1000를 사용하여 세포 현탁액을 희석하는 것이 좋습니다.
- 즉시 정렬 후 TRIzol-LS에 캡처된 세포의 소용돌이 각 튜브.
7. 대표 결과
흐름 정렬을위한 세포 현탁액을 생산하는 조직 분리는 충분한 효소 소화과 낮은 세포 viabilities이 발생할 수 있습니다 피하고 지나친 소화 사이의 미묘한 균형이다. 조직 분리의 원하는 수준의 예제는 그림 2에 표시됩니다. 적절하게 소화 조직에서는 하위를 해부 기관의 수동 분쇄 조각이 아직 명확하게 증거들이 전에 (그림 2B, 2 층). 효소 처리 시간이나 효소의 너무 높은 농도에서 너무 오랜 기간 동안 치료하고 조직에서 발생하는 정지는 조직의 잔여 대형 조각 (그림 2D, 2 시간)가 부족합니다.
필터링 적절한 분리 및 수동은 일반적으로 큰 90 % 이상 가능한 세포를 전시하고 EGFP 발현 높은 수준의 (그림 4)를 보여 유동세포계측법에서 정렬 프로파일을 생산하고 있습니다. 이 방법으로 얻은 세포 집단은 좋은 예시생존하며 EGFP의 캡쳐 +의 연결을 progenitors 위해 게이팅에 의해 유전자 발현의 후속 문화 또는 분석을 위해 캡처 할 수 있습니다.
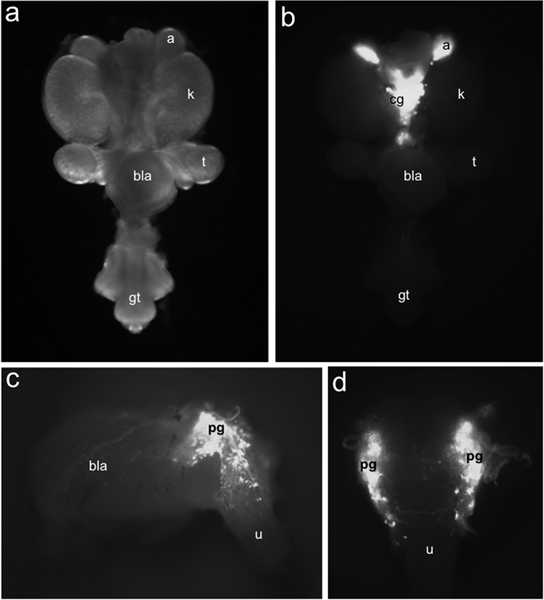
그림 1. 태아 마우스 LUT의 TH-EGFP +의 연결을 progenitors 분포. 15.5 dpc에서 온 마운트 urogenital 요로은 형광 조명 (B)에서 식별된 TH-EGFP의 transgene 발현에 의해 분류 EGFP + 세포의 분포에 비해 () 명시야 조명 아래 ventrally 조회. TH-EGFP 식은 adrenals ()와 medially 위치한 복강의 신경 구 (CG)에 속해 있습니다. 골반 신경 (PG), 방광 벽 (즐) 및 요도 (U)의 transgene 표현에서 형광 15.5 dpc TH-EGFP 하위 해부하는 방광 전시의 측면 (C) 볼 수 있습니다. 지느러미보기에서 (D) EGFP + 세포는 앞쪽에 지느러미 요도에 분명 있습니다. 다른 레이블 : 신장 (K), testis (T), 방광 (즐 ~)와 성기 결절 (GT).

그림 2. 15 dpc 태아의 LUT () 및 대장 (전자)의 Brightfield 이미지는 각각 분리 보육의 끝에, 분리의 잠복기를 통해 중간 몇 군데 전에 수동으로 중단 이후 중단 (B, F), (C, G), 그리고 샘플에 그 (D, H) 지나치게 dissociated되었습니다.
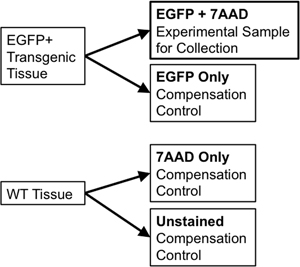
그림 3. 도식 다이어그램은 엄격한 FACS의 게이팅 매개 변수를 설정하는 데 필요한 보상 컨트롤을 보여줍니다.
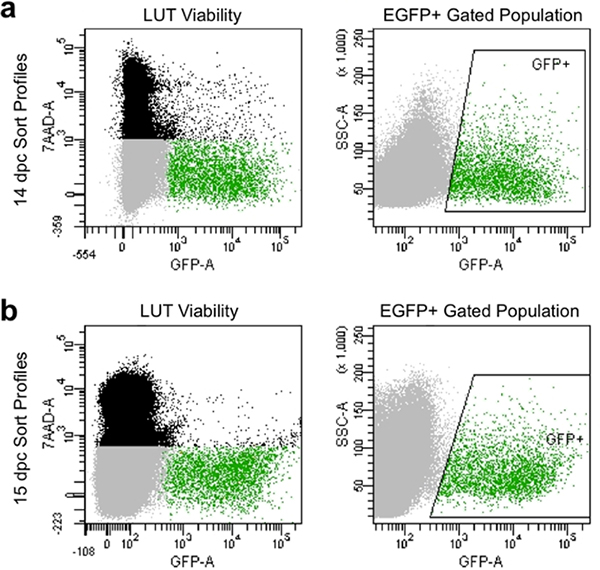
그림 4. 유동 정렬 프로파일 대표 이미지 14.5 dpc ()와 15.5 dpc (B)에서. 흑인 인구는 죽은 순방향 및 측면 산란을 바탕으로 하나의 세포로 구성되어와에 의해 표시됩니다7-AAD의 형광. 그레이 인구는 7-AAD을 제외하기 때문에 실용적입니다했습니다 순방향 및 측면 산란을 바탕으로 일중 세포 구성되어 있습니다. 그린 게이트 인구는 박스 "GFP +"구역으로 표시되며, 7-AAD합니다 (가능한) 제외하고 EGFP의 형광을 전시했습니다 단일 세포로 구성되어있다.
토론
형광 기자를 표출 마우스 기자 라인 murine 유전학 사회 1,8,9의 여러 노력으로 널리 사용되고있다. 따라서 여기에 그림과 분리 방법은 널리 태아 또는 성인 조직 중의 신경 전달 물질이나 수용체 발현 패턴을 바탕으로 이산의 연결을 subtypes의 고립을 위해 적용할 수 있습니다. 우리가 형광등 transgene 기자의 표현을 바탕으로이 방법을 최적화하고 있지만, 그것은 또한 라이브 셀 immuno-라벨링 ?...
공개
관심의 어떠한 충돌 선언 없습니다.
감사의 말
저자는 그림과 예술적인 도움 밴더빌트 대학 메디컬 센터와 멜리사 A. Musser에서 유동세포계측법 공유 자원의 지원을 세포 분리 방법과 케빈 Weller, 데이빗 레어 티 및 브르타뉴 맷락요에 대한 제안 캐서린 Alford 감사드립니다. 우리는 Drs 감사드립니다. 의 연결을 progenitors의 절연을 구현에 대한 조언 잭 Mosher와 숀 모리슨. VMC 유동세포계측법 공유 리소스는 밴더빌트 Ingram 암 센터 (P30 CA68485)와 밴더빌트 소화기 질환 연구 센터 (P30 DK058404)에 의해 지원됩니다. 이 작품은 건강 보조금 DK064251, DK086594 및 DK070219의 미국 국립 연구소의 자금 지원에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 시약 이름 | 공급 업체 | 카탈로그 번호 | 댓글 |
| Accumax | 시그마 (mfr : 혁신적인 휴대 기술) | A7089-100ML | 한 ML의 aliquots에 냉동 보관 |
| DNase I | 시그마 | D-4527 | 저장된 -20에서 냉동 ° 1xHBSS의 C 5 밀리그램 / ML, (끄다에서 사용 1시 5분를 끄지) |
| 10X PBS의 산도 7.4 | Gibco | 70011-044 | 그리고 살균 필터는 조직 문화 등급 물로 1X까지 확인 |
| 10X HBSS W / O 칼슘이나 MG | Gibco | 14185-052 | 그리고 살균 필터는 조직 문화 등급 물로 1X까지 확인 |
| Leibovitz의 L-15 배지 | Gibco | 21083027 | |
| 100X 페니실린은 / 스트렙토 마이신 | Gibco | 15140-133 | 저장소가 -20 ° C에서 aliquoted |
| BSA | 시그마 | A3912-100G | -20 ° C, 물 100 밀리그램 / ML에 aliquoted 저장 |
| Biowhittaker 1M은 0.85 % NaCl에 HEPES | Lonza | 17-737E | |
| 38 μm의 NITEX 나일론 메쉬 막 | Sefar 미국 | 3-38/22 | ~ 3cm의 사각형으로 잘라. 자외선은 조직 문화 후드에서 멸균을 위해 하룻밤 사이에 치료. |
| 7-AAD | Invitrogen | A1310 | 1 MG / ML |
| TRIzol LS | Invitrogen | 10296-028 | |
| 5 ML의 폴리스티렌 튜브 | 매 | 352,058 | |
| 15 ML 원뿔 튜브 | 코닝 | 430,790 | |
| 파인 분석 해 봅시다 집게 | 파인 과학 계측기 | 11251-30 | 뒤몽 # 5 Forcep, Dumoxel, 표준 팁 0.1x0.06mm |
| 숟가락을 해부 | 파인 과학 계측기 | 10370-18 |
참고문헌
- Gong, S. A gene expression atlas of the central nervous system based on bacterial artificial chromosomes. Nature. 425, 917-925 (2003).
- Morrison, S. J., White, P. M., Zock, C., Anderson, D. J. Prospective identification, isolation by flow cytometry, and in vivo self-renewal of multipotent mammalian neural crest stem cells. Cell. 96, 737-749 (1999).
- Kruger, G. M. Neural crest stem cells persist in the adult gut but undergo changes in self-renewal, neuronal subtype potential, and factor responsiveness. Neuron. 35, 657-669 (2002).
- Bixby, S., Kruger, G. M., Mosher, J. T., Joseph, N. M., Morrison, S. J. Cell-intrinsic differences between stem cells from different regions of the peripheral nervous system regulate the generation of neural diversity. Neuron. 35, 643-656 (2002).
- Walters, L. C., Cantrell, V. A., Weller, K. P., Mosher, J. T., Southard-Smith, E. M. Genetic background impacts developmental potential of enteric neural crest-derived progenitors in the Sox10Dom model of Hirschsprung disease. Human Molecular Genetics. , (2010).
- Corpening, J. C. Isolation and live imaging of enteric progenitors based on Sox10-Histone2BVenus transgene expression. Genesis. 49, 599-618 (2011).
- Morrison, S. J. . Isolation of fetal rat neural crest stem cells (NCSC) from gut and sciatic nerve. , (2012).
- Skarnes, W. C. A conditional knockout resource for the genome-wide study of mouse gene function. Nature. 474, 337-342 (2011).
- Harding, S. D. The GUDMAP database--an online resource for genitourinary research. Development. 138, 2845-2853 (2011).
- Joseph, N. M. Enteric glia are multipotent in culture but primarily form glia in the adult rodent gut. J. Clin. Invest. 121, 3398-3411 (2011).
- Newgreen, D. F., Murphy, M. Neural crest cell outgrowth cultures and the analysis of cell migration. Methods Mol. Biol. 137, 201-211 (2000).
Erratum
Formal Correction: Erratum: An Optimized Procedure for Fluorescence-activated Cell Sorting (FACS) Isolation of Autonomic Neural Progenitors from Visceral Organs of Fetal Mice
Posted by JoVE Editors on 10/01/2012. Citeable Link.
The authors middle initials were omitted from the publication of An Optimized Procedure for Fluorescence-activated Cell Sorting (FACS) Isolation of Autonomic Neural Progenitors from Visceral Organs of Fetal Mice.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유