Method Article
인플루엔자 중합 효소의 유전자에 대한 구조 결정 PB2 소단위를위한 멀티 타겟 병렬 처리 방식
* 이 저자들은 동등하게 기여했습니다
요약
구조 기반 약물 설계 약물 개발에 중요한 역할을한다. 병렬로 여러 대상을 추구하는 것은 크게 선 발견의 성공의 기회를 증가합니다. 다음 문서는 감염성 질환 시애틀 구조 유전체학 센터 PB2 인플루엔자 단위체의 유전자에 대한 구조 결정을위한 멀티 타겟 접근 방식을 활용하는 방법 강조한다.
초록
높은 악성 인플루엔자 변종 유행성 독감 발생은 전 세계적으로 인간의 인구의 대폭적인 병적 상태와 사망률의 원인이 될 수 있습니다. 혼자 미국에서 41,400 사망자와 1,860,000 입원의 평균은 매년 1 인플루엔자 바이러스 감염에 의해 발생합니다. 효소의 기본적인 단백질이 소단위 (PB2)의 점 돌연변이는 인간 2 바이러스 감염의 적응에 연결되어있다. 이러한 연구의 결과는 따라서 항 바이러스 약물 표적으로서의 가능성을 강조, 독성 요인으로 PB2의 생물학적 중요성을 공개했다.
알레르기 및 전염병 국립 연구소 (NIAID)가 내다 구조 유전체학 프로그램은 에메랄드 바이오와 함께 감염증 (SSGCID)의 시애틀 구조 유전체학 센터를 구성하는 세 가지 다른 태평양 북서부 기관에 자금을 제공한다. SSGCID는 thre에 함께 과학계를 제공하기 위해 최선을 다하고 있습니다NIAID 종류 AC 병원균의 전자 차원 단백질 구조. 과학계에서 사용할 수 같은 구조 정보를 만드는 것은 구조 기반 약물 설계를 가속화하는 역할을한다.
구조 기반 약물 설계 약물 개발에 중요한 역할을한다. 병렬로 여러 대상을 추구하는 것은 크게 통로 또는 전체 단백질 가족을 대상으로 새로운 리드 발견을위한 성공의 기회를 증가합니다. 에메랄드 바이오 컨소시엄을 지원하는 유전자에 대한 구조 결정을위한 높은 처리량, 멀티 타겟 병렬 처리 파이프 라인 (MTPP)를 개발했다. 여기에서 우리는 네 가지 독감 변종에서 PB2 단위체의 구조를 결정하는 데 사용되는 프로토콜을 설명합니다.
프로토콜
프로토콜의 개요는 그림 1에 제시되어있다.
분자 생물학
1. 디자인 구성
단백질 구조와 코돈 설계 합성 유전자 염기 서열을 설계하는 유전자 Composer 소프트웨어를 사용합니다. 유전자 Composer 소프트웨어의 사용은 다른 3 세부에서 제공되었습니다.
- 정렬 뷰어 모듈을 사용하여 단백질 서열 정렬을 비교하고 단백질 구조를 정의하는 설계 모듈을 구축합니다. 가능한 경우, (그림 2) 단백질 데이터 은행 (PDB)의 상동에서 기본 및 3D 구조 요소를 모두 대상 아미노산 서열을 맞 춥니 다.
- 기본 구조의 보전과 상동의 3 차원 구조를 기반으로 새 테르를 선택하여 구조 유도 구조 디자인을 만들기 위해 맞춤 정보를 사용합니다.
- 디자인을 삽입 PCR (IPCR) 및 벡터 PCR (vPCR) amplimers (터미널 프라이머).
- 유전자 C를 사용하여omposer의 단백질 - 투 - DNA 알고리즘은, 코돈 설계 핵산 서열로 구조 아미노산 서열을 백 변환합니다.
- E.의 발현 순서를 최적화하기 위해 적절한 코돈 사용 테이블 (CUT)를 사용하여 대장균.
- 거의 쉽게 정화 할 수있는 N-말단 배 히스티딘 태그와 Smt3/SUMO 융합 단백질을 포함하도록 수정 pET28 벡터에 삽입을 복제.
- DNA 2.0 및 통합 DNA 기술에서 주문 프라이머 합성 유전자 순서를 배치합니다.
2. 효소의 불완전한 프라이머 확장 (PIPE) 복제
- 프라이머와 유전자를 준비
- 1 분간 1,000 rpm으로 프라이머를 포함하는 공급 업체가 번호판을 원심 분리기.
- 프라이머 농도 100 μM로 가져와 50 μL TE 버퍼를 추가합니다.
- 96 - 웰 V-바닥 판의 탈 (DI) 물과 10 μM에 프라이머를 희석.
- 1 분 동안 1,300 rpm에서 1.5 ML 튜브의 공급 업체가 유전자를 원심 분리기.
- TE 버퍼를 사용하여, 50 NG / μL 각 튜브의 DNA의 농도를 가져옵니다.
- 1.5 ML 튜브 각 프라이머의 희석 10 NG / μL로한다.
- 사용하지 않을 때는 -20 ° C에서 보관 프라이머 및 유전자.
- 삽입 PCR (IPCR)를 준비
- 얼음에 Pfu와 마스터 믹스의 병을 해동, 상온에서 유전자와 프라이머를 유지합니다.
- 프라이머 세트로 접시지도 할당 우물을 만들고 구성.
- 96 - 웰 PCR 플레이트의 각 웰에 DI 물 13 μl를 추가합니다.
- 각 우물 사이의 팁을 변경할 수 있도록, 플레이트 맵에 따라 96 - 웰 플레이트의 각 반응에 앞으로의 5 μL 및 역방향 프라이머의 5 μl를 추가합니다.
- 잘 플레이트 맵에 따라 그 해당 각 전체 길이 유전자의 2 μl를 추가합니다.
- 각 우물 사이의 팁을 변경할 수 있도록 각 well에 Pfu와 마스터 믹스 25 μl를 추가합니다.
- 다음 PCR 조건을 사용하여 반응주기 :
- 95 ° C 2 분
- 95 ° C 30 초
- 50 ° C 45 초
- 68 ° C 3 분
- 4 ° C ∞
- 25 사이클 단계 BD를 반복합니다.
- 새로운 96 - 웰 PCR 플레이트에 각 IPCR 반응의 10 μl를 전송합니다.
- 각 샘플에 배의 부하 염료의 3 μl를 추가합니다.
- 단편 증폭을 확인하기 위해 100 ~ 500 bps의 DNA 사다리 옆에 110 V에서 1 % TAE EtBr 아가 로스 젤에 각각의 샘플을 분리합니다.
- -20 ° C에서 보관 IPCR 제품을 사용하지 않을 때 (동결 해동 가능한 한 피하십시오).
3. 벡터 PCR (vPCR을)를 준비
- 변형 E.의 야간 문화를 시작 플라스미드 pET28 벡터를 대장균.
- 50 ㎍ / ㎖의 카나마이신 2-YT 국물의 두 10 ML 튜브에 접종한다.
- 220 rpm에서 37 하룻밤 문화 ° 셰이커 C를 성장.
- 15 분 동안 3,000 rpm에서 원심 분리하여 하룻밤 성장 후 문화를 스핀 다운.
- Qiagen의 QIA를 사용준비 스핀 Miniprep 키트 제조업체의 지침에 따라 세균 펠릿 pET28 벡터를 추출한다.
- 의 설치 제한 효소 digestions는 pET28 플라스미드 추출.
- pET28 벡터의 20 μL에 10X BamHI 버퍼 2.2 μL와 BamHI과 HindIII 1 μl를 추가합니다.
- 37 1 시간 동안 반응을 품어 ° C.
- 젤에 별도의 소화 제품입니다.
- 2.2.10 단계를 참조하십시오.
- 젤에서 벡터 밴드를 잘라 제조 업체의 지침에 따라 QIAquick 젤 추출 키트를 사용하여이를 정화.
- Nanodrop 분광을 사용하여 DNA 농도를 정량화.
- 10 NG / μL로 벡터를 잘라 희석. -20 ° C 사용하지 않을 때에 저장할 수 있습니다.
- vPCR 프라이머를 준비합니다.
- 1,300 rpm에서 1 분간 IDT 제공 oligonucliotides을 원심 분리기.
- DI 워터와 100 μM로 농도를 가져옵니다.
- 1.5 ML 튜브에 모두 순방향 및 역방향 프라이머 10 μM 희석을 준비합니다.
- -20 ° C.에 저장 프라이머 프라이머 희석
- 실온에서 얼음 해동 템플릿과 프라이머에 Pfu와 마스터 믹스를 녹여.
- 96 - 웰 PCR 플레이트 설치 vPCR 반응 :
- 96 - 웰 플레이트의 첫 번째 행에서 순방향 및 역방향 vPCR 프라이머 모두 60 μL 소화 pET28 템플릿 (μL / 10 NG)의 24 μL을 결합한다.
- 12 팁 멀티 채널 피펫 사용하여 각 판의 잘 남아있는 12의 프라이머 μL 및 템플릿 마스터 믹스를 전송할 수 있습니다. 이 입문서 및 플레이트의 각 우물에서 템플릿 마스터 믹스 12 μL가 발생합니다.
- 각 well에 증류수 13 μl를 추가합니다.
- 각 well에 Pfu와 마스터 믹스 25 μl를 추가합니다.
- 단계 2.2.7에서 사용되는 PCR 조건을 통해 순환 반응.
- 수영장 15 ML 팔콘 튜브에 vPCR 반응의.
- (소화 pET28 벡터의 예상 길이 젤에 풀링 된 PCR 제품의 10 μl를 분리하여 단편 증폭을 확인대략 6 KB)입니다.
- 2.2.10 단계를 참조하십시오.
- 접시를 병합 준비합니다.
- 96 - 웰 V-바닥 판의 각 우물에 vPCR 제품의 나누어지는 3 μL.
- -20 스토어 번호판 ° IPCR 제품과 병합 될 때까지 C.
4. IPCR 및 vPCR 제품을 병합
- 해동 IPCR 제품 및 사전 분주 vPCR는 96도 상온에서 판을 병합합니다.
- 병합 판의 각각의 well에 각 IPCR 제품의 3 μl를 추가합니다.
- 최고 열 화학적 유능한 세포로 판을 병합 변환 할 수 있습니다.
- 공급 업체에서 화학적으로 유능한 세포의 단일 50 μL 튜브에 각 병합 반응 2 μL를 추가하고 제조 업체의 공급 프로토콜로 진행합니다.
- 변환 플레이트의 각 구조에 대한 야간 문화를 준비합니다.
- 깊은 우물 블록의 각 웰에 25 ML 멸균 용기에서 나누어지는 5 ML의 TB 국물 (50 ㎍ / ㎖ 카나마이신과 함께).
- steri를 사용하여르 기술은 각각의 변환 판에서 고립 된 식민지를 선택하고 깊은 우물 블록의 적절한 잘 접종.
- Airpore 덮개 블록을 포함한다.
- 37 ° C 하룻밤에 220 rpm에서 블록을 흔들어.
- 4,000 rpm에서 30 분 동안 블록을 원심 분리하여 펠렛 세포.
- 상층 액을 붓고 종이 타월로 건조 블록의 상단을 두드려.
- 미니 준비는 제조업체의 지시 사항에 따라 Qiagen의 96 - 웰 진공 장치를 사용하여.
5. 성공적으로 복제 된 구문의 글리세롤 주식을 준비
- 성공적으로는 제조업체의 지시 사항에 따라 BL21 (DE3) 화학적 유능한 세포로 순서 검증 DNA를 복제 변환 할 수 있습니다.
- 각 구조에 대해, 2 YT 국물 1 ㎖ (50 ㎍ / ㎖ 카나마이신 포함)로 BL21 (DE3) 변환 및 접종에서 하나의 고립 된 식민지을 선택합니다.
- 37 ~ 4 시간 동안 220 rpm에서 문화를 흔들 ° C.
- 1.5 mL를 레이블독특한 구조 식별 번호, 세포 변형 및 날짜와 캡 튜브를 고정합니다. 50 % 글리세롤의 500 μL와 세포 배양 500 μl를 추가하고 여러 번 반전. 즉시 드라이 아이스 또는 -80 ° C 냉동고에서 글리세롤 주식을 저장합니다.
6. 식 테스트
| 용해 Buffe은 R | 버퍼를 씻어 | 용출 버퍼 |
| 50 밀리미터의 NaH 2 PO 4, 산도 8.0 300 mM의 NaCl을 10 MM 이미 다졸 1 % 트윈 20 2 mM의 MgCl 2 0.1 ML / μL Benzonase 1 MG / ML 라이 소 자임 | 50 밀리미터의 NaH 2 PO 4, 산도 8.0 300 mM의 NaCl을 20 mM의 이미 다졸 0.05 % 트윈 20 | 25 MM 트리스, 산도 8.0 300 mM의 NaCl을 250 mM의 이미 다졸 0.05 % 트윈 20 |
* 추가 Benzonase, 라이소자임,즉시 용해 이전과 단백질 분해 효소 억제제.
- 행진은 카나마이신 선택 한천 배지 위에 글리세롤 주식에서 샘플을 37에서 밤새 품어 ° C.
- 갓 재배 E.와 0.5 %의 포도당과 보충 접종 1.2 ML의 TB 국물 (50 MG / ML 카나마이신에); 96 - 웰 둥근 바닥 블록에 비 유도 전 문화를 시작합니다 대장균 분리. 야간 37 ℃에서 220 rpm으로 흔들어 성장
- 하룻밤 성장 후, Novagen 사 하룻밤 Express 시스템 1 (제조 업체의 프로토콜에 따라) 전 문화의 40 μL와 함께 보충 TB 국물의 1.2 ML (50 MG / ML 카나마이신과 함께)을 접종하여 유도 배양을 시작합니다.
- 220 rpm으로 흔들어, 48 시간 동안 20 ° C에서 소규모 유도 문화를 성장.
- 15 분 동안 4,000 rpm에서 원심 분리하여 수확 세포는 처리하기 전에 적어도 1 시간 동안 -20 상층 및 저장 ° C를 붓는다.
- 96 - 웰 블록에서 300 μL 용해 버퍼에있는 세포 펠렛을 resuspend을.
- 적극적으로 실온에서 30 분간 흔들어 기계 용해 다음 30 분 동안 상온에서 용해 버퍼에있는 세포를 품어.
- 4 ℃에서 4,000 rpm에서 30 분간 원심 분리하여 원유 해물을 명확히
- 96 - 웰 플랫 아래쪽 트레이 (Qiagen의)에 명확히 해물 (분획) 200 μl를 전송하는 멀티 채널 피펫을 사용합니다. 잘 예제를 포함 각 40 μL 니켈 - NTA 자석 구슬 (Qiagen의)를 추가합니다.
- 조심스럽게 16 ℃에서 1 시간 동안 로커에 접시를 교반
- 자기 게시물 플레이트 (Qiagen의)에 접시를 놓고 언 바운드 분획을 제거합니다. 니켈 - NTA 비즈의를 피펫하지 않도록주의하십시오.
- 게시물 플레이트에서 플레이트를 제거하고 부드럽게 200 μL 세척 버퍼에 구슬을 재현 탁. 피펫 아래로 30 초 동안 다음 게시물 접시에 다시 접시를 놓습니다.
- 세척 버퍼를 제거하고 단계 6.12를 반복합니다.
- 게시물 플레이트에서 플레이트를 제거하고 니켈 - NTA는 따 바인딩 용출5 분 50 μL 용출 버퍼로 세척하여 rget 단백질.
- 자기 게시물 플레이트 편평한 바닥 판을 반환하고 신선한 96도 V-하단 플레이트에 용출를 전송합니다.
- 신선한 96도 V-하단 플레이트에 용출의 20 μl를 전송하고 1 μL ULP1 단백질 분해 효소로 반응합니다.
- 제조 업체의 프로토콜에 따라, LabChip 90를 사용하여 모세관 전기 영동에 의해 용출과 용출 + Ulp1 비율을 분석합니다.
- 또한, 식 테스트에서 모든 분수는 SDS-PAGE를 통해 분석 할 수 있습니다.
7. 대규모 발효
- 글리세롤 주식에서 부스러기를 얻기 위해 멸균 피펫 팁을 사용하여, 100 ML 결핵 국물 (50 MG / ML 카나마이신과)를 접종하고 하룻밤 성장. 220 rpm으로 37 ℃에서 흔들
- 하룻밤 성장 후, 10 mL로 2 L 당황 플라스크에 EMD의 autoinduction 솔루션 (제조 업체의 프로토콜 참조) (50 MG / ML 카나마이신와)과 TB 국물 1 L를 접종하여 전 배양을 확장사전 문화 (1:100 희석).
- 37 확장 된 1 L의 문화를 흔들어 ° C, 20에 떨고 인큐베이터의 온도를 변경할 ° C 0.6 (OD 600)의 광학 밀도에 도달 할 때.
- 하룻밤 성장 후, 식 시험의 각 구조에서 대표 10 ML의 나누어지는 가져 가라.
- 수확 셀은 15 분 동안 5,000 rpm으로 원심 분리하여 붙여 상층 액을 버린다.
- -80 붙여 동결 세포 ° C.
단백질 정제
버퍼 :
| 용해 버퍼 | (평형)을 버퍼 | 버퍼 B (용출) | 열 버퍼 크기 조정 |
| 25 MM 트리스, 산도 8.0 200 mM의 NaCl을 0.5 % 글리세롤 0.02 % 챕스 10 MM 이미 다졸 1 mM의 TCEP 50 밀리미터 아르기닌 5 μL Benzonase 100mG 리소 3 프로테아제 억제제 정제 (EDTA 무료) | 25 MM 트리스, 산도 8.0 200 mM의 NaCl을 10 MM 이미 다졸 1 mM의 TCEP 50 밀리미터 아르기닌 0.25 % 글리세롤 | 25 MM 트리스, 산도 8.0 200 mM의 NaCl을 200 mM의 이미 다졸 1 mM의 TCEP | 25 MM 트리스, 산도 8.0 200 mM의 NaCl을 1 % 글리세롤 1 mM의 TCEP |
* 즉시 용해하기 전에 각 150 ML의 샘플 Benzonase, 리소자임, 그리고 단백질 분해 효소 억제제 정제를 추가합니다.
8. 세포 용해
- 용해 버퍼 2 L을, 라이소자임, 단백질 분해 효소 억제제 정제 또는 benzonase (각 샘플이 용해 버퍼 150 ㎖에 별도로 용해됩니다) 추가하지 않습니다.
- 해동을 Resuspend 세포 1:5 질량에 용해 버퍼에 붙여 넣습니다 : 부피 비율을 적극적으로 4에서 30 분 동안 교반 ° C.에 의해 깨끗한 주걱을 사용하여 비커의 측면에서 느슨한 덩어리를 휴식. 이 기간 동안 니켈과 Dialy을 준비SIS 버퍼
- 얼음, Misonix의 sonicator (3 분 70 %의 전력, 2 초에 / 1 초 Off 펄스)를하고 과열을 방지하기 위해 부드럽게 소용돌이 컨테이너를 사용하여 세포를 용해. 향후 분석을 위해 원유 해물의 작은 (200 μL) 나누어지는을 저장합니다.
- 4 35 분 18,000 XG에서 원심 분리하여 원유 해물 ° C를 명확히 상층 액을 수집하고 향후 분석을 위해 소형 (200 μL) 나누어지는을 저장합니다. 매장 펠릿 4 ° C에서이 단백질 분획에 용해되어 확정 될 때까지.
9. 프리 런 단백질 메이커 설정
- 단백질 메이커 켜져 있고 소프트웨어가 열기, 기기를 초기화합니다.
- 일단 초기화되면, 샘플의 각 갠트리 별도의 줄에 하나의 5.0 ML GE 헬스 케어 HisTrap FF 니켈 - 킬레이트 열 (니켈 열)를 연결합니다.
- 각 컬럼을 통해 평형 버퍼의 3-4 열 볼륨 (CV)를 실행합니다.
- 평형 및 용출 버퍼 라인을 프라임.
- Equilibr한 번 열을 통해 버퍼를 흡입하여 열을 먹었다.
10. 니켈 1 (NI1) 열
- 저장 버퍼를 제거하는 20 ML 밀리 Q 물과 함께 각 열을 씻으십시오. 5 ML 버퍼 B와 평형 25 ML 버퍼를 실행합니다.
- 2 ㎖ / min의 속도로 열로 용해 단백질을 포함 명확히 해물을로드 한 후 버퍼 A.와 함께 15 ML 세척에 의해 수행
- 버퍼를 사용하여 단계 그라데이션에 바인딩 단백질을 용출 정중하게 다음과 같은 비율로 A와 B : 5 ML 95:5, 5 ML 60:40, 10 ㎖ 0:100. 개별적으로 각각의 용출 분획을 수집합니다.
- 분석 : SDS-PAGE에 의해 용출 분수, 원유 해물, 명확 해물, 그리고 흐름을 통해합니다. 풀 분수 단백질을 포함하고 대략 단백질 존재의 양을 결정하기 위해 280를 측정하는 Nanodrop 분광을 사용합니다.
11. ULP1 분열
- 이후 젤 분석을위한 NI1 열 풀의 작은 나누어지는 (250 μL)를 유지한다. 나머지를 가지고10 ㎖와 그의-Smt을 선호도 태그를 제거하는 전체 단백질의 1 μL / 5 밀리그램 유비퀴틴 같은 단백질 분해 효소 1 (ULP1)를 추가로 NI1 수영장.
- 4 ℃에서 저어 접시에 10 kDa의 분자량 차단 (MWCO)에서 4 ° C에서 4 시간 동안 버퍼의 2 L에 NI1 수영장 + ULP1을 Dialyze
- 투석 후 NI1 수영장, NI1 수영장 + ULP1 ULP1 분열이 성공 여부를 결정하는의 SDS-PAGE를 실행합니다.
12. 니켈 2 (Ni2) 열
- 같은 니켈 열을 통해 절단 된 단백질을로드하고 1 ML / 분으로 감소 유량 단계 9.3를 반복합니다. 쪼개진 오프 태그는 열에 바인딩하고 tagless 대상 단백질은 이제 흐름을 것입니다. 신선한 용기에 흐름을 통해 수집합니다.
- 3 ML 버퍼와 니켈 열을 씻어 그의 모든 태그가하고 비특이적으로 결합 단백질을 용출하는 버퍼 B 5 ㎖에 의해 따랐다. 개별적으로 각 부분을 수집합니다.
- Ni2의 SDS-PAGE 씻어 흐름을 통해와 Ni2 용출 분획 ULP1 분열을 확인하고 그 실행을 홍보otein은 흐름을 통해에 존재합니다. 대략 단백질의 존재를 확인하기 위해 280를 측정하는 Nanodrop 분광을 사용합니다.
13. 집중
- Ni2 흐름을 통해 집중 (와 단백질이 존재하는 경우 Ni2 용출) Amicon 울트라 10 kDa의 MWCO 원심 분리기 튜브 5 ML에. 4 ℃에서 4,000 rpm에서 10 분 간격으로 회전 막 따라 과잉 집중에서 단백질을 방지하기 위해 각 스핀 사이의 피펫과 혼합.
14. 사이즈 배제 크로마토 그래피 (SEC)
- 0.5 ML / AKTApurifier 시스템 (GE 헬스 케어)에 분의 유속 200 mL를 삼성 버퍼 equilibrating에 의해 Sephacryl S-100 30분의 10 GL 열 (GE 헬스 케어)을 설정합니다.
- 제조업체의 지침에 따라 SEC 컬럼에 사용하기 위해 10 ㎖의 superloops을 준비합니다.
- 5 ML의 주사기를 사용하여 superloops에 샘플을로드하고 SEC 실행을 시작합니다.
- 작은 양 FR을 수집하는 동안 280 nm에서 UV-흡수 추적 모니터링행동.
- SDS-PAGE를 통해 SEC 분수를 실행합니다.
- 높은 강도의 밴드를 보여주는 삼성 분수 수영장.
- 풀링 삼성 분수를 집중한다. 13.1 단계를 참조하십시오.
- 100 μL 샘플, -80에서 액체 질소와 저장소에 플래시 동결 ° C.에 나누어지는 단백질
결정화
15. 단백질 결정화
- 선택의 결정화 화면의 80 μL (에메랄드 바이오)를 96 - 웰 컴팩트 주니어 결정 플레이트의 각 저수지 (에메랄드 바이오)를 미리 입력합니다.
- 2-20 ㎎ / 얼음 ML 및 저장소에 버퍼 크기 조정 단백질을 희석.
- 96 우물 각각에 단백질 결정화 화면의 0.4 μL의 0.4 μL를 분배하고 맑은 바다 표범 어업 테이프 (맨코)를 포함한다.
- 16에 접시를 저장 ° C 해부 현미경으로 다음 몇 주 동안 정기적으로 단백질 결정화를 확인하는 동안.
16. 크리스탈 수확
- 모액 및 에틸렌 글리콜에서 동결 방지제를 만들 수 있습니다. 대상 단백질 크리스탈 잘 덮고있는 투명 테이프를 잘라. 빈 잘하려면 해당 결정화 조건의 1.6 μl를 추가하고 에틸렌 글리콜의 0.4 μL 20 %의 에틸렌 글리콜의 최종 농도를 산출하고 80 %는 조건을 결정화 결합. 참고 : 글리세롤, 기름, 낮은 MW 폴리에틸렌 글리콜, 및 / 또는 동결 방지제의 비율을 변화시 : 결정 회절을 최적화하기 위해 다음과 같은 서로 다른의 cryoprotectants를 사용해보십시오.
- 뚜껑 액체 질소와 커버로 가득 듀어에서 ALS 스타일 퍽 냉각 수확하기 전에.
- 자기 크리스탈 완드 (홀리데이 연구)과 잘 솔루션에서 직접 국자에 결정의 크기를 일치 내경 CryoLoop을 배치하여 결정을 수확.
- 바로 C를 고정 깜박하는 ALS 스타일 퍽의 동결 방지제 다음 물속에 수확 크리스탈 CryoLoop을 찍어rystal. 결정의 원하는 번호에 대해 반복합니다.
17. 크리스탈 검사 / 데이터 수집
- 일단 수확 ALS 퍽에 자기 CRYO 퍽 뚜껑을 배치 퍽 지팡이를 사용하여 완료됩니다. 구부러진 집게로, 퍽을 거꾸로 뒤집습니다.
- Rigaku ACTOR 듀어에 퍽을 전송, 퍽에 퍽 미는 나사, 최대 직면 핀 듀어에두고 뚜껑을 펀치.
- JDirector 소프트웨어를 사용하여 다음 매개 변수를 설정에서 화면 각 수정 : 0.5도 설정 빔 슬릿, 50mm로 설정 감지기 거리, 70도까지 이미지 단계, 및 노출 길이는 30 초로 설정합니다.
- 당신은 최고의 결정과 전략은 데이터 수집을위한 것입니다 어떤 결정하기 위해 JDirector로 촬영 한 테스트 이미지를 Mosflm를 실행합니다.
- Mosflm에서 결과에 따라 전체 데이터 집합을 수집합니다.
18. 자료 처리 / 구조 결정
- 데이터 집합을 처리하는 XDS / 엑스 스케일 4를 실행합니다.
- CCP4 Suite 소프트웨어를 엽니 다.
- 가능한 높은 상 동성 검색 모델을 사용하여 분자 대체 솔루션을 계산하는 페이저 5를 실행합니다. 이 경우 우리는 검색 모델 6으로 PDBID 3CW4를 사용했습니다.
- 데이터 집합에서 수집 한 관측 반사에 대한 귀하의 분자 모델을 구체화 할 Refmac 7을 실행합니다. 최종 해상도가 높은 껍질을 기반 다음과 같은 매개 변수에 의해 결정되어야한다 : R 요인> 50 % I / 시그마> 2, 완전성> 90 %.
- 분자 그래픽 소프트웨어 검둥 오리 8과 3 차원 전자 밀도 모델을 구축 할 수 있습니다.
- PDB의 구조를 증착하기 전에 구조의 품질을 확인 MolProbity 9 소프트웨어와 함께 확인 증착에 적합합니다.
결과
다음과 같은 결과를 설명하는 프로토콜의 예상 결과를 설명하고, PB2, 관찰 결과의 경우합니다.
인플루엔자 바이러스 중합 효소의 소단위 PB2 다섯 전체 길이 대상 아미노산 서열 (그림 2) 설계되었습니다, 유전자 작곡가를 사용하여. PB2 시퀀스는 다시 변환 많은 엔지니어링 단계 3 대상, E.의 표현에 최적화 된 코돈 조화 시퀀스의 결과되었습니다 대장균. IPCR 제품 (그림 3B), 서른 넷 구조의 총에서 성공적으로 그림 3A와 같이 파이프 복제 3를 사용하여 그의-Smt을 융합 태그 N-말단 배와 수정 pET28 벡터 시스템 (10)에 클로닝 하였다. 복제 워크 플로우의 개요는 그림 4에 표시됩니다.
성공적으로 복제 한 후 각 구조의 마이크로 스케일의 단백질 발현은 BL21 (DE3) E.에서 테스트되었습니다대장균 세포. 세포는 220 rpm에서 진탕 배양기 세트에 20 ° C에서 48 시간 동안 Novagen 사 익일 인 1 매체 (제조 업체의 프로토콜에 따라)로 보충 TB 배지에서 성장했다. 성장 후, 세포 캘리퍼스 LabChip 90 모세관 electrophoreses를 사용하여 수용성 단백질 발현을위한 수확 및 테스트되었습니다. 수용성 목적 단백질을 주도하고 서른 넷 PB2 구조의 열네 대규모 발효에 들어갔다. 각 구조의 대규모 배양 제조 업체의 프로토콜에 따라 Novagen 사의 하룻밤 익스프레스 1 매체와 보충 TB 배지에서 성장했다. 성장 후, 세포를 원심 분리를 통해 수확되었고, -80에 저장 ° C. 각 문화의 대규모 단백질 발현은 대규모 정화를 진행하기 전에 SDS-PAGE 분석 (그림 5)를 통해 확인 하였다.
단백질 메이커 열네 PB2 구조의 병렬 정제를 수행하는 데 사용되었다. 알의 명확히 해물내가 십사 구조는 니켈 - 킬레이트 칼럼을 통해 실행되었습니다. SDS-PAGE에 의해 표적 단백질을 포함하는 분획 결정한 후, 해당 분수는 각 샘플에 대한 풀링 된 각각의 농도는 280 독서에 의해 결정되었다. 배 그의-Smt 개의 태그 제거는 하룻밤 투석 두 번째 니켈 열 다음에 ULP1의 추가에 의해 실시되었다. 그의-Smt 개의 태그 제거의 확인은 SDS-PAGE (그림 6)에 의해 실시되었다, 각 샘플은 10 kDa의 Amicon 울트라 원심 분리 관에 집중되었다. Amicon 울트라 원심 분리기 튜브를 사용하여 농축 한 후, 각 샘플은 결정학 순도를 달성하기 위해 크기 조정 컬럼을 통해 실행되었습니다. 두 번째 농도는 결정화에 필요한 수준으로 단백질 농도를 높이기 위해 실시되었다. 모든 열네 구조가 성공적으로 정제 및 결정화 실험을 체결 하였다.
결정화 이전에 천을 해동에 의해 시작되었다OZEN 단백질. 결정은 16에서 기후 제어 방에서 수행되었다 ° C 앉아 드롭 증기 확산 (그림 7)를 위해 특별히 디자인 플레이트 (에메랄드 바이오)와 함께. 초기 심사 개의 스파 스 매트릭스 화면으로 실시되었다 JCSG +, 협정, 마법사 전체, 그리고 확장 뉴먼 전략에 따라 CryoFull (에메랄드 바이오). 단백질 용액 0.4 μL는 96 - 웰 컴팩트 주니어 결정 플레이트 (에메랄드 바이오)를 사용하여 해당 저장소에서 crystallant 0.4 μL (또는 저수지 용액)로 혼합 하였다. 열네 정제 시료의 그 아홉은 회절 연구 (그림 8)에 적합한 결정이 나왔고. 사내 회절 데이터 세트는 Osmic VARIMAX HF 광학 및 토성 944 + CCD 검출기가 장착 된 Rigaku SUPERBRIGHT FR-E + 회전 양극 X-선 발생기를 사용하여 구리 Kα 파장에서 결정 구 구조의 오 (그림 9에서 수집 된 ). 각 데이터 세트는 XDS / 엑스 스케일 4로 처리했다 < / 한모금>와 최종 해상도로 확장. 분자 교체하여 구조를 해결하기 위해 시도 CCP4 스위트 7에서 페이저 5를 실시 하였다. 최종 모델은 REFMAC 7 검둥 오리 11의 수동 재 구축에 정제 한 후 하였다. 구조 평가 및 MolProbity 9 형상 및 피트니스에 대해 보정 하였다. PB2 subunit의 네 가지 구조의 총 결정 (그림 10)와 PDB로 입금되었다. 그림 11 MTPP 파이프 라인의 각 단계에서 전체 결과를 보여줍니다.

그림 1. 에메랄드 바이오시 멀티 타겟 병렬 처리를위한 SSGCID 유전자에 구조 통로의 개요.
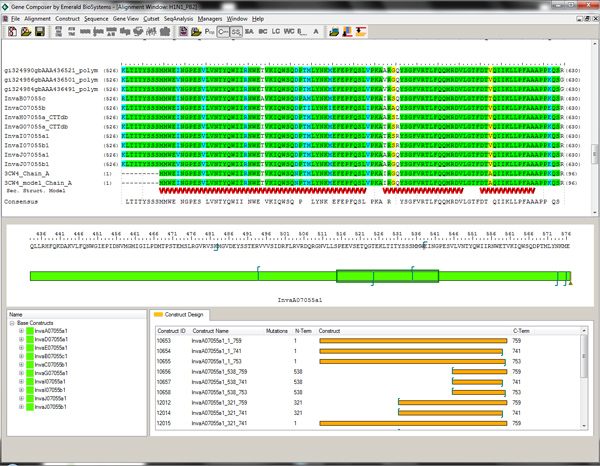
그림 2. 정렬 뷰어 및 단백질 유전자 Composer 소프트웨어의 설계 모듈을 구축합니다. 아미노산베이스 그린 (가운데 창) 및 대체 구문의 구조 유도 잘림이 금 (하단 창)에 표시됩니다에 표시되어 대상의 구성. 여러 독감 바이러스 PB2 서열 정렬이 순서와 이차 구조 요소에 비해 표시됩니다 PDBID 3CW4의 C-말단 도메인의. 도메인 구조 및 이차 구조 요소의 지식은 N-말단 잘림이 원하는 아미노산을 마우스 오른쪽 버튼으로 클릭하여 유전자 작곡가 디자인 모듈 내에서 선택 할 수 있습니다. 큰 그림을 보려면 여기를 클릭하십시오 .
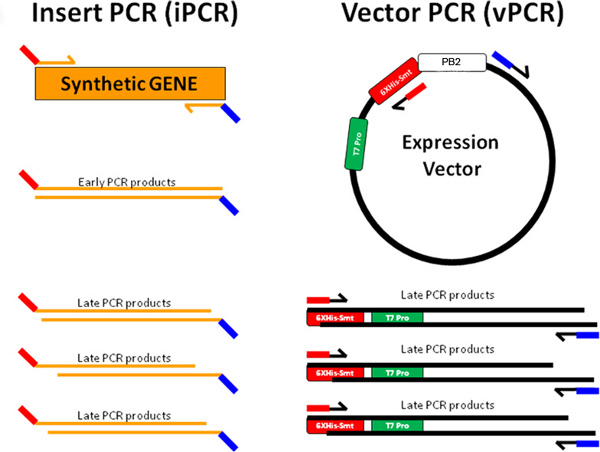
그림 3A. 파이프 복제는 합성 유전자 삽입 (오렌지)가 앞으로 디자인 (레드 오렌지 선)와 생성 역 (오렌지 블루 라인) 프라이머는 PCR 물질을 삽입하여 증폭되는 것을 특징으로 설명되어 있습니다. 발현 벡터가 반대 (빨강 - 검정 라인 증폭 ) 앞으로 (블루 블랙 라인) 프라이머 벡터 PCR 자료를 생성합니다. 터미널 시퀀스 IPCR 제품은 vPCR 제품 (IPCR의 붉은 IPCR의 vPCR와 블루 vPCR 블루 보완 빨간 보완)의 단자 시퀀스를 보완합니다. 이 IPCR 및 vPCR 제품은 호스트 BL21 (DE3) 화학적 관할 E.으로 변화에 복제되는 플라스미드를 형성 어닐링 할 수 있습니다 대장균 세포.

그림 3b. IPCR 생산의 영동 분석 성공적인 IPCR 제품은 강력한 밴드로 표현하는 동안 PB2 소단위에서 TS. IPCR 실패는, 희미하거나 더럽혀진 밴드로 볼 수 있습니다. IPCR 제품의 품질은 일반적으로 복제의 성공과 상관 될 수 있습니다. 분자량 마커 kiloDaltons에 있습니다. 그림은 레이몬드 외., 2011 12에서 재생됩니다.

그림 4. 대상 유전자 공학 단계 PB2 단백질이 유전자 Composer 소프트웨어를 사용하여 수행 하였다. 설계 핵산 서열이 각 대상에 대해 설립 후 6-7 다른 단백질 구조는 각 위해 설계되었습니다. 유전자 설계 및 복제의 초기 단계에있는 다중 표적 병렬 처리는 E.에 용해 단백질을 생산 가능한 대상이었다 14 어느 34 구조, 결과 대장균.
다시 10 "SRC ="/ files/ftp_upload/4225/4225fig5.jpg "/>
그림 5. 강력한 단백질 발현 (25.76 kDa의의 예상 크기), (레인 7) 용출 된 단백질에서 배 그분-Smt을 (를) 태그의 분열을 약 50 %의 수용성 (레인 4)와 50 %를 보여주는 대규모 발효의 대표 SDS-PAGE 분석.
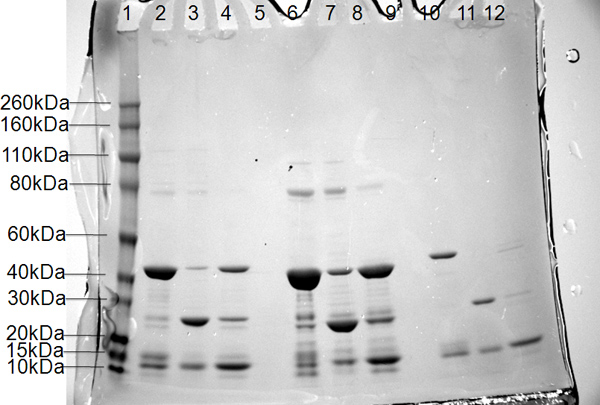
그림 6. 효소의 PB2 subunit의 세 가지 구조에 대한 SDS-PAGE 결과 레인 1, 분자량 마커 (kDa의의 왼쪽에 표시). 레인 2, 6, 10, 니켈 1 열에서 풀링 단백질, 레인 3, 7,과 11 니켈 2에서 버퍼에 쪼개진 단백질의 흐름을 통해, 레인 4, 8, 12, 니켈 2에서 버퍼 B에 배 그의-Smt 개의 태그를 제거.
d/4225/4225fig7.jpg "/>
그림 7. 앉아있는 드롭 방법으로 수증기 확산의 개략도. 단백질 결정화 앉아 드롭 방법은 증기 확산의 범주에 속합니다. 이 방법은 단백질과 높은 농도에서 유사한 조건을 포함하는 큰 저수지와 평형하는 침전제의 정제 된 샘플을 수반한다. 물이 단백질 샘플 및 전송에서 저수지 증발로 침전 농도는 단백질 결정화에 대한 최적의 수준으로 증가합니다.

그림 8. 인플루엔자 바이러스의 변형에서 효소의 PB2 소단위 단백질 크리스탈.

그림 9. 에서 효소의 PB2 소단위의 X-선 회절 이미지인플루엔자 바이러스의 변형.

그림 10. 4 PB2 구조 결정학 비대칭 단위 분자의 리본 다이어그램. 해당 PDB 코드에 무지개의 패턴 컬러 차 구조. () 3K2V (A/Yokohama/2017/2003/H3N2) (B) 3KHW (A / 멕시코 / InDRE4487/2009/H1N1) (C) 3KC6 (A/Vietnam/1203/2004/H5N1) (D) 3L56 (A/Vietnam/1203/2004/H5N1).

그림 11. 설명 된 방법에 의한 인플루엔자 PB2 대상에 대한 결과 분석. structur에이전자 측정 파이프 라인은 다섯 단계에 설명되어 있습니다 : 복제, 용해도, 정제, 결정화 및 구조 결정.
토론
멀티 타겟 병렬 처리
구조 기반 약물 설계 약물 발견에 중요한 역할을한다. SSGCID는 NIAID 종류 AC 병원균부터 3 차원 단백질 구조와 과학 커뮤니티를 제공하기 위해 최선을 다하고 있습니다. 널리 사용되는 이러한 구조 정보를 만드는 것은 궁극적으로 구조 기반 약물 설계를 가속화하는 역할을합니다.
MTPP 방식의 첫 번째 중요한 단계는 구조 디자인입니다. 각 대상 단백질의 여러 구조는 성공적인 구조 결정 및 증가 턴어라운드의 가능성을 증가시킵니다. 그것은 몇 가지 단백질 구조는 파이프 라인의 단계에서 실패 할 불가피하다. PIPE 복제 방법을 구현하는 것은 노동 집약적 인 정제 단계없이 96 - 웰 형식의 여러 구조의 생성을 허용하여 MTPP 방법을 지원합니다. 같은 96 - 웰 형식 (캘리퍼스 실험실에서 단백질 발현을 분석 할 수있는 능력 PIPE 복제 페어링칩 90) 더 전반적인 흐름을 촉진. 이러한 방법의 페어링 대규모 단백질 생산 및 정제의 성공을 보장 수용성 단백질을 생산하는 구조를 빠르게 식별 할 수 있습니다.
MTPP 높은 처리량의 성공에 필수적인 측면은 단백질 메이커 (미국 특허 번호 6,818,060, 에메랄드 바이오) 악기입니다. 단백질 메이커 높은 처리량 단백질 생산 및 관련 구조 게놈 파이프 라인 연구 프로그램의 효율성을 향상하기 위해 특별히 개발 된 24 채널 병렬 액체 크로마토 그래피 시스템입니다. 단백질 메이커 앞에서 설명한 프로토콜을 사용하여 장점은 한 줄 FPLC 시스템에 비해 분명합니다. 한 사람은 8 시간 내에 병렬 48 대상을 정화 할 수 있습니다. 반면, 한 줄 FPLC 시스템을 사용하여 한 사람은 같은 시간 내에 네 개의 대상의 최대를 정화 할 수 있습니다. 각 대상에 대한 순도 높은 수준의구조 분석을위한 성장 단백질 결정의 이후 성공에 중요한 요소는 단백질 메이커로 달성했다.
제한 사항 및 문제 해결
X-선 결정학에 의해 입체 구조를 해결하는 것은 수용성 목적 단백질의 다량을 얻을 수 없다는 것입니다 중 하나는 많은 도전과 다단계 노력입니다. 용해도 문제를 극복하기 위해 구현 할 수있는 하나의 전략은 E.와 같은 다른 표현 호스트의 사용 대장균 세포는 몇 가지 중요한 진핵 번역 후 수정을 수행 할 수 없습니다. 이러한 번역 후 수정을 수행 할 수있는 각종 효모 발현, 곤충 및 포유 동물 세포 라인은 종종 적절한 대안이다. 표적 단백질은 종종 표현하지만, 표준 용해 조건에서 완전히 용해된다. 단백질 메이커 대체 세포 용해 상태의 신속한 테스트를위한 귀중한 자원이 될 수 있습니다로 스미스 등의 설명. 2011 13. 이 전략은 종종 목표는 파이프 라인을 통해 계속 이동해야합니다. 어떤 구조 유전체학 파이프 라인, 표준화 된 프로토콜은 파이프 라인 및 대상 개별 최적화를해야 할 수도 통해 나오는 모든 대상에 적합하지 않을 수 있습니다. 예를 들어, 우리는 모든 동결 방지제에 대해 20 %의 에틸렌 글리콜을 사용하도록 선택했습니다. 이 조건이 적합하지 않습니다 경우에, 대안의 cryoprotectants 또는 농도 테스트해야 할 수도 있습니다.
각각의 단백질 대상의 고유 한 특성으로 인해, 속도 제한 및 구조를 결정하는 예측 단계는 결정됩니다. 최초의 스파 스 매트릭스 화면에서 최적화 단백질 결정화의 MTPP 파이프 라인 오프셋은 일반적으로 낮은 성공률. 상업적으로 이용 가능한 스파 스 매트릭스 화면에서 적중 각각의 초기 결정은 더욱 E-스크린 빌더 (에메랄드 바이오)에 최적화되어 있습니다. 최적화 화면이 AR 설계버퍼 염 및 첨가제의 농도 변화, 초기 크리스탈 히트의 상태를 운드. 성공적인 최적화 화면 회절 연구 및 구조 결정을위한 적합한 결정을 얻을 수 있습니다.
알레르기 및 전염병 국립 연구소 (NIAID)가 내다 구조 유전체학 프로그램은 에메랄드 바이오와 함께 SSGCID (에메랄드 바이오, SeattleBiomed, 워싱턴 대학과 퍼시픽 노스 웨스트 국립 연구소) 세 가지 다른 태평양 북서부 기관에 자금을 제공 . 컨소시엄의 각 구성원은 NIAID 구조 유전체학 프로그램의 목표를 달성에 필요한 최첨단 기술을 적용하는 전문성을 위해 선택되었다. 지금까지 SSGCID은 세계에서 일곱 번째로 큰 기여자로 PDB 순위 그것으로 461 구조를 기탁했으며, 2011 년, 가장 생산. SSGCID의 프로토콜과 방법론을 혜택의 의도와 함께 제공됩니다사회 과학 및 감염성 질환의 연구를 영속.
공개
저자는 에메랄드 바이오 주식 회사의 직원입니다
감사의 말
저자는 SSGCID 컨소시엄의 모든 구성원을 감사드립니다. SSGCID의 목표 달성은 에메랄드 바이오의 모든 팀 구성원의 엄청난 노력에 의해 가능하게된다. 이 연구는 알레르기와 감염증, 건강 및 보건 복지부의 국립 연구소의 국립 연구소에서 연방 계약 번호 HHSN272200700057C에서 후원했다.
자료
| Name | Company | Catalog Number | Comments |
| Primers | IDT | ||
| Genes | DNA 2.0 | ||
| TE buffer | Qiagen | provided in kit | |
| 96-well half skirt PCR plates | VWR | 10011-248 | |
| PFU Master Mix | |||
| 6X Orange Loading Dye | Fermentas | R0631 | |
| 10X TAE | Teknova | T0280 | |
| Agarose | Sigma-Aldrich | A9414-10G | |
| pET28 vector | |||
| 2-YT Broth | VWR | 101446-848 | |
| Kanamycin | Teknova | K2151 | |
| Restriction Enzymes | Fermentas | ||
| QIAquick Gel Extraction Kit | Qiagen | 28704 | |
| Top 10 chemically comp cells | Invitrogen | C4040-06 | |
| Disposable Troughs (Sterile, 25 ml) | VWR | 89094-662 | |
| Airpore covers (Rayon films for bio cultures) | VWR | 60941-086 | |
| 24-well blocks | VWR | 13503-188 | |
| QIAvac 96 | Qiagen | 19504 | |
| BL21(DE3) cells chemcomp (phageR) | NEB | C2527H | |
| 50% Glycerol | VWR | 100217-622 | |
| TB Media | Teknova | T7060 | |
| IPTG | Sigma-Aldrich | ||
| 1 M Tris pH 8.0 | Mediatech | 46-031-CM | |
| 5 M NaCl | Teknova | S0251 | |
| Glycerol | Aldrich | G7893-4L | |
| CHAPS | JT Baker | 4145-01 | |
| Imidazole | Sigma | 56749-1KG | |
| TCEP | Amresco | K831-10G | |
| L-arginine | Amresco | 0877-500G | |
| Benzonase | EMD | 70746-3 | |
| Lysozyme | USB | 1864525GM | |
| 10 kDa MWCO dialysis tubing | Thermo | 68100 | |
| Amicon Ultra 10 ka MWCO concentrators | Millipore | UFC901024 | |
| HisTrap FF columns | GE | 17-5255-01 | |
| HiTrap Chelating columns | GE | 17/0408-01 | |
| Compact Jr crystallization plates | Emerald Bio | EBS-XJR | |
| Crystalization screens | Emerald Bio | ||
| Ethylene Glycol 100% | Emerald Bio | EBS-250-EGLY | |
| Crystal Wand Magnetic Straight | Hampton Research | HR4-729 | |
| Mounted CryoLoop 0.1-0.2 mm | Hampton Research | HR4-955 | |
| ALS style puck | |||
| Puck Wand | |||
| Bent Tongs | |||
| Puck Pusher |
참고문헌
- Lowen, A. C., Mubareka, S., Steel, J., Palese, P. Influenza virus transmission is dependent on relative humidity and temperature. PLoS Pathogens. 3 (10), 1470-1476 (2007).
- Yamada, S., et al. Biological and structural characterization of a host-adapting amino acid in influenza virus. PLoS Pathog. 6, e1001034 (2010).
- Lorimer, D., Raymond, A., Walchli, J., Mixon, M., Barrow, A., Wallace, E., Grice, R., Burgin, A., Gene Stewart, L. Composer: database software for protein construct design, codon engineering, and gene synthesis. BMC Biotechnol. 9, 36 (2009).
- Kabsch, W. Integration, scaling, space-group assignment and post-refinement. Acta Cryst. D. 66, 125-132 (2010).
- McCoy, A. J., Grosse-Kunstleve, R. W., Adams, P. D., Winn, M. D., Storoni, L. C., Read, R. J. J. Phaser crystallographic software. Appl. Cryst. 40, 658-674 (2007).
- Kuzuhara, T., Kise, D., et al. Structural basis of the influenza A virus RNA polymerase PB2 RNA-binding domain containing the pathogenicity-determinant lysine 627 residue. J. Biol. Chem. 284, 6855-6860 (2009).
- Murshudov, G. N., Skubàk, P., Lebedev, A. A., Pannu, N. S., Steiner, R. A., Nicholls, R. A., Winn, M. D., Long, F., Vagin, A. A. REFMAC5 for the refinement of macromolecular crystal structures. Acta Cryst. D. 67, 355-367 (2011).
- Cowtan, K. Recent developments in classical density modification. Acta Cryst. D. 66, 470-478 (2010).
- Chen, V. B., Arendall, W. B., Headd, J. J., Keedy, D. A., Immormino, R. M., Kapral, G. J., Murray, L. W., Richardson, J. S., Richardson, D. C. MolProbity: all-atom structure validation for macromolecular crystallography. Acta Cryst. D. 66, 12-21 (2010).
- Mossessova, E., Lima, C. D. Ulp1-SUMO crystal structure and genetic analysis reveal conserved interactions and a regulatory element essential for cell growth in yeast. Mol. Cell. 5, 865-876 (2000).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and development of Coot. Acta Cryst. D. 66, 486-501 (2010).
- Raymond, A. C., Haffner, T. E., Ng, N., Lorimer, D., Staker, B. L., Stewart, L. J. Gene design, cloning and protein-expression methods for high-value targets at the Seattle Structural Genomics Center for Infectious Disease. Acta Cryst. F. 67, 992-997 (2011).
- Smith, E. R., Begley, D. W., Anderson, V., Raymond, A. C., Haffner, T. E., Robinson, J. I., Edwards, T. E., Duncan, N., Gerdts, C. J., Mixon, M. B., Nollert, P., Staker, B. L., Stewart, L. J. The Protein Maker: an automated system for high-throughput parallel purification. Acta Cryst. F. 67, 1015-1021 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유