JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Zebrafish 배아 Neuroepithelium의 투과율에 대한 분석
요약
우리는 배아 zebrafish의 뇌의 투자율의 라이브 전체 동물 양적 측정을 설명합니다. 기술은 신경 튜브 내강 내에서 서로 다른 분자 무게의 중추 신경계와 분자를 보유 할 수있는 능력을 분석하고 심실의 움직임을 단정 지을. 이 방법은 개발과 질병 중 상피 투자율과 성숙의 차이를 결정하는 데 유용합니다.
초록
뇌 심실 시스템은 vertebrates 사이에 보존되어 있으며 뇌 개발의 초기 단계에서 형성과 동물의 삶을 통해 유지 뇌 심실라는 상호 충치의 일련의로 구성되어 있습니다. 뇌 심실 시스템은 vertebrates에서 발견하고, 심실은 중앙 루멘은 뇌척수 (CSF) 1,2로 채워 때, 신경 튜브 형성 한 후 개발을하고 있습니다. CSF는 정상적인 두뇌 개발과 기능 3-6을 위해 필수적이며 단백질 풍부한 액체이다.
신경 튜브가 폐쇄 된 후 zebrafish에서 뇌 심실 인플레이션은 약 18 시간 게시물 수정을 (hpf)에서 시작됩니다. 여러 프로세스가 neuroepithelium 형성, 투자율 및 CSF의 생산을 조절 긴밀한 접합 형성 등의 뇌 뇌실 형성와 연결되어 있습니다. 우리는이 모든 과정에 영향을 미치는, 오세영가 K-ATPase는 뇌 심실 인플레이션 필요하다고 보여claudin의 5A 꼭 접합부 형성 9 필요한 반면 에스 7,8. 또한, 우리는 마이 오신의 억제를 통해 배아 neuroepithelium의 "휴식"을 보여 뇌 심실 인플레이션과 연결되어 있습니다.
zebrafish의 뇌 심실 인플레이션 동안 투자율의 규정을 조사하기 위해, 우리는 심실 염료 유지 분석을 개발했습니다. 이 방법은 휘황 중추 신경계에 라벨을, 거실 zebrafish의 배아, 이전에 우리 연구소 10 개발 기술에 뇌 뇌실 주입을 사용합니다. 태아는 다음 뇌 심실과 neuroepithelium을 통해 형광 염료 이동으로 시간이 지남에 따라 이미징 있습니다. 거리 염료 전면 정량 멀리 시간이 지남에 따라 neuroepithelium의 기초 (비 luminal) 측에서 이동하고 neuroepithelial 투자율의 측정 (그림 1)입니다. 우리는 염료 70 kDa과 작은이 neuroepithelium을 통해 이동한다는 관찰하고 detecte 할 수 있습니다24 hpf (그림 2)에서 배아 zebrafish의 뇌 이외의 D.
이 염료 유지 분석은 개발 기간 동안 다른 시간에 서로 다른 유전 배경을 다양한 neuroepithelial 투자율을 분석하는 데 사용, 환경 섭동 후 할 수 있습니다. 또한 CSF의 병적 인 축적을 조사에 유용 할 수 있습니다. 전반적으로,이 기법은 수사관 개발과 질병 중 투자율의 역할과 규정을 분석 할 수 있습니다.
프로토콜
1. Microinjection 준비
- 셔터 계기 바늘 풀러를 사용하여 모세관 튜브를 당겨 microinjection의 바늘을 준비합니다.
- 형광 염료와로드 microinjection의 바늘 (FITC-Dextran).
- micromanipulator 및 microinjection 장치에 바늘을 탑재합니다.
- 조심스럽게 폭 약 2 μm로 집게를 사용하여 microinjection의 바늘을 부러 그러나, 이렇게하면 microinjector 설정에 따라 달라집니다. 우리 microinjection의 바늘이 구부리하지 않는 끝에서 바늘의 첫 번째 지역에 해당합니다.
- 각각의 주입은 1 NL을 제공합니다 있도록 분사 시간과 압력을 조정, 기름에 방울 크기를 측정합니다. 하버드 장치 microinjector 예를 들어 설정은 다음과 같습니다 P 잔액 = 1.4 PSI, P = 1.4 PSI 아웃, P는 0.4-0.7 초의 분사 시간 = 22.9 PSI, P 명확 = 67.8 PSI를 삽입. 이러한 설정을 사용하여 Google 바늘의 직경은 약 2 μm이다. 그러나, 설정 microinjector 구체적으로, 그리고이 달라집니다바늘 직경 쪽에서 그러는데 마이애미의 해변 에선.
2. 태아 준비
- 코트는 2 각 조건 물에 1% 아가로 오스와 요리 1-200 μl 피펫 팁과 아가로 오스에 포크 구멍, 그리고 아가로 오스 플러그를 제거합니다. 배아 미디어와 요리를 채 웁니다.
- 사용 포셉, stereomicroscope 18 명의 hpf 세 이상 dechorionate 배아. 태아도 Kimmel 외에 따라 개최됩니다. 11.
- 첫째 아가로 오스 코팅 그릇에 dechorionated 배아를 전송합니다.
- 배아는 (Westerfield 12에 따라 변경) 이동 중지 할 때까지 배아를 마취시키기 위해서, 음식에 tricaine을 (0.1 밀리그램 / ML)를 추가합니다.
3. 뇌 심실을 주입
- 동양의 배아 그래서 당신은 구멍에 배의 꼬리를 넣어 자신의 등쪽 옆에 찾고 있습니다. 귀하의 micromanipulator가 오른쪽에 있으면 forebrain의 오른쪽에 왼쪽과 hindbrain에이되도록 한 다음 배아를 이동합니다.
- 무선의 위치 바늘hindbrain의 심실의 목적지 가리 킵니다.
- 난황 (그림 1A)로 뇌의 깊이 통과하지 않도록 것 hindbrain의 심실의주의 깊게 관통 지붕 판.
- 염료는 뇌 심실의 전체 길이를 채우고 확인하는 심실에 형광 염료를 1-2 NL를 삽입.
- 배아 미디어로 가득 번째 아가로 오스 코팅 접시에 배아를 전송하고 다시 마취로 2.4에 설명되어 있습니다.
- 즉시로 시간 제로 이미지를 위해 제 4에 설명 된 이미지를 시작합니다.
4. 영상
- 구멍에 자신의 꼬리 동양의 배아는 3.1에 설명되어 있습니다.
- brightfield의 등쪽 이미지를 취할 전송 및 형광등을 모두 빛으로 해부 현미경을 사용합니다. 다른 배아의 이미지 사이의 배율이 일정하게 유지. 이 이미지 J (5.2-6)를 사용하여 수행 분석의 직접적인 비교를 할 수 있습니다.
- 태아의 현미경이나 접시를 이동하지 않고,을해당 형광 이미지.
- 원하는 시간 지점에서 각각의 배아에 대해 반복합니다.
5. 염료 운동의 정량화
- 이전 Gutzman와 Sive (10)에 의해 설명 된대로 포토샵에서 brightfield 및 형광 이미지를 병합합니다.
- 거리에게에서 제공 이미지 J 소프트웨어의 염료 전면 이동 측정 http://rsbweb.nih.gov/ij/을 .
- 이미지 J와 neuroepithelium에서 10-20 ° 각도 (그림 1A)에서 전면 색깔을 할 수있는 forebrain 힌지 점에서 라인을 그릴 줄 도구를 사용에서 열기 병합 파일을 만듭니다. 이 야생 유형 neuroepithelium 밖으로 누출되는 염료의 최초이자 가장 눈에 띄는 사이트입니다 때문에이 지역은 선정되었습니다.
- 라인의 길이를 계산하기 위해 측정 도구를 선택합니다.
- 할 때마다 포인트에 대해 반복합니다.
- 염료 앞에 다른 시간 지점에서 t = 0에서 거리를 차감하여 시간이 지남에 따라 이동 순 거리를 계산합니다.
- 에 플롯그래프.
6. 대표 결과
야생 유형 배아를 사용하여 neuroepithelial 투자율 분석에서 얻은 결과의 예는 그림 1B-D로 표시됩니다. 정확하게 투과성을 차별화하는 데, 그것은 야생 유형 또는 제어 배아 (그림 2)에서만 약간 새는있는 크기를 식별하는 다른 분자 weightsto와 염료를 테스트하는 데 유용합니다. 이 유전자 돌연변이 나 환경 조건의 식별을 허용 그 중 증가 또는 감소는 투자율 (그림 1D, 녹색과 붉은 라인을 각각). 24 hpf의 zebrafish의 neuroepithelium를 들어, 70 kDa FITC Dextran 누출 천천히 2 시간 이상, 2,000 kDa이되지 않고 즉시 10 kDa 누수가 아웃 반면. 따라서 70 kDa 모두 증가하고는 neuroepithelial 투자율이 감소하는 조건을 식별 할 수있는 이상적인 분자량입니다.
바늘은 심실 내강, 형광 w를 그리워하는 경우병 t에서 뇌 이외의 표시 = 0 (예를 들어 Gutzman과 Sive 2009 년 10 참조). 주입 된 색소는 처음 뇌에 포함되지 않은 및 neuropeithelium의 염료 및 투자율의 움직임에 대한 명확한 결론이 내려 수 없습니다 때문에 이러한 배아는 폐기해야합니다.
마지막으로, 배아 전에 형광 염료의 주입을 수행 할 수있는 작은 심실 또는 해제 - 팽창 뇌 심실, 생리 식염수로 심실의 사전 주입이있는 경우. 이 형광 염료를 주입하면 쉽게 심실의 후속 시각화하는 심실 웃기 구 있네. 적절한 컨트롤은 생리의 주입이 정상 신경 튜브의 개발을 방해 여부를 판단하기 위해 수행해야합니다.
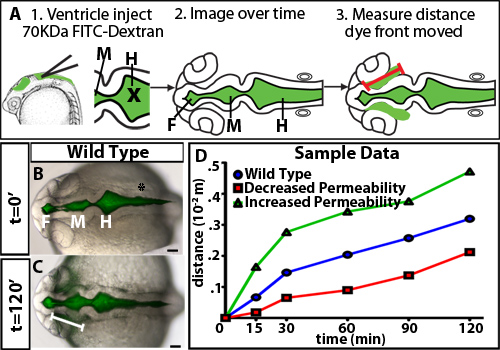
1 그림. 다른 분자량의 염료의 시간 코스입니다. (A) 실험 다이어그램. 처음으로, 형광 색소는 심실에 주입되어 있습니다. X 분사에 대한 바늘의 = 위치. 다음 등쪽의 이미지는 시간이 지남에 캡처됩니다. 마지막으로, 거리 경첩 점은 (빨간색 선으로 표시) 측정 forebrain에서 염료를 전면으로 옮겼습니다. (BC) 22 hpf (t = 0 분, B), 24 hpf (t = 120 분, C)에서 brightfield 및 형광 등의 이미지를 흡수 합병. 화이트 라인은 forebrain 심실에서 염료 앞의 거리를 나타냅니다. (D) 가정 해봐 샘플 투자율 데이터입니다. 블루 = 야생 종류 나 컨트롤 제어 상대적으로 증가 투자율과 감소 제어 할 상대 투자율, 그리고 녹색 = 샘플과 붉은 색 = 샘플.
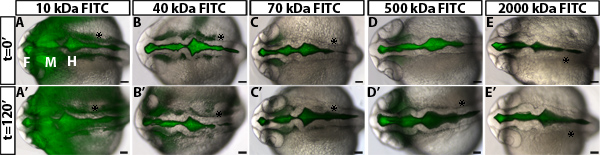
그림 2. 다른 분자량의 염료에 neuroepithelial 투자율의 측정. (AE) 등의 병합 brightfield과 t 22 hpf 야생 유형 배아의 형광 이미지 = 0 분 FITC-D로 주입 후10 kDa (A), 40 kDa (B), 70 kDa (C), 500 kDa (D)와 2,000 kDa (E) 다음 분자량의 extran. t = 24 hpf의 120 분의에서와 같이 (A'-E ')과 동일 배아 (AE). 왼쪽 앞. F = forebrain, M = midbrain, H = hindbrain. 별표 = 귀.
토론
우리는 주어진 분자 무게의 주입 염료에 대한 결정으로 생활 배아 zebrafish의 뇌의 투자율을 수량화 할 수있는 능력을 보여줍니다. 배아 zebrafish의 neuroepithelium는 분자 가중치를 서로 다른의 염료에 differentially 투과성있는 것으로 관찰 염료가 paracellular 투자율을 통해 이동하는 것이 좋습니다. 그러나, 우리는 관찰 투자율에 transcellular 공헌의 가능성을 배제 할 수 없습니다. 이 기술은 튜브의 내부와 ?...
공개
관심 없음 충돌이 선언 없습니다.
감사의 말
이 작품은 국립 정신 건강 연구소와 국립 과학 재단 (National Science Foundation)에서 지원되었습니다. 전문가 생선 축산에 대한 많은 유용한 토론과 건설적인 비판, 그리고 올리버 Paugois에 대한 Sive 연구소 회원에게 특별 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | |
| Dextran, Fluorescein, 음이온, 리신 고칠 수 | Invitrogen | D7136, D7137, D1822, D1820, D1845 | |
| Tricaine 분말 | 시그마 | A5040 | |
| 모세관 튜브 | FHC 주식회사 | 30-30-1 |
참고문헌
- Harrington, M. J., Hong, E., Brewster, R. Comparative analysis of neurulation: first impressions do not count. Mol. Reprod. Dev. 76, 954-965 (2009).
- Lowery, L. A., Sive, H. Strategies of vertebrate neurulation and a re-evaluation of teleost neural tube formation. Mech. Dev. 121, 1189-1197 (2004).
- Salehi, Z., Mashayekhi, F. The role of cerebrospinal fluid on neural cell survival in the developing chick cerebral cortex: an in vivo study. Eur. J. Neurol. 13, 760-764 (2006).
- Martin, C. Early embryonic brain development in rats requires the trophic influence of cerebrospinal fluid. Int. J. Dev. Neurosci. 27, 733-740 (2009).
- Lehtinen, M. K. The cerebrospinal fluid provides a proliferative niche for neural progenitor cells. Neuron. 69, 893-905 (2011).
- Gato, A. Embryonic cerebrospinal fluid regulates neuroepithelial survival, proliferation, and neurogenesis in chick embryos. Anat. Rec. A. Discov. Mol. Cell Evol. Biol. 284, 475-484 (2005).
- Lowery, L. A., Sive, H. Totally tubular: the mystery behind function and origin of the brain ventricular system. Bioessays. 31, 446-458 (2009).
- Lowery, L. A., Sive, H. Initial formation of zebrafish brain ventricles occurs independently of circulation and requires the nagie oko and snakehead/atp1a1a.1 gene products. Development. 132, 2057-2067 (2005).
- Zhang, J. Establishment of a neuroepithelial barrier by Claudin5a is essential for zebrafish brain ventricular lumen expansion. Proc. Natl. Acad. Sci. U.S.A. 107, 1425-1430 (2010).
- Gutzman, J. H., Sive, H. Zebrafish brain ventricle injection. J. Vis. Exp. , (2009).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev. Dyn. 203, 253-310 (1995).
- Westerfield, M., Sprague, J., Doerry, E., Douglas, S., Grp, Z. The Zebrafish Information Network (ZFIN): a resource for genetic, genomic and developmental research. Nucleic Acids Research. 29, 87-90 (2001).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유