Method Article
셀 추적 염료를 사용하여 전지 부문 모니터링에 최적화 된 착색 및 확산 모델링 방법
요약
면역 세포 기능과 확산을 모니터하기위한 셀 추적 염료의 성공적인 사용은 몇 가지 중요한 단계를 포함한다. 우리가 방법을 설명합니다 : 1) 막 염료를 갖춘 밝고 균일 재현 라벨 - ING 획득, 2) fluorochromes 및 데이터 수집 조건을 선택을하고, 3) 염료 희석에 따라 세포 증식을 수량화 할 수있는 모델을 선택.
초록
형광 셀 추적 염료는, 흐름 및 이미지 세포 계측법과 결합, 체외 및 생체의 여러 세포 유형의 상호 작용과 운명을 공부하는 강력한 도구입니다. 1-5 등 염료를 사용하여 출판물의 수천의 일부가 그대로가 있지만 가장 일반적으로 발생 셀 추적 응용 프로그램의 모니터링을 포함 :
- 줄기 및 전구 세포 정지, 확산 및 / 또는 차별화 6-8
- 항원 기반 멤브레인 전송 구 및 / 또는 전구체 세포 증식 3,4,10-18 및
- 면역 규정 및 효과기 세포 기능 1,18-21.
상업적으로 이용 가능한 세포 추적 염료는 화학 및 형광 속성에 다양하지만, 셀 라벨 자신의 메커니즘에 따라 두 클래스 중 하나에 대다수의 가을. "막 염료는"높은 lipophilic 염료는 t이며, PKH26에 의해 typified셀 멤브레인 1,2,11에 안정적으로하지만 비 covalently 모자 파티션. "단백질 염료는"CFSE에 의해 typified, 세포 단백질 4,16,18과 안정적인 공유 결합 채권을 형성 아미노 반응 염료 있습니다. 각 클래스는 자신의 장점과 한계를 가지고있다. 성공적인 사용의 핵심은, 특히 여러 염료가 다른 세포 유형을 추적하는 데 사용되는 여러 가지 빛깔의 연구에 각 클래스 2-4,16,18,24의 최적 사용을 가능하게하는 중요한 문제를 이해하는 것이 있습니다.
프로토콜 셀 추적 염료를 사용하는 경우 가난한 또는 가변 결과의 세 가지 일반적인 원인을 강조 여기에 포함되어 있습니다. 이는 다음과 같습니다
- 밝고 균일 재현 라벨을 달성하기 실패했습니다. 이 모든 세포 추적 연구를위한 필요 출발점이 될 것입니다하지만 단백질 염료 또는 항체와 같은 평형 구속력이 시약을 사용할 때보다 막 염료를 사용하여 다른 변수에주의가 필요합니다.
- 차선 fluorochrome 조합차 / 또는 실패는 중요한 보상 컨트롤을 포함 할 수 있습니다. 염료 형광을 추적하면 일반적으로 10 2 - 항체 형광보다 10 3 배 더 밝아. 이 추적 염료의 존재가 사용하는 다른 프로브를 감지 할 수있는 능력을 손상하지 않습니다 있는지 확인하는 것이 중요합니다.
- 최대 모델링 소프트웨어과 잘 맞는지를 얻기 위해 실패했습니다. 이러한 소프트웨어는 전구체 주파수 또는 기타 통계에 따라 서로 다른 집단이나 자극에 걸쳐 proliferative 응답 양적 비교를 할 수 있습니다. 적합한 구하기 그러나,의 염료 희석 프로필을 왜곡 할 수 세포를 죽음과 관찰 염료 희석 프로파일의 특성과 모델을 근간 가정의 일치 / 죽었어. 제외가 필요합니다
여기에 주어진 예는 세포 증식을 모니터링 막 및 / 또는 단백질 염료를 사용하는 경우이 변수가 결과에 영향을 미칠 수 방법을 보여줍니다.
프로토콜
1. PKH26 셀 추적 염료와 일반 막 라벨링 (Ref. 25, 그림 1)
- 1.9 - 단계 1.1 무균 기술을 사용합니다. 혈소판 오염을 최소화하기 위해 최종 300 XG 스핀의 추가와 함께 실험실의 표준 방법을 사용하여 ~ 10 7 사람 말초 혈 mononuclear 세포 또는 림프구를 (hPBMC, hPBL) 준비합니다. 2 단계에서 사용하기 위해 500 μl 나누어지는을 (5x10 6 셀) 예약, 10 얼음에 HBSS 1%의 BSA와 장소에서 7 / ML에서 세포를 Resuspend.
- 12 X 75mm 원뿔 폴리 프로필렌 관 장소 5x10 6 셀 (500 μl). 3.5 ML의 HBSS에 한 번 씻으십시오. 조심스럽게 잔류 유체의 더 이상 15-25보다 μl를두고 있지만, 세포를 제거 할 수 없습니다를 돌보는 표면에 뜨는을 대기음. 단계 1.4에서 2 배 세포 현탁액을 준비하려면이 튜브를 사용하십시오.
- 단계 1.2에서 세척 셀 동안 12 X 75mm 원뿔 폴리 프로필렌 튜브에 희석제 C 라벨 차량의 0.5 ML을 (PKH26GL 키트에서) 추가 할 수 있습니다. 사립이 튜브를 사용하여단계 1.5에서 2 배 PKH26 솔루션입니다.
- 단계 1.2에서 한물 세포 펠렛에 희석제 C 라벨 차량의 0.5 ML를 추가하고 단일 세포 현탁액 (2 배 세포)를 얻기 위해 3-4 회를 기음과 분배. 세포 생존과 복구를 줄일 수 있습니다 거품 형성과 혼합 과도한를 피하십시오.
- 즉시 단계 1.4에서 2 배 세포 현탁액을 준비 후, 단계 1.3과 소용돌이에 준비 희석제 C 관에 에탄올에 1.0 MM PKH26 염색 가공 (PKH26GL 키트에서) 2.0 μl를 추가하여 2 배 (4 μM) 염료 솔루션을 준비 균일하게 분산.
- 즉시 단계 1.5에서 2 배 염료 솔루션을 준비 후, 신속하게 배 염료 솔루션에 단계 1.4에서 2 배 세포 현탁액을 피펫 동시에 기음 완전히 염료에 세포를 분산하기 위해 3-4 회를 분배하지 않습니다.에 직접 1.0 밀리미터 염료를 추가 세포, 배 염료로 2 배 세포를 부어, 또는 vortexing하면서 염료를 배에 배 셀을 추가 할 수 있습니다. 착색 거의 즉시이기 때문에, 이러한 방법은 적은 얻을 수권장하는 방법보다 균일 한 농도 (그림 2).
- 1 분 후, 열 inactivated 혈청 또는 셀 멤브레인에 염료 이해를 중지 할 수 HBSS 5퍼센트의 BSA의 1.0 ML를 추가합니다. 충분한 단백질을 사용하지 않으면 세척 단계에서 세포를 가지고 펠릿 수와 다른 세포의 의도 라벨을 일으킬는 실험에서 제시 염료 집계의 형성을 위험. 10% 열 inactivated 혈청 (CM) 또는 HBSS 1퍼센트 BSA와 매체가 정지 시약으로 사용되는 경우, 15 ML 원뿔 폴리 프로필렌 튜브에 얼룩 수행과 모든 흡착을 확보하기 위해 정지 시약 최소한 5.0 ML를 추가합니다 비법 염료.
- 5 분의 라벨 세포를 원심 분리기 @ ~ 400 X g. 세포를 제거하지 않고 표면에 뜨는을 자세히 대기음. 잘 recentrifugation 전에 펠렛을 분산, CM 또는 HBSS 1%의 BSA 4 ML로 두 번 펠렛을 씻으십시오. 튜브 벽에 adsorbed 염료의 carryover를 최소화하고 세정 효율을 최대화하기 위해 Fi 접속 설비를 한 후 새로운 폴리 프로필렌 튜브에 세포를 전송첫 resuspension. 참고 : 적절하게 스테인드 세포 펠렛의 독특한 핑크 가미을 전시합니다.
- 1.0 ML HBSS 하나의 %의 BSA에 씻은 세포 펠렛을 Resuspend. , 셀을 계산 셀 복구를 결정, 10 7 / ML의 최종 농도를 제공 볼륨을 조정할 수 있습니다. 주의 흡인으로, 세포 복구 ≥ 85%해야합니다. 세포 복구가 <70% 경우, 더 진행하기 전에 원인을 결정한다. 2 단계에서 사용하기위한 얼음에 150 μl 나누어지는 (1.5x10 6 셀) 및 장소를 철회 할 수 있습니다.
2. 악기 및 분석 설정 컨트롤의 작성 (표 1)
- 1, 3, 4, 5, 7 다섯 1.8 ML Eppendorf 튜브의 각 단계에 1.1에서 저장 한 세포 현탁액에서 흠없는 세포의 나누어지는 50 μl (5x10 5). 2, 6, 8 : PKH26 POS의 세 관의 각 단계에 1.9 세포 나누어지는 50 μl (5x10 5).
- 튜브 1-8로, 10 μl IgG 블록 (시약의 표를 참조 100 μg / IgG의 관을)를 추가그리고 주위 온도 (20-25 ° C)에서 10 분에 품다.
- 포화 튜브 4, 5, 7 표 1에 나와있는 항체의 양 (이거 야), 그리고 8 추가 30 주위 온도에서 분, 빛으로부터 보호의 모든 샘플을 (튜브 1-8) 품다.
- 모든 샘플에 HBSS 1%의 BSA의 1.5 ML를 추가 펠릿 원심 분리 (5 분 @ 400 XG)와주의 염원과 함께 HBSS 1퍼센트 BSA의 1.5 ML로 한 번 씻어하여 셀은 셀 손실을 방지합니다.
- HBSS 1퍼센트의 BSA 500 μl 각 샘플을 Resuspend. 귀하의 cytometer에 분석 할 시료에 필요한 경우, 12 X 75mm 둥근 바닥 튜브로 전송할 수 있습니다. 표 1에 표시된대로 튜브 3, 6, 7, 8-100 μg / ML 7 AAD 작동 주식 매일 (시약의 표 참조) 10 μl를 추가합니다. 흐름 cytometer 설정 및 착색 확인 (3 단계)에서 사용하기 전에 30 분을 위해 얼음을 품다.
3. 흐름 Cytometer 설치 및 착색 확인
- 있는지 확인 흐름 cytome적이 매일 품질 관리를위한 실험실의 설립 절차를 사용하여 제대로 작동합니다. 그 신호를 확인하는 것은 쉽게 사용할 수 있도록 각각의 스펙트럼 창에 감지하고, 검출기 응답이 확산 모니터링 14에 사용되는 창에서 강도를 신호에 비례 것을. 할 수 있습니다
- 선형 디스플레이 비늘을 사용하여 FSC 대 튜브 1 SSC 데이터를 수집. 림프구 인구가 점 음모의 왼쪽 하단 사분면에 속하는 각 검출기의 증폭 이러한 조정, 각 매개 변수에 오프 규모 없으며, 임계 값으로 인해 중단되지 않습니다. 3.7 - 3.3 단계의 모든 샘플 ungated FSC 대 SSC 데이터를 수집합니다.
- 모든 4 형광 검출기에 대한 컬러 보상 및 로그 디스플레이 비늘을 사용하지, 튜브 1 데이터를 수집. / 더 셀 첫 번째 채널에 몇 축적되지과 규모에 흠없는 림프구의 autofluorescence을 배치 각 검출기의 높은 전압 (HV)를 조정합니다. 각 히스토그램에 대한 분석 경계를 설정흠없는 셀의 밝은 2 %에 해당.
- 단계 3.2 3.3 년에 설립 어떤 색 보상 및 HV 설정을 사용하지, FSC, SSC와 모든 4 형광 감지기에서 신호를 수집, 튜브 2 데이터를 수집. PKH26 형광을 모니터링하는 데 사용되는 검출기를 들어, 마지막으로 채널에 몇 / 아니오 세포로, 모든 PKH26 POS 세포는 3 -4 번째 시대에서 하나의 대칭 정상으로 규모에 표시되는지 확인합니다. 거기에 여러 봉우리가 또는 최고 모양이 왜곡되는 경우, 최소화 및 혼합 기술 (그림 2) 솔트 세심한주의와 함께 1 단계를 반복합니다. 필요한 경우, 염료 농도를 조정합니다.
- 단계 3.3 년에 설립 된 설정을 사용 FSC, SSC와 모든 4 형광 감지기에서 신호를 수집 관 3 데이터를 수집. 7 AAD의 형광을 모니터링하는 데 사용되는 검출기를 들어, 7 AAD POS 세포 (비 가능한 세포가 잘 해결 즉, 단계 3.3 년에 설립 된 2 %의 경계 위에 떨어질 있는지 확인가능한 7 AAD 제외 세포에서).
- 단계 3.3 년에 설립 된 설정을 사용 FSC, SSC와 모든 4 형광 감지기에서 신호를 수집 관 4 데이터를 수집. CD8 POS 세포가 잘 흠없는 세포 (즉, FITC 검출기에 대한 단계 3.3 년에 설립 된 2 %의 경계 위의 가을)에서 해결되었는지 확인합니다. 튜브 5 반복하고 CD8 POS 세포가 잘 흠없는 세포 (예를 들면 가을 APC 감지기를위한 단계 3.3 년에 설립 된 2 %의 경계 위)에서 해결되어 있는지 확인합니다.
- 단계 3.3 년에 설립 된 사용 설정, FSC, SSC와 모든 4 형광 감지기에서 신호를 수집 튜브 6, 7, 8에 대한 데이터를 수집.
- 튜브 1-5와 다른 세 fluorochromes를 모니터링하는 데 사용되는 감지기의 각 fluorochrome에 대한 행렬을 겹치는 색상을 설정하려면 색상 보정 소프트웨어를 수집 목록 모드 파일을 사용합니다. 샘플 6 목록 모드 파일에이 행렬을 적용하고 확인이 PKH26 연구소의 존재eling는 7 AAD POS 세포를 감지 할 수있는 기능을 변경하지 않습니다.
- ) 3 잘 해결 subpopulations합니다 (3 번 CD 제외의 CD4 제외, 3 번 CD POS CD4 제외하고 3 번 CD POS CD4 POS) FITC 대에서 확인할 수 있습니다 : 색상 샘플 7 목록 모드 파일에 단계 3.8에서 행렬을 중복 확인 신청 APC 점 플롯, 그리고 반에는 3 번 CD-FITC 및 안티 CD4-APC의 b)는 존재는 7 AAD POS 세포를 감지 할 수있는 기능을 변경하지 않습니다. 반에는 3 번 CD-FITC의 존재가 PKH26 검출기에서 수집 데이터에 대한 상위 2 %의 경계를 변경하는 경우, 필요에 따라 경계를 재조정.
- 단계 3.8의 샘플 8 목록 모드 파일에 색 중복 행렬을 적용합니다. PKH26 라벨의 존재 단계 3.3에서 autofluorescence 컨트롤을 사용하는 세트에서 FITC, 7 AAD 또는 APC 감지기에 대한 2 %의 경계를 변경하는 경우, 표 1의 관 7을 사용 필요에 따라 경계 (이거 야)를 재조정하고 확인 그게 아직 disting 할 수 있습니다uish에는 3 번 CD POS CD4 POS, 3 번 CD POS CD4 제외하고, 3 번 CD 제외의 CD4 제외 전지는 조정 된 경계 (이거 야)를 사용하여.
4. 염료 희석하여 전지 부문 모니터링을위한 확산 모델 선택
- 당신의 cytometer에 채널과 로그 수십 년의 수에 따라 달라집니다 세대 사이의 간격을 결정합니다. 디지털 기기를 들어,이 값은 일반적으로 4 ~ 5 년은 디지털 신호 프로세서에서 용기의 수에 의해 결정됩니다. 아날로그 악기에서 수십 년의 수는 거의 전체 숫자입니다 위치를 정확하게 모델링은 실험적으로 결정되는 수십 년의 정확한 숫자가 필요합니다. 이 작업을 수행하려면 제조업체 할당 상대적 농도로 보정 된 형광 구슬의 혼합물의 데이터는 실험에 사용 된 동일한 검출기 높은 전압 설정에서 획득됩니다. 구슬 봉우리의 위치는 정수의 관점에서 로그 눈금의 교정이 가능로그 10 년마다 ensity 범위. 특히, 이것은 제조업체 할당 된 값의 로그에 대해 각 구슬 유형에 대한 채널 번호를 음모에 의해 이루어집니다. 비드 데이터 값에 대한 최적 직선의 기울기는 채널 당 상대 강도 단위의 수를 제공합니다. 채널의 수를 곱한 값,이 값은 다음 강도의 두 배 감소 (즉, 딸이 생성 간격)에 해당하는 채널의 수는 14으로 계산 할 수있는 전체 규모에 대한 로그 수십 년의 수, 될 것입니다.
- 세대 간의 고정 된 간격을 사용하거나 간격이 떠 허용할지 여부를 결정합니다. 표준 (고정) 설정은 각 세대의 위치를 지정하는 단계 4.5에서 결정된 세대 간격 값을 사용하며, 히스토그램이 뚜렷한 봉우리가 부족하면 일반적으로 사용됩니다. 플로트 설정은 각 세대 피크의 위치는 히스토그램 모양에 의해 결정 할 수 있습니다 언제 distinguishabl 일반적으로 사용됩니다전자 세대 봉우리가 분명 있습니다.
- 모든 세대 또는 부동 너비를 고정 피크 폭을 사용할지 여부를 결정합니다. 고정 폭은 모든 세대를 모델로 unstimulated 컨트롤 샘플의 SD는 계산 사용하여 샘플 구별 세대 봉우리가 부족하면 일반적으로 선택됩니다. 부동 폭이 프로그램은 독립적으로 각 세대의 SD을 변경할 수 있으며 가장 구별 세대 봉우리과 함께 사용됩니다.
- 확산 분석 모듈 (여기 ModFit LT 버전 3.3)이 포함 된 프로그램을 실행을 클릭합니다. (예를 들어, 표 1 관 8로 counterstained PKH26 POS 세포의 자극을 96 시간 문화) 분석하도록 설정 데이터를 자극 PKH26 POS 파일을로드합니다.
- 이 경우 가능한에 출입을 금지 PKH26 (42분의 585) (7 AAD 제외)에는 3 번 CD POS 림프구와 작은 파편 및 대형 집계 (그림 3)을 제외 FSC 대 SSC에, 분석에 대한 매개 변수를 선택합니다. 정의에이 지역은 폭발는 일반적으로 발견되는 높은 기대 분산 지역을 포함하고 3 번 CD 표현이 자극을 문화 속에서 변조 될 수 있습니다에주의해야합니다.
- 확산 마법사를 사용하여 새 확산 모델을 만듭니다. 개방형 데이터 파일 (시작 탭)을 사용하여 unstimulated PKH26 POS 제어 파일을로드하고 나눌 세포에 해당하는 부모의 분포에서 피크 채널의 위치를 정의합니다.
- 부모 피크 위치와 폭 (표준 편차)에 대한 값을 지정하고 unstimulated PKH26 POS 컨트롤에 대한 파일을 분석합니다. 고정 피크 폭 (SD)가 필요하다면, 잠금 SD를 선택합니다.
- PKH26 제외 제어 (예를 들어, PKH26 제외 세포의 96 시간 문화 표 1 관 7로 counterstained)을로드합니다. PKH26 제외 컨트롤 위의 dimmest 세대를위한 정상 채널을 설정하여 세대의 수를 조정합니다. 이것은 뉴를 결정모델이 정확하게 넣을 수 딸 세대의 mber하고 일반적으로 6-9 세대입니다.
- 자극 샘플에 대한 데이터 파일을 (예를 들어, 표 1 관 8과 같은 counterstained PKH26 POS 세포의 자극을 96 시간 문화) 열고 단계 4.7에 정의 된 부모 피크 위치와 SD의 영역은 변경되지 않습니다되었는지 확인합니다. 고정 세대 간격이 필요하다면, 표준 모델 옵션을 선택하고, 그렇지 않으면 떠 옵션을 선택합니다.
- 단계 4.9에 정의 된 동일한 모델을 사용하여 데이터 집합에있는 각 실험 파일을 분석합니다. 모두 시각 및 감소 치 광장 (RCS) 값에 의해 정의 된 부모 피크 위치에 사소한 조정에 가장 적합한 맞춤을 위해 필요할 수 있습니다.
- 데이터 집합의 각 실험 파일에 대한 최적으로 인해 원하는 확산 통계를 기록합니다. 가능한 통계의 포괄적 인 설명을 보려면 참조를 참조하십시오. 22.
결과
PKH26 같은 막 염료는 세포 멤브레인에보다는 화학 반응 (CFSE) 또는 평형 바인딩 (항체)을하여 가까운 순간 파티션으로 얼룩. 그림 1에서 설명하는 중요한 문제에 관심의 부족은도 2에 도시 된 유형의 희미하거나 이기종 착색 될 수 있습니다. 반면, (그림 1, 표 2) 최적화 된 라벨 조건의 염료 희석 (그림 3)에 따라 세포 분열 모니터링을 포함한 셀 추적 응용 프로그램의 다양한 적합 밝은 균일 한 분포의 결과를 사용합니다. 죽은 / 죽어 셀 폭이 넓어 및 / 또는 왜곡 딸이 생성 농도와 염료 희석 3,4,16,18에 따라 확산 모델링을 복잡하게 할 수 있습니다 추적 염료의 양을, 다양한 잃게됩니다. 죽은 세포의 중요한 번호는 미리 할 수 있습니다 조건 하에서 염료 희석 데이터를 수집 할 때 생존의 염료의 사용은 따라서 권장합니다이러한 자극의 문화 (그림 3) 이상 표본 (그림 4)로 보냈습니다.
염료 라벨을 추적하는 것은 일반적으로 형광 강도에게 immunophenotyping보다 더 큰 규모의 여러 주문을 할 수 있기 때문에 적절한 보상 컨트롤 (표 1)를 포함하고 염료를 추적의 존재가 항체 긍정적이고 부정적인 세포를 (그림 해결 할 수있는 능력을 저해하지 않는 있는지 확인하는 것이 중요합니다 4). 과도한 색상 보정의 필요성을 방지하려면, 그것은 추적 염료에 인접 스펙트럼 채널에 밝은 fluorochrome, 또는 라이브 세포에 의해 제외 염료로 관심 세포에서 찾을 수 없습니다 하나 (들)을 배치 바람직합니다 (그림 4A & B VS. 4C & D). 적합한를 획득, 확산의 정도를 수량화하기 위해 최대 모델링 소프트웨어를 사용하는 경우는 염료 희석 교수의 특성에 모델 내에서 일치 가정을 필요로iles는 (그림 5 표 3) 분석된다. 추적 염료와 생존의 시약의 적절한 선택과 동시에 여러 림프구 subpopulations에 proliferative 응답을 특징하는 것도 가능합니다. 그림 6에 도시 된 바와 같이 예를 들어, 둘째 추적 염료의 추가는 규제 T 세포 (CellVue 피와 함께 표시) 및 높은 확산 효과기 T 세포 사이의 차별을 단순화 (CFSE로 표시)과 얻을 수있는 것보다 자신의 상호 작용에 대한 훨씬 더 자세한 정보를 제공합니다 3 H-thymidine 라벨 18,27을 사용합니다.
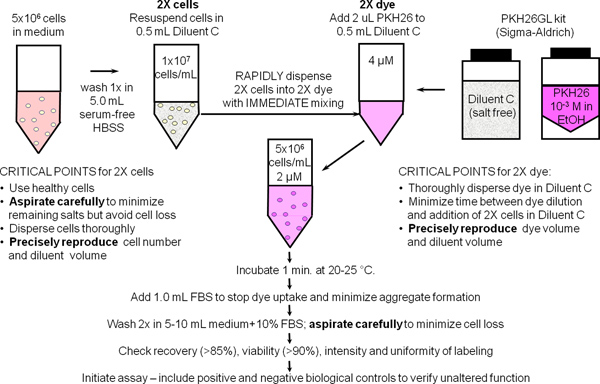
1 그림. PKH26, PKH67 및 CellVue 염료 일반 멤브레인 라벨 프로토콜. 세포 membra에 이러한 높은 lipophilic 염료의 파티션선은 착색이 염료 용해도 및 착색 효율을 극대화하기 위해 제공 소금 무료 희석제 C 차량에서 수행되는 세포와 혼합시 즉시 근본적으로 발생합니다. PKH26와 일반 막 라벨이 도식에 요약으로, 밝고, 균일하고 재현 착색 따라서 가장 쉽게 얻은 것입니다 : 1) 처리됩니다 혼합 기술을 사용) 착색 단계 2에서 제시 단백질 및 / 또는 소금의 양을 최소화 염료의 세포의 급속한 균일 한 분산 (즉, 동시에 염료의 동일한 농도에 대한 모든 세포를 제공합니다).
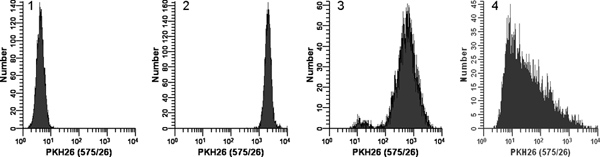
그림 2. PKH26 형광 배포판 (참조에서 재. 18)에 대한 조건을 얼룩의 효과는. logarithmically 성장, 교양 U의 샘플을 복제이나 염료를 2 배하는 배 세포의 추가에 따라 즉시 혼합하지 않고, 주위 온도에서 3 분을 위해 : - 937 세포는 PKH26 (15 μM PKH26 1 개 10 7 세포 / ML, 12 최종 농도) 물들되었습니다. 세척 후, 스테인드 세포는 일정한 악기 설정을 사용하여 Beckman 보습 바로 앞에 달린 풀 베는 날 시안 흐름 cytometer에 분석 된 히스토그램 1. PKH26 검출기 전압 흠없는 컨트롤이 몇 / 더 셀 첫 번째 채널에 축적되지과 함께 첫 10 년에 규모의 모든 셀을 배치 조정. 히스토그램 2 : 즉시 혼합으로 염료를 배에 배 셀의 추가를 사용하여 15 μM의 염료의 염색은 몇 / 마지막 채널에 축적없이 세포 (gMFI =와, 밝은, homogenously 스테인드, 네 번째 년대에 배치 세포의 대칭 인구 결과 . 2,548, gCV = 26.2 %) 히스토그램 3 : 염료를 배에 배 셀의 추가를 사용하여 15 μM의 염료에 있지만, 즉각적인 혼합없이 착색이 감소 강도를 높이고 폭 넓은 CV (gMFI = 505 , gCV은 = 116 %)뿐만 아니라 관의 벽에보다는 2 배 염료 솔루션에 투여 셀의 드롭로 인해 어렴풋이 스테인드 subpopulation, 히스토그램 4. 착색 오류가 농축 에탄올 염료의 3 μl으로 이어 재고가 더 오히려이 12 μm의 최종 염료 농도의 결과 희석제 C.의 2 배 염료 솔루션을 준비하는 데 사용되는보다 혼합하지 않고 희석제 C의 세포를 배에 직접 추가하지만, 매우 희미하고 이기종 착색을 (준 될 gMFI = 32.9, gCV = 1천20퍼센트). 바로 왜곡 가능성이 가장 높은이의 결합 효과를 반영 관찰 : 나는) 그 불쌍한 널리 서로 다른 전지 및 염료 볼륨으로 인해 혼합을, 및 II) 염료 분배 지점에 가장 가까운 셀이 더보다는 염료의 높은 농도에 노출 될 사실 거리. 큰 그림을 보려면 여기를 클릭하십시오 .
다시 3 "SRC ="/ "구경 : 콘텐츠 폭 ="files/ftp_upload/4287/4287fig3.jpg 4.5in "강한 : SRC ="/ files/ftp_upload/4287/4287fig3highres.jpg "/>
그림 3. 생존 프로브를 사용 T 세포 증식 프로파일의 게이팅을 간단하게 hPBMC이 PKH26 (최종 세포 농도 : 3x10 7 / ML, 최종 염료 농도 : 10 μM)으로 표시되었습니다.. 96 앞에서 시간 (자극) 또는 반에는 3 번 CD와 IL-2의 부재 (unstimulated)에 대한 문화 후 세포가 반에는 3 번 CD-FITC, 항 CD19-APC와 7 AAD과 counterstained했고,에 분석 하였다 FACSCalibur 흐름 cytometer (자세한 내용은 참조 13 참조). 색상 보정은 고정 배선 보상 회로를 사용하여 데이터 수집시 수행되었다. ModFit LT3.3에 확산 마법사를 사용하여 4 단계에 설명 된대로 확산의 정도는 모델링되었습니다. PKH26 제외 제어 (표 1, 튜브 7)의 데이터가 참조 (열 3의 회색 가득 histograms)에 중첩됩니다. unstimulated에 대한 Viabilities 및 STImulated 문화 76%과 62 % (패널 ungated 데이터를 A와 B, 각각)했다. 중간에 96 시간을위한 배양 패널 A. PKH26 스테인드 세포가 가능한 (7 AAD 제외)에는 3 번 CD POS 세포를 (R1) 포함 출입을 금지했다. 항체를 포함하고 7 AAD 죽은 세포 제외 게이트뿐만 아니라, 앞으로 분산 (FSC) 대 측 분산은 (SSC) 문은 (R2) 파편과 집계를 제외하는 데 사용되었다. 이 패널의 마지막 음모의 죽은 세포의 부재를 확인합니다. PKH26 확산 프로파일 (열 3) 가장 적합한 모델은 RCS = 2.1 (기부 6, 표 3)를 나타내는 좋은 대칭으로 하나의 피크를 주었고, 부모의 위치를 정의하는 데 사용하고 자극의 분석을 위해 최대 폭을 시작했다 이 데이터 세트 (패널 B)에서 샘플. 패널 B.는 PKH26 스테인드 세포의 복제 나누어지는이 떠있는 최고 위치에있는 A. 모델 패널에서와 같은 방법으로 96 시간 및 개폐에 반에는 3 번 CD와 IL-2와 교양 및 부동 피크 폭주고 RCS = 1.3 (기부 6, 표 3). 패널 C.는 7-AAD 데이터를 사용하지 않고 분석 된 패널과 같은 데이터 파일을 사용하여 해당 데이터에 대한 가장 적합한. 주요 FSC 대 SSC가 부분적으로 죽은 세포 및 집계 (R2)와 3 번 CD 긍정적 인 이벤트를 (R3)을 선택 할 수있는 보조 문을 제외하는 데 사용되었을 때, 죽은 세포의 작은 잔류 인구는 (출입을 금지 사건의 0.2 %) 있었다. 가장 적합한 모델은 (게이트 사건의 1.29 %) 자극 예제에서 죽은 세포의 큰 잔류 인구를 참고 패널 C.에서와 같이 패널에서와 같이 B 출입을 금지했다 RCS = 2.2. 패널 D. 동일한 데이터 파일에 하나의 피크 준 이 게이팅 전략. 가장 적합한 모델은 부동 피크 위치 및 부동 피크 폭 (RCS는 = 1.3)의 하나였습니다. 더 큰 그림을 보려면 여기를 클릭하십시오 .
ig4.jpg "강한 : 콘텐츠 폭 ="5in "강한 : SRC ="/ files/ftp_upload/4287/4287fig4highres.jpg "/>
4 그림. fluorochrome 선택과 PKH26으로 표시 immunophenotype의 림프구에 대한 능력 염료 농도의 효과. hPBMC는 24 시간 이전 혈액에서 분리 착색는 12 X 75mm 둥근 바닥으로 수행되었는지를 제외하고, 1 단계의 설명 PKH26와 라벨이 붙지 만 폴리스티렌 튜브보다 12 X 75mm 원뿔 폴리 프로필렌 튜브보다. 즉시 PKH26와 라벨 후, 세포는 지정된 immunophenotypic과 생존 시약과 counterstained, 그리고 그림 3A의 게이팅 전략 다음과 같은 광학 구성하여 LSRFortessa 흐름 cytometer에 분석 하였다 : 488 nm의 레이저 : FSC-A을 (488 nm 정도), SSC - A (10분의 488 BP), FITC-A (30분의 530 BP), PKH26-A (26분의 575 BP), 7-AAD-A 또는 PerCP-A (40분의 695 BP). 640 nm의 레이저 : APC-A 또는 TOPRO-3-A (14분의 670 BP). 색상 보정은 BD 디바 소프트웨어를 사용하여 데이터 수집시 수행되었다. "자동"(패널 C와 D를위한 A와 B, PerCP 패널 APC) 관련 스펙트럼 창에서 노 항체 제어 autofluorescence 나타냅니다. PKH26 제외 제어 (표 1, 튜브 7)의 데이터가 참조 (회색 가득 histograms, 칼럼 (5))에 중첩됩니다. 후 염색의 viabilities는 모든 샘플 (88-92%)에 비슷. 2 μm의 최종 농도에 PKH26으로 표시 패널 A. 셀 안티 - 3 번 CD-FITC, 항 CD4-APC, 7-AAD (를 사용하여 counterstained되었습니다 튜브 표 3의 8). 가능한에 게이팅 (7-AAD 제외)에는 3 번 CD POS의 림프구 (열 1) 파편과 FSC와 SSC (그림 3A 참조)에 따라 집계의 제외하면 PKH26 강도는 APC의 CD4 (열 2, 3)과 함께 평가되었습니다. uncompensated (열 2) 또는 (열 3) 보상 여부,이 fluorochrome 조합) CD4 POS T 세포와 CD4 제외 T 세포 사이 좋은 해상도의 결과 등을 모두 금지에 의해 확인ntibody, autofluorescent 제어 (표 1 관 6, 열 4)과 3 번 CD VS의 2 색 줄거리. CD4 (열 6). 패널 B. 패널에서 동일한 fluorochrome 조합으로 사용하지만, 4 μM의 마지막 PKH26 농도를 증가에 악영향 CD4 제외 T 세포에서 CD4 POS T 세포를 해결 할 수있는 능력에 영향을 미치지 않았다. 패널 C. 독립적으로 2 μm의 최종 농도에 PKH26 라벨이 세포의 복제 나누어지는이 반에는 3 번 CD-FITC, 항 CD4-PerCP 및 TOPRO-3를 사용하여 counterstained되었습니다. 가능한 (TOPRO-3 제외)에는 3 번 CD POS 림프구 (열 1) 파편과 FSC와 SSC (그림 3A 참조)에 따라 집계의 제외에 대한 게이팅 후, PKH26 강도가 반 CD4-PerCP (열 2와 함께 평가되었다 3). PerCP 채널에 PKH26의 상당한 스펙트럼 오버랩은 uncompensated 데이터 (열 2) 분명하고, PKH26 POS의 CD4 사이의 해상도 POS 및 PKH26 POS의 CD4 제외 이벤트가 한계입니다. 패널 D.는 PKH26 집중은 4 μM로 증가되면 가능한 더 이상 없습니다 PerCP 채널로 PKH26에서 패널 C. 스펙트럼 중복의 fluorochrome 조합을 사용하는 것은 CD4 (열 2) CD4에서 신호의 강도를 초과하는 POS PKH26 POS 이벤트가 더 이상 CD4에서 제외 PKH26 POS T 세포 (칼럼 (3) 해결 할 수 없습니다 VS. 열 4). 더 큰 그림을 보려면 여기를 클릭하십시오 .
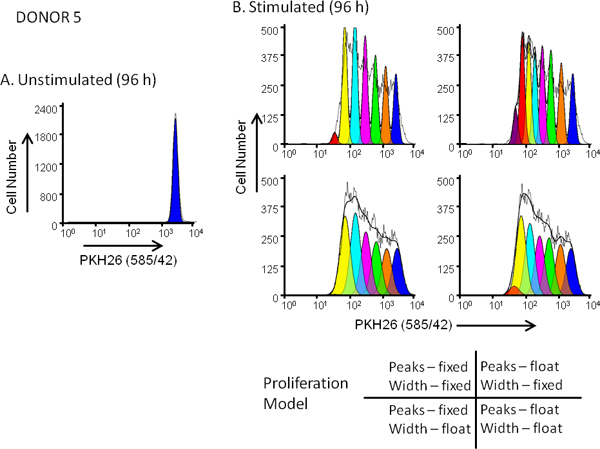
그림 5. 에 확산 모델 선택의 영향. 염료 희석 프로파일에 맞는의 선은 hPBMC는 PKH26 (:; 최종 염료 농도 3x10 7 / ML : 10 μM 최종 세포 농도)로 분류되었습니다. 96 앞에서 시간 (자극) 또는 반에는 3 번 CD와 IL-2의 부재 (unstimulated)에 대한 문화 후, 세포가 반에는 3 번 CD-FITC, 항 CD19-APC와 FACSCalibur에 7 AAD 및 분석과 counterstained 수확했다 흐름 cytometer (자세한 방법에 대한 참고 13 참조). 색상 보정은 고정 배선 보상 회로를 사용하여 데이터 수집시 수행되었다. 패널도 3a에 표시되고 ModFit 확산을 제공하기 위해 사용되는. 기부자 5, 중간 응답에 대한 unstimulated 96 시간의 문화에서 PKH26 강도 프로필 출입을 금지했다 . 패널 B 전적인 부모의 셀을 나타내는 피크에 대한 위치와 폭의 첫 번째 추정과 마법사. 병렬에서 PKH26 강도 프로파일을 96 시간 문화를 자극은에서 시작 견적을 사용하여 분석되었다그림과 같이 연속 딸 세대를위한 패널과 4 고정 또는 부동 최고 농도에 해당하는 '확산 마법사'설정의 다른 조합, 그리고 고정 또는 부동 피크 폭을. 으로 표 3, 관측 데이터에 가장 적합한 준 모델에 요약 (최저 감소 치 평방, RCS) 정상 위치뿐만 아니라 딸이 생성 봉우리 표준 편차뿐만 아니라 허용 된에서 "부동 / 유동"조합했습니다 다양합니다 (RCS = 1.5). 같은 모델은 기부자 6, 높은 응답 (그림 3B 및 표 3)에 대한 가장 적합한했다.
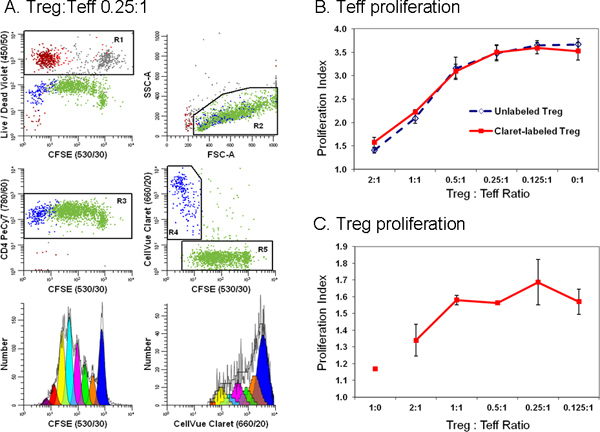
6 그림. 두 번째 셀 추적 염료의 추가는 유동 cytometric 억제 분석에 효과기 및 규제 T 세포 사이의 차별을 단순화. TRIMA leukapheresis 필터에 준비 단핵 세포 - 고갈 림프구가 안티 CD127-PE, 항 CD4-PE-Cy7 물들되었다 (. 18 참조에서 적응), 및 안티 CD25-APC와 흐름 이펙터 (Teff의 인구로 분류, CD4 POS CD127 밝은 CD25 흐린), 규제 (Treg, CD4 POS CD127 희미 CD25 POS) 및 액세서리 (CD4 제외) 세포. CFSE (최종 세포 농도 : 5 × 10 7 / ML, 최종 염료 농도, 5 μM)로 표시하고 정렬 Teff :; CellVue 피 (1 μM 최종 염료 농도 1x10 6 / ML 최종 세포 농도)로 표시된 정렬 Treg 세포였다 반에는 3 번 CD, 항 CD28 및 방사능 액세서리 세포의 존재에 비율을 변화에 공동 배양 하였다. 96 시간 후, 문화가 수확 된, 항 CD4-PE-Cy7 죽은 / LIVE 고칠 누나와 함께 counterstained, 그리고 LSRII 흐름 cytometer 및 색상 보정을 분석의 데이터 acquisitio시 수행 된N BD 디바 소프트웨어 (보상 제어 등의 자세한 내용은 참조 18 참조)를 사용하여. 4 단계에 설명 된대로 Teff와 Treg의 확산 지수는 ModFit LT3.3에 확산 마법사를 사용하여 모델링되었다. 패널 B와 C의 데이터 요소는 세중의 샘플의 평균 ± 1 표준 편차를 나타냅니다 패널 A. 대표 데이터가 Treg 세명 세중의 샘플 중 하나에 표시됩니다 :. 0.25:1의 Teff 비율입니다. 다른 모든 데이터 플롯에서, LIVE / 죽었 고칠 보라 시약은 죽은 세포 (= 붉은 갈색, nonviable Teff = 회색 nonviable Treg = 붉은 색 액세서리 세포 R1, 왼쪽 상단 줄거리)을 제외하는 데 사용되었다. CellVue 피에 착색이 가능한 Treg을 (R4, 가운데 오른쪽 줄거리, 파란색) 구별하는 데 사용 가능한뿐 아니라 매우 Teff을 (R5, 가운데 오른쪽 줄거리, 녹색) 확산. Teff (왼쪽 아래 플롯)에 대한 하나의 매개 변수 CFSE 확산 프로필이 CFSE POS (R5), 실용적 CD4 POS (R3), (하지 R1)이었다 세포에 게이팅에 의해 생성하고, 림프구 SC가 생겼 대요atter 서비스 (R2). Treg을위한 하나의 매개 변수 CellVue의 피 확산 프로필이 CellVue 피 POS (R4), 실용적 CD4 POS (R3), (하지 R1)이었다 세포에 게이팅에 의해 생성하고, 림프구 분산 속성 (R2)를 가지고했습니다. 림프구 폭발을 포함하도록 정의 된 관대 한 림프구 지역 (R2)를합니다. 수집 할 셀의 총 관심의 가장 낮은 주파수 인구에 따라 달라집니다 수도 있습니다. 관심 인구가 7 ~ 8 세대 셀의 다수의 최대 나타내는 농도의 넓은 범위에 걸쳐 분산 될 수있는 세포 증식 실험에서 정확하게 모델링하고 각 세대에있는 셀의 개수를 계산하기 위해 수집해야합니다. 희귀 한 세포를 연구 할 때, 단순히 이벤트의 최대 수를 수집하기 위해 거의 건조 샘플 튜브를 실행해야 할 수도 있습니다. 샘플 여기에 표시를 들어,이 일을하면 11923이 Teff 된 중 ~ 25000 이벤트 (확산 I의 총 결과ndex 3.85)과 1380은 Treg (확산 지수 1.83)이었다. 패널 B. 예상대로, Teff의 세포 증식의 큰 억제으로 이어 공동 문화에 Tregs 존재의 비율을 증가합니다. 비슷한 결과가 효력을 Treg에 영향을주지 않은 CellVue 피 추적 염료와의 착색을 나타내는 CellVue 피 묻은 (실선) 또는 흠없는 (점선) Treg 모두 획득했다. 패널 C. Treg이 예상대로 상대적으로 anergic하고, 한 Teff 세포의 부재 (: 1시의 Teff 비율 Treg)의 반에는 3 번 CD, 항 CD28 및 액세서리 세포와 incubated 때 세포 분열 따위에 의해 번식 수 없습니다. 그러나, 공동 문화에 Teff 존재하는 비율 (즉, Treg 등 : Teff 비율이 감소) 증가, Treg 확산의 범위도 증가했다. 적어도 부분에서 이러한 데이터에 대한 일반적으로 큰 오차 막대는 불확실 Teff를 기준으로하고 더 수집 이벤트의 작은 숫자로 이어지는 확산의 제한된 범위를 반영각 세대에 세포의 수를 모델링에 타이. 큰 그림을 보려면 여기를 클릭하십시오 .
| 튜브 번호 (목적) | PKH26 | 항체 (이거 야) | 7-AAD |
| 1 (설정, 보상) | - | - | - |
| 2 (설치, 보상) | + | - | - |
| 3 (설치, 보상) | - | - | + |
| 4 (보상) | - | CD8-FITC B | - |
| 5 (보상) | - | CD8-APC B | - |
| 6 (없음 AB 제어) | + | - | + |
| 7 (없음 추적 염료 죄수trol) | - | 3 번 CD-FITC CD4-APC 또는 CD19-APC C | + |
| 8 (T0 제어) | + | 3 번 CD-FITC CD4-APC 또는 CD19-APC C | + |
. 표 1 악기 설정을 조정을 사용하여 4 색 CD4 T 세포 증식 모니터링 분석에 적합한 나열된 컨트롤 :. PKH26 (확산 염료), 3 번 CD-FITC (팬-T 세포의 마커), CD4-APC (T-도우미 세포 마커), 7 aminoactinomycin D (7 AAD, 죽은 세포 제외) 나 3 번 CD-FITC와 CD4-APC에 대한 밝은 surrogates (보상 오류를 감지하는 가장 좋은 능력) C 그림 3 :.. 3 번 CD-FITC와 CD19-APC. D 그림 4 : 3 번 CD-FITC와 CD4-APC.
| 셀 유형 | 최종 세포 농도 | 최종 염료 농도 </ strong>을 | 참고 |
| hPBMC B | 1 개 10 7 / ML | 2 μM PKH67 | 10,17 |
| 5 × 10 6 / ML | 2 μM PKH26 | 12 | |
| 3 × 10 7 / ML | 10 μM PKH26 | 13 | |
| 5 × 10 7 / ML | 30 μM PKH26 | 18 | |
| 1 × 10 6 / ML | 1 μM의 CellVue의 피 C | 18 | |
| 3 × 10 7 / ML | 4 μM CellVue의 피 | 13 | |
| 5 × 10 7 / ML | 5 μM CellVue의 피 | 18 | |
| 문화의 셀 | 5 × 10 5 / ML | 0.1 μM PKH26 (1 ° 유방 세포) | 8 |
| 1 개 10 7 / ML | 15 μM PKH26 (U937) | 18 | |
| 1 개 10 7 / ML | 12.5 -15 μM PKH26 (U937) | 15 | |
| 1 개 10 7 / ML | 1 μM PKH67 (K562) | 18 | |
| 1 개 10 7 / ML | 1 μM PKH67 (T 세포 라인) | 9 | |
| 1 개 10 7 / ML | 10 μM의 CellVue의 피 (냑-1) | 23 |
표 2. 비 Perturbing 막 염료의 염색 조건. 적응 및 참조 업데이트 될 수 있습니다. 18. B 저속 세척 (300 XG)이 혈소판 오염을 최소화하기 위해 사용되었습니다. C Treg 세포는 (흐름 정렬 CD4 POS POS CD25 CD127 제외의 림프구).
| 모델 설정 | 모델 결과 | ||||||||
| 기증자 | 치료 | 피크 위치 | SD | 부모 위치 | 부모 SD | # 봉우리의 마감 | RCS | PI | PF |
| 5 | Unstimulated | 뜨다 | 뜨다 | 209 | 4.5 | 1 | 5.1 | 1.0 | 0 |
| 5 | 자극 | 고정 | 고정 | 209 | 4.5 | 7 | 35 | 3.9 | 31 |
| 5 | 자극 | 뜨다 | 고정 | 209 | 4.5 | 8 | 19 | 4.3 | 30 |
| 5 | 자극 | 고정 | 뜨다 | 209 | 9.2 | 6 | 1.9 | 3.8 | 30 |
| 5 | 자극 | 뜨다 | 뜨다 | 209 | 9.0 | 7 | 1.5 | 3.7 | 29 |
| 6 | Unstimulated | 뜨다 | 뜨다 | 205 | 4.0 | 1 | 2.1 | 1.0 | 0 |
| 6 | 자극 | 고정 | 고정 | 205 | 4.0 | 6 | 42 | 6.6 | 60 |
| 6 | 자극 | 뜨다 | 고정 | 205 | 4.0 | 7 | 12 | 7.4 | 60 |
| 6 | 자극 | 고정 | 뜨다 | 205 | 8.6 | 6 | 6.9 | 6.8 | 62 |
| 6 | 자극 | 뜨다 | 뜨다 | 205 | 6.5 | 6 | 1.3 | 6.5 | 59 |
표 3. 맞춤의 신 이여 (RCS) 및 확산 통계 그림 3A & B에 설명 된대로. 샘플 염색, 데이터 수집 및 게이팅에 확산 모델의 영향.
토론
여기에 설명 된 방법은 대부분 안정적으로 막 염료에게 13,16,18를 사용하여 hPBMC 라벨링와 막이나 단백질 염료 2,11,13,16을 사용하여 림프구 집합의 phenotyping과 확산 추적을위한 최적의 결과를 제공하기 위해 결합 된 실험실에서 발견 한 아르 18. 도 1 및도 2에 도시 된 바와 같이, 밝은 균일 한 라벨이 가장 쉽게 physiologic 소금의 존재를 제한하고 혼합 기법을 사용하여 달성된다 염료의 동일한 농도에 대한 모든 세포의 급속한, 균일 한 노출의 결과가. 막 염료로 착색은 지질 이중층에 파티션으로 발생하기 때문에, 무료 염료 농도를 변경 다른 변수는 라벨의 효율성에 영향을 미칠 수 있습니다. 예를 들어, 이전 희석제 C의 resuspension에 소금을 덜 효율적으로 유실에 둥근 바닥 폴리스티렌 튜브 결과에 라벨 있으며, 특히, 튜브 벽에 흡착 색깔을 사용하기 때문에 감소 무료 염료 농도낮은 염료 농도에서. 두 요인은 원추형 바닥 폴리 프로필렌 튜브를 (도 3, 4 및 사용 라벨이 완료되면보다 폭 넓은 착색 분포를 제공하는 경향이 게시되지 않은 결과). 최적화 된 착색 절차를 사용하는 경우에도 샘플 연령과 유형도 최대 폭에 영향을 미칠 수 있습니다. 예를 들어, 24 시간 이전의 혈액 샘플이나 TRIMA pheresis 필터 범위로부터 격리 림프구에 대한 CVS 반면 14~20%에서 갓 그려 혈액 범위 (그림 3, 참조. 13되지 않은 결과)에서 분리 PKH26 POS의 림프구에 대한 CVS 25-30에서 % (그림 4 참조. 18).
균일 및 비 가능한 세포 분석에서 제외 모두 구별의 딸 봉우리가 차례로 관측 데이터 (그림 5와 6에 맞게 확산 모델의 선택에 영향을 미치는 염료 희석 프로필에서 분명 여부에 영향을 될 수있는 범위를 더럽히는 것 ). ModFit (진실성 소프트웨어 하우스, Topsham, ME)이 같은 확산 지수와 전구체 주파수 (도 3, 5, 6, 표 3)과 같은 통계를 생성하는 데 사용되는 소프트웨어의 한 예로서 여기에 사용되지만, 다른 소프트웨어 패키지는 모듈 분석이 포함 확산 데이터입니다. 이 포함 FCSExpress (드 노보 소프트웨어, 로스 앤젤레스, CA)과 FlowJo (트리 스타 주식회사, 애쉬 랜드, OR). 이러한 프로그램은 모두 반복적 위치, 높이와 순차 딸이 세대를 대표하는 가우스 피크의 SD (또는 폭)을 변경하여 원시 데이터에 가장 적합한를 찾을 비선형 최소 제곱 분석을 사용합니다. Proliferative 지수 (PI) 및 전구체 주파수 (PF)는 확산의 범위에 가장 일반적으로 사용되는 조치입니다. 로 ModFit에 의해 정의 된 PI는 thymidine의 호응을 분석의 '자극 지수'와 유사한 분석의 과정 동안 세포 수의 증가,을 측정하기위한 한 방법입니다. PF는 초기 populat에 세포의 일부를 반환proliferating하여 자극에 반응 이온. 용어는 소프트웨어 패키지 (예를 들어, FlowJo 및 ModFit는 "확산 지수 '을 뜻합니다에 대해 서로 다른 정의와 계산을 사용하여) 22 중 다소 차이가 있기 때문에 기사를 읽을 때주의 그러나, 권장합니다.
단백질 염료를 사용할 때 막 염료와 라벨링과 확산 분석을 보시려면 여기를 논의 중요한 문제도 발생하고 있습니다. 예를 들어, 혼합 기술에 대한 세심한주의도 CFSE (그림 6) 2-4,13,18,24를 사용하면 균일 한 분포와 구별 딸이 봉우리를 얻기 위해, 죽은 / 죽어 세포의 배제와 함께 준수해야합니다. phenotyping 및 생존 능력 평가를위한 fluorochromes의 적절한 선택은 특히 같은 CFSE 2-4,11,13,16,18와 같은 눈에 보이는 발광 단백질 염료와 함께 과도한 스펙트럼 중복 및 항체 양성 세포를 인식 할 수 없다는를 방지하는 것도 중요합니다 . 추적 염료의 농도를 줄이면 인접 스펙트럼 채널에 보상 문제를 감소하지만, 딸 세포의 농도가 autofluorescence과 중복을 시작하기 전에도 모니터링 할 수 있습니다 셀 부문의 수를 제한합니다. 또는, 그러한까지 붉은 색 발광 CellVue의 피 (시그마 - 알드리치, 세인트 루이스, MO) 또는 보라색 발광 CellTrace 누나 (생명 기술, 그랜드 아일랜드, NY)와 같은 새로운 셀 추적 염료의 보상 문제 (그림 6)을 줄일 수 있습니다 사용합니다. 막 염료는 일반적으로 덜 독성 11,26을 전시하는 경향이 있지만 마지막으로,이 염료 중 클래스와 오버 레이블 셀 수 있습니다. 그것은 사용 추적 염료의 농도가 추적 할 수있는 세포의 기능 (그림 6) 3,13,16,18를 변경되지 않았는지 확인하는 것이 그러므로 필요가 있습니다.
공개
K. 험프리, JD Tario, 주니어 PK 월레스 생활 기술 주식회사와 BD Biosciences의 평가를 위해 사전 상업 셀 추적 시약을 받았습니다. AD는 Bantly와 JS 무어 평가 시약을 추적 사전 상업 셀을받은 염료를 추적 다양한 CellVue 전지의 사전 상업적 특성에 대한 PTI 연구, 주식회사의 생명 기술의 주식회사와 기금. K. Muirhead는 (Phanos 기술 주식회사에 컨설팅 서비스를 제공합니다 (PKH 및 CellVue 염료의 소유자)와 시그마 - 알드리치 및 분자 타겟팅 기술 주식회사에 대한 백업 기술 지원을 제공합니다 SciGro 주식회사에 의해 고용되어 이들의 유통 염료).
이 기사에 생산 및 무료 액세스 시그마 - 알드리치의 후원을받습니다.
감사의 말
브루스 Bagwell (진실성 소프트웨어 하우스), Nadège Bercovici (IDM), Lizanne Breslin (Zynaxis 세포 과학 PTI 연구) : 저자는 특히 년 동안 이러한 방법의 개발에 자신의 기술 및 지적 공헌에 대한 다음 개인을 감사드립니다 브라이언 그레이 (PTI 연구), 월 피셔 (다트머스 의과 대학), 앨리스 Givan (다트머스 의과 대학), 베시 Ohlsson - 빌헬름 (SciGro 주식회사), 그리고 마리아 Waugh (다트머스 의과 대학). 또한 그림 2에 표시된 데이터를 생성 연간 연구 방법의 과정과 유동 세포 계측법의 응용에서 2006 년 Bowdoin 클래스를 감사드립니다.
유동 세포 계측법은 NIH 공유 악기 프로그램에서 장비 교부금의 일부에 설립 된 로즈웰 파크 암 연구소의 유동 세포 계측법 연구소에서 수행하고, 국가의 핵심 권한 부여 (5 P30 CA016056-29)의 지원을받는되었다암 로스웰 파크 암 연구소로, 그리고라고 Abramson 암 센터의 유동 세포 계측법 및 NIH 공유 악기 프로그램에서 장비 교부금의 일부에 설립 된 펜실베니아 대학의 셀 정렬 자원 연구소의 연구원, 그리고 NIH # 2P30에서 지원을받는 국립 암 연구소에서 CA016520. 도 3 및도 5에 도시 된 작품은 PTI 연구, 주식회사에게 수여 바이오 메디컬 이미징 및 생물의 국립 연구소 (NIBIB)에서 SBIR 보조금 EB00228에 의해 부분적으로 지원되었다
자료
| Name | Company | Catalog Number | Comments |
| 시약이나 장비 | 회사 | 카탈로그 번호 | 코멘트 |
| 상업적으로 구입 | |||
| 7 Aminoactinomycin D | 시그마 - 알드리치 | A9400 | |
| 소 혈청 알부민 (BSA) | 시그마 - 알드리치 | A4503 | |
| 태아 소 혈청 (FBS) | 애틀랜타 체액 | S11150 | |
| 행크스 균형 소금 솔루션 (HBSS) | 생명 기술 | 14175-079 | 페놀 붉은없이 칼슘, 마그네슘 무료, |
| 인간 IgG Cohn 분수 II 및 III 글로블린 | 시그마 - 알드리치 | G-4386 | |
| 마우스 반 인간 3 번 CD-FITC | BD Biosciences | 349201 | 실험실 적정에 의해 결정으로 포화 농도 |
| 마우스 반 인간 CD4-APC | BD Biosciences | 340672 | 실험실 적정에 의해 결정으로 포화 농도 |
| 마우스 반 인간 CD4-PECy7 | BD Biosciences | 348799 | 실험실 적정에 의해 결정으로 포화 농도 |
| 마우스 반 인간 CD8-FITC | BD Biosciences | 347313 | 실험실 적정에 의해 결정으로 포화 농도 |
| 마우스 반 인간 CD8-APC | Caltag (생명 기술) | MHCD0805 | 실험실 적정에 의해 결정으로 포화 농도 |
| 마우스 반 인간 CD19-APC | Caltag (생명 기술) | MHCD1905 | 포화 농도 |
| 마우스 반 인간 CD25-APC | BD Biosciences | 340938 | 실험실 적정에 의해 결정으로 포화 농도 |
| 마우스 반 인간 CD127-PE | BD Biosciences | 557938 | 실험실 적정에 의해 결정으로 포화 농도 |
| 마우스 반 인간 3 번 CD | eBiosciences | 16-0037-85 | 1.0 MG / ML, azide 무료 |
| 마우스 반 인간 CD28 | eBiosciences | 16-0289-85 | 1.0 MG / ML, azide 무료 |
| PBS | Gibco | 21300-058 | |
| EtOH 10-3M PKH26 및 희석제 C를 포함하는 PKH26 붉은 형광 세포 링커 키트 | 시그마 - 알드리치 | PKH26GL - 1KT 또는 MINI26 - 1KT | 1 단계 절차도 적용PKH67을 포함하는 키트 또는 기타 CellVue 염료에 |
| EtOH 및 희석제 C에서 10 3M CellVue의 피를 포함하는 CellVue 피까지 붉은 형광 세포 링커 키트 | 시그마 - 알드리치 | MINCLARET - 1KT 또는 MIDCLARET - 1KT | |
| 5 - (및-6) carboxyfluorescein의 diacetate, succinimidyl 에스테르 (CFDA-SE) | Invitrogen (생명 기술) | C34554 | 비 형광, 형성 할 막 esterases으로 흘리고 형광 아미노 반응 carboxyfluorescein succinimidyl 에스테르 (CFSE) |
| 죽었 / LIVE 고칠 수 있었던 | Invitrogen (생명 기술) | L34955 | |
| 멸균 12 원뿔형 X 75mm 폴리 프로필렌 튜브 및 모자 | VWR | 60818-102 | 더 나은 막 염료 착색 효율을 (; 표면에 뜨는 흡인하는 동안 더 적은 세포의 손실을 감소 염료 흡착) 제공 |
| 12 X 75mm rounD 바닥 폴리스티렌 튜브 | Becton 디킨슨 | 21008-936 | |
| 흐름 cytometer | Bioscience BD | FACSCalibur LSRFortessa | 그리고 APC 예, FITC, PKH26, 7-AAD (. 그들 각각 520 nm의, 567 nm의, 그리고 655 nm의, 예 : 488 nm의)를 감지 할 수있는 어떠한 cytometer. 633-640 나노 미터, 그들을. 660 nm의) |
| 흐름 cytometer | Beckman 보습 바로 앞에 달린 풀 베는 날 | LSRII 청록색 | 그리고 APC 예, FITC, PKH26, 7-AAD (. 그들 각각 520 nm의, 567 nm의, 그리고 655 nm의, 예 : 488 nm의)를 감지 할 수있는 어떠한 cytometer. 633-640 나노 미터, 그들을. 660 nm의) |
| 연구소는 준비 | |||
| 7 Aminoactinomycin D, 농축 가공 | NA | NA | PBS 1 MG / ML. -20 ° C.에서 aliquots 및 저장소에 고정 |
| 7 Aminoactinomycin D, wor왕 주식 | NA | NA | 100 μg / PBS에 ML은, 1 MG / ML 냉동 가공에서 매일 준비합니다. |
| IgG 블록 | NA | NA | HBSS + 10 MG / ML 인간 IgG Cohn 분수 II 및 III 글로블린 + 10 MG / ML BSA. |
참고문헌
- Poon, R. Y., Ohlsson-Wilhelm, B. M., Bagwell, C. B., Muirhead, K. A., Diamond, R. A., DeMaggio, S. Use of PKH Membrane Intercalating Dyes to Monitor Cell Trafficking and Function. Living Color: Flow Cytometry and Cell Sorting Protocols. , 302-352 (2000).
- Wallace, P. K., Muirhead, K. A. Cell Tracking 2007: A Proliferation of Probes and Applications. Immunol. Invest. 36, 527-562 (2007).
- Hawkins, E. D., Hommel, M., Turner, M. L., Battye, F. L., Markham, J. F., Hodgkin, P. D. Measuring lymphocyte proliferation, survival and differentiation using CFSE time-series data. Nat. Protoc. 2, 2057-2067 (2007).
- Quah, B. J., Warren, H. S., Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nat. Protoc. 2, 2049-2056 (2007).
- Bolton, D. L., Minang, J. T., Trivett, M. T., Song, K., Tuscher, J. J., Li, Y., Piatak, M., O'Connor, D., Lifson, J. D., Roederer, M., Ohlen, C. Trafficking, Persistence, and Activation State of Adoptively Transferred Allogeneic and Autologous Simian Immunodeficiency Virus-Specific CD8+ T Cell Clones during Acute and Chronic Infection of Rhesus Macaques. J. Immunol. 184, 303-314 (2010).
- Juopperi, T. A., Sharkis, S. J. Isolation of Quiescent Murine Hematopoietic Stem Cells by Homing Properties. Meth. Mol. Biol. 430, 21-30 (2008).
- Kusumbe, A. P., Bapat, S. A. Cancer stem cells and aneuploid populations within developing tumors are the major determinants of tumor dormancy. Cancer Res. 69, 9245-9253 (2009).
- Pece, S., Tosonim, D., Confalonieri, S., Mazzarol, G., Vecchi, M., Ronzoni, S., Bernard, L., Viale, G., Pelicci, P. G., Fiore, P. P. D. i. Biological and Molecular Heterogeneity of Breast Cancers Correlates with Their Cancer Stem Cell Content. Cell. 140, 62-73 (2010).
- Gertner-Dardenne, J., Poupot, M., Gray, B. D., Fournié, J. -. J. Lipophilic fluorochrome trackers of membrane transfers between immune cells. Immunol. Invest. 36, 665-685 (2007).
- Bercovici, N., Givan, A. L., Waugh, M. G., Fisher, J. L., Vernel-Pauillac, F., Ernstoff, M. S., Abastado, J. P., Wallace, P. K. Multiparameter precursor analysis of T-cell responses to antigen. J. Immunol. Methods. 276, 5-17 (2003).
- Givan, A. L., Fisher, J. L., Waugh, M. G., Bercovici, N., Wallace, P. K. Use of cell-tracking dyes to determine proliferation precursor frequencies of antigen-specific T cells. Methods Mol. Biol. 263, 109-124 (2004).
- Schwaab, T., Tretter, C. P., Gibson, J. J., Cole, B. F., Schned, A. R., Harris, R., Fisher, J. L., Crosby, N., Stempkowski, L. M., Heaney, J. A., Ernstoff, M. S. Tumor-related immunity in prostate cancer patients treated with human recombinant granulocyte monocyte-colony stimulating factor (GM-CSF). Prostate. 66 (6), 667-674 (2006).
- Bantly, A. D., Gray, B. D., Breslin, E., Weinstein, E. G., Muirhead, K. A., Ohlsson-Wilhelm, B. M., Moore, J. S. CellVue Claret, a New Far-Red Dye, Facilitates Polychromatic Assessment of Immune Cell Proliferation. Immunol. Invest. 36, 581-605 (2007).
- Givan, A. L. A flow cytometric assay for quantitation of rare antigen-specific T-cells: using cell-tracking dyes to calculate precursor frequencies for proliferation. Immunol. Invest. 36, 563-580 (2007).
- Tario, J. D., Gray, B. D., Wallace, S. S., Muirhead, K. A., Ohlsson-Wilhelm, B. M., Wallace, P. K. Novel lipophilic tracking dyes for monitoring cell proliferation. Immunol Invest. 36, 861-885 (2007).
- Wallace, P. K., Tario, J. D., Fisher, J. L., Wallace, S. S., Ernstoff, M. S., , ., Muirhead, K. A. Tracking Antigen-Driven Responses by Flow Cytometry: Monitoring Proliferation by Dye Dilution. Cytometry. 73, 1019-1034 (2008).
- Barth, R. J., Fisher, D. A., Wallace, P. K., Channon, J. Y., Noelle, R. L., Gui, J., Ernstoff, M. S. A Randomized Trial of Ex vivo CD40L Activation of a Dendritic Cell Vaccine in Colorectal Cancer Patients: Tumor-Specific Immune Responses Are Associated with Improved Survival. Clin. Cancer Res. 16, 5548-5556 (2010).
- Tario, J. D., Muirhead, K. A., Pan, D., Munson, M., Wallace, P. K. Tracking Immune Cell Proliferation and Cytotoxic Potential Using Flow Cytometry. Meth. Mol. Biol. 699, 119-164 (2011).
- Fuse, S., Underwood, E. Simultaneous Analysis of In Vivo CD8+ T Cell Cytotoxicity Against Multiple Epitopes using Multicolor Flow Cytometry. Immunol. Invest. 36, 829-845 (2007).
- Schütz, C., Fleck, M., Mackensen, A., Zoso, A., Halbritter, D., Schneck, J. P., Oelke, M. Killer artificial antigen-presenting cells: a novel strategy to delete specific T cells. Blood. 111, 3546-3552 (2008).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Rev. Vaccines. 9, 601-616 (2010).
- Roederer, M. Interpretation of cellular proliferation data: Avoid the panglossian. Cytometry. 79A, 95-101 (2011).
- Quah, B. J. C., Parish, C. R. The Use of Carboxyfluorescein Diacetate Succinimidyl Ester (CFSE) to Monitor Lymphocyte Proliferation. J. Vis. Exp. (44), e2259 (2010).
- Houlihan, D. D., Newsome, P. N. Critical Review of Clinical Trials of Bone Marrow Stem Cells in Liver Disease. Gastroenterology. 135, 438-450 (2008).
- Brusko, T. M., Hulme, M. A., Myhr, C. B., Haller, M. J., Atkinson, M. A. Assessing the In Vitro Suppressive Capacity of Regulatory. T Cells. Immunol. Invest. 36, 607-628 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유