JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
게놈 DNA에서 도보로 5 hydroxymethylcytosine의 선택적 캡처
요약
설명이 쉽고 밀도에 독립적 인 강화를위한 비오틴 링커를 전송할 클릭 화학에 이어, 5 HMC에 azide - 포도당를 전송하는 β-glucosyltransferase (β-GT)를 사용하여 두 단계 라벨 프로세스입니다. 이 효율적이고 특정 라벨 방식은 차세대 시퀀싱을 통해 매우 낮은 배경과 높은 처리량 epigenomic 매핑과 5 HMC의 농축이 가능합니다.
초록
5 methylcytosine (5-MC)는 인간 게놈 DNA의 총 cytosines의 ~ 2-8%를 구성하고 유전자 발현, 게놈 무결성 유지, 부모의 각인, X-염색체 불 활성화, 규제 등의 생물학적 기능의 광범위한 영향을 개발, 노화, 암 1. 최근 산화 5 MC, 5 hydroxymethylcytosine (5 HMC)의 존재는 배아 줄기 (ES) 세포와 neuronal 세포 2-4, 특히 포유류의 세포에서 발견되었습니다. 5 HMC는 TET 가족 철 (II) / α-ketoglutarate에 따라 달라 dioxygenases 2, 3 5 - MC 촉매의 산화에 의해 생성됩니다. 5 HMC는 배아 줄기 (MES) 세포, 정상 조혈 및 malignancies, 그리고 접합자 개발이 5-10의 유지에 참여 제안합니다. 더 나은 5 HMC의 기능을 이해하기 위해서는 안정적이고 간단한 시퀀싱 시스템이 필수적입니다. 전통 bisulfite 배열은 5 - MC 11 일부터 5 HMC을 구별 할 수 없습니다 12 포도당 잔기를 추가 박테리오파지 효소 활용, 라벨 및 5-HMC를 캡처 할 수있는 매우 효율적이고 선택적 화학 접근 방식을 개발했습니다.
여기 5 HMC의 선택적 화학 라벨에 대한 간단한 두 단계 절차를 설명합니다. 첫 번째 라벨 단계에서, 게놈 DNA의 5 HMC는에서 5 HMC에 6 azide 포도당를 전송하는 방식으로, β-GT, T4 박테리오파지에서 glucosyltransferase로 6 azide-포도당 촉매으로 표시됩니다 수정 cofactor, UDP-6-N3-Glc (6 N3UDPG). 두 번째 단계, biotinylation에서 이황화 비오틴의 링커는 클릭 화학으로 azide 그룹에 연결되어 있습니다. 두 단계는 게놈 지역에서 5 HMC의 풍부한 관계없이 라벨 매우 낮은 배경을 제공 완료로 이어지는, 매우 구체적이고 효율적이다. 5 HMC의 후 biotinylation, 5 HMC 함유 DNA 조각을 한 후 선택적으로 캡처되어밀도 독립적 인 방식으로 streptavidin 비즈를 사용합니다. 그 결과 5 HMC 강화 DNA 조각은 차세대 시퀀싱 등의 다운 스트림 분석을 위해 사용될 수있다.
우리의 선택 레이블 및 캡처 프로토콜은 다양한 / 변수 5 HMC의 abundances과 게놈 DNA의 소스에 해당 높은 감도를, 수여. 이 프로토콜의 주요 목적은 자사의 다운 스트림 응용 프로그램 (예., 차세대 시퀀싱은 게놈의 5 HMC 배포를지도)이지만, 단일 분자입니다 실시간 SMRT (DNA) 시퀀싱과 호환됩니다 5 HMC의 단일 기본 해상도 시퀀싱을 제공 할 수.
프로토콜
1. 게놈 DNA 조각
원하는 크기 범위로 sonication을 사용하여 조각 게놈의 DNA는 게놈 전체 시퀀싱 플랫폼에 가장 적합합니다. (우리는 보통 ~ 300 BP에 sonicate.) 1% 아가로 오스 겔 (그림 1)에 조각 게놈의 DNA의 크기 분포를 확인합니다.
2. DNA 준비
게놈 DNA의 5 HMC의 풍부한에 따라 시작 DNA 금액을 확인합니다. 5 HMC 수준이 다른 조직 유형에 크게 다르므로, 시작 DNA의 금액은 샘플 5 HMC 수준에 따라 달라집니다. 예제 표 1을 참조하십시오.
3. β-GT 촉매 반응 (포도당 전송 반응)
- 1 시간에 37 ° C 물 목욕의 표 2와 배양에 명시된 바와 같이 혼합물을 pipetting하여 섞는다.
- 부화 후, DNA의 10 μg을 당 사용 QIAquick 염기 제거 키트와 반응을 정리열. 열 30 μl 물 Elute과 조화를 이루고 있습니다.
4. Biotinylation 반응 (클릭 화학)
- 150 μm의 최종 농도 (즉, 30 μl DNA 솔루션에 따라 솔루션을 작업 5 μl)에 용출 DNA 솔루션 (3 단계에서) DBCO-SS-PEG3 - 비오틴 공액 작업 솔루션 (1 MM)를 추가합니다.
- 2 시간에 37 ° C 물 목욕에 pipetting 및 배양하여 섞는다.
- QIAquick 염기 제거 키트와 반응을 정리. 이상적인 총 용출 볼륨은 100 μl입니다.
- 마이크로 리터 규모 분광 광도계 (예를 들면., NanoDrop)를 사용하여 복구 DNA 금액을 수량화.
5. 5 HMC 함유 DNA의 캡처
- 제조업체의 지시에 따라 1X B & W 버퍼 1 ML과 Dynabeads MyOne Streptavidin C1의 50 μl 3 번 씻으십시오. 자기 스탠드로 구슬을 분리합니다.
- 복구 biotinylated D에 배 B & W 버퍼의 동등한 볼륨을 추가세척 구슬로 NA (100 UL).
- 회선 근의 부드러운 회전 실온에서 15 분에 품다.
- 자기 스탠드로 구슬을 분리하고 1X B & W 버퍼 1 ML과 구슬에게 3 번 씻는다.
- 회선 근의 부드러운 회전 상온에서 2 시간에 신선하게 조리 된 50 ㎜의 DTT의 100 μl의 구슬을 잠복기하여 DNA를 Elute.
- 자기 스탠드로 구슬을 분리합니다. DTT를 제거 할 수있는 제조 지침에 따라 마이크로 바이오 스핀 6 열로 eluent와 부하를 대기음. 대상 DNA는 이제 솔루션입니다.
- EB 버퍼의 10 μl의 Qiagen PCR MinElute 정화 키트 및 elute의 DNA에 의해 이전 단계에서 용출 DNA를 정화. 농도가 20 NG / UL보다 높은 경우 큐빗 Fluorometer, 또는 NanoDrop를 사용하여 DNA를 정량화. DNA는 다운 스트림 게놈 전체 시퀀싱 도서관 준비 할 준비가되었습니다.
6. 대표 결과
품질 O 경우F 게놈 DNA가 높은, β-GT와 biotinylation 반응 후 일반적인 복구 수율은 ~ 60-70% 있습니다. 그러나, 캡처 효율은 샘플의 5 HMC 수준에 따라 서로 다른 조직 유형 상당히 다릅니다. 일반적으로, 뇌 게놈의 DNA에 대한 캡처 효율은 ~ 4-9%이며, 일부 극단적 인 경우에 효율은 12 %까지 도달 할 수 있습니다. ES 세포의 경우 평균 캡처 효율은 신경 줄기 세포에 대한 ~ 0.5 %로 대조적으로, ~ 2-4%입니다. 본 최저 효율은 지금까지 암 세포의 게놈 DNA에 대한했습니다. 모든 농축 DNA는 표준 차세대 도서관 준비 프로토콜 준비가되었습니다. 또한 캡처 한 DNA는 또한 관련 프리 머를 사용할 경우 입력 DNA에 비해 몇 조각의 강화를 감지하는 실시간 PCR을위한 템플릿으로 사용할 수 있습니다.
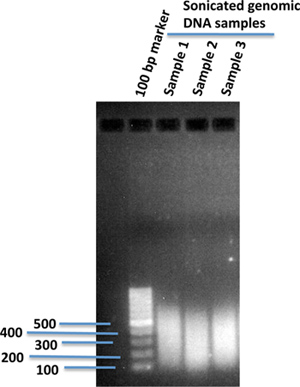
1 그림. 에 Sonicated 인간 게놈의 DNA 조각1퍼센트 아가로 오스 겔. 1X TE 버퍼 120 μl 인간의 IPS 세포로부터 격리 게놈 DNA의 10 μg은 sonication 장치 (Covaris)를 사용하여 sonicated되었습니다. sonication 후, sonicated DNA의 2 μl은 sonicated DNA 조각의 크기를 비교하는 DNA 마커의 100 BP를 사용하여 1퍼센트 아가로 오스 겔에로드했습니다.
| 구성 요소 | 음량 | 최종 농도 |
| 물 | _ μl | |
| 10 X β-GT 반응 버퍼 | 2 μl | 1 X |
| 최대 10 μg의 게놈의 DNA에 | _ μl | 최대 500 μl / NG |
| UDP-6-N 3-Glc (3 ㎜) | 0.67 μl | 100 μM |
| β-GT (40 μM) | 1 μl | 2 μM |
| 총 볼륨 | 20 μl |
조직 게놈의 DNA (높은 5 HMC 내용> 0.1 %)의 경우 I)
| 구성 요소 | 음량 | 최종 농도 |
| 물 | _ μl | |
| 10 X β-GT 반응 버퍼 | 10 μl | 1 X |
| 20 μg의 게놈의 DNA에 | _ μl | 최대 500 μl / NG |
| UDP-6-N3-Glc (3 ㎜) | 1.33 μl | 100 μM |
| β-GT (40 μM) | 2 μl | 2 μM |
| 총 볼륨 | 40 μl |
II) 줄기 세포 게놈의 DNA (평균 5 HMC 내용 ~ 0.05 %)의 경우
| 구성 요소 | 음량 | 최종 농도 |
| 물 | _ μl | |
| 10 X β-GT 반응 버퍼 | 10 μl | 1 X |
| 최대 50 μg의 게놈의 DNA에 | _ μl | 최대 500 μl / NG |
| UDP-6-N3-Glc (3 ㎜) | 3.33 μl | 100 μM |
| β-GT (40 μM) | 5 μl | 2 μM |
| 총 볼륨 | 100 μl |
III) 암 세포 게놈의 DNA (낮은 5 HMC 내용 ~ 0.01 % 용)
표 1. 입력 DNA와 선택 화학 라벨 방식에 의한 다양한 5 HMC 수준으로 샘플을 사용하여 라벨 반응 금액의 예.
| 견본 | 5 HMC 수준 | 시작 DNA (μg) | 라벨 후 복구 (구슬로 입력) (μg) | 복구 수율 | 풀다운 DNA (NG) | 풀다운 얻을 수 |
| 성인 마우스 소뇌 | 0.4 % | 10 | 7.5 | 75% | 236 | 3.1 % |
| 출생 후의 일 7 마우스 소뇌 | 0.1 % | 11 | 9 | 82% | 140 | 1.6 % |
| 마우스 ES 세포 E14 | 0.05 % | 60 | 42 | 70% | 350 | 0.8 % |
표 2. 마우스 뇌 조직 및 ES 세포의 대표 결과입니다.
Access restricted. Please log in or start a trial to view this content.
토론
5 hydroxymethylcytosine (5 HMC)는 특정 포유류의 세포 유형에서 상당한 양의 최근 확인 epigenetic 수정 존재입니다. 여기에 제시된 방법은 5 HMC의 게놈 전체의 분포를 결정하기위한 것입니다. 우리는 5 HMC의 수산기 그룹에 azide 그룹을 포함하는 엔지니어링 포도당 잔기를 전송하는 β-glucosyltransferase T4 박테리오파지를 사용합니다. azide 그룹은 화학적으로 포유류의 genomes에 5 HMC 함유 DNA 조각의 감지, 연관성 ?...
Access restricted. Please log in or start a trial to view this content.
공개
관심 없음 충돌이 선언 없습니다.
감사의 말
이 연구는 국립 보건원 (CH와 NS051630/MH076090/MH078972에 PJ에 GM071440)에 의해 부분적으로 지원되었다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 이름 | 회사 | # 카탈로그를 | 논평 |
| 시약 | |||
| 5M 나트륨 염화물 (NaCl) | Promega | V4221 | |
| 0.5M pH8.0 Ethylenediaminetetraacetic 산 (EDTA (에틸렌 다이아 민 테트라 초산)) | Promega | V4231 | |
| 1M Trizma베이스 (트리스) pH7.5 | Invitrogen | 15567-027) | |
| HEPES 1M, pH7.4 | Invitrogen | 15,630 | |
| 염화 마그네슘 (MgCl 2) 1M | Ambion | AM9530G | |
| 디메틸 sulfoxide (DMSO) | 시그마 | D8418 | |
| 십대 초반 20 | 피셔 BioReagents | BP337-100 | |
| DBCO-SS-PEG3 - 비오틴 공액 | 화학 도구를 클릭합니다 | A112P3 | |
| 1,4 - Dithiothreitol, ultrapure (DTT) Superpure | Invitrogen | 15508-013 | |
| QIAquick 염기 제거 키트 | Qiagen | 28,304 | |
| 마이크로 바이오 스핀 6 열 | 바이오 RAD | 732-6222 | |
| Dynabeads MyOne | Invitrogen | 650-01 | |
| Streptavidin C1 | |||
| Qiagen PCR MinElute 정화 키트 | Qiagen | 28,004 | |
| UltraPure 아가로 오스 | Invitrogen | 16500500 | |
| UDP-6-N 3 포도당 | 활성 Motif로 | 55,013 | |
| 효소 | |||
| β-glucosyltransferase (β-GT) | 뉴 잉글랜드 Biolab | M0357 | |
| 장비 | |||
| Sonication 장치 | Covaris | ||
| 데스크탑 원심 분리기 | |||
| 열탕 목욕 | 피셔 과학 | ||
| 젤 실행 장치 | 바이오 RAD | ||
| NanoDrop1000 | 열 과학 | ||
| Labquake 튜브 쉐이커 | Barnstead | ||
| Labquake 튜브 쉐이커 | Thermolyne | ||
| 자기 분리 스탠드 | Promega | Z5342 | |
| 큐빗 2.0 Fluorometer | Invitrogen | ||
| 시약 설정 10 X β-GT 반응 버퍼 (500 MM의 HEPES 산도 7.9, 250 MM MgCl 2) 2 X 구속력과 (10 MM 트리스 산도 7.5, 1 ㎜ EDTA (에틸렌 다이아 민 테트라 초산), 2 M NaCl, 0.02 % 십대 초반 20) (B & W) 버퍼를 세척 . |
참고문헌
- Jaenisch, R., Bird, A. Epigenetic regulation of gene expression: how the genome integrates intrinsic and environmental signals. Nat. Genet. , Suppl 33. 245-254 (2003).
- Ito, S. Role of Tet proteins in 5mC to 5hmC conversion, ES-cell self-renewal and inner cell mass specification. Nature. 466, 1129-1133 (2010).
- Tahiliani, M. Conversion of 5-methylcytosine to 5-hydroxymethylcytosine in mammalian DNA by MLL partner TET1. Science. 324, 930-935 (2009).
- Kriaucionis, S., Heintz, N. The nuclear DNA base 5-hydroxymethylcytosine is present in Purkinje neurons and the brain. Science. 324, 929-930 (2009).
- Ko, M. Impaired hydroxylation of 5-methylcytosine in myeloid cancers with mutant TET2. Nature. 468, 839-843 (2010).
- Koh, K. P. Tet1 and tet2 regulate 5-hydroxymethylcytosine production and cell lineage specification in mouse embryonic stem cells. Cell Stem Cell. 8, 200-213 (2011).
- Iqbal, K., Jin, S. G., Pfeifer, G. P., Szabo, P. E. Reprogramming of the paternal genome upon fertilization involves genome-wide oxidation of 5-methylcytosine. Proceedings of the National Academy of Sciences of the United States of America. 108, 3642-3647 (2011).
- Wossidlo, M. 5-Hydroxymethylcytosine in the mammalian zygote is linked with epigenetic reprogramming. Nat. Commun. 2, 241(2011).
- Gu, T. P. The role of Tet3 DNA dioxygenase in epigenetic reprogramming by oocytes. Nature. 477, 606-610 (2011).
- Dawlaty, M. M. Tet1 is dispensable for maintaining pluripotency and its loss is compatible with embryonic and postnatal development. Cell Stem Cell. 9, 166-175 (2011).
- Huang, Y. The behaviour of 5-hydroxymethylcytosine in bisulfite sequencing. PLoS One. 5, e8888(2010).
- Song, C. X. Selective chemical labeling reveals the genome-wide distribution of 5-hydroxymethylcytosine. Nat. Biotechnol. 29, 68-72 (2011).
- Pastor, W. A. Genome-wide mapping of 5-hydroxymethylcytosine in embryonic stem cells. Nature. 473, 394-397 (2011).
- Matarese, F., Pau, C. arrillo-deS. anta, E,, Stunnenberg, H. G. 5-Hydroxymethylcytosine: a new kid on the epigenetic block. Mol. Syst. Biol. 7, 562(2011).
- Szwagierczak, A., Bultmann, S., Schmidt, C. S., Spada, F., Leonhardt, H. Sensitive enzymatic quantification of 5-hydroxymethylcytosine in genomic DNA. Nucleic Acids Res. 38, 181(2010).
- Terragni, J., Bitinaite, J., Zheng, Y., Pradhan, S. Biochemical characterization of recombinant β-glucosyltransferase and analysis of global 5-hydroxymethylcytosine in unique genomes. Biochemistry. , (2012).
- Rusmintratip, V., Sowers, L. C. An unexpectedly high excision capacity for mispaired 5-hydroxymethyluracil in human cell extracts. Proc. Natl. Acad. Sci. U.S.A. 97, 14183-14187 (2000).
- Globisch, D. Tissue distribution of 5-hydroxymethylcytosine and search for active demethylation intermediates. PLoS One. 5, e15367(2010).
- Yildirim, O. Mbd3/NURD Complex Regulates Expression of 5-Hydroxymethylcytosine Marked Genes in Embryonic Stem Cells. Cell. 147, 1498-1510 (2011).
- Szulwach, K. E. Integrating 5-hydroxymethylcytosine into the epigenomic landscape of human embryonic stem cells. PLoS Genet. 7, e1002154(2011).
- Szulwach, K. E. 5-hmC-mediated epigenetic dynamics during postnatal neurodevelopment and aging. Nat. Neurosci. 14, 1607-1616 (2011).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유