JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
의 리그닌 아래로 규제
요약
이중 가닥 RNA 간섭 (dsRNAi) 기술은 옥수수 신나 코엔자임에게 낮은 식물 리그닌 함량에 대한 환원 (ZmCCR1) 유전자를 하향 조절하기 위해 사용된다. 세포벽에서 리그닌 다운 규제는 현미경 분석에 의해 시각과 Klason 방법에 의해 정량화된다. 헤미셀룰로오스 및 결정 셀룰로오스의 조성 변화를 분석됩니다.
초록
생물 전환 공정 동안에 대안 바이오 에너지 자원 등 목질 계 바이오 매스의 사용을 촉진하기 위하여, 전처리 단계는 세포벽 탄수화물의 접근성을 증가, 식물 세포벽의 구조를 열 필요가있다. 리그닌, 많은 세포 유형의 벽에 존재하는 폴리 페놀의 재료는, 액세스를 효소 심각한 지장으로 알려져있다. 식물의 구조적 완전성과 방어 시스템을 방해하지 않는 레벨로 리그닌 함량의 감소는 바이오 에탄올 생산 비용을 줄이기 위해 가치있는 단계 일 수있다. 이 연구에서는 유전자 이중 가닥 RNA 간섭 기술을 통해 리그닌 생합성 관련 유전자 중 하나, 신나-CoA 환원 (ZmCCR1)를 아래로 조절했다. ZmCCR1_RNAi 구조체는 입자 충격 법을 사용하는 옥수수 게놈에 통합 하였다. 형질 전환 옥수수 식물에없이 야생형 대조군 식물과 비교하여 일반적으로 성장형질 전환 식물의 잎 중간 갈비, 껍질에 갈색 착색의 표시를 제외하고, 바이오 매스의 성장이나 방어 메커니즘으로 terfering 및 줄기. 현미경 분석은 조직 학적 분석과 함께, 잎 후벽 섬유 박형화되었지만 다른 주요 혈관 시스템 구성 요소의 구조 및 크기가 변경되지 않았 음을 밝혔다. 유전자 변형 옥수수의 리그닌 함량은 7-8.7 % 감소시키고, 결정 성 셀룰로오스, 리그닌 함량 감소에 응답하여 증가하고, 헤미셀룰로오스는 그대로 남아 있었다. 분석은 탄소 흐름이 셀룰로오스 생합성에 리그닌 생합성에서 변환 된 경우가 있습니다 나타낼 수 있습니다. 이 문서의 RNAi 기술을 통해 옥수수의 리그닌 함량을 하향 조절하기 위해 사용되는 절차를 묘사하고 세포벽 조성은 세포벽 구조에 대한 변형의 효과를 검증하기 위해 사용 분석한다.
서문
목질 계 바이오 매스로부터 바이오 연료 생산으로 인해 미국 1 년에 현재 풍부하는 것이 매우 바람직하며, 농림업 잔기의 지속 수확의 경우, 식품 및 동물 사료의 생산에 사용되는 농경지에 직접 경쟁 할 수있는 능력. 그러나, 현재 미국에서 생성 된 바이오 연료의 주요 소스 옥수수 곡물, 달리, 리그 노 셀룰로오스 물질은 훨씬 더 복잡하고 어려운 무너 뜨리는 수 있습니다. 장쇄 탄수화물, 셀룰로오스와 헤미셀룰로오스, 리그 노 셀룰로오스 성 물질의 발효 중에 당류의 주 소스이며, 식물 세포벽의 많은 유형 또한 리그닌을 포함하고, 병원체의 공격에 대하여 강도, 방위를 제공 phenylpropanoid 중합체 및 소수성 외에 벽을 셀. 식물의 성장과 생존에 필요한 반면, 리그닌은 셀룰로오스 hemicellu의 성공적인 효소 전환에 상당한 장벽을 제공합니다수용성 당을 잃게됩니다. 높은 리그닌 함량을 가진 재료는 일반적으로 (생물학적 변환 경로를 통해) 생물 연료 및 가공 특성 및 제품의 품질에 부정적인 영향으로 인한 펄프와 종이 산업에 모두 덜 바람직한 물질이다. 따라서, 작물 구조 강도 및 방어 시스템을 방해하지 않는 수준에서 리그닌 감소를위한 식물 재료의 유전자 조작은 리그 노 셀룰로오스 바이오 연료와 펄프 및 제지 산업을 모두 생산 비용의 감소를 위해 중요 할 수 있습니다.
옥수수 (ZEA 메이)에서 리그닌 공유 ferulate 및 diferulate 다리를 통해 2 차 전지 벽에 헤미셀룰로오스에 대한 상호 연결되어 있습니다. 리그닌 헤미셀룰로오스 복잡한 이차 전지 벽에 무결성과 힘을 부여 복잡한 매트릭스를 형성, 수소 결합을 통해 셀룰로오스 미세 섬유에 결합한다. 식물 세포벽의 기계적 강도는 크게 리튬의 유형에 의해 결정된다gnin 3-5 소단위. 이전의 연구에서, 리그닌 서브 유닛의 비율을 변경하는 효소 소화 6-11에 뚜렷한 경향을 보이지 않고있다. 그러나, 리그닌 함량의 감소는 일반적으로 변환 (12, 13)의 향상을 보여 endocellulases, cellobiohydrolases 및 β-글루코시다 제 (14)를 포함하여 가수 분해 효소에 의해 식물 소재의 소화율을 증가시키는 열쇠가 될 수 있습니다.
전 사체의 발현 정도를 조절하는 유전 공학 광범위 작물 특성을 개선하기 위해 실시되었다. 안티센스 (15)과 공동 16 억제 기술 등 고급 기술은, 아래로 규제 대상 유전자의 효과적인 수 있습니다. 완전한 유전자 녹아웃은 머리핀 구조 (17) 인트론 접합 RNA를 암호화하는 유전자의 구조를 사용하여 달성되었습니다. 또한, 이중 가닥 RNA 간섭 (dsRNAi) 기술, 즉 강력하고 효과적인 유전자 발현 미디어대상으로 성적 저하 또는 번역 탄압 중 하나에 의해 작동 토르, 목표 mRNA의 18에 억제 효과의 넓은 범위를 유도하는 강력한 수단을 제공한다. 유전자 침묵 기술은 몇 가지 제한 사항을 보여줍니다. 이러한 기술은 정확하게 전사의 수준을 규제하지 않고는 다른 동종 유전자에 예기치 않은 침묵 효과를 일으킬 수 있습니다.
이 방법에서는, 우리는 dsRNAi은 옥수수 게놈에 생성 수행하는 입자 충격을 채택했다. 현재까지 식물 종의 광대 한 배열이 성공적으로 입자 충격, 아그로 박테 리움 매개 형질 전환, 일렉트로 및 미세 주입 방법을 사용하여 변형되었다. 그것은 가장 효율적이므로 옥수수 유전자 변형에서, 입자 충격 법은 모든 다른 방법에 비해 유리하다. 입자 충격 박테리아에 의존하지 않는, 그래서 방법은 유전자의 유전자, 종의 크기 또는 생물 제약은 무료입니다이긴, 또는 식물의 유전자형. 물리적 유전자 전달체는 높은 변환 효율이 19에서 엽록체로 식물 게놈에 및 경우에 따라 도입 될 고 분자량 DNA 복수 유전자를 가능하게한다. 잎 중앙 리브의 혈관계에서 리그닌 환원은 샘플의 지형 및 조성을 조사하기위한 유리한되는 주사 전자 현미경 (SEM)을 통해 가시화 될 수있다.
옥수수 식물, 신나-CoA 환원의 두가 (ZmCCR1 : X98083 및 ZmCCR2 : Y15069) 유전자는 옥수수 게놈 (20)에서 발견되었다. 신나 모일-CoA 환원은 신나 밀 알데히드로 hydroxycinnamoyl 아실-CoA 에스테르의 전환을 촉매한다. 유전자가 모든 lignifying 조직에서 발현되어 있기 때문에 우리는이 효소를 하향 조절하는 ZmCCR1 유전자를 선택했다. 시퀀스 것으로 나타났다 때문에 ZmCCR1 유전자의 3 '말단에 523 개의 뉴클레오티드는 dsRNAi가 구성을 위해 선택되었다ZmCCR2들에 비해보다 다양. 따라서, dsRNAi 구조는 정확하게 21를 입을 오프 대상 피하고 만 ZmCCR1에 바인딩합니다. ZmCCR1_RNAi 구조체는 세포질 발현 시스템 ImpactVector1.1 태그로 설계 하였다 (1.1 IV) 녹색 조직 특이 적 프로모터를 함유하는, 리불 로스 -1,5 - 비스 포스페이트 카복실 시게나 (RuBisCO).
dsRNAi는 형질 전환 식물에서 생성의 효과를 연구하기 위해, 리그닌 함량을 정량 하였다. Klason (산 불용성) 리그닌 측정 리그닌 (22)의 일부를 용해 산성 세제 리그닌 정량 방법에 비해 더 정확한 것으로 알려져있다. 따라서 Klason 리그닌은 형질 전환 된 옥수수 줄기 측정 하였다. 이 절차는 수용성 단당류 (23) 내로 중합체 탄수화물 변환 두 단계의 산 가수 분해로 구성된다. 가수 매스이어서 산 가용성 및 불용성 분획으로 MATERIALS 및 산 불용성 리그닌은 이전 연구 23, 24에 따라 측정 하였다. 이상적으로, 리그닌 분석 전에 결과를 방해 할 수있는 가용성 물질을 제거하기 위해, 가수 분해 단계, 잔사에 존재하는 회분을 고려하여 리그닌 잔기의 후 가수 분해 연소에 물, 에탄올 추출을 포함해야한다. 이 단계없이, 시료의 리그닌 함량을 인위적으로 팽창 될 수있다. 전체 방법은 그러나 우리의 실험을 위해 우리가로 인해 테스트에 사용할 재료의 작은 볼륨으로 이러한 단계를 모두 수행 할 수 없습니다, 여기에 제시되어
다른 두 세포벽 성분, 셀룰로오스와 헤미셀룰로오스는 리그닌 하향 조절 된 유전자 변형 옥수수 라인 분석 하였다. 이보고되고있다 그 중 하나를 자신의 페닐알라닌 암모니아 리아제 (PAL) 25, 4-coumarate 아래로 조절 된 형질 전환 식물 : CoA를 리가 (4CL) 26, 또는 신나lcohol 탈수소 효소 (CAD)는 27 일 다른 세포 벽 구조 구성 요소의 증가를 보여줍니다. 우리의 연구에서 첫 단계로서, 결정질 셀룰로오스 Updegraff 방법 (28)을 사용하여 측정 하였다. 이 방법은 원래 cellulolytic 세균 및 곰팡이의 다수의 셀룰로오스의 결정을 위해 고안되었다. 헤미셀룰로오스, 리그닌 및 xylosans을 제거하기 위해 간단히, 분쇄 옥수수의 주식은 Updegraff 시약 (물 : 질산 초산)으로 처리 하였다. 결정 셀룰로오스는 완전히 SO 4 H 2를 추가하여 Saeman 가수 분해를 통해 포도당으로 가수 분해시켰다. 결정 셀룰로오스는 다음 비색 트론 방법 29을 사용하여 측정 하였다. 헤미셀룰로오스의 내용이 변경된 경우를 확인하기 위해, 분쇄 된 수피로부터 단당류 추출물을 트리 플루오로 아세트산을 사용하여 가수 분해 알디 톨 아세테이트의 방법을 사용하여 유도체 화 한 후, 가스 크로마토 그래피 (GC) (30)에 의해 분석 하였다. 결정에 셀에 대한 자세한 절차lulose 내용과 매트릭스 다당류 성분의 분석은 포스터 등으로 설명되어 있습니다. (2010) 31.
여기, 우리는 리그닌에 사용되는 절차에 대해 설명 아래 규제의 RNAi 기술, 입자 충격의 변환 및 바이오 연료 발효 설탕에 옥수수 리그 노 셀룰로오스 바이오 매스의 가속 해체를위한 리그닌 분석을 통해 옥수수에서.
프로토콜
1. ZmCCR1의 아래 규제에 사용 dsRNAi 구문의 준비
- dsRNAi 노크 아웃에 ZmCCR1 유전자를 구성하기 위해 필요한 제한 효소 사이트를 포함한 디자인 유전자 특이 적 프라이머. 두 개의 프라이머 세트는 ZmCCR1의 cDNA의 두 조각 세그먼트를 증폭하도록 설계되었습니다 :. 1271 뉴클레오티드 748에서 523 bp의 단편, 그리고 1271 뉴클레오티드 986에서 285 bp의 단편 ZmCCR1의 cDNA는 애리조나 게놈 연구소 (AGI)에서 제공되었다. 더 자세한 내용은 그림 1에 설명되어 있습니다.
- ZmCCR1_748F_BglII 프라이머 (5'-AGATCTACATCCTCAAGTACCTGGAC-3 ')와 ZmCCR1_1271R_NcoI (5'-CCATGGTTTACACAGCAGGGGAAGGT-3')를 사용하여 cDNA를 ZmCCR1 템플릿으로부터 중합 효소 연쇄 반응 (PCR)에 의해 큰 단편을 증폭한다. ZmCCR1_986F_BglII 프라이머 (5'-AGATCTGGAAGCAGCCGTACAAGTTC-3 ')와 ZmCCR1_1271R_SacI (5R을 이용하여 더 작은 프래그먼트 (285 BP)를 증폭17]-GAGCTCTTTACACAGCAGGGGAAGGT-3 ').
- 개별 제조업체의 지침에 따라을 pGEM-T 쉬운에 조각을 결찰.
- 각각 포함, 개별 형질 전환 체로부터 미니 준비 플라스미드 DNA 분리를 수행을 pGEM-T 상용 미니 준비 플라스미드 키트를 사용하여 구성합니다.
- 두 다이제스트에 BglII과를 NcoI 모두와을 pGEM-T :: ZmCCR1 (523 BP)과 ImpactVector (IV) -1.1 (세포질 발현 벡터).
- IV-1.1 정제 소화 젤로 큰 소화 겔 정제 ZmCCR1 조각 (523 BP)을 결찰.
- IV-1.1 :: ZmCCR1 (523 BP)에 작은 조각을 삽입하기 위해 BglII에와 SacI에 모두을 pGEM-T :: ZmCCR1 (285 BP)와 IV-1.1 :: ZmCCR1 (523 BP)를 소화.
- IV-1.1 정제 소화 겔 :: ZmCCR1 (523 BP)에 작은 소화 겔 정제 ZmCCR1 조각 (285 BP)을 결찰.
- 523 BP 285 BP의 fragmen 모두 복제거꾸로 반복 조각의 중간에 238 bp의 스페이서 (그림 1 참조)와 285 bp의 역 반복 서열을 가지는 ZmCCR1의 RNAi가 구성 할 수있는 IV-1.1에 TS.
- 이 대장균 (대장균)에 구축 이동, 그들을 성장과 옥수수 유전자 변형에 대한 충분한 플라스미드 DNA를 얻기 위해 미디 준비 크기의 플라스미드 DNA 분리를 수행합니다.
2. 유전자 변형 옥수수
- 텅스텐 입자의 제조
- 1.5 ML 튜브에 텅스텐 구슬 60 밀리그램 (M10)을 넣고 2 분 동안 소용돌이로 교반하여 70 % 에탄올 1 ㎖로 씻는다. 23 ° C에서 10 분 동안 배양 한 다음 2 분 동안 18,894 XG에서 원심 분리하고 상층 액을 버린다.
- 2 분 동안 원심 분리하고 상층 액을 버리고, 1 ㎖ 100 % 에탄올로 3 회 씻는다. 60 ㎎ / ㎖로 미세 입자의 농도를 가지고 멸균 50 % 글리세롤의 1 ML을 추가합니다.
- 사격에 대한 DNA의 준비
- 경기 수1.5 ML 튜브에 50 % 글리세롤 제조 텅스텐 구슬의 50 μL (3 mg)을 에이스. IV-1.1의 5 μL (1 μg) :: ZmCCR1 RNAi의 플라스미드 DNA, 2.5 M 염화칼슘의 50 μL, 0.1 M 스퍼 미딘의 20 μl를 추가합니다. 간단히 위의 시약의 각 추가 사이의 소용돌이.
- 소용돌이 30 초 동안 18,894 XG에 텅스텐 비드 DNA 혼합물 간단히 원심 분리기. 뜨는을 붓고, 70 % 에탄올 140 μL에 펠렛을 재현 탁. 액체를 제거하고 폐기. 100 % 에탄올 140 μl를 추가합니다. 액체를 제거하고 폐기.
- 100 % 에탄올 48 μl를 추가합니다. 이전의 폭격에 최대 4 시간 동안 즉시 사용하거나 얼음에 저장합니다.
- 충격
- 32 (osmotium로) 적어도 4 시간 전에 폭격에 N6OSM 미디어를 포함하는 100mm 배양 접시의 중간에 (아이오와 주립 대학의 옥수수 변환 센터에서 제공) 3-5 cm 직경 안녕-II 배 발생 옥수수 캘러스를 놓습니다.
- Prepar제조업체의 지침 33에 따라 전자 PSD-1000/He 입자 전달 장치.
- 70 % 에탄올로 챔버 벽을 살균. 멸균 고정 캡으로 멸균 650 PSI 파열 디스크를 넣습니다. 마크로 캐리어, 건조 잠깐의 표면에 M10-DNA 솔루션 5-6 μl를 확산. 로드 마크로 캐리어 및 마이크로 캐리어 발사 어셈블리로 화면을 중지.
- 정지 화면 (L2 = 6 CM) 및 가까운 문에서 선택한 거리에서 챔버에서 마이크로 캐리어 발사 조립 및 옥수수 캘러스를 놓습니다. 와이어 메쉬 스크린에 대해 27 PSI의 진공 가속화.
- 파열판 버스트 및 헬륨 압력 게이지가 제로로 떨어질 때까지 화재 버튼을 누릅니다. 발사 버튼을 놓습니다.
- 27 ° C에서 어둠 속에서 16 시간 동안 N6OSM (삼투 배지) (32)를 포함하는 페트리 접시에 포격 캘러스를 품어 약 10 조각으로 캘러스를 중단하고 N6E (캘러스 유도 배지)에 배양 접시에 32을 전송하고 5 일 동안 배양 난N 27 ° C에서 어둠.
- 선택
- N6E 5 일 후, N6S 매체 (선택 미디어) 32에 캘러스를 전송합니다. 서브 컬쳐 선택 매체의 모든 캘러스 캘러스 구조를 방해하지 않고 8~12주마다 30 일.
- 8 ~ 10 주 후, 흰색 빠르게 성장하는 부문은 비 증식 부분적으로 괴사 어머니 캘러스 밖으로 성장할 것입니다. 흰색 빠르게 성장하는 조직을 절제하고 신선한 선택 배지 (N6S) (32)을 배양하고 위의 배양을 계속합니다.
- 재건
- 재생 매체 (32)에 흰색과 빠르게 성장하는 배아 캘러스를 전송하고 1 주 동안 위와 같이 품어. 25 ~ 27 ° C에서 16 시간의 일광과 8 시간의 어둠의 기간에 재생 배 발생 캘러스 스위치
- 회생이 응원에 3-4주 후 유리 테스트 튜브 매체 (32)를 촬영 전송, 상기와 같이 배양을 계속합니다. 상당한 연구 후OOT 개발은 토양 4 "화분에 묘목을 이식 한 후, 물 꼭지에서주의 깊게 뿌리를 씻어 나타납니다. 촉촉하게 유지하기 위해 플라스틱 가방과 함께 냄비를 커버. 이일은 작은 구멍 비닐 봉투를 한 후. 5-6일 후 비닐 봉투를 제거합니다. 다른 5~6일 위와 같이 배양을 계속합니다.
- 온실
- 토양 18 "화분에 모종을 전송하고 전체 여름 햇빛 또는 온실 빛을 유지한다. 첫 번째 씨앗은 T 1 세대에 속하는 반면, 초기 재생 식물은 T 0이라고합니다.
3. 조직 학적 분석
- 10 % 중성 포르말린 5 ㎖에 옥수수 잎 중순 갈비뼈를 고정합니다.
- 공정 및 진공 티슈 프로세서를 사용하여 티슈 프로세서 파라핀으로 침투.
- HistoCentre III 임베딩 스테이션을 사용하여 파라핀의 조직을 포함합니다.
- 가장자리에서 초과 파라핀을 제거 한 번 블록KS는 냉각된다.
- 마이크로톰을 사용하여 마이크로톰 4-5 μm의 섹션에 샘플.
- 현미경 슬라이드 및 2-24 시간 동안 56 ° C 배양기에서 건조에 섹션을 배치합니다. 확인 섹션은 완전히 슬라이드에 부착되어 있습니다.
- 23 ℃에서 5 분 동안 크실렌의 두 가지 사항에 Deparaffinize 섹션
- 수화물은 2 분 동안 100 % 에탄올 두 가지 변경, 23 ℃에서 2 분 95 % 에탄올의 두 가지 변경을 통해 슬라이드
- 2 분 동안 흐르는 수돗물에 섹션을 씻어.
- 1 ~ 2 분 동안 0.05 % 톨루이딘 블루 O와 얼룩 DDH 2 O로 간단히 씻어
- 광학 현미경과 침수 오일 및 시각화 샘플을 커버 슬립을 놓습니다.
- 주사 전자 현미경 (SEM)
- 4 % 글 루타 알데하이드 (glutaraldehyde)의 횡단 옥수수 잎 중순 갈비뼈를 수정하고 1 ~ 2 시간 동안 4 ° C에서 0.1 M 인산 나트륨 완충액 (pH 7.4).
- 간단히 버퍼의 샘플을 씻어, 그들에 탈수10 분, 3X 각 계조하고 100 % 에탄올에서 15 분 동안 에탄올 시리즈 (25 %, 50 %, 75 %, 95 %).
- 과도 유체로서 액체 이산화탄소를 사용 임계점 건조기에서 탈수 횡단 옥수수 잎 중앙 리브 말린다.
- 높은 진공 탄소 탭을 사용하여 알루미늄 스텁에 건조 된 샘플을 탑재
- 코트 옥수수 잎 중간 갈비 아르곤 가스로 치환 스퍼터 코팅기에 금 (약 20 nm의 두께)와 알루미늄 스텁에 장착.
- JEOL JSM-6400V (란탄 hexaboride 전자 에미 터) 주사 전자 현미경에 코팅 된 샘플을 검사합니다.
- 디지털 이미지는 분석 프로 소프트웨어 (버전 3.2)을 사용하여 묘사 하였다.
4. Klason 리그닌 측정
- 2 ㎜의 스크린 공장은 샘플.
- 각 샘플의 수분 함량을 결정하고 값을 기록하는 수분 분석기를 사용한다.
- ~ 각 샘플 1.5 g을 칭량하고 중량을 기록한다. Extract 자동화 된 용매 추출 (추출 당 3 회 ~ 사이클 당 14 분) 또는 속실 렛 장치 (추출 당 8 시간)을 사용하여 두 번째 추출 에탄올 다음에 제 1 추출, 물을 사용하여 샘플. (참고 :이 단계는 명백한 Klason 리그닌 함량이 증가, 산 가수 분해 동안 응축하고 정확한 리그닌 측정을 방해 할 수있는 추출액을 제거합니다.)
- 밤새 45 ° C에서 추출 된 샘플을 건조하고이를 데시 케이 터, 다시 무게를 할 수 있습니다.
- 30 ° C.에 인큐베이터를 설정 (샘플 당 삼중 권장) 나사 정상 고압 튜브에 각각 건조, 추출 된 샘플 0.3 g을 측정하고 가장 가까운 0.1 mg의 무게를 기록한다. 각 압력 튜브에 72 % H 2 SO 4 3 ㎖를 추가합니다.
- 유리 또는 테플론 교반 막대를 사용하여 샘플을 섞는다. 물이 배양 한 다음 추가 될 때까지 튜브에 교반 막대를 둡니다.
- 인큐베이터에 튜브를 놓고 그 자체30 ° C에서 60 분 동안 150 rpm의 t. 1 시간 후 4 %로 산 농도를 희석 교반로드와 혼합 탈 이온수 84 ㎖를 추가합니다. 물 라인 위의 유리 병의 측면에 샘플의 많은 양이 남지 않도록주의하십시오.
- 단단히 모든 병의 마개를 밀봉 금속 랙 또는 큰 비커에 배치합니다. 1 시간 동안 액체 살균주기를 사용하여 121 ° C에서 압력솥. 그들을 열기 전에 실온으로 냉각 할 수 있습니다.
- 최소 4 시간 동안 575 ° C에서 가열로에서 필터링 도가니를 미리 재가. 도가니는 한 시간 이상 건조기를에 냉각 할 수 있습니다.
- 진공 도가니 확보 고무 어댑터를 이용하여, 별도의 도가니를 통해 각각의 튜브로부터 용액을 고를. 튜브에 남아있는 입자를 씻어 탈 이온수를 사용합니다.
- 4 시간의 최소 105 ° C에서 리그닌 잔류 물을 건조. 건조 도가니 잔류의 무게를 기록한다.
- 575 ° C를 사용하는 경우, 사전에- 화재 분젠 버너에 샘플이 더 연기 나 재가없는 한 후 24 시간 동안 가열로에 배치, 또는 프로그램 노를 사용하는 경우, - 재를 미리 다음과 같은 프로그램을 사용하지 않는 때까지 :
- 105 ° C 상온에서 진입로와 12 분 동안 누르고 있습니다.
- 10 ° C / 분에서 250 ° C의 램프와 30 분 동안 누르고 있습니다.
- 20 ° C / 분에서 575 ° C의 램프 적어도 180 분 동안 누르고 있습니다.
- 로에서 도가니를 제거하고 데시 케이 터. 도가니 재 무게.
- 다음 식을 이용하여 산 불용성 잔사를 계산
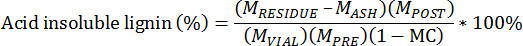
사전 추출 된 바이오 매스의 M PRE = 질량
후 추출 된 바이오 매스의 M POST = 질량
추출 된 바이오 매스의 M 유리 병 = 질량은 유리 병에 추가
도가니와 리그닌 잔 유의 M 잔류 = 질량UE
도가니와 화산재의 M ASH는 = 질량
사전 추출 된 바이오 매스, 총 중량을 기준으로 전체의 MC = 수분 함량
5. 탄수화물 분석
- 세포벽 탄수화물 포스터 등을 기준으로 분석한다. (2010) 프로토콜 31을 수행합니다. 간단히, 동결 건조 식물 재료에서 알코올 불용성 잔류 물을 준비합니다. 그런 다음 트리 플루오로 아세트산과 물질을 가수 분해 및 해당 알디 톨 아세테이트에 용해 된 단당류 유도체와 일치합니다. 중극 질량 분석계에 연결된 가스 크로마토 그래피 (GC)에 의해이 휘발성 유도체를 분석.
결과
우리는 RNAi를 통해 옥수수 식물의 리그닌 함량 감소를 보여 주었다. 입자 충격의 변환 방법은 약 30 % trnasformation 효율을 얻었다. ZmCCR1의 유전자 침묵 일관 T0-T2 세대에서 관찰되었다. 리그닌 감소 된 형질 전환 체는 잎 중간 리브, 껍질, 줄기에 갈색 채색을 표시 제외 야생형 옥수수 식물과 유사하게 성장했다. 조직 학적 분석은 돌연변이 라인 옥수수 잎 중앙 리브 (18)의 후벽 섬유의 ?...
토론
세포벽 다당류를 심는 미생물 셀룰라아제의 액세스는이 페놀 폴리머 (23)와 연결되어있는 정도에 크게 의존한다. 설탕을 발효 될 수있는 목질 계 바이오 매스 변환 속도에 부정적인 식물 secondadry 세포벽에 입금 리그닌 함량과 상관 관계가있다. 이 상관 관계는 그러한 소수성 (24), 화학 등의 이질성 리그닌의 물성에 기인 한 정규 가수 분해성 intermonomeric의 부재 (25)를 결합하...
공개
관심 없음 충돌 선언하지 않습니다.
감사의 말
현미경 이미지는 고급 현미경의 미시간 주립 대학 센터의 서비스를 통해 실시되었다. 옥수수 캘러스 아이오와 주립 대학의 옥수수 변환 센터에서 구입했다. 저자는 탄수화물 분석에 대한 기술적 인 지원을 MSU 식물 연구소의 제프리 R. 웨더에게 감사의 말씀을 전합니다. 이 연구는 관대 미시간의 옥수수 마케팅 프로그램 (CMPM) 및 식물 생명 공학 연구를위한 컨소시엄 (CPBR)에 의해 투자되었다.
자료
| Name | Company | Catalog Number | Comments |
| N6OSM (Osmotic medium) | Made in-house | ||
| N6E (Callus induction) | Made in-house | ||
| N6S media (Selection media) | Made in-house | ||
| Regeneration medium | Made in-house | ||
| Rooting medium | Made in-house | ||
| 10% Neutral buffered formalin (1 L) | Made in-house | ||
| Bio-Rad PSD-1000/He Particle Delivery device | Hercules, CA, United States | ||
| Zeiss PASCAL confocal laser scanning microscope | Carl Zeiss, Jena, Germany | For brightfield microscopy, the images were recorded using a Zeiss (Jena, Germany) PASCAL confocal laser scanning microscope with a 488 nm excitation mirror, a 560 nm emission filter, and a 505-530 nm emission filter. Image analysis was performed using Laser scanning microscope PASCAL LSM version 3.0 SP3 software. | |
| Excelsior ES Tissue Processor | Thermo Scientific, Pittsburgh, PA, United States | ||
| HistoCentre III Embedding Station | Thermo Scientific, Pittsburgh, PA, United States | ||
| Microtome Model Reichert 2030 | Reichert, Depew, NY, United States | ||
| Emscope Sputter Coater model SC 500 | Ashford, Kent, England | ||
| JEOL JSM-6400V Scanning Electron Microscope | JEOL Ltd., Tokyo, Japan | ||
| Fitzpatrick JT-6 Homoloid mill | Continental Process Systems, Inc., Westmont, IL | ||
| MA35 Moisture Analyzer | Sartorius | ||
| Critical point dryer, Balzers CPD | Leica Microsysstems Inc, Buffalo Grove, IL, United States | ||
| Screw-top high pressure tubes | Ace Glass, Vineland, NJ | #8648-27 | |
| Screw-top high pressure tube plugs | Ace Glass, Vineland, NJ | #5845-47 |
참고문헌
- Ralph, J., Grabber, J. H., Hatfield, R. D. Lignin-ferulate cross-links in grasses - Active incorporation of ferulate polysaccharide esters into ryegrass lignins. Carbohydrate research. , 275-178 (1995).
- Park, S. -. H. . Expediting cellulosic biofuels agenda: Production of high value-low volume co-products and lignin down-regulation of bioenergy crops [Ph.D. thesis]. , (2011).
- Boerjan, W., Ralph, J., Baucher, M. Lignin biosynthesis. Annual review of plant biology. 54, 519-546 (2003).
- Gibson, L. J. The hierarchical structure and mechanics of plant materials. Journal of the Royal Society, Interface / the Royal Society. 9, 2749-2766 (2012).
- Dien, B. S., et al. Enhancing alfalfa conversion efficiencies for sugar recovery and ethanol production by altering lignin composition. Bioresource technology. , 102-6486 (2011).
- Fu, C. X., et al. Downregulation of Cinnamyl Alcohol Dehydrogenase (CAD) Leads to Improved Saccharification Efficiency in Switchgrass. Bioenerg Res. 4, 153-164 (2011).
- Grabber, J. H., Ralph, J., Hatfield, R. D., Quideau, S. p-hydroxyphenyl, guaiacyl, and syringyl lignins have similar inhibitory effects on wall degradability. Journal of agricultural and food chemistry. 45, 2530-2532 (1997).
- Li, X., et al. Lignin monomer composition affects Arabidopsis cell-wall degradability after liquid hot water pretreatment. Biotechnology for biofuels. 3, (2010).
- Mansfield, S. D., Kang, K. Y., Chapple, C. Designed for deconstruction--poplar trees altered in cell wall lignification improve the efficacy of bioethanol production. The New phytologist. 194, 91-101 (2012).
- Studer, M. H., et al. Lignin content in natural Populus variants affects sugar release. Proceedings of the National Academy of Sciences of the United States of America. 108, 6300-6305 (2011).
- Chen, F., Dixon, R. A. Lignin modification improves fermentable sugar yields for biofuel production. Nature. 25, 759-761 (2007).
- Ziebell, A., et al. Increase in 4-coumaryl alcohol units during lignification in alfalfa (Medicago sativa) alters the extractability and molecular weight of lignin. The Journal of biological chemistry. 285, 38961-38968 (2010).
- Park, S. -. H., et al. The quest for alternatives to microbial cellulase mix production: corn stover-produced heterologous multi-cellulases readily deconstruct lignocellulosic biomass into fermentable sugars. Journal of Chemical Technolog., and Biotechnology. 86, 633-641 (2011).
- Mol, J. N., et al. Regulation of plant gene expression by antisense RNA. FEBS letters. 268, 427-430 (1990).
- Adamo, A., et al. Transgene-mediated cosuppression and RNA interference enhance germ-line apoptosis in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 109, 3440-3445 (2012).
- Smith, N. A., et al. Total silencing by intron-spliced hairpin RNAs. Nature. 407, 319-320 (2000).
- Park, S. -. H., et al. Downregulation of Maize Cinnamoyl-Coenzyme A Reductase via RNA Interference Technology Causes Brown Midrib and Improves Ammonia Fiber Expansion-Pretreated Conversion into Fermentable Sugars for Biofuels. Crop Sci. 52, 2687-2701 (2012).
- Altpeter, F., et al. Particle bombardment and the genetic enhancement of crops: myths and realities. Mol Breeding. 15, 305-327 (2005).
- Pichon, M., Courbou, I., Beckert, M., Boudet, A. M., Grima-Pettenati, J. Cloning and characterization of two maize cDNAs encoding cinnamoyl-CoA reductase (CCR) and differential expression of the corresponding genes. Plant molecular biology. 38, 671-676 (1998).
- Mansoor, S., Amin, I., Hussain, M., Zafar, Y., Briddon, R. W. Engineering novel traits in plants through RNA interference. Trends in plant science. 11, 559-565 (2006).
- Hatfield, R. D., Jung, H. -. J. G., Ralph, J., Buxton, D. R., Weimer, P. J. A comparison of the insoluble residues produced by the Klason lignin and acid detergent lignin procedures. J Sci Food Agr. 65, 51-58 (1994).
- Sluiter, J. B., Ruiz, R. O., Scarlata, C. J., Sluiter, A. D., Templeton, D. W. Compositional analysis of lignocellulosic feedstocks. 1. Review and description of methods. Journal of agricultural and food chemistry. 58, 9043-9053 (2010).
- Sluiter, A., Hames, B., Ruiz, R., Scarlata, C., Sluiter, J., Templeton, D., Crocker, D. Determination of structural carbohydrates and lignin in biomass. Laboratory Analytic Procedure. , (2008).
- Bate, N. J., et al. Quantitative Relationship between Phenylalanine Ammonia-Lyase Levels and Phenylpropanoid Accumulation in Transgenic Tobacco Identifies a Rate-Determining Step in Natural Product Synthesis. Proceedings of the National Academy of Sciences of the United States of America. 91, 7608-7612 (1994).
- Hu, W. J., et al. Repression of lignin biosynthesis promotes cellulose accumulation and growth in transgenic trees. Nature. 17, 808-812 (1999).
- Lapierre, C., et al. Signatures of cinnamyl alcohol dehydrogenase deficiency in poplar lignins. Phytochemistry. 65, 313-321 (2004).
- Updegraff, D. M. Semimicro determination of cellulose in biological materials. Anal Biochem. 32, 420-424 (1969).
- Yemm, E. W., Willis, A. J. The estimation of carbohydrates in plant extracts by anthrone. The Biochemical journal. 57, 508-514 (1954).
- Filomena, A. P., Cherie, W., Geoffrey, B. F., Antony, B. Determining the polysaccharide composition of plant cell walls. Nature. 7, 1590-1607 (2012).
- Foster, C. E., Martin, T. M., Pauly, M. Comprehensive Compositional Analysis of Plant Cell Walls (Lignocellulosic biomass) Part II: Carbohydrates. J. Vis. Exp. (e1837), (2010).
- Department of Agronomy, Iowa State University. Particle bombardment of Hi II immature zygotic embryos and recovery of transgenic maize plants. , (2005).
- Cano-Delgado, A., Penfield, S., Smith, C., Catley, M., Bevan, M. Reduced cellulose synthesis invokes lignification and defense responses in Arabidopsis thaliana. The Plant journal : for cell and molecular biology. 34, 351-362 (2003).
- Boudet, A. M., Kajita, S., Grima-Pettenati, J., Goffner, D. Lignins and lignocellulosics: a better control of synthesis for new and improved uses. Trends in plant science. 8, 576-581 (2003).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유