Method Article
라이브 마우스의 직렬 내시경 이미징을 사용하여 소장 병변에 대한 새로운 치료제의 효능의 비 침습적 평가
요약
We describe methods for longitudinal monitoring of the efficacy of therapeutics for the treatment of colonic pathologies in mice using a rigid endoscope. This protocol can be readily used for the characterization of the therapeutic response of an individual tumor in live mice and also for monitoring potential disease relapse.
초록
Animal models of inflammatory bowel disease (IBD) and colorectal cancer (CRC) have provided significant insight into the cell intrinsic and extrinsic mechanisms that contribute to the onset and progression of intestinal diseases. The identification of new molecules that promote these pathologies has led to a flurry of activity focused on the development of potential new therapies to inhibit their function. As a result, various pre-clinical mouse models with an intact immune system and stromal microenvironment are now heavily used. Here we describe three experimental protocols to test the efficacy of new therapeutics in pre-clinical models of (1) acute mucosal damage, (2) chronic colitis and/or colitis-associated colon cancer, and (3) sporadic colorectal cancer. We also outline procedures for serial endoscopic examination that can be used to document the therapeutic response of an individual tumor and to monitor the health of individual mice. These protocols provide complementary experimental platforms to test the effectiveness of therapeutic compounds shown to be well tolerated by mice.
서문
대장 암 (CRC)은 악성 종양 전세계 1의 4 번째 가장 일반적인 원인이다. 이 질병의 가족 기초에 대한 우리의 이해에 상당한 진전에도 불구하고, 유전 적 소인은 CRC의 경우 2 ~ 20 %에 기여하고있다. 나머지는 만성 염증 등 다양한 외부 환경 요인에 기인한다. 인간에서 만성 염증과 대장 암 사이의 링크는 궤양 성 대장염 대장염 관련 대장 암 (CAC)을 개발하는 큰 위험을 가지고 (UC) 환자에 분명하다, 염증성 질환 (3)의 기간, 범위와 정도에 따라 -5. 따라서, 신규 한 치료법은 면역 반응 및 염증 종양 미세 환경에 의해 6-8 성장 촉진 인자 연관된 생산을 제어하는 발전에있다. 의 치료 효능을 특성화하기위한 적절한 전임상 동물 모델에 대한 증가하는 요구가있다개발 및 질병의 진행에 대한 이러한 약물.
마우스 모델은 명백히 염증 미세 환경에도 명백한 염증 9,10의 부재 하에서, CRC의 진행에 기여하고 있음을 증명하고있다. 이러한 모델은 상피 상해 및 급성 및 만성 염증성 장 질환 (IBD)을 모델링 11,12 마우스의 식수에 구비 다당류 덱스 트란 황산나트륨 (DSS)의 사용을 포함한다. DSS는 점막 손상 및 대장염을 유발하는 메커니즘이 완전히 이해되지는 않지만, 일부 연구 DSS가 셀들 내에 셀룰러 역전사 및 리보 뉴 클레아 활동을 저해하거나 결장 막이 손상 상피 선도 융합 나노 지질 복합체의 형성을 촉진하는 것이 시사 13, 14. 표준 DSS 모델에 대한 수정은 대장 상피 세포 조직의 항상성 및 regu을 유지하는 메커니즘에 중요한 통찰력을 제공하고 있습니다후반 점막 면역 반응 (15).
아족시 메탄 (AOM)의 복강 내 투여는 단독으로, 또는 DSS와 함께, 상피 점막 염증 및 간질 미세 환경 (16, 17)에 체세포 돌연변이 사이의 상호 작용을 조사하기위한 모델을 제공합니다. AOM 직접 DNA 돌연변이 발생하지 않습니다 발암 물질 1,2- 디메틸 하이드라진 (DMH)의 대사 산물이다. 대신, AOM은 MAM은 글루 쿠 론산과 접합하고 담즙 분비 부위 (18)를 통해 이송되어 간에서 시토크롬 이성체 CYP2E1 그래피 (MAM) methylazoxymethanol 가수 분해이다. 이것은 박테리아 β 글루 쿠로니다 아제는 DNA 알킬화 결과 MAM의 열화 19 상피 세포의 돌연변이의 축적에 기여하는 것으로 생각된다. 대부분 AOM 유도 결장 종양은 프로 테오 degradati에 내성 단백질 렌더링 코딩하는 유전자 β 카테닌의 과오 돌연변이 항구정식이 Wnt 신호 전달 경로 (20)의 비정상적인 활성화에 어떤 결과에. AOM의 활성에 의해 유발되는 DSS 점막 손상과 결합되면, 치유 반응 계속되는 돌연변이 된 상처가 상피 세포의 성장과 팽창에 도움이되는 미세 환경을 생성한다. 이 모델의 변형에서, 단독으로 몇 주에 걸쳐 AOM의 반복적 인 투여는 DSS 유도 10,17 대장염의 부재 하에서, 간헐적 인 대장 암을 모델링하는데 사용될 수있다. 이 두 가지 무료 모델은 염증성 종양 미세 환경 (10)과 관련된 두 가지 모두 각각 CAC 산발적 CRC를 연구하는 실험 설정을 제공합니다.
마우스에서 일련 내시경의 사용은 21 베커 동료가 개척 한 대장염 및 종양 진행의 길이 모니터링 할 수 있었다. 여기에서 우리는 DSS에 의한 점막 손상 및 / 또는 AOM 매개 TU에 따라 세 전임상 프로토콜을 제공MOR 유도 재현성 특정 대장 병변을 유도합니다. 첫 번째 프로토콜은 IBD와 관련된 조직 병리학 많은 기능을 유도하기 위해 DSS 관리에 대한 응답에서 급성 점막 손상을 유발 설명합니다. 제 2 프로토콜은 일반적 IBD 환자에서 관찰 된 염증의 플레어를 모방하는 DSS 투여 연속 3주기에 기초하고, AOM 유발 돌연변이와 함께 수행 될 수있다. 최종 프로토콜은 AOM에 의한 산발적 인 상피 돌연변이를 기반으로합니다. 이들 프로토콜 각각에 대해, 우리는 새로운 약물의 효능을 모니터링하도록 개발 예방 및 치료 적 중재 방법을 포함하는 관련 표준 절차에 대한 확장.
프로토콜
의료 연구 동물 윤리위원회의 월터 엘리자 홀 의학 연구소는 이러한 프로토콜에 설명 된 절차의 각을 승인했다.
실험 쥐의 1. 준비
- 적어도 네 남녀의 실험 동료 구도를 사육과 같은 특정 병원체 무료 (SPF) 동물 시설 / 방에 보관하고 멸균 된 음식과 물을 함께 제공됩니다 6~8주 된 C57BL / 6 마우스 (M.의 musculus)을 일치. 암컷 마우스의 사용은 다른 라인 제한 상자 번호 쥐에서의 공동 주택을 허용하고, 케이지 케이지 간 변동을 감소시킬 것이다.
- 3.0 mm 직경 내시경 외피를 사용하여 내시경 검사 절차를 가능하게하는 나이가 최소 6 주 생쥐를 확인합니다.
- 가능한 장내 세균총과 관련된 변화를 줄이기 위해 동일한 랙에 저장된 케이지에서, 같은 마우스의 유전 적 배경을 사용하여. 동물 시설과 미생물의 변화는 고려 갔지에주의해야한다n은 각각 실험 22 적절한 대조군 마우스 및 유전자형을 결정하는 단계를 포함한다.
- 귀 / 발가락 스크랩, 문신, 또는 유사한로 표시 마우스는 쉽게 식별 할 수 있도록합니다.
- 기준 실험 가중치를 결정하기 위해, 일 0에 마우스의 무게를.
- 내시경 검사를 수행하여 기본 대장 표현형을 기록하는 일 0에 마우스 (5 장 참조).
상피 손상 및 급성 대장염 모델에서 2. 전 임상 시험
- 치료제의 용액을 제조 테스트 할. 구강 투여 (PO)에 의해 전달 치료제를 들어, 100 μL의 최대 볼륨으로 솔루션을 준비합니다. 복강 내 (IP) 주입에 의해 전달 치료제를 들어, 200 μL의 최대 볼륨으로 솔루션을 준비합니다.
참고 : 시간의 연장 기간 동안 반복 IP 또는 포 약물 투여가 변경된 마우스 동작이 발생할 수 있습니다. 장시간 불편을 피하기 위해 IP 주입 사이트 번갈아. 포 투여의 경우, autoc와 마우스를 제공'치료'로 laved 해바라기 씨앗 위관 절차에 부정적인 연관을 최소화합니다. - 1 일에서, 관심 (2.1 단계에서 준비)하고 적절한 차량 컨트롤의 치료를 관리 할 수 있습니다. 제공된 예 (도 6a), 재조합 인간 (RH) iInterleukin (IL)의 -11 단백질 5㎍을 200 ㎕의 인산 완충 식염수에 용해 하였다 (PBS) 및 IP 투여
- . 테스트중인 치료 시약 확립 약동학 프로파일에 의존한다 투여의 타이밍 및 주파수를 결정 실험 1의 과정을 통해 IP 회 주사를 이용하여 예방 적 치료를 설명도.
- 대변의 일관성과 혈액의 존재를 포함하여, 모니터, 매일 각 마우스의 무게를. 치료의 날, 치료약의 투여와 일치해야하는 것은 계량 반복 처리에 의한 생쥐에 응력을 최소화한다.
- 3 일에, 2.5 % (2.5 g / 100 ml)을 정기적으로 동물 시설에 의해 마우스에 제공되는 식수에 DSS 솔루션을 준비합니다. 약 5 ㎖ / 마우스 / DSS 솔루션의 날 실험이 필요합니다. 동물 시설의 주위 온도가 변동하는 경우 DSS 물의 소비량은 변할 수있다.
참고 : DSS는 자극성 및 MSDS 지침에 따라 처리해야합니다. - 5 연속 일 동안 깨끗한 물을 병에 쥐 임의로 신선한 DSS를 제공합니다. 5 일 저녁에 으깬 음식 펠릿뿐만 아니라 작은 배양 접시 (100g 식품 알약 / 10g의 단백질 쉐이크 / 물 10 ㎖)에 제공되는 단백질 보충에 일반 식수를 제공합니다. 이것은 탈수를 방지하고 심한 체중 감량을 최소화으로 지원합니다.
- 이산화탄소 중독으로 쥐를 안락사와 8 일, 또는 아침에 이후의 조직 학적 분석을위한 조직을 수집하는 마우스는 세 개 이상의 C에 대한 ≥15 %의 체중 감량을 경험하는 경우둘 중 먼저 발생하는 onsecutive 일.
참고 : 1-4 % 사이 DSS 량을 조정 (W / V) 동물 시설의 미생물과 DSS의 배치에 따라. 해당 DSS의 용량과 우회 배치 별 변화를 설립, 일상적인 배치 시험을 수행하십시오. 적절한 투여 량은 체중 감소 (원래의 중량의 15 % 이하)에 근거하고, 조직 병리학 장염을 확인해야한다.
만성 대장염이나 대장염 관련 암 모델에서 3. 전 임상 시험
- 만성 대장염 모델의 단계 3.7에서 시작합니다.
- 대장염 관련 암 (CAC) 모델의 경우 1 일에, 10 ㎎ / ㎏ (w / w) 아족시 메탄 (AOM, 250 μL, IP)와 각 마우스를 주입.
참고 : AOM 발암 물질이며, MSDS 지침에 따라 처리해야합니다. - AOM의 재고 솔루션은 10 ㎎ / ㎖ 분량으로 준비하고 -20 ° C에 저장됩니다. 주사 당일, AOM 원액을 해동하고, 1 ㎎ / m로 희석PBS의 리터. 반복 된 동결 AOM 원액 해동 피해야한다.
- AOM 도즈는 8-12 ㎎ / kg 사이에서 조정될 수있다. 일상적인 배치 시험 인해 뱃치 간 변이 마우스에 대한 독성을 회피하기 위해 적절한 투여 AOM을 확립 할 필요가있다.
- 1-7 일 동안 투여 AOM 무게가 안정 될 것이다 다음 이러한 이유로 중량 모니터링은 배설물에서 독성 대사 산물을 배설 할 처리 동물을 피하기 위해 1-7 일 동안 생략 될 수있다.
- 7 일째 모든 세포 독성 침구 절차에 따라 변경 될 필요가있다. 침구 변경이 완료되면 더 이상 세포 독성 대사 배설되지 바와 같이, 동물은 더 이상 세포 독성 처리 절차가 필요 없다.
- 제 8 일에, 2.5 % (2.5 g / 100 ㎖) (단계 2.5에 기재된 바와 같이) DSS 용액을 제조하고 마우스에 임의로 제공한다.
- 러플 쿵푸를 포함, 실험을하는 동안 매일 마우스의 무게를 측정하고 질병의 징후를 모니터링R, 혈변 감소 운동을 hunching.
- 날 13 일, DSS 솔루션을 제거하고 28 일 8-28 만성 대장염 / CAC 프로토콜의 하나의 '주기'를 구성하는 날까지 정상적인 식수와 마우스를 제공한다.
- 일 13-28,에 쥐가 정상적인 식수를 제공하는 경우, 으깬 음식 펠릿와 마우스 및 작은 배양 접시 (100g 식품 알약 / 10g의 단백질 쉐이크 / 물 10 ㎖)에 제공되는 단백질 보충을 제공합니다. 이것은 탈수를 방지하고 심한 체중 감량을 최소화으로 지원합니다.
주 : 매쉬의 단백질 보충제 생쥐 DSS 소비의 일관성을 보장하기 위해 식수 DSS 함유받을 때 제공되지 않아야한다. - 날 20 일 (5 장 참조) 개별 마우스 상태를 모니터링 할 수있는 두 번째 내시경 검사를 수행합니다.
- 하루 29 반복에 DSS주기 (사이클 2 : 2.5 % (V) 일 34-50시 29-33 일 정상 식수 동안 제공 DSS / W).
- 날에 (40)는 생을 수행마우스 개체의 상태를 모니터하고, 종양 부하를 결정하는 내시경 검사를 RD (섹션 5 참조).
- 더 종양이 날 (40)에 내시경 볼 수없는 경우, 일 50-72에 세 번째 DSS주기 시작 (사이클 3 : 2.5 %을 (/ V) 일 56-72시 50-55 일 정상 식수 동안 제공 DSS 와트). 일반적으로, 종양은 40 일에 의해 드러나게 DSS의 세번째 사이클을 생략 할 수있다.
- 종양은 내시경 검사에서 볼 수있게되면, 각 마우스에게 내시경 종양 점수 (5 장 참조) 할당 및 이와 유사한 기준 종양 부담와 동료 개별 쥐를 할당합니다.
- (종양 볼 수 있습니다) 경우 42 일에서 치료 화합물 또는 관련 차량 제어를 (2.2 절 참조) 관리 할 수 있습니다. 투여시기는 치료의 약물 동태 학적 프로파일에 의존한다. 개입 치료의 예는 종양 확립 제공된다 (도 2)과 함께 마우스에서 세 번 매주 IP 주사.
- 전자를 수행치료를 지속 시간 동안 일주일에 한 번씩 ndoscopic 시험은 종양 부하를 모니터링한다. 일반적으로, 치료 적 처치 4 주 목적은 치료 반응을 관찰하기에 충분하다. 치료의 종료 후, 마우스의 코호트 연구는 종양 재발에 대한 내시경 검사로 모니터링 할 수있다.
- 이산화탄소 중독으로 쥐를 안락사와 마우스가 세 개 이상의 일 연속 ≥15 %의 체중 감량을 경험하는 경우 나, 둘 중 먼저 발생하는 날 (72)의 아침에 생화학 적 및 / 또는 조직 학적 분석을위한 조직을 수집합니다.
산발적 인 대장 암 모델에서 4. 전 임상 시험
- 1 일에서 10 ㎎ / ㎏ AOM (단계 3.2 참조)에서 마우스를 사용할 때마다 IP를 주입. AOM 도즈는 8-12 ㎎ / kg 사이에서 조정될 수있다. 일상적인 배치 시험 인해 뱃치 간 변이 마우스에 대한 독성을 회피하기 위해 적절한 투여 AOM을 확립 할 필요가있다.
- 매주의 첫날에 주사를 반복5 주 동안 (그림 3). 마우스 전체 육주에 대한 세포 독성 안전 절차에 따라 처리해야합니다.
- 반복 처리에 의한 생쥐에게 고통을 최소화 AOM 분사의 날에 각 마우스의 무게.
참고 : AOM 발암 물질이며, MSDS 지침에 따라 처리해야합니다. - 모든 동물은이 프로토콜에 대한 요구 AOM의 IP 주사 6 주 동안 세포 독성 안전 절차에 따라 처리해야합니다.
- 8 주 동안 신흥 종양 (5 장 참조) 모니터 할 내시경 검사를 수행합니다. 종양이 표시 될 때까지 내시경 검사는 모든 이주 수행해야합니다. 일반적으로, 야생형 C57BL / 6 AOM 동물의 초기 투여 후 약 40주 의해 종양을 개발하기 시작한다.
- 종양은 내시경 검사에서 볼 수있게되면, 각 마우스에게 내시경 종양 점수를 할당 (5 장 참조)과 유사한으로 코호트 개별 마우스를 할당 치료를 개시하기 전에 종양 부담.
- (종양 제 볼 때 또는) 40 주 동안 치료 적 화합물 또는 중요한 차량 제어를 관리.
- 투여 량의 타이밍이 치료제의 약물 동태 학적 프로파일에 의존한다 (단계 2.1 참조). 개입 치료의 예는 종양 확립 제공된다 (도 3)와 마우스에서 매주 3 회 IP 주사.
- 종양 부담을 모니터링하는 치료 적 처치 기간 동안 매주 내시경 검사를 수행한다. 일반적으로, 치료 적 처치 4 주 목적은 치료 반응에 충분하다. 치료 중단 후, 마우스의 코호트 연구는 종양 재발에 대한 내시경 검사로 모니터링 할 수있다.
- 이산화탄소 중독으로 쥐를 안락사와 주 (45), 또는 치료의 사주를 다음 중 대장 종양의 생화학 적 및 / 또는 조직 학적 분석을위한 조직을 수집합니다.
- 내시경 장비는 표준 절차 (16)에 따라 조립해야합니다.
- 멸균 및 70 % 에탄올 또는 항균 윤활제 내시경 프로브 청소.
- 동영상은 iMovie와 같은 데스크톱 또는 랩톱 컴퓨터와 미디어 표준 소프트웨어를 사용하여 기록 할 수있다. 표준 컴퓨터 모니터 대신 의료용 모니터, 내시경 검사 절차 (도 4) 동안 결장을 시각화하기에 충분하다.
- 0.2 ~ 0.4 L / min의 속도로 동시에 100 % O 2에서 3 % 이소 플루 란 챔버 5-6 쥐 그룹을 마취. 발가락 핀치에 의해 확인 마취 된 쥐, 일단; 이소 플루 란 수준은 유지 보수를 위해 0.5 %로 변경해야합니다.
- 챔버에서 개별 마우스를 제거하고 코 콘에 고정 머리와 복부면이 위를 향하도록 놓습니다. 전체 마취 모니터링해야 그들이 S가되도록 뒷다리 조정되어야마우스 뒤를 tretched.
- 건조 함을 방지하기 위해 마우스의 눈에 수의사 연고를 놓습니다.
- 이 명확하게 항문을 나타 내기 위해 낮은 척추을 충족 마우스의 꼬리를 잡으십시오. 물을 비이커에 경질 내시경 칼집을 넣고 한 번에 하나의 작은 기포의 방출을 할 수 있도록 공기 흐름을 조절합니다.
- 공기 흐름은 콜론 팽창 허용됩니다. 공기 흐름이 너무 강하면, 공기가 마우스의 복부에 주입한다. 추가 윤활이 필요하지 않습니다.
- 조심스럽게 직장에 경질 내시경 칼집을 넣습니다. 일반적으로, 내시경 마우스 곡선에 콜론을 지적하고 단단한 내시경에 액세스 할 수 없습니다되는 3cm, 최대 삽입 할 수 있습니다.
- 내시경 검사 과정에서 공통의 어려움으로 인해 대변에 대장의 내강에 대한 접근 차단합니다. 부드럽게 FECA 주위에 내시경을 조종 조심스럽게 배변을 장려하기 전에 절차를 쥐의 뱃속의 마사지, 또는하여이를 피절차를 수행하는 동안 리터의 문제. 연동 운동은 대장 근육이 이완 될 때까지 그 동안 내시경 위치에 유지해야 발생할 수 있습니다.
- 내시경 검사 절차의 모든 단계에서 동영상 촬영을 시작합니다. 질병 점수는 절차 중에 경험 조수에 의해 기록 또는 비디오 파일로부터 나중 시점에서 할 수있다.
- 내시경 검사 후, 자신의 케이지에 마우스를 반환하고 마취에서 회복하는 동안을 모니터링 할 수 있습니다. 동물 이소 플루 란 관리 코 콘에서 제거 다음 2 분 이내에 일반적으로 깨어 이동합니다.
- 이러한 절차는 숙련 된 과학자에 의해 수행되어 있는지 확인합니다. 각 내시경 검사 절차는 마우스 당 약 2 분 소요됩니다.
6. 질병 점수
- (I)의 변화를 문서화 대장염의 심각도 뮤린 내시경 지수 (MEICS) (16)로 나타내는 투명성 결장 벽의 두께 비디오 스코어 대장염을 모니터링 할(Ⅱ) (Ⅳ)을 세분화 방식으로 존재 궤양 및 재생이 영역 (V) 예금 (도 5a)에 의해 지시 피브린 출혈 대변 일관성, (ⅲ) 혈관 무결성 및 존재.
- 종양 부담을 모니터링하기 위해, 종양의 빈도와 크기에 대한 비디오를 점수. 종양 크기는 종양 (16) (도 5b)에 의해 점유 된 결장 내강의 직경에 의해 결정된다. 그것은 하나의 마우스 모두 대장염 및 종양 득점 매개 변수를 사용하는 것이 일반적입니다. 내시경, 개별 종양 및 대장 점막의 상태를 사용하면 하나의 동물에서 새로운 치료제의 성공을위한 판독을 제공하여 시간에 걸쳐 모니터링 될 수도있다.
- (선택 사항) 정지 영상 대표적인 인물 (그림 6)의 생성을 위해 동영상에서 추출 할 수 있습니다.
결과
체중 감량 일상적 마우스의 전반적인 건강을 모니터링하는 데 사용되는 대장염과 관련된 질환에 대해 모니터링 표준 매개 변수로서 사용된다. 동물 DSS가 함유에 물을 투여하는 동안 일반적으로 자신의 체중을 유지하고 정상적인 식수로 돌아 경우에만 느슨한 무게로 시작합니다. 허용 가능한 중량 손실 파라미터는 동물 기관의 윤리위원회에 따라 확립되어야한다. , 장기간 설사와 관련된 탈수를 방지 매쉬의 일상적인 조항을 사용하려면 (음식 펠릿 으깬 마시는 물 혼합) 정상 마시는 물뿐만 아니라 단백질 쉐이크로 보충.
대안 마취, 케타민 / 자일 라진 또는 유사한 제제를 사용할 수있다, 만약 이소 플루 장비를 사용할 수 없습니다. 때문에 내시경의 단단한 특성으로,이 절차는 마우스 대장의 가장 말단 3cm의 시각화 할 수 있습니다. 와 최신 내시경 (유연성 및 형광을 포함)의 추가 기능은 실험의 필요에 따라 가능하다. DSS의 해로운 영향은 주로 중간 결장에서 관찰되는 온화한 병리 마우스의 원위 결장에 한정되어 있기 때문에, 강성 내시경 개별 마우스의 점막 상태 모니터링을 방해하지 않는다. 우리가 DSS 유발 급성 대장염의 예방 적 치료를위한 프로토콜을 기술했지만,이 프로토콜은 쉽게 개입 치료 전략을 시험하기 위해 수정 될 수있다. 상피 성 대장염 및 손상을 완화하기위한 약물의 효능은 생쥐에서 종 방향으로 개개의 모니터링되고 설명 스코어링 파라미터들 (도 5)에 기초하여 정량화 될 수있다. 이 실험 프로토콜 중 특정 시점에서 마우스의 컬링을 필요 전통적인 실험 디자인 유리한이고, 시간이 지남에 따라 치료에 대한 질병 반응의 특성화를 허용하지 않는다.
t "> 인간에서 임상 연구는 개개의 환자 치료에 어떻게 반응하는지 종양에서의 상당한 변화를 강조 하였다. 여기에서 설명하는 절차는 전체 종양 부담뿐만 아니라 과정을 통해 개개의 종양의 치료 반응을 모니터링하기위한 수단을 제공한다 실험. 그것은 암 모델에 설명 된 중재 프로토콜 고려 종양 개시에 대한 치료 효과를 고려하지 않는다는 것을 고려하는 것이 중요하다. 예방 적 프로토콜, 종양 내시경으로 표시 될 때, 이전에 제공된 치료, 이 정보를 얻기 위해 요구된다. 여기에 설명 된 프로토콜을 진행에서의 치료 효과에 대한 정보를 제공하는 각각의 종양 (종양 크기에 의해 측정). 종양 퇴행이 보일 종양의 수의 감소에 의해 표시 될 수있다.g "/>
도 1 :. 급성 대장 손상 모델에서 예방 적 치료 요법의 효능을 모니터링 (a) 실험 프로토콜은 시작부터 종료까지 8 일이 필요하다. 치료법은 예방 치료를 위해 1 일에서 (나) 관리됩니다. DSS는 실험 프로토콜의 3 일에서 식수 (c)에 제공된다. 내시경 동물에서 질병의 진행을 모니터하기 위해 (d)를 행한다. 제안 시점들은 5 일, 8 (질병 부담을 결정하는) 일 0 (치료)과 2 일 (상태 모니터링)를 포함한다. 실험은 야생형 마우스 (F)은 시간이지나면서 증가 질환의 진행에있어서의 날 (8)의 (E) 아침 종료된다.
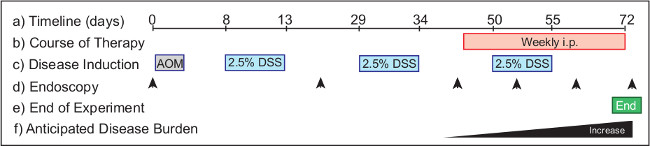
도 2 : O 모델에서 중재 요법의 효능을 모니터링F 암 대장염 관련. () 실험 프로토콜은 시작부터 완료 72 일이 필요합니다. (b)는 치료제가 개입 트리트먼트의 날 (46)로부터 설립 종양 마우스에 투여된다. AOM (c)는 제 1 일에 주입되고, DSS 8. 내시경 (d)는 동물에서 질병의 진행을 모니터하기 위해 수행되는 날부터, 실험 프로토콜의 3주기의 과정을 통해 음용수 제공된다. 제안 시점들은 (그룹 동물에 종양 부담에 따라)의 날 (치료) 0, 20 일 (상태 모니터링), 일 (40)를 포함한다. 내시경 질병 결과를 모니터링하는 치료 적 처치에 걸쳐 매주 수행된다. 실험 (E)는 40 일 이후부터 증가 야생형 마우스 (F), 종양 부하 (72)의 하루를 아침 종료된다.

그림 3 :. 자연 대장 암의 모델에 개입 치료의 효과를 모니터링 실험 프로토콜 (a)는 시작부터 완료까지> 50주이 필요합니다. (b)는 치료제가 개입 치료에 대한 설립 종양 마우스에 투여된다. AOM (c)는 실험 프로토콜의 과정을 통해, 그 후 6 주간 연속 주입을위한 제 1 일에 주입하고있다. 내시경 (d)는 동물에서 질병의 진행을 모니터하기 위해 수행된다. 제안 시점들은 격주이 (종양 부담을 설정) 후 0 일 (치료)와 8 주 (종양 모니터링) 등이 포함됩니다. 내시경 치료 결과를 모니터링하는 치료 과정 동안 매주 수행된다. 실험 (E)는 40 주째에서 증가 야생형 마우스 (F) 종양 부담을 50 주에 종결된다. P>

그림 4 :. 장비 설정 개별 장비와 내시경 장치에 대한 실험 장치 (A)는 지적했다. 개별 구성 요소와 경질 내시경 (b)가 나타났다. 스케일 바 = 2.5 cm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
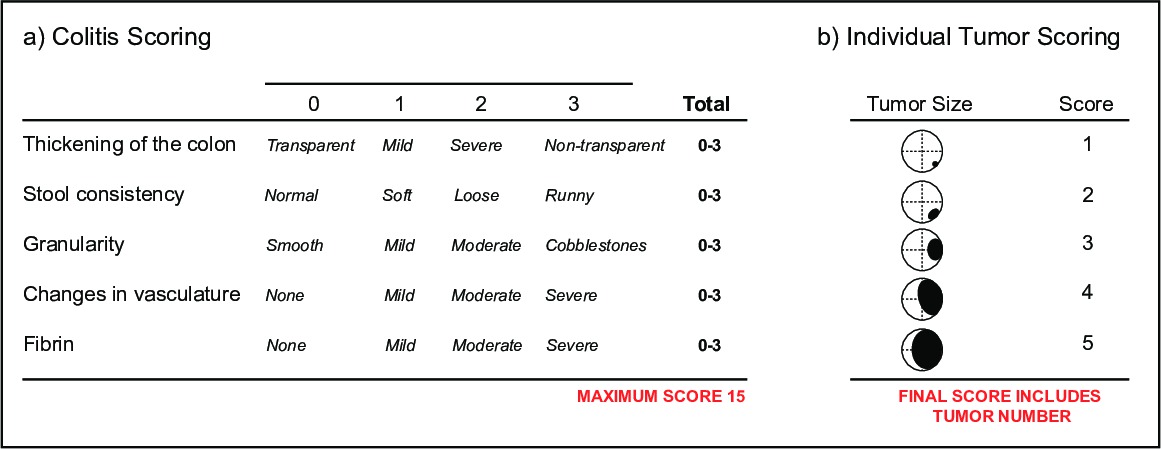
그림 5 :. 내시경에 의한 득점 질병 매개 변수 개요 () 성 대장염 심각도의 쥐 내시경 지수 (MEICS)의. 개별 종양 스코어링 파라미터 윤곽 (b).ES / ftp_upload / 52383 / 52383fig5highres.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
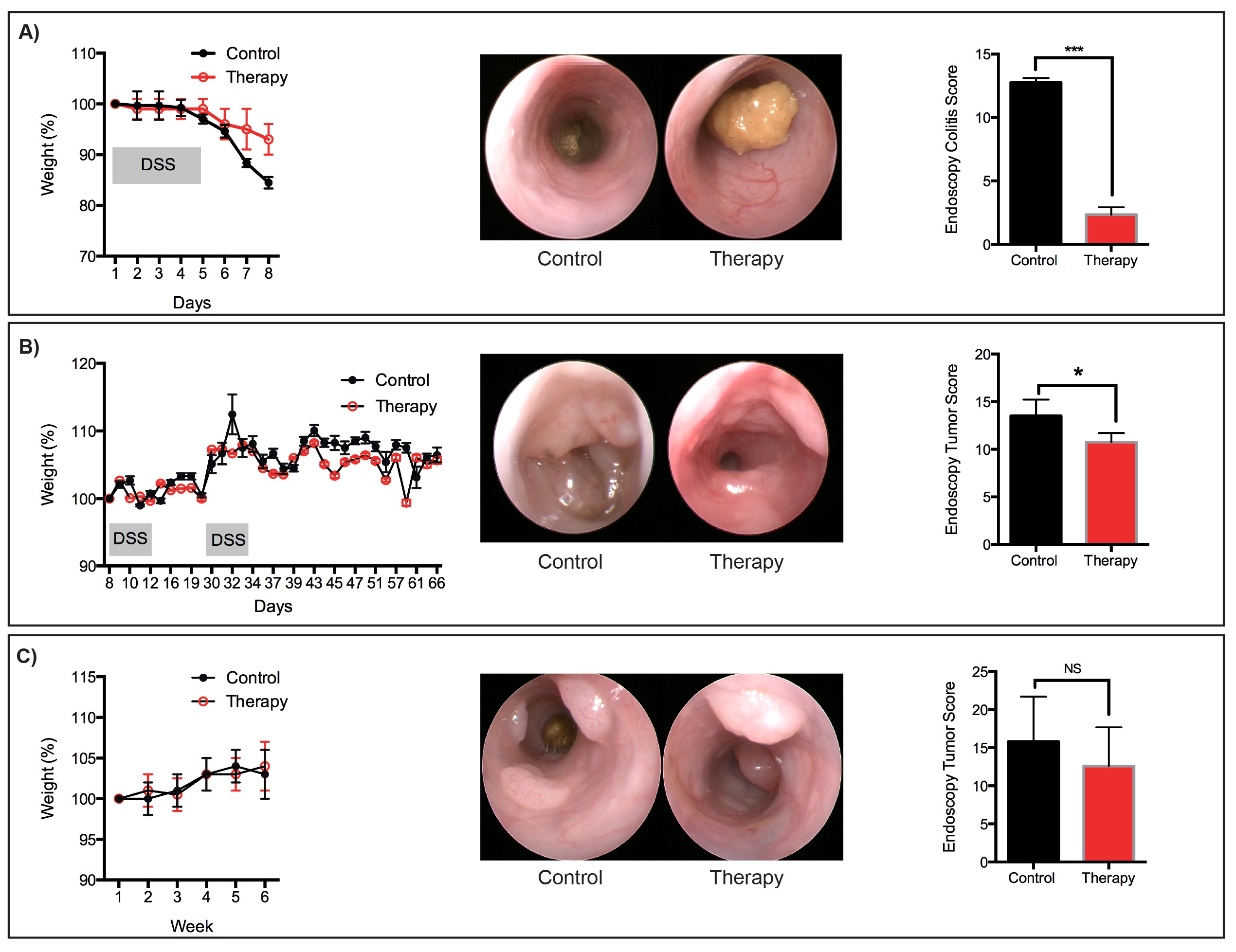
그림 6 : 대표 치료 트리트먼트 대표 체중 감량, 내시경 이미지와 점수 :. () 급성 점막 손상을 DSS는 유도 (b)는 순차에 따라 개발 된 AOM / DSS 프로토콜 다음 개발 종양 (C) 종양.. AOM 프로토콜입니다. 그룹 당 N은 = 3 마우스. * P <0.05, *** P <0.001 (학생의 T-시험). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
쥐에서 대장 질환 병리의 신뢰성과 재현성 유도의 개요 방법을 설명하는 세 가지 프로토콜을 지원합니다. 일상적인 내시경 모니터링 및 여기에 설명 된 중재 전략과 결합 할 때,이 프로토콜은 치료제의 효능에 강력한 전임상 통찰력을 제공 할 것입니다. 우리 연구소는 정기적으로 새로운 치료제 10,23,24의 성공을 모니터링하는 이러한 프로토콜을 모두 사용합니다.
전임상 동물 모델을 선택하는 새로운 치료제를 테스트 할 때 고려 사항들이있다. 이들은 인간 질병 모델의 관련성, 및 치료 대상의 동작 제안에 종양 미세 환경의 기여를 포함한다. 여기에서 우리는 설립 장내 질병 모델에서 치료 개입에 대한 세 가지 프로토콜을 제공합니다. 이러한 모델은 재현성과 질병을 유도하는 시약의 전달은 쉽게 관리 할 수 있습니다. 중요한 것은, 모델은 관련성이 높은여러 측면 및 대장염의 발병 및 종양 개시 및 진행 단계에. 연구진은 상당히 25 다를 수 있습니다 DSS 및 / 또는 AOM에 의해 유도 된 질병에 대한 감수성으로, 고려 실험을 설계 할 때 사용되는 마우스 균주의 유전 적 배경을해야합니다. 또한, 다른 미생물 군집은 세균에 의해 대사된다 AOM의 컨텍스트에서 다른 대사 능력을 가질 수있다. 우리는 하나의 실험에서 (상업 업체 포함) 다른 동물 시설에 태어난 쥐의 다른 동료를 사용에 대해 경고한다. 마찬가지로, 다른 시설에서 사용 된 생쥐에서 다른 미생물은 다른 호스트 응답이 각막 상피 손상 (11)을 유도 DSS에 유도 할 수 있습니다. 또한, (예를 들어, RNA 정화용) 조직의 적절한 분석은 후속 분석 26,27 분자에 영향을 역전사 효소를 억제하는 DSS의 능력 때문에, 고려되어야한다.
마우스 내시경 반복 마우스 개체에서 질환 발병과 진행을 모니터링하는 최첨단 기술이다. 동영상을 녹화 및 정지 영상을 추출 할 수있는 능력은 여러 질병의 매개 변수와 종양의 쉬운 모니터링을 허용합니다. 동물 복지 향상에 더하여, 내시경 관찰하는 것은 전통적 질병 결과를 추적하기 위해 서로 다른 시간 지점에서 발췌 한 실험 쥐의 여러 코호트에 대한 필요성을 감소시킨다. MEICS 채점 시스템은 조직 병리학 적 분석을위한 대체 아니지만 대안 살아있는 쥐 동물 건강 및 점막 손상을 모니터링하는 수단을 제공한다. 마우스 내시경 전문 실험실 기술이며, 모든 절차는 마우스의 적절한 조작 및 처리를 보장하기 위해,뿐만 아니라 질병 득점에 사용되는 이미지의 일관성있는 품질을 제공하기 위해 숙련 된 기술자가 수행해야합니다. 자격을 갖춘 개인의 손에, 우리는 내시경 검사가 tumo에 거의 또는 전혀 손상을 유도하는 것을 발견했다내 종양 대 출혈을 야기 RS. 그것은 초기 종양 부담을 결정하는 수단을 제공하고, 치료 약물의 투여 이전에 유사한 종양 부담과 동물 군 코호트 우리 할 수 있으므로 약술 치료 프로토콜을 위해, 우리는, 내시경 매우 유리 고려한다. 마우스의 연속 모니터링은 적시에 실패한 실험을 종료하는 옵션을 사용하여 초기에 신규 치료법의 효능을 결정하기 위해 연구를 가능하게한다.
염증성 장 질환과 대장 암 진행에 대한 우리의 이해로, 치료를위한 새로운 목표를 식별 할 수 있습니다. 적절한 동물 모델이 가장 유망한 새로운 치료법이 임상 시험을 향해 이동되는 것을 보장에 통합 될 것이다.
공개
The authors have nothing to disclose.
감사의 말
We would like to thank CSL Ltd. for supporting the purchase of the endoscopy equipment. The research in the laboratory of ME is supported by the Ludwig Institute for Cancer Research, and the laboratories of TP and ME are supported by the Victorian State Government Operational Infrastructure Support and the National Health and Medical Research Council of Australia. ME is an NHMRC Senior Research Fellow.
자료
| Name | Company | Catalog Number | Comments |
| Dextran sulfate sodium (MW 36,000-50,000) | MP Biochemicals | 160110 | Requires batch testing. |
| Azoxymethane | Sigma | A5486-100MG | Requires batch testing. |
| Vanilla protein shake | N/A | N/A | Available from hospital pharmacies. |
| Isoflurane | PPC | M60303 | This is a restricted reagent, which should be stored under lock and key. |
| 70% ethanol | N/A | N/A | Standard lab reagent. |
| Coloview miniendoscopic system | |||
| Endovision Tricam | Karl Storz | 20212001-020 | |
| Xenon 175 light source with anti-fog pump | Karl Storz | 20134001 | |
| HOPKINS straight Forward Telescope | Karl Storz | 64301AA | |
| Endoscopic sheath (total diameter 3 mm) | Kalr Stroz | 61029C | |
| Fiber optic light cable | Kalr Stroz | 69495ND | |
| Computer and media player software | Apple | iMovie | |
| Scale | Any | Any scale suitable for weighing mice. |
참고문헌
- Tenesa, A., Dunlop, M. G. New insights into the aetiology of colorectal cancer from genome-wide association studies. Nat Rev Genet. 10, 353-358 (2009).
- Rustgi, A. K. The genetics of hereditary colon cancer. Genes Dev. 21, 2525-2538 (2007).
- Rutter, M., et al. Severity of inflammation is a risk factor for colorectal neoplasia in ulcerative colitis. Gastroenterology. 126, 451-459 (2004).
- Eaden, J. A., Abrams, K. R., Mayberry, J. F. The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut. 48, 526-535 (2001).
- Lakatos, P. L., Lakatos, L. Risk for colorectal cancer in ulcerative colitis: changes, causes and management strategies. World J Gastroenterol. 14, 3937-3947 (2008).
- Xiang, B., Snook, A. E., Magee, M. S., Waldman, S. A. Colorectal cancer immunotherapy. Discov Med. 15, 301-308 (2013).
- Feng, Q. Y., et al. Anti-EGFR and anti-VEGF agents: Important targeted therapies of colorectal liver metastases. World J Gastroenterol. 20, 4263-4275 (2014).
- Dinarello, C. A. Anti-inflammatory Agents: Present and Future. Cell. 140, 935-950 (2010).
- Grivennikov, S. I., et al. Adenoma-linked barrier defects and microbial products drive IL-23/IL-17-mediated tumour growth. Nature. 491, 254-258 (2012).
- Putoczki, T., Thiem, S., Loving, A., Busuttil, R. A., Wilson, N. A., Ziegler, P., Nguyen, P., Preaudet, A., Farid, R., Edwards, K., Boglev, Y., Luwor, R. B., Jarnicki, A. J., Horst, D., Boussioutas, A., Heath, J., Sieber, O., Nash, A., Greten, F., McKenzie, B. S., Ernst, M. Interleukin-11 is the dominant IL-6 family cytokine during gastrointestinal tumorigenesis and can be targeted therapeutically. Cancer Cell. 24, 257-271 (2013).
- Perse, M., Cerar, A. Dextran sodium sulphate colitis mouse model: traps and tricks. J Biomed Biotechnol. 2012, 718617(2012).
- Rose, W. A. 2nd, Sakamoto, K., Leifer, C. A. Multifunctional role of dextran sulfate sodium for in vivo modeling of intestinal diseases. BMC Immunol. 13, 41(2012).
- Laroui, H., et al. Dextran sodium sulfate (DSS) induces colitis in mice by forming nano-lipocomplexes with medium-chain-length fatty acids in the colon. PLoS One. 7, e32084(2012).
- Miyazawa, F., Olijnyk, O. R., Tilley, C. J., Tamaoki, T. Interactions between dextran sulfate and Escherichia coli ribosomes. Biochim Biophys Acta. 145, 96-104 (1967).
- Peterson, L. W., Artis, D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nat Rev Immunol. 14, 141-153 (2014).
- Neufert, C., Becker, C., Neurath, M. F. An inducible mouse model of colon carcinogenesis for the analysis of sporadic and inflammation-driven tumor progression. Nat Protoc. 2, 1998-2004 (2007).
- Schwitalla, S., et al. Loss of p53 in Enterocytes Generates an Inflammatory Microenvironment Enabling Invasion and Lymph Node Metastasis of Carcinogen-Induced Colorectal Tumors. Cancer Cell. 23, 93-106 (2013).
- Fiala, E. S. Investigations into the metabolism and mode of action of the colon carcinogens 1,2-dimethylhydrazine and azoxymethane. 40, 2436-2445 (1977).
- Chen, J., Huang, X. F. The signal pathways in azoxymethane-induced colon cancer and preventive implications. Cancer Biol Ther. 8, 1313-1317 (2009).
- Bollrath, J., et al. gp130-mediated Stat3 activation in enterocytes regulates cell survival and cell-cycle progression during colitis-associated tumorigenesis. Cancer Cell. 15, 91-102 (2009).
- Becker, C., Fantini, M. C., Neurath, M. F. High resolution colonoscopy in live mice. Nat Protoc. 1, 2900-2904 (2006).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139, 485-498 (2009).
- Thiem, S., et al. mTORC1 inhibition restricts inflammation-associated gastrointestinal tumorigenesis in mice. J Clin Invest. 123, 767-781 (2013).
- Stuart, E., et al. Therapeutic inhibition of Jak activity inhibits progression of gastrointestinal tumors in mice. Mol Cancer Ther. 13, 468-474 (2014).
- De Robertis, M., et al. The AOM/DSS murine model for the study of colon carcinogenesis: From pathways to diagnosis and therapy studies. J Carcinog. 10, 9(2011).
- Viennois, E., Chen, F., Laroui, H., Baker, M. T., Merlin, D. Dextran sodium sulfate inhibits the activities of both polymerase and reverse transcriptase: lithium chloride purification, a rapid and efficient technique to purify RNA. BMC Res Notes. 6, 350(2013).
- Kerr, T. A., et al. Dextran sodium sulfate inhibition of real-time polymerase chain reaction amplification: a poly-A purification solution. Inflamm Bowel Dis. 18, 344-348 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유