JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
유 전적으로 변형 된 세포 이식을위한 미세 패턴 배양 플레이트에 회전 타원체 세포를 향해 유전자 형질
요약
This protocol describes a cell transplantation system using genetically modified, injectable spheroids. Cell spheroids are cultured on micropatterned culture plates and recovered after gene introduction using polyplex nanomicelles. This system facilitates prolonged transgene expression from the transplanted cells in host animals while maintaining the innate function of the cells.
초록
세포 이식의 치료 효과를 향상시키기 위해, 유 전적으로 변형 된, 주사 타원체의 이식 시스템이 개발되었다. 셀 타원체가 열성 중합체로 코팅 미세 패턴 플레이트에 배양 시스템에서 제조된다. 구 상체의 수는 폴리에틸렌 글리콜 (PEG) 매트릭스에 의해 피복 비 접착 영역에 의해 둘러싸여 정기적 이차원으로 배열되어 100 ㎛ 직경의 세포 접착 부분에 대응하는, 플레이트 상에 형성된다. 스페 로이드 쉽게 플레이트의 온도를 낮춤으로써 액체 현탁액으로서 회수 할 수 있고, 그 구조는 잘 (27 G 이상)를 충분히 큰 구경으로 주사 바늘을 통해 그들을 통과시킴으로써 유지된다. 유전 적 변형은 구형 구조를 방해하지 않으면 서 세포에 유전자를 도입 할 수있는 원래의 비 바이러스 성 유전자 전달체, nanomicelle 폴리 플렉스를 사용하여 유전자 형질 전환에 의해 달성된다. 꼼꼼한 들어알부민 식으로 나타낸 바와 같이 루시페라아제 발현 유전자로 형질 진 간세포 타원체는 루시퍼 라제는 지속 보존 간세포 기능과 함께 이식 된 동물에서 얻어진다. 이 시스템은 중간 엽 줄기 세포를 포함한 다양한 종류의 세포에 적용 할 수있다.
서문
세포 이식 치료는 다양한 난치성 질환을 치료하기 위해 널리 주목 받고있다. 이식 된 세포에 의해 분비 활성 및 생체 활성 인자의 반감기는 세포 이식 시스템의 개선 된 치료 효과에 필수적이다. 이식 이전에 세포의 유전 적 변형을 조절하고 생체 활성 인자의 분비를 포함한 세포 기능을 조작하는 유리한 기술이다. 또한 세포 사멸 또는 세포 활성의 손실을 방지하기위한 셀 유리한 미세 환경을 유지하는 것도 중요하다. 세포 간 상호 작용이 잘 보존되어있는 3 차원 (3D) 회전 타원체 세포 배양은, (일차 간세포의 알부민의 분비를 개선하고, 중간 엽 줄기 세포에서 다중 계통 분화 촉진을 위해, 예를 들어,이 목적을 위해 중간 엽 줄기 세포를 유망한 ) 1-7.
spheroi이 연구에서는, 신규 한 콤비네이션 시스템D 문화와 유전자 형질이 유전자 변형 세포 이식을위한 플랫폼 역할을하는 데 사용됩니다. 회전 타원체 세포를 만들기위한, 미세 패턴 배양 플레이트에 회전 타원체 배양 시스템이 사용된다. 이 판에, 직경 100 ㎛의 세포 접착 영역은 규칙적으로 이차원으로 배열되고, PEG 행렬 (3)에 의해 피복 된 비 접착 영역에 의해 둘러싸여있다. 세포의 적절한 수를 파종하여, 직경 100 ㎛의 3 차원 회전 타원체의 배열은 미세 패턴 문화 침대에 대응하여 형성된다.
회전 타원체는 온도 감응성 고분자, 폴리 (이소 프로필 아크릴)로 코팅 된 열성 세포 배양 플레이트를 사용하여 자신의 3D 구조 (PIPAAm) 8-10을 방해하지 않고 복구됩니다. 미세 패턴 구조는 열성 판에 구성된다 (주문 제작). 단순히 플레이트의 온도를 낮춤으로써, 타원체는 배양 베드로부터 분리되어 분산되어인산 D는 식염수 (PBS)를 버퍼. 따라서, 100 ㎛의 균일 한 크기와 타원체의 다수 주사 현탁액의 형태로 얻을 수있다.

도 1 미세 패턴 플레이트에 회전 타원체 배양 시스템의 도식 표현. 유전 적 변형이 원래 비 바이러스 유전자 전달체, nanomicelle 폴리 플렉스를 사용하여 유전자 형질 전환에 의해 달성된다. 이는 플라스미드 DNA (pDNA에) 및 폴리에틸렌 글리콜 (PEG) -polycation 블록 공중 합체 (11)로 구성된다. 이러한 특성 코어 - 쉘 (core-shell) 구조, PEG 쉘과 농축의 pDNA의 내부 코어로 구성된 치료 목적 (11)에 대한 세포로 안전하고 효과적인 유전자 도입을 허용있다. 생의 더 큰 버전을 보려면 여기를 클릭하십시오를의 그림입니다.
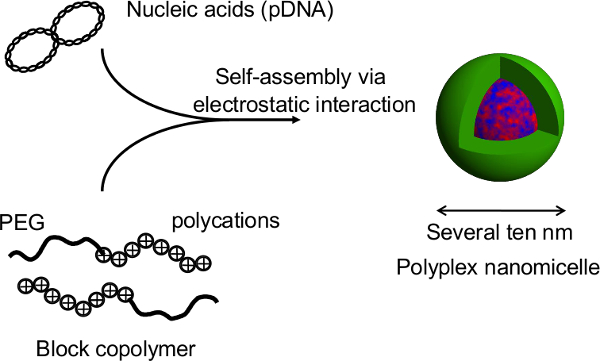
도 핵산 및 PEG-블록 폴리 양이온 블록 공중 합체의 복합체에 의해 형성된 폴리 플렉스 nanomicelle 2. 구조.이 연구에서,이 기술의 주요 장점은 회전 타원체 구조 nanomicelles 의한 유전자 형질 전환시에 파괴되지 않는다는 것이다. 일차 래트 간세포 구 상체의 nanomicelle - 매개 형질 감염 후 장기간 유전자 발현은 형질 감염되지 않은 구 상체 (12)의 것과 유사한 수준으로 간세포에서 연속 알부민 분비 개월 이상이 얻어진다. 회전 타원체에서 유전자 발현과 알부민 분비 또한 열성 판에서 회복 후 유지됩니다. 그것은 nanomicelles 안전하게 형 간염의 타고난 기능을 손상시키지 않고 유전자 도입을 용이하게 할 수 있음을 알 수있다atocytes. 따라서, 유전자 도입 nanomicelles를 사용하여 유전자 변형 세포 이식을위한 유망한 플랫폼과 열성 미세 패턴 접시에 배양 회전 타원체 세포의 결합. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Access restricted. Please log in or start a trial to view this content.
프로토콜
모든 동물 실험은 도쿄 대학의 동물 관리 및 사용위원회, 일본 도쿄의 승인을 실시 하였다.
1. 셀 준비
- 차 간세포를 들어, 수정 두 단계 콜라겐 분해 공정 (13, 14)에 의해 쥐의 간세포 분리를위한 프로토콜을 따릅니다.
- 이소 플루 란과 흡입 마취 스프 라그 돌리 (SD) 쥐 (남, 5 주 이전)를 마취. 챔버에 대한 이소 플루 란을 제공하기 위해 마취 기계에 연결된 실에 쥐를 놓습니다. 잠들기 후 쥐를 꺼내, 그리고 마스크를 사용하여 환기가 운영 테이블에 설정합니다. 쥐의 상태를 확인하여 0.7 L / 분 - 이소 플루 란은 0.4에서 약 흐름을 제어 할 수 있습니다. 8g / L 염화나트륨 이루어지는 특수 용액 (염화나트륨), 400 ㎎ / ℓ 염화칼륨 (KCl), 78 mg의로 간문맥으로부터 스프 라그 도울 리 (Sprague Dawley, SD) 랫트 (수컷 5 주령)의 간을 관류 / L소듐 디 하이드 로젠 포스페이트 디 하이드레이트 (의 NaH 2 PO 4 · 2H 2 O), 151 밀리그램 / L 나트륨, 인산 일 수소 칼슘 수화물 (NA 2 HPO 4 · 12H 2 O), 2.38 g / L 2- [4- (2- 히드 록시 에틸) -1- 피 페라 지닐] 에탄 설 폰산 (HEPES), 190 ㎎ / ℓ, 에틸렌 글리콜 디아민 테트라 아세트산 (EGTA), 350 밀리그램 / L 탄산 수소 나트륨 (NaHCO3를) 및 900 ㎎ / ℓ 글루코스.
- 간 콜라게나 통해 용액을 순환시켜.
NOTE는 : 용액 500 ㎎ / ℓ의 콜라게나 제, 9.8 g / L 행크 완충 염으로 구성되어 2.38 g / ㎖ HEPES, 556 ㎎ / ㎖ 염화 칼슘 수화물 (염화칼슘 2 · H 2 O), 350 ㎎ / ℓ의 NaHCO3, 상기 pH가 50 ㎎ / ℓ 트립신 억제제, 7.2로 조정. - 신중 간을 제거하고, 메스 블레이드를 사용하여 접시에 부드럽게 말하다 추가, 둘 베코 변형 이글 배지에 10 % 소 태아 혈청 (FBS)으로 보충 (DMEM), 및 100 ㎛를 통해 세포 현탁액을 필터나일론 메쉬. 추가 파편을 제거하기 위해 1 분 동안 20 × g에서 세포 현탁액을 원심 분리기. 이 단계에서 간세포 상등액에있다.
- 두 번 원심 분리 단계 (세 회 원심 총)을 반복합니다. 3 분 펠릿의 형태들을 복구하기 위해 마지막으로, 50 × g에서 원심 분리 간세포.
- 10 % FBS가 보충 된 DMEM으로 이루어지는 특수 배지에서 4 × 105 세포 / ml의 농도, 1 % 펜 연쇄상-공급 과잉 (PSQ), 1 % 디메틸 설폭 사이드에 간세포를 다시 일시 정지 (DMSO), 0.1 μmol / L 덱사메타손, / ㎖ 인슐린 0.5 μg의 10 밀리몰 / L의 니코틴 아미드, 0.2 밀리몰 / L 아스코르브 인산화 (ASC-2P) 및 10 NG / ㎖ 인간 표피 성장 인자 (hEGF) 15. 이 특수 매체는 시험관 조건에서 간 기능을 유지하기위한 필수입니다.
- 쥐 중간 엽 줄기 세포를 얻기위한, isoflur의 과도한 관리에 의해 스프 라그 돌리 (SD) 쥐 (남, 5 주 이전)를 안락사메탄. 대퇴골과 경골을 절제하고, 10 ml의 DMEM + 10 % FBS가 보충 된 이물질을 세정하는 뼈의 축으로 22 G 바늘을 삽입하여 골 수집 된 marrows. 100 ㎛ 나일론 메쉬를 통한 여과에 의해 세포를 수집.
- DMEM은 10 % FBS와 1 % 페니실린 / 스트렙토 마이신을 함유하여 10cm 배양 접시 상에 세포를 시드. 회전 타원체의 실험을 위해, 5 통로 내에서 중간 엽 줄기 세포를 사용합니다.
3D 셀 회전 타원체 2. 준비
- 상업적으로 세포 접착 영역이 규칙적으로 PEG 매트릭스에 의해 피복 된 비 접착 구역에 의해 둘러싸인 2 차원 방식으로 100 μm의 직경에 배열 된 미세 패턴 배양 플레이트를 얻었다.
주 : 세포 이식, 감온 중합체 PIPAAm 함께 추가적인 코팅 플레이트를 냉각하여 세포 분리를 허용 할 필요가있다 (단계 5.1 참조). 온도 변동이 중합체의 화학적 변화를 유도 할 수있다8-10. 37 ° C에서 PIPAAm는 세포가 정상 조건에서 배양 할 수 있도록 약간 소수성이다. 세포의 자연 박리에 이르는 빠른 수화 중합체의 32 ° C의 결과를 이하의 온도에서 감소. - 또한, 5 % CO 2를 함유하는 가습 분위기하에 37 ℃에서 그들을 andincubate / 4 × 105 세포의 밀도로 12- 웰 플레이트에 미세 패턴 간세포 또는 중간 엽 줄기 세포를 시드. 세포는 미세 패턴 접착 분야에 축적 점차 2 일 내에 둥근 회전 타원체를 형성 할 것이다.
주 : 단층 배양에서 대조군 세포의 제조, 통상 12 웰 플레이트를 사용하여 상술 한 것과 유사한 절차에 따라, 동일한 밀도로 세포를 시드.
폴리 플렉스 Nanomicelles 3. 준비
- (PEG Mw가 = 12 블록 공중 합체, PEG-PAsp (DET) (폴리 [(2- 아미노 에틸) -2- 아미노 에틸] aspartamide - - [N N '])을 합성000, 중합도 PAsp (DET) 세그먼트 (DP) = 59), 및 이전에 저자 (11)에 의해 기술 된 절차에 따라, 단 양이온 성 세그먼트 [PAsp (DET) (DP = 55)로 구성되는 단일 중합체, 16, 17.
- 33.3 μg의로 중합체 농도를 조절하여 10 mM의 HEPES 완충액 (pH 7.3)에서 잔류 아미노기 동등한 몰비 PEG-PAsp (DET) 블록 공중 합체의 혼합 용액과 PAsp (DET) 호모 폴리머를 준비 / ㎖ 및 각각 19.1 μg의는 / ㎖,.
주의 : 전술 한 중합체의 농도 변화 할 수있다 (10) N / P 비율의 pDNA (N / P 비율)에 인산기로 두 중합체의 총 아미노기의 잔류 몰비 nanomicelles 제조 대표 값은 (자세한 내용은 설명을 참조) 전지 종류 및 목적에 따라. 두 중합체의 병용은 엔도 좀을 향상시키기 위해 효과적인 차폐 및 PEG PAsp (DET)의 기능을 모두 달성 할 수있다탈출 (18) (자세한 내용은 토론 참조). - pCAG-GS 플라스미드에 각각의 유전자를 발현하는 세그먼트 (http://www.cdb.riken.jp/pcs/protocol/vector/map/m36.html을 복제하여의 pDNA 인코딩 Gaussia 루시 페라 제, GL4 루시 페라 제, 또는 에리트로 포이 에틴을 준비 ) 제조사의 프로토콜에 따라 상업적 키트를 사용 CAG 프로모터 / 인핸서 하에서 발현을 얻었다. 유능한 대장균 균주에서의 pDNA를 증폭하여 엔도톡신 무 플라스미드 DNA 정제 시스템을 사용하여 정제. 10 mM의 HEPES 완충액 (pH 7.3)에 150 μg의 / ml의 용액을 얻었다 260 nm의 흡광도에서의의 pDNA의 농도를 결정한다.
- (부피 기준) 1 : 폴리 플렉스 nanomicelles을 준비하기 위해 철저의 pDNA 용액 (10 mM의 HEPES 완충액에 150 μg의 / ㎖)과 (2)의 비율로 두 중합체의 혼합 용액을 혼합한다.
회전 타원체로 4. 유전자 형질
- (간세포를 세포를 품어성숙한 회전 타원체의 형성이 가능하도록 미세 패턴 판에 파종 후 72 시간 또는 중간 엽 줄기 세포). 유전자 형질 전환을 위해, 신선한 배지 1 ml의 배양 배지를 교체 한 후, 각 웰에 (의 pDNA의 10 μg의 함유) 폴리 플렉스의 nanomicelle 용액 100 μL를 추가한다. 24 시간 동안 nanomicelle 솔루션 배양을 계속합니다.
- 지질 계 형질 감염 시약을 이용하여 제어를 들어, 지질 계 시약 nanomicelle 방법 모두에 대해 동일하게 pDNA를 최종 투여 량을 조절 (3)의 중량비 시약 / pDNA에에서 시약의 pDNA 용액을 혼합한다.
셀 회전 타원체 5. 복구 및 이식
- 냉장 PBS 200 μL와 배지를 교체하고 얼음에 접시를 놓습니다.
주 : 일반적으로, 회전 타원체 약 15 분으로 분리하고 이식 현탁액의 형태로 회수 될 수있다. - 부드럽게 200 μL의 세포를 대기음생체 내 주사에 대한 23 G 또는 27 G 바늘과 주사기를 사용하여 정지.
형질 전환 유전자 발현 6. 평가
- 정확히 24 시간 신선한 배지로 교체 한 후 배지 100 ㎕ - 배지에서 분비 Gaussia 루시페라아제의 발현의 시험 관내 평가를 위해, 50 모은다. 상업적 레 닐라 루시퍼 라제 분석 시스템 및 제조자의 프로토콜에 따라 루미를 사용 루시페라아제 발현을 추정한다.
주 : Gaussia 루시 페라 일주일 이상 배지에서 안정적으로 유지. 따라서, 유전자 발현을 실시간으로 효율을 평가 샘플 매체를 수집하기 전에 하나 신선한 배지를 교체한다. 매체 변화의 타이밍은 유연 할 수있다. - 세포 이식을 다음 숙주 동물에서 유전자 발현의 생체 내 평가를 들어, BALB / C 누드 마우스 (암컷 마취; 7주이소 플루 란과 흡입 마취 이전).
- 챔버에 대한 이소 플루 란을 제공하기 위해 마취 기계에 연결된 챔버에 마우스를 놓습니다. 잠들기 후 마우스를 꺼내, 그리고 마스크를 사용하여 환기가 운영 테이블에 설정합니다. 마우스의 상태를 확인하여 0.5 L / 분 - 이소 플루 란은 0.2에서 약 흐름을 제어 할 수 있습니다.
- 복부의 피하 조직으로 (4.1에서 설명) GL4 루시페라아제 발현 형질 타원체의 pDNA를 포함하는 세포 현탁액 200 μl를 주입한다.
- (150 ㎎ / ㎏, 정맥 내 경로) 즉시 D-루시페린을 주입 한 후, 제조자의 프로토콜에 따라 IVIS 이미징 시스템을 사용하여 루시 페라 제 발현을 측정한다.
- 세포 이식의 치료 효과를 평가하기위한, 에리트로 포이 에틴으로 코딩하는 pDNA를 형질 스페 로이드를 함유하는 세포 현탁액 200 μl를 주입복부의 피하 조직.
- 혈액 (19)의 약 200 μl를 얻기 위해 턱밑 출혈로 혈액 샘플을 수집합니다. 혈액 시료 분석기를 이용하여 헤모글로빈 및 헤마토크리트를 측정한다.
참고 : 이식 세포 수는 판에 시드 숫자에 의해 조절된다. 불행히도, 타원체 내부 개수를 측정 할 수 없기 때문에 정확한 세포 수를 확인하는 것은 곤란하다.
- 혈액 (19)의 약 200 μl를 얻기 위해 턱밑 출혈로 혈액 샘플을 수집합니다. 혈액 시료 분석기를 이용하여 헤모글로빈 및 헤마토크리트를 측정한다.
- 실험 후 마취에서 각성 할 때까지 온도 컨트롤러와 연결된 가열 패드에 마우스를 놓습니다.
Access restricted. Please log in or start a trial to view this content.
결과
Gaussia 루시페라아제 발현의 pDNA 유전자 형질 전환은 폴리 플렉스 nanomicelles 또는 제어 지질 계 형질 감염 시약 (12)을 이용하여 간세포 또는 MSC들에 의해 형성된 회전 타원체 수행 하였다. 제어 시약 크게 형질 (도 3) 한 후 하루 구조를 파괴하는 반면 nanomicelles은, 미세 패턴 플레이트에 비 형질 구 상체에 비해 회전 타원체 구조에서 거의 변화가 유발하지 않는다. nanomicelles, 일관?...
Access restricted. Please log in or start a trial to view this content.
토론
이 프로토콜에서, 유전자 도입 및 회전 타원체 회복 단계 동안 회전 타원체의 3 차원 구조를 유지하는 것이 중요하다. 세포는 세포 사멸 또는 세포 활성의 손실을 방지하는 것이 유리한 미세 환경을 유지하는 것이 필수적이다. 기존의 단일 층 문화의 간세포가 급속하게 (12) 파종 후 몇 일 자신의 분비 능력을 잃게 예를 들어, 알부민 분비, 간세포의 대표 타고난 기능은 물론, 간세포 구 상체...
Access restricted. Please log in or start a trial to view this content.
공개
The authors declare that they have no competing financial interests.
감사의 말
우리는 깊이 열성 미세 패턴 배양 플레이트뿐만 아니라 과학적인 조언을 제공하기 위해 토요 고세, 도쿄, 일본에서 박사 타케시 Ikeya 및 기술 직원을 주셔서 감사합니다. 우리는 또한 동물 실험에 대한 기술 지원을 위해 양 사토미 오구라 씨 성폭력 스즈키 씨 아스카 미요시 씨와 Katsue Morii 감사합니다. 이 작품은 재정적으로 JSP를 KAKENHI 보조금 에이드에서 과학 연구에 의해 부분적으로 지원, 혁신 (COI) 프로그램의 중심과 일본 과학 기술 진흥기구 (JST)의 S-혁신 프로그램 및 JSP를 코어 - 에 코어 프로그램, A. 고급 연구 네트워크.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Pen-Strep-Glut | GIBCO | ||
| Dexamethasone | Wako Pure Chemical Industries | 041-18861 | |
| Nicotinamide | Wako Pure Chemical Industries | 141-01202 | |
| Hank’s buffered salt and L-ascorbic acid 2-phosphate (Asc-2P) | Sigma-Aldrich | A8960 | |
| Human epidermal growth factor (hEGF) | Toyobo | PT10015 | |
| Cell-able multi-well plates | Toyo Gosei | PP-12 | |
| Thermosensitive cell culture plates (Upcell) | CellSeed Inc | The micropatterned architecture is constructed on the thermosensitive plates (custom-built by Toyo Gosei) | |
| Lipid-based transfection reagent (FuGENE HD) | Promega | E2311 | |
| Renilla Luciferase Assay System | Promega | E2810 | |
| pGL4 Luciferase Reporter Vector | Promega | E6651 | |
| pDNA expressing Gaussia luciferase | New England BioLabs | N8082S | |
| Mouse erhthropoietin-expressing vector | Origene | MC208445 | |
| pCAG-GS | Kindly provided by Laboratory for Pluripotent Cell Studies, Center for Developmental Biology, RIKEN | ||
| Escherichia coli DH5α competent cells | Takara | 9057 | |
| Endotoxin-free plasmid DNA purification system | Nippon Genetics | NucleoBond Xtra EF | |
| Collagenase | Wako Pure Chemical Industries | 639-00951 | |
| Trypsin inhibitor | GIBCO | R-007-100 | |
| Luminometer | Promega | GloMax™ 96 Microplate Luminometer | |
| IVIS Imaging System | Xenogen Corp. | Xenogen IVIS Spectrum in vivo imaging system | |
| Blood sample analyzer | Sysmex | pocH-100i Automated Hematology Analyzer |
참고문헌
- Landry, J., Bernier, D., Ouellet, C., Goyette, R., Marceau, N. Spheroidal aggregate culture of rat liver cells: histotypic reorganization, biomatrix deposition, and maintenance of functional activities. J Cell Biol. 101 (3), 914-923 (1985).
- Yuasa, C., Tomita, Y., Shono, M., Ishimura, K., Ichihara, A. Importance of cell aggregation for expression of liver functions and regeneration demonstrated with primary cultured hepatocytes. J Cell Physiol. 156 (3), 522-530 (1993).
- Otsuka, H., et al. Two-dimensional multiarray formation of hepatocyte spheroids on a microfabricated PEG-brush surface. Chembiochem. 5 (6), 850-855 (2004).
- Wang, W., et al. 3D spheroid culture system on micropatterned substrates for improved differentiation efficiency of multipotent mesenchymal stem cells. Biomaterials. 30 (14), 2705-2715 (2009).
- Bartosh, T. J., et al. Aggregation of human mesenchymal stromal cells (MSCs) into 3D spheroids enhances their antiinflammatory properties. Proc Natl Acad Sci U S A. 107 (31), 13724-13729 (2010).
- Frith, J. E., Thomson, B., Genever, P. G. Dynamic three-dimensional culture methods enhance mesenchymal stem cell properties and increase therapeutic potential. Tissue Eng Part C Methods. 16 (4), 735-749 (2010).
- Nakasone, Y., Yamamoto, M., Tateishi, T., Otsuka, H. Hepatocyte spheroids underlayered with nonparenchymal cells for biomedical applications. IEICE Transactions on Electronics. E94, 176-180 (2011).
- Nishida, K., et al. Corneal reconstruction with tissue-engineered cell sheets composed of autologous oral mucosal epithelium. N Engl J Med. 351 (12), 1187-1196 (2004).
- Ohashi, K., et al. Engineering functional two- and three-dimensional liver systems in vivo using hepatic tissue sheets. Nat Med. 13 (7), 880-885 (2007).
- Sekine, H., et al. Cardiac cell sheet transplantation improves damaged heart function via superior cell survival in comparison with dissociated cell injection. Tissue Eng Part A. 17 (23-24), 2973-2980 (2011).
- Itaka, K., Kataoka, K. Progress and prospects of polyplex nanomicelles for plasmid DNA delivery. Curr Gene Ther. 11 (6), 457-465 (2011).
- Endo, T., Itaka, K., Shioyama, M., Uchida, S., Kataoka, K. Gene transfection to spheroid culture system on micropatterned culture plate by polyplex nanomicelle: a novel platform of genetically-modified cell transplantation. Drug Deliv and Transl Res. 2 (5), 398-405 (2012).
- Howard, R. B., Christensen, A. K., Gibbs, F. A., Pesch, L. A. The enzymatic preparation of isolated intact parenchymal cells from rat liver. J Cell Biol. 35 (3), 675-684 (1967).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J Cell Biol. 43 (3), 506-520 (1969).
- Tateno, C., Yoshizato, K. Long-term cultivation of adult rat hepatocytes that undergo multiple cell divisions and express normal parenchymal phenotypes. Am J Pathol. 148 (2), 383-392 (1996).
- Kanayama, N., et al. A PEG-based biocompatible block catiomer with high buffering capacity for the construction of polyplex micelles showing efficient gene transfer toward primary cells. ChemMedChem. 1 (4), 439-444 (2006).
- Itaka, K., Ishii, T., Hasegawa, Y., Kataoka, K. Biodegradable polyamino acid-based polycations as safe and effective gene carrier minimizing cumulative toxicity. Biomaterials. 31 (13), 3707-3714 (2010).
- Uchida, S., et al. PEGylated Polyplex With Optimized PEG Shielding Enhances Gene Introduction in Lungs by Minimizing Inflammatory Responses. Mol Ther. 20 (6), 1196-1203 (2012).
- Golde, W. T., Gollobin, P., Rodriguez, L. L. A rapid, simple, and humane method for submandibular bleeding of mice using a lancet. Lab Anim (NY). 34, 39-43 (2005).
- Uchida, S., et al. An injectable spheroid system with genetic modification for cell transplantation therapy. Biomaterials. 35 (8), 2499-2506 (2014).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유