JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
연속 흐름 처리를 사용하여 수행 반응의 실시간 모니터링 : 예를 들어 3 Acetylcoumarin의 제조
요약
실시간 모니터링은 연속 흐름 처리를 수행하여 빠른 반응의 최적화를 허용한다. 여기 -3- acetylcoumarin의 제조는 예로서 사용된다. 반응을 최적화하는데 필요한 단계는 다음과 같이 인 시츄 라만 모니터링을 수행하기위한 장치가 설명된다.
초록
인라인 모니터링을 이용하여, 간단하고 신속하게 연속 흐름 처리를 수행하여 반응을 최적화하는 것이 가능하다. 그것은이 기술을 이용하여 시간에 걸쳐 일관된 제품 품질을 보장하는 것도 가능하다. 우리는 여기에 라만 분광기로 시판 흐름 장치를 인터페이스하는 방법을 보여줍니다. 라만 플로우 셀은 대기압에서 작동 될 수 있음을 의미 배압 조절기 뒤에 배치된다. 또한, 상기 생성물 스트림은 플로우 셀에 들어가기 전에 튜빙의 길이를 통과한다는 사실 재료 RT에 있다는 것을 의미한다. 이는 라만 신호 강도는 온도에 의존하기 때문에 스펙트럼 등온 조건 하에서 획득하는 것이 중요하다. 장치를 조립하는 데, 우리는 다음의 화학 반응을 모니터링하는 방법을 보여, 살리 실 알데히드, 에틸 아세토 아세테이트로부터 3 acetylcoumarin 피 페리 딘의 합성 촉매는 예로서 사용된다. 흐름 속도를 반응물 범위에서 수행 될 수있다D 온도, 인 시츄 모니터링 도구는 간단하고 용이하게 조건을 최적화하기 위해 사용된다.
서문
연속 흐름 처리를 사용함으로써, 화학자들은 안전하게 효과적으로 용이성 1,2-로 화학 반응을 수행 할 수있는 범위에 있음을 발견하고있다. 그 결과, 흐름 화학 장비는 교육 기관에서 산업 설정에 모두 반응뿐만 아니라 연구소를 실행하기위한 필수적인 도구가되고있다. 합성 화학 변환의 다양한 유동 반응기는 3,4-에서 수행되었다. 선택의 경우, 일괄 적으로 동작하지 않는 반응은 연속 흐름 조건 하에서 5 순조롭게 진행하는 것으로 나타났다. 반응 최적화 및 품질 제어 모두, 인라인 반응물 흐름 프로세싱 모니터링 혼입은 상당한 이점을 제공한다. 인라인 모니터링 실제 샘플 조건에 실시간 응답에 연속 분석을 제공한다. 이 빠르며, 유사한 오프라인 기술보다 어떤 경우에는,보다 신뢰성. 인 - 라인 분석 기법의 수는 F와 인터페이스 된낮은 원자로 7. 예를 들면 적외선 등이 8,9, UV-NMR 가시 12,13, 14,15 라만 분광법 및 질량 분석법 16,17, 10,11.
우리의 연구 그룹은 과학적 마이크로파 (18)와 라만 분광기 인터페이싱있다. 이 사용의 반응 범위는 모두 19 질적 및 양적 20 관점에서 모니터링 하였다. 이러한 성공을 바탕으로, 우리는 최근 지속적인 흐름 단위 중 하나로 우리 라만 분광 인터페이스와 키 의약 관련 유기 변형 다수의 인라인 반응 모니터링을 채용 하였다. (21)가 모니터링 할 수 있었다 각 경우에 반응과 같은 일 예시에서, 검량선을 이용하여, 우리는 라만 분광 데이터로부터 제품 전환을 결정할 수있다. 여기에서 우리는 장치를 설치하고 반응을 모니터하는 데 사용하는 방법을 설명한다. 우리는 3-AC의 피 페리 딘 촉매 합성을 사용etylcoumarin (1) 여기에 모델 반응으로 에틸 아세토 아세테이트 (그림 1)과 살리 실에서.
그림 1. 자료 (1). 3 acetylcoumarin을 얻었다 살리 실 알데히드와 에틸 아세토 아세테이트 사이의 축합 반응을 촉매 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
1. 반응 모니터링에 적합한 신호를 찾기
- 모든 출발 물질 및 제품에 대한 라만 스펙트럼을 얻습니다.
- 스펙트럼 오버레이 및 제품에 고유 한 강렬한 밴드를 식별합니다.
- 반응의 진행을 모니터하기 위해 라만 밴드를 사용한다. 1,608cm에서 밴드는 -1이 경우 선정되었다.
2. 플로우 셀을 설정
- 적절한 흐름 세포를 얻습니다. 6.5 mm의 폭, 20mm의 높이 및 5mm (그림 2A)의 경로 길이 : 여기에 다음과 같은 치수 하나를 사용하십시오.
- 외광이없는 환경을 제공하는 용기의 플로우 셀을 배치했다.
- (이 경우 1mm ID PFA 튜브에서) 플로우 셀의 입구 및 출구에 배관을 연결한다.
3. 플로우 셀과 라만 분광계를 인터페이싱
- C에 배치 될 수있는가요 성 광학 어셈블리와 적합한 라만 분광을 얻기플로우 셀에 근접을 잃는다.
- 흐름 셀 어셈블리 (그림 2B)를 포함하는 상자에 적절한 크기의 구멍을 통해 광학 어셈블리를 놓습니다.
- 는 흐름 세포에 닿을 때까지 광학 어셈블리를 밀어 후 1 ~ 2 mm의 간격을두고 다시 그것을 잡아 당깁니다.
- 100 % 아세톤 흐름 셀을 채 웁니다.
- 라만 분광기를 켜고 연속 스캔 모드에서 스펙트럼을 취득.
- 부드럽게시 도광판을 분획을 이동시킴으로써 레이저 초점. 신호가 가장 큰 강도로하고 피크가 샤프하고 잘 정의 될 때까지 광 파이프를 이동하십시오.

그림 2. (A) 휴대 및 사용 (B) 라만 인터페이스 흐름. 더 큰 VE를 보려면 여기를 클릭하십시오이 그림의 rsion.
4. 시약 및 용매 솔루션을 준비
- 50 ㎖ 용량 플라스크에 (6.106 50 밀리몰를 들어, 1 당량) 및 에틸 아세토 아세테이트 (6.507 g, 50 밀리몰, 1 당량) 살리 실을 추가합니다.
- 50 ㎖의 전체 부피에 에틸 아세테이트를 추가 한 다음 내용물을 완전히 혼합한다.
- 자기 교반 막대를 함유하는 20 mL 유리 바이알에 스톡 용액 10 ㎖ 분취 량을 전송. 이 유리 병 "시약을."레이블
- 100 ㎖ 병 위의 에틸 아세테이트 90 mL에. "용매"이 병 레이블. 100 ㎖ 병 장소 아세톤 90 mL 중에. 이 병 "용매 절편을"레이블.
5. 흐름 장치를 준비
- "P1"및 "P2"를 유동 장치는 적어도 두 개의 펌프가 있는지 확인하고 레이블을 붙입니다. 각 펌프에 대한 용매와 시약 입구 라인을 확인합니다. 두에 "수집"및 "폐기물"라인에서 출구 라인을 놓고 전ndividual 100 ㎖ 병은 각각 "제품"및 "폐기물"로 표시된.
- 반응기로서, 가열 될 수있는 10 ㎖ 용량 PFA 코일을 사용한다.
- PFA 반응기 코일의 입구에 튜브 종료 (P1)를 연결합니다.
- 반응기 코일 후 3 포트 폴리 에테르 에테르 케톤 (PEEK) - 티 혼합기를 설치한다.
- , 티 - 믹서 반응기 코일 출구 튜브에서 180 ° 튜브 종료 (P2)를 연결합니다. 티 - 믹서의 제 3 포트에 튜브의 조각을 연결합니다. 이 관의 타단에 배압 조절기를 배치했다.
- 플로우 셀의 입력에 배압 조절기의 출력으로부터 라인을 연결한다. "폐기물 / 수집"스위치에 흐름 전지의 출력에서 회선을 연결합니다.
- 프라임 P1과 P2뿐만 아니라 용매 (P1)의 시약 라인 모두를위한 용매 라인. 시약 병에 용매 병에서 P1의 시약 라인을 이동합니다.
- P1을 사용하여, 반응기를 에틸 아세테이트 합격2ml의 코일에 / 분이를 때까지 충전된다. 2 분 / 2 ml의 유속으로 P2를 통해 분 아세톤 합격.
- 1 ml / 분에게 모두 P1 및 P2에 대한 용매 유량을 조정합니다. 7 bar의 압력을 배압 조절기를 설정한다. 원하는 온도까지 반응기 코일 온도를 설정한다.
- 그림 3의 회로도와 같이 장비가 구성되어 두 번 확인합니다.
- 시스템은 일정 온도 및 압력에 도달하면, 누출을 확인하고, 반응을 실행.
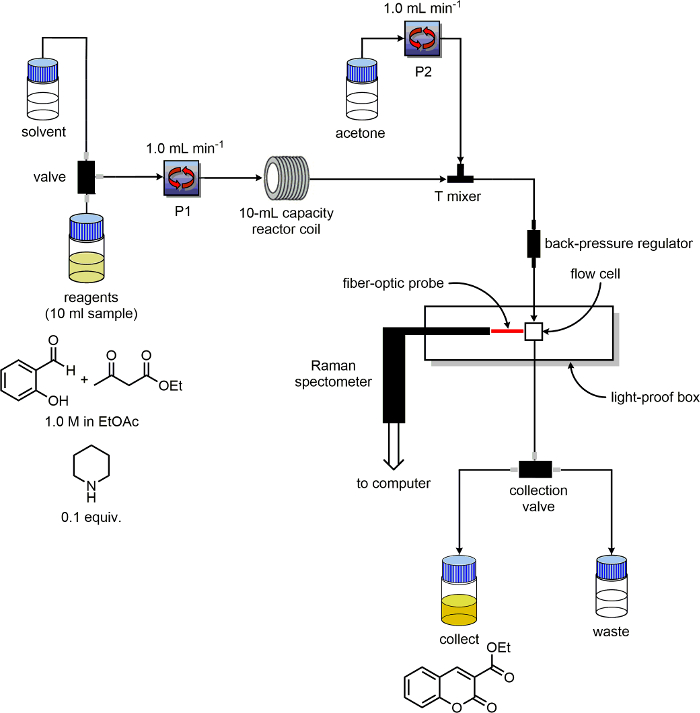
그림 반응 모니터링 실험에 사용되는 장비 구성 3. 도식. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
6. 반응을 모니터링
- 탁에틸 아세테이트 / 아세톤 용매 계의 EA 백그라운드 스캔이 플로우 셀을 통과있다. 이것은 자동으로 모든 후속 검사에서 차감됩니다.
- 스캔마다 15 초 걸릴 분광계 구성 (이 경우 라만 분광기는 10 초 적분 시간에 박스 카 = 3을 설정하고, 1 = 평균 하였다).
- "시약"라는 레이블이 붙은 유리 병에 한 번에 (0.05 ㎖, 0.05 밀리몰, 0.1 당량) 피 페리 딘을 주입한다.
- 철저히에서, 스위치 (P1)을 혼합 한 후 "시약."할 수있는 출구 스트림 "용매"설정 "을 수집합니다."
- 모든 재료가 완전히 위로 "시약"에서, 스위치 (P1) "용매를."로드 될 때 또 다른 30 분 동안 원자로 코일을 통해 용매 흐르는 계속합니다. 이 시간이 경과되면, 난방을 끄십시오.
- 원자로 코일 온도가 50 ° C 이하로 냉각되면 전원을 켜고은 P1과 P2 오프 펌프.
7. 데이터 분석
- 1,608cm -1 대에서 스프레드 시트 플롯 라만 강도 라만 분광기 데이터를 내보낼 시간.
- 조건을 최적화하기 위해, 반복적 인 방식으로 유량 및 반응기 온도의 숫자에서 반응을 수행한다.
- 1,608cm -1 대에서 라만 강도의 오버레이 플롯 시간.
주 : 높은 라만 강도가 높은 제품 변환과 상관.
8. 최적화 된 조건을 사용하여 반응을 실행
- 스크리닝 다양한 조건 (가변 유량 / 반응기 온도)을 갖는, 높은 변환 생성물을 수득하기 위해 최적화 된 조건을 이용하여 반응을 실행.
9. 제품을 분리
- 제품 플라스크의 내용물을 얼음 100 ㎖ 및 2 M 염산 20 ㎖를 넣은 비커에 넣고, 그것을 붓는다.
- 비이커에 에틸 아세테이트 (2 mL) 및 전사 최소량 상품 플라스크를 씻어.
- 얼음 혼합물을 교반모든 얼음이 완전히 녹아 때까지.
- 허쉬 깔때기, 사이드 암 플라스크, 고무 칼라 고무 진공 튜브의 길이와 여과 시스템을 설정합니다.
- 진공 하에서 생성 된 침전물을 필터링 냉 디 에틸 에테르 (10 ㎖)로 세정하고 가열 램프 (2-3 시간) 또는 건식 O / N 진공하에 건조 할 수있다.
- 용매로서 사용을 CDCl3 1 H 핵 자기 공명 (NMR) 분광법에 의한 생성물의 신원을 확인한다. 다음 500 MHz의 NMR 분광계를 들어, 3 acetylcoumarin의 1H NMR 데이터는 : δ = 2.73 (S, 3 H) 7.31-7.40 (m, 2 H) 7.65 (DDD, J = 7.53, 4.37, 2.60 Hz의 , 2 H) 8.51 (S, 1H) PPM, 13 C NMR 데이터 : δ = 30.84 (CH 3) 117.00 (CH) 118.56 (C) 124.86 (CH) 125.27 (CH) 130.51 (CH) 134.68 (C) 147.74 (CH) 155.64 (C) 159.52 (C) 195.77 (C) PPM.
결과
3 acetylcoumarin의 연속 흐름 준비가 인라인 모니터링을위한 대표적인 반응으로 선택되었다. 용매로서 아세트산 에틸을 사용할 때 일괄 적으로, 반응이 충분히 진행한다. 그러나, 제품 (1)을 실온에서 완전히 용해되지. 배압 조절기의 전위 막힘을 방지뿐만 아니라, 신호 포착을 교란 할 플로우 셀에 고체 입자를 갖는 위험을 완화하기 위해, 우리는 우리가 다른 반응 (22)에 대해 이?...
토론
라만 분광기는 유동 장치와 인터페이스 할 수있는 용이성 반응 모니터링에 유용한이 인라인 기술한다. 반응 변수의 수는 사용자가 빠른 오프라인 방법을 사용할 때보다 최적의 반응 조건에 도달 할 수 있도록 신속하게 탐색 할 수있다. 또한 본원에 설명 된 기술의 애플리케이션은 적합한 대역이 발견 될 수있다 가정하면, 부 생성물의 형성을 모니터링 할 수있다. 조건은 또한 불순물의 양이 낮은 ...
공개
The authors have nothing to disclose.
감사의 말
Financial support provided by National Science Foundation (CAREER award CHE-0847262. We thank Vapourtec Ltd and Enwave Optronics for equipment support, and Daniel Daleb of the University of Connecticut for his assistance in construction of the flow cell apparatus.
자료
| Name | Company | Catalog Number | Comments |
| Salicylaldehyde | Sigma-Aldrich | S356 | Reagent Grade, 98% |
| Ethyl acetoacetate | Acros Organics | 117970010 | 99% |
| Piperidine | Sigma-Aldrich | 104094 | Reagent Plus, 99% |
| Hydrochloric acid | Sigma-Aldrich | 320331 | ACS Reagent, 37% |
| Ethyl acetate | Sigma-Aldrich | 34858 | CHROMASOLV, for HPLC, >99.7% |
| Acetone | Sigma-Aldrich | 650501 | CHROMASOLV, for HPLC, >99.9% |
| Flow cell | Starna Cells | 583.65.65-Q-5/Z20 | |
| Flow unit | Vapourtec | E-series system | |
| Raman spectrometer | Enwave Optronics Inc | Model EZRaman-L |
참고문헌
- Wiles, C., Watts, P. . Micro Reaction Technology in Organic Synthesis. , (2011).
- van den Broek, S. A. M. W., et al. Continuous Flow Production of Thermally Unstable Intermediates in a Microreactor with Inline IR-Analysis: Controlled Vilsmeier–Haack Formylation of Electron-Rich Arenes. Org. Process Res. Dev. 16 (5), 934-938 (2012).
- Baxendale, I. R. The integration of flow reactors into synthetic organic chemistry. J. Chem. Technol. Biotechnol. 88 (4), 519-552 (2013).
- Malet-Sanz, L., Susanne, F. Continuous Flow Synthesis. A Pharma Perspective J. Med. Chem. 55 (9), 4062-4098 (2012).
- Hartwig, J., Metternich, J. B., Nikzad, N., Kirschning, A., Ley, S. V. Continuous flow chemistry: a discovery tool for new chemical reactivity patterns. Org. Biomol. Chem. 12 (22), 3611-3615 (2014).
- De Beer, T., et al. Near infrared and Raman spectroscopy for the in-process monitoring of pharmaceutical production processes. Int. J. Pharm. 417, 32-47 (2001).
- McMullen, J. P., Jensen, K. F. Integrated microreactors for reaction automation: New approaches to reaction development. Annu. Rev. Anal. Chem. 3, 19-42 (2010).
- Moore, J. S., Jensen, K. F. Automated multitrajectory method for reaction optimization in a microfluidic system using online IR analysis. Org. Process Res. Dev. 16 (8), 1409-1415 (2012).
- Carter, C. F., et al. ReactIR Flow Cell: A New Analytical Tool for Continuous Flow Chemical Processing. Org. Process Res. Dev. 14 (2), 393-404 (2010).
- Ferstl, W., et al. Inline Analysis in Microreaction Technology: A Suitable Tool for Process Screening and Optimization. Chem. Eng. Technol. 30 (3), 370-378 (2007).
- Benito-Lopez, F., et al. Optical fiber-based on-line UV/Vis spectroscopic monitoring of chemical reaction kinetics under high pressure in a capillary microreactor. Chem. Commun. (22), 2857-2859 (2005).
- Gökay, O., Albert, K. From single to multiple microcoil flow probe NMR and related capillary techniques: a review. Anal. Bioanal. Chem. 402 (2), 647-669 (2012).
- Jones, C. J., Larive, C. K. Could smaller really be better? Current and future trends in high-resolution microcoil NMR spectroscopy. Anal. Bioanal. Chem. 402 (1), 61-68 (2012).
- Mozharov, S., et al. Improved Method for Kinetic Studies in Microreactors Using Flow Manipulation and Noninvasive Raman Spectrometry. J. Am. Chem. Soc. 133 (10), 3601-3608 (2011).
- Chaplain, G., Haswell, S. J., Fletcher, P. D. I., Kelly, S. M., Mansfield, A. Development and evaluation of a Raman flow cell for monitoring continuous flow reactions. Aust. J. Chem. 66 (2), 208-212 (2013).
- Browne, D. L., et al. Continuous flow reaction monitoring using an on-line miniature mass spectrometer. Rapid Comm. Mass. Spectrosc. 26 (17), (1999).
- Koster, S., Verpoorte, E. A decade of microfluidic analysis coupled with electrospray mass spectrometry: An overview. Lab Chip. 7 (11), 1394-1412 (2007).
- Leadbeater, N. E., Schmink, J. R., Hamlin, T. A., de la Hoz, A., Loupy, A. Tools for Monitoring Reactions Performed Using Microwave Heating. Microwaves in Organic Synthesis. 1, 327-376 (2012).
- Leadbeater, N. E., Schmink, J. R. Use of Raman spectroscopy as a tool for in situ. monitoring of microwave-promoted reactions. Nature Protoc. 3 (1), 1-7 (2008).
- Schmink, J. R., Holcomb, J. L., Leadbeater, N. E. Use of Raman spectroscopy as an In Situ. Tool to Obtain Kinetic Data for Organic Transformations. Chem. Eur. J. 14 (32), 9943-9950 (2008).
- Hamlin, T. A., Leadbeater, N. E. Raman spectroscopy as a tool for monitoring mesoscale continuous-flow organic synthesis: Equipment interface and assessment in four medicinally-relevant reactions. Beilstein J. Org. Chem. 9, 1843-1852 (2013).
- Kelly, C. B., Lee, C., Leadbeater, N. E. An approach for continuous-flow processing of reactions that involve the in situ. formation of organic products. Tetrahedron Lett. 52 (2), 263-265 (2011).
- Wren, S. N., Donaldson, D. J. Glancing-angle Raman spectroscopic probe for reaction kinetics at water surfaces. Phys. Chem. Chem. Phys. 12, 2648-2654 (2010).
- Leadbeater, N. E., Smith, R. J. Real-Time Monitoring of Microwave-Promoted Suzuki Coupling Reactions Using in Situ. Raman Spectroscopy. Org. Lett. 8 (20), 4589-4591 (2006).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유