JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
전기장에 의한 해제 및 측정 (EFIRM)에 의해 Exosomal 바이오 마커의 검출
Erratum Notice
요약
Exosomes are microvesicular structures found within biofluids that potentially carry important disease discriminatory biomarkers. Here, a novel method is used to specifically extract exosomes and rapidly test the exosomal cargo for both RNA/protein targets following the disruption of exosomes using non-uniform electric cyclic square waves.
초록
엑소 좀은 세포 간 의사 소통의 매개 역할을 microvesicular 구조입니다. 그것은 그들이 질병 차별적 인 바이오 마커를 가지고 있는지 확인 엑소 좀의 내부화물을 연구하는 관심입니다. exosomal 분석을 수행하기위한, 그것을 추출하여 내부 콘텐츠를 손상시키지 않고 타겟 biofluids에서 엑소 좀을 분석하기위한 방법을 개발하는 것이 필요하다.
전계 방출 유도 및 측정 (EFIRM)는 구체적 biofluids에서 엑소 좀을 추출 그들의화물을 하역하고, 내부 RNA / 단백질 함량을 테스트하기위한 방법이다. 항 인간 CD63에 특이적인 항체를 사용하여 자성 미립자, 엑소 좀은 제 biofluids으로부터 침전된다. 다음 추출, 저전압 전기 순환 구형파 (CSW)는 기공을 막 중단 및화물 하역의 원인에 적용됩니다. 엑소 좀의 함유량 ...로서 대한 전극 표면에 고정화 DNA 프라이머 또는 혼성화 항체분자 내용의 ntification.
EFIRM 방법은 용해 완충액없이 분석 엑소 좀의 추출 및 언화물 유리하다. 이 방법은 엑소 모두 RNA와 단백질의 특이 표적 바이오 마커 검출을 수행 할 수있다. 크기 기반의 기술과 반대로 EFIRM 특히 그 표면 마커에 기초하여 엑소 좀을 추출한다.
투과 전자 현미경 (TEM) 분석은 엑소 및 캡쳐 및 분석을위한 방법의 기능을 설명한다. EFIRM 방법은 인간 폐암 H640 세포를 주입 구 마우스의 분석 식염수 컨트롤을 수신 (11) 쥐에 대해 자신의 엑소 프로파일을 테스트하기 위해 (엑소 마커 인간 CD63-GFP를 발현하는 형질 감염된 세포주) exosomal 도포 하였다. exosomal 바이오 마커의 상승 된 레벨 (참고 GAPDH 유전자 및 단백질 표면 마커 인간 CD63-GFP)는 H640 모두 혈청 및 타액 샘플 주입을 위해 쥐를 발견 하였다. 또한, SalI로버지니아 및 혈청 샘플은 선형성 (R = 0.79)가 입증되었다. 이러한 결과는 말초 질환의 검출을위한 타액 엑소 바이오 마커의 실행 가능성에 대한 암시이다.
서문
엑소 조사 RNA 1, 2 DNA 및 단백질 3화물을 운반 지질 마이크로 소포를 검사 조사의 새로운 분야입니다. 엑소 생물학의 이전 조사는 혈액 4, 소변 5, 모유 6, 침 7로 biofluids에서 엑소 좀의 식별을 주도했다. 연구는 원격으로 본체 (8)의 서로 다른 시스템 간의 통신을 명상, 엑소 좀 다른 세포질 통로에 역할을한다는 것을 증명하고있다. 역할의 엑소 좀은 세포 간 통신에서 재생하기 때문에, 그들이 질병 상태와 상관 생체 분자 표적 (단백질, RNA 및 DNA)를 패키지 가설이 성립된다. 시험관 3 및 동물 모델 (9) 연구는이 가설을 확증하기 위해 나타납니다. 바이오 마커 발견에 대한 콘텐츠를 조사 exosomal, 그것은 선택적 엑소 biofluids로부터 격리를위한 방법론을 개발하는 것이 필요하다, 유도 expulsi엑소 좀에서화물 및 엑소 생체 분자의 정량에. 이 일의 범위에서, 엑소 좀은 구조가 약 70 ~ 100 nm의 직경을 갖는 표면 마커 CD63을 갖는 것으로 정의한다.
연구진은 일반적으로 첫 번째 초 원심 분리 (10)에 의해 엑소 좀을 정화하고 용해 버퍼 키트의 사용을 통해 exosomal 내용을 처리합니다. 용해 버퍼 방법의 사용은 분에서 시간에 이르기까지 배양 시간이 필요합니다. 이 과정은 잠재적으로 엑소화물을 손상 및 열화를 샘플링 될 수 있습니다. 예를 들어, 주변의 세포 외 환경으로 용해 완충액을 통해 방출 타액 엑소의 RNA는 exosomal의 RNA 후 - 용균 측정 안정화 시약 (11)의 첨가없이 특히 어려운 태스크를 버퍼링하게 1 분 아래의 반감기를 갖는다. 용해 및 안정화를위한 다양한 시약을 추가하는 복리 효과는 복잡 에이전트를 소개하고 analy을 방해 할 수 있습니다exosomal 내용의 동생. 또 다른 방법은 빠르게 exosomal 내용을 하역하고 안전하게 특성에 대한화물을 보존 도움이 될 수 있습니다.
본 연구에서는 exosomal 콘텐츠 릴리스 불균일 전기장의 사용을 제안한다. 전기 필드는 편광 및 세포막을 형성하는 지질 이중층을 방해하는 기능을 수행하는 것으로 알려져있다. 우리의 실험 작업은 엑소 좀의 마이크로 소포 구조를 방해하고 수행화물을 해제하기위한 비 균일 순환 구형파 (CSW)의 사용을 탐구한다. 이 방법은 대부분의 생체 분자가 중단되지 않을 것임을 의미하는 수백 밀리 볼트 범위의 전압을 사용합니다. 우리는 환상 구형파의 사용량이 주변 환경으로의 유체 타액 엑소 mRNA의 함량의 방출을 작동 할 수 있다는 것을 입증한다. exosomal 함량이 릴리스 원활 바이오 마커의 발현 정도를 정량화하는데 사용될 수있다 전극 시스템과 통합되어 12,13.이 제안 된 방법은 엑소 콘텐츠의 빠른, 민감한, 그리고 용해 버퍼 무료로 분석 할 수 있습니다.

EFIRM 워크 플로우 1. 개요를 그림.. EFIRM 방법은 크게 정화 및 분석 엑소 좀에 필요한 세 가지 주요 단계로 구분된다.
이 CSW exosomal 기반 컨텐츠 방출 및 분석 방법은 엑소 격리를위한 자기 고유의 CD63 마이크로 비드와 함께 사용된다. 이러한 CD63-친화 비즈 타액 샘플 (및 기타 biofluids)에서 엑소 좀의 선택적 분리를 위해 할 수 있습니다. 인큐베이션과 자화 비드 엑소 좀을 이용하여 추출 후, 비드는도 1. 컨텐츠 방출 실험과 분석을 기초 부 CSW위한 전기 화학적 센서 시스템으로 마이그레이션 작업의 개요를 제공 아르EFIRM 방법의 흐름.
프로토콜
1. 자기 비드 기반 엑소 추출
- 비드를 재현 탁하는 마이크로 원심 분리 튜브에 인산 완충 생리 식염수 (PBS) 완충액 495 ㎕를 스트렙 타비 딘으로 코팅 된 자성 미립자의 5 μL의 혼합 된 용액을 피펫. 자기 랙을 사용하여 세 번 세척하고 PBS 500 μL와 구슬을 재현 탁. 랙 샘플 튜브를 마이크로 원심 수납 할 하우징 유닛의 측면에 자석의 배열이다.
- 각각의 세척을 위해, 먼저 튜브 1 분 동안 선반에 앉아서 조심스럽게 구슬을 방해하지 않고 뜨는 버퍼를 제거하기 위해 피펫 팁을 사용하자.
- 측면에 자석이없는 일반 랙에 튜브를 놓습니다. 튜브에 PBS의 500 μl를 추가하고 함께 해결책과 구슬을 혼합하는 피펫을 사용합니다. 다시 용액으로부터 비드를 분리하는 자기 선반에 다시 넣어 튜브.
- PBS의 자화 및 재 부유를 통해 버퍼의이 제거를 수행합니다3 회 총. 이 자성 입자의 초기 세척을 수행한다.
- 자기 랙의 비자 성 부분 상에 배치 된 튜브, PBS 완충액 490 μL로 비드를 재현 탁. 피펫 구슬의 혼합물에 1.0 ㎎ / ㎖ 농도의 스톡 오티 닐화 마우스 항 인간 CD63 항체 5 μL. 용액에 구슬과 항체를 혼합하는 피펫을 사용합니다.
- 샘플 회에 구슬과 비오틴 항체 혼합물의 microcentrifuge 튜브를 놓습니다. 90 ° 5 초 동안 기울를 1 초 동안 5 °에서 진동에 왕복 회전에 대한 샘플 회전의 회전 매개 변수를 설정합니다. 실온에서 30 분 동안 이러한 매개 변수에 샘플 비드 혼합 튜브를 회전합니다.
- 결합 후 결합되지 않은 항체를 제거합니다.
- RT에서 회전 30 분 후, 5 분 동안 다시 자기 랙에 튜브를 배치합니다.
- 마이크로 피펫을 이용하여 액체 상을 제거하여 구슬 세 세척을 수행하고, 500 μ 씻어; PBS의 리터. 트리플 세척 한 후, 랙의 자화되지 않은 부분에 490 카제인 PBS의 μL과 장소에 구슬을 재현 탁.
- 항체 코팅 구슬을 사용 엑소 추출.
- 타겟 샘플 ID와 각 튜브 레이블. 마이크로 원심 튜브에 혈청 또는 타액의 10 μL 샘플을 피펫. 여러 번 피펫 팅하여 샘플 및 자기 구슬을 혼합하는 피펫을 사용합니다.
- 회 전자에 샘플 및 안티 인간 CD63 항체 구슬 튜브를 삽입하고 실온에서 2 시간 동안 회전합니다. 단계 1.2에 기재된 바와 같이 동일한 회 파라미터를 사용한다.
- 회전 샘플의 2 시간 후, 솔루션에서 별도의 구슬 자화 마이크로 피펫과 액상을 제거하고, 트리스 - 염산 완충액 500 μL에 구슬을 재 부유하여 트리플 세척을 수행합니다. 결과 구슬은 이제 엑소 좀 바인딩 및 전기장 방출 및 측정을위한 준비가되어 있습니다.
2. 전기장 유도 출시차 Exosomal 내용의 측정
- GADPH 프라이머와 전극의 초기 프리 코팅
- 플라스틱 잘은 개별 전극의 교차 오염을 방지하기 위해 전극 배열을 적용합니다. 이 실험을 위해, 베어 금으로 제조 작업, 카운터 및 기준 전극으로 구성된 어레이의 각 전극 부 16 센서 전극 어레이를 사용한다.
- 초순수 증류수로 튜브에 재고 시약을 피펫 팅 100 nm의 DNA 프로브, 0.3 M KCl을, 10 mM의 피롤의 재고 혼합물을 준비합니다. 와동에 의해 철저하게 섞는다.
참고 : 본 연구를 위해, 선택된 DNA 프로브 엑소 좀 내에 존재하는 것으로 알려져 참조 GAPDH 유전자에 대응한다. 사용되는 프로브 서열은 다음과 '- 비오틴 AGGTCCACCACTGACACGTTG 5'-3. 모든 전극에이 혼합물을 사용합니다. - 피펫 각 금 전극의 표면 상에 모노머-DNA 프로브 혼합물을 60 μL. 작업, (C)의 적절한 범위가되도록하여 전극을 검사액체 혼합물에 의해 ounter, 전극과 기준 전극.
- 프로브 Electropolymerize 단량체 혼합물을 전극 표면에 환상 구형파 (CSW) 전계 프로파일을 적용하여 전극 표면에 전도성 고분자 층을 생성한다. 이 전기장은 9 초 동안 350 MV를 적용하고 바로 1 초 동안 950 MV로 전환 구성되어 있습니다. 인가 전기장의 100 초, 총 10 사이클 용 전극이 환상 구형파 프로파일을 적용한다.
- 전극의 표면으로부터 액체를 제거하는 센서 표면을 증류수와 질소 가스와 건조로 3 회 헹군다. 그 액체가 제대로 전극에서 제거되어 있는지 확인합니다.
- 엑소화물 하역
- 로드 5 비드 - 엑소 좀 복잡한 혼합물의 495 μL에 검출기 프로브의 1 μM의 μL와 혼합 피펫을 사용합니다.
주 : 검출기 프로브가 3 '말단에 형광 분자에 접합 된 DNA 프라이머 서열이다. 검출기 확률값본 연구를 위해 사용 된 전자 서열 엑소 좀 내에있는 GAPDH mRNA에 대응한다. 형광 검출기 공액 프로브의 서열은 : 5'- 플루오 레세 GCAGTGGGGACACGGAAGGCC-3 '. - 피펫 아래 자석 배열과 금 전극 표면 상에 프로브와 엑소 - 비드 복합체의 60 μL. 이 자석 어레이가 센서의 작용 극에 대응하도록 정렬 된 여섯 2.54 mm 직경 네오디뮴 자석으로 이루어져있다.도 2a는 자석 비드 - 엑소 용액의 배치를 도시한다.
- 샘플이 전극 표면에로드되면, -300 MV에서 9 초 및 200 MV (200 초 총)에서 1 초에 CSW 전기장의 20주기를 적용합니다. 해제 exosomal화물은 전극의 표면에 프라이머 혼성화한다. 엑소 좀의 표면 마커는 조사의 대상이되는 경우. 실험의이 부분을 건너 2b는이 과정을 도시한다. <리> 워시 오프 트리플 증류수로 전극 표면을 세정함으로써, 전극 표면에 결합되지 않은 분석 물질. 질소 가스와 함께 전극을 건조.
- 로드 5 비드 - 엑소 좀 복잡한 혼합물의 495 μL에 검출기 프로브의 1 μM의 μL와 혼합 피펫을 사용합니다.
- 기자 항체 및 판독
- (1,000 희석 1 HRP) 카제인 / PBS에 희석 고추 냉이 과산화 효소에 결합 150 단위 / ml의 방지 형광 항체의 60 μl를 추가합니다.
- 프로브 샌드위치 복잡한 안티 플루 HRP에 전기장 구동 결합을 사용합니다. 1 초와 전극 표면에 5 사이클을 1 초 동안 500 MV에 대해 -200 MV를 적용합니다. 그림 2a는 단백질과 핵산 시스템 모두에 대해 캡처 및 검출기 프로브 단지를 보여줍니다.
- 증류수 및 질소 가스를 이용하여 건식 세척 트리플 센서면.
- 언 바운드 초과 방지 형광 항체의 워시 오프에 이어, 3,3 ', 5,5'- 테트라 메틸 벤지딘 (TMB) 기판의 60 μl를 추가합니다. 멀티 채널 피펫을 사용하여 각 센서 표면에이 기판을 넣습니다.
- . 16 개의 채널을 동시에 측정 할 수있는 전기 화학적 텐쇼을 60 초 동안 사용하여 -200 Mv로, 전극 전류를 측정함으로써, 현재의 판독 전류 측정을 수행 2C는 판독시 전류 프로파일의 일례도이다.
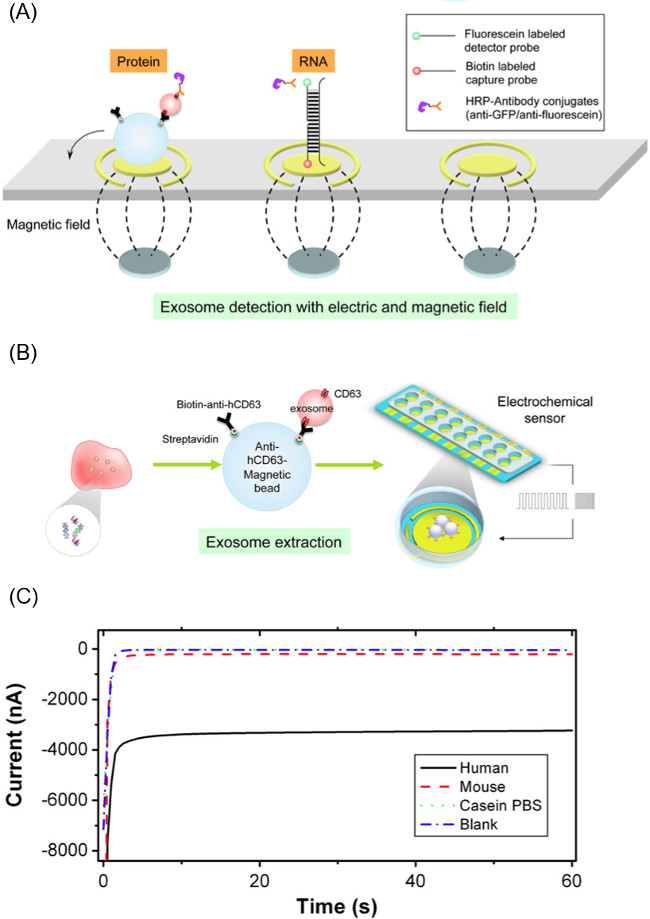
EFIRM 방법 그림 2. 구성 요소. (A) 항 - 인간 CD63 코팅 자성 미립자를 사용하여 체액에서 엑소 좀을 추출하고 입자 엑소 좀 복잡한에 적용 순환 광장 파도를 사용 엑소화물을 하역하는 방법. 릴리스 엑소에서 RNA / DNA / 단백질 표적을 검출하기 위해 사용되는 바이오 센서의 전극 (B) 방식. 큰 전류 크기가 t에 해당 (C) EFIRM 방법론에서 전류 측정 판독의 대표적인 예생체 분자의 높은 수준 O. 이 그림은 웨이 등 알에서입니다. (14)는 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
TEM을 사용하여 구슬의 엑소 캡처의 검증
항 인간 CD63 자성 비드를 이용하여 타액에서 엑소 좀의 분리는 투과 전자 현미경 (TEM) 이미지를 이용하여 추출 프로토콜 다음 검증 하였다. TEM은 엑소 좀의 알려진 프로파일과 일치 바로 인접 (도 3a를 참조하고, 3B) 70 ~ 100 나노 입자와 자성 비드를 보여줍니다. 아니 70 ~ 100 nm의 과립은 이전에 그들?...
토론
결과가 나타내는 바와 같이, 항 인간 CD63 코팅 된 자성 나노 입자는 특히 70 ~ 100 nm의 범위의 크기를 갖는 작은 입자를 포착 할 수있다. 이 캡처 된 입자는 엑소 좀 이전에 관찰 된 프로파일과 일치한다. 또한, 입자의 캡처 다음 저전압 CSW의 사용은 비드 표면에서 제거화물 릴리스 전통적인 용해 완충액 기반 방법과 동일한 DNA 분해 프로파일을 일으키는 것으로 도시되어있다. 이 데이터는 exosomal화물 ...
공개
데이비드 웡 RNAmeTRIX 주식, 분자 진단 회사의 공동 설립자이다. PeriRx LLC는 RNAmeTRIX에서 분자 진단에 관한 지적 재산권을 재사용 권. 데이비드 웡 PeriRx 컨설턴트입니다.
감사의 말
이 작품은 연구 자원을위한 국가 센터 (FW에) 부여 UL1TR000124을 통해 번역 상 과학, 건강의 국립 연구소를, 전진을위한 국가 센터에 의해 지원되었다; 펠릭스 & 밀드레드 깨갱 기증 교수 및 (DTWW에) 반스 가족 기금 (MT에) 상 수 T90DE022734에서 국립 보건원 (National Institutes of Health)의 치과 및 두개 안면 연구소의 국립 연구소. 내용은 전적으로 저자의 책임이며 반드시 국립 보건원의 공식 견해를 대변하지 않습니다.
자료
| Name | Company | Catalog Number | Comments |
| Helios 16-Channel Reader System with Chip Interface | Genefluidics, USA | RS-1000-16 | |
| 16x Sensor Chip, Bare Gold, pack of 5 chips | Genefluidics, USA | SC1000-16X-B | |
| Biotinylated anti-human CD63 Antibody | Ancell, USA | 215-030 | |
| Dynabeads MyOne Streptavidin T1 | Invitrogen, USA | 65601 | |
| Neodynium Magnetics (1/10" dia. x 1/32" thick) | K&J Magnetics, USA | DH101 | |
| Ultrapure Distilled Water | Life Technologies, USA | 10977-023 | |
| Mettler Toldeo 3 M KCl Solution | Fisher Scientific, USA | 1911512 | |
| Pyrrole | Sigma-Aldrich, USA | W338605-100g | |
| Anti-Fluorescein-POD, Fab fragments | Roche, Germany | 11426346910 | |
| 3,3′,5,5′-tetramethylbenzidine substrate (TMB/H2O2, low activity) | Neogen, Usa | 330175 | |
| Phosphate Buffered Saline Solution | Life Technologies, USA | 10010023 | |
| Casein/PBS | Fisher Scientific, USA | 37532 |
참고문헌
- Rabinowits, G., Gerçel-Taylor, C., Day, J. M., Taylor, D. D., Kloecker, G. H. Exosomal MicroRNA: A Diagnostic Marker for Lung Cancer. Clinical Lung Cancer. 10 (1), 42-46 (2009).
- Thakur, B. K., et al. Double-stranded DNA in exosomes: a novel biomarker in cancer detection. Cell Research. 24 (6), 766-769 (2014).
- Lau, C. S., Wong, D. T. W. Breast Cancer Exosome-like Microvesicles and Salivary Gland Cells Interplay Alters Salivary Gland Cell-Derived Exosome-like Microvesicles In. Vitro. PLoS ONE. 7 (3), e33037 (2012).
- Bala, S., et al. Circulating microRNAs in exosomes indicate hepatocyte injury and inflammation in alcoholic, drug-induced, and inflammatory liver diseases. Hepatolog. 56 (5), 1946-1957 (2012).
- Dear, J. W., Street, J. M., Bailey, M. A. Urinary exosomes: A reservoir for biomarker discovery and potential mediators of intrarenal signalling. Proteomics. 13 (10-11), 1572-1580 (2013).
- Lässer, C., et al. Human saliva, plasma and breast milk exosomes contain RNA: uptake by macrophages. Journal of Translational Medicine. 9 (1), 9 (2011).
- Palanisamy, V., et al. Nanostructural and Transcriptomic Analyses of Human Saliva Derived Exosomes. PLoS ONE. 5 (1), e8577 (2010).
- Camussi, G., et al. Exosomes/microvesicles as a mechanism of cell-to-cell communication. Kidney International. 78 (9), 838-848 (2010).
- Lau, C., et al. Role of pancreatic cancer-derived exosomes in salivary biomarker development. The Journal of Biological Chemistry. 288 (37), 26888-26897 (2013).
- Théry, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and Characterization of Exosomes from Cell Culture Supernatants and Biological Fluids. Current Protocols in Cell Biology. 3 (22), (2001).
- Park, N. J., Li, Y., Yu, T., Brinkman, B. M. N., Wong, D. T. Characterization of RNA in Saliva. Clinical Chemistry. 52 (6), 988-994 (2006).
- Wei, F., et al. Bio/Abiotic Interface Constructed from Nanoscale DNA Dendrimer and Conducting Polymer for Ultrasensitive Biomolecular Diagnosis. Small. 5 (15), 1784-1790 (2009).
- Wei, F., et al. Electrochemical Sensor for Multiplex Biomarkers Detection. Clinical Cancer Research. 15 (13), 4446-4452 (2009).
- Wei, F., Yang, J., Wong, D. T. W. Detection of exosomal biomarker by electric field-induced release and measurement (EFIRM). Biosensors and Bioelectronics. 44, 115-121 (2013).
Erratum
Formal Correction: Errata: Detection of Exosomal Biomarker by Electric Field-induced Release and Measurement (EFIRM)
Posted by JoVE Editors on 1/01/1970. Citeable Link.
An erratum was issued for Detection of Exosomal Biomarker by Electric Field-induced Release and Measurement (EFIRM). The disclosures were updated.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유