Method Article
멀티 장기 칩 - 장기 멀티 조직 공 배양을위한 미세 유체 플랫폼
요약
Here, we present a protocol to coculture primary cells, tissue models and punch biopsies in a microfluidic multi-organ chip for up to 28 days. Human dermal microvascular endothelial cells, liver aggregates and skin biopsies were successfully combined in a common media circulation.
초록
The ever growing amount of new substances released onto the market and the limited predictability of current in vitro test systems has led to a high need for new solutions for substance testing. Many drugs that have been removed from the market due to drug-induced liver injury released their toxic potential only after several doses of chronic testing in humans. However, a controlled microenvironment is pivotal for long-term multiple dosing experiments, as even minor alterations in extracellular conditions may greatly influence the cell physiology. We focused within our research program on the generation of a microengineered bioreactor, which can be dynamically perfused by an on-chip pump and combines at least two culture spaces for multi-organ applications. This circulatory system mimics the in vivo conditions of primary cell cultures better and assures a steadier, more quantifiable extracellular relay of signals to the cells.
For demonstration purposes, human liver equivalents, generated by aggregating differentiated HepaRG cells with human hepatic stellate cells in hanging drop plates, were cocultured with human skin punch biopsies for up to 28 days inside the microbioreactor. The use of cell culture inserts enables the skin to be cultured at an air-liquid interface, allowing topical substance exposure. The microbioreactor system is capable of supporting these cocultures at near physiologic fluid flow and volume-to-liquid ratios, ensuring stable and organotypic culture conditions. The possibility of long-term cultures enables the repeated exposure to substances. Furthermore, a vascularization of the microfluidic channel circuit using human dermal microvascular endothelial cells yields a physiologically more relevant vascular model.
서문
약물 개발에 대한 현재의 단층 또는 현탁 세포 배양 분석은 사람 세포 미세 환경을 모방하고, 따라서 급속한 탈분화 및 일차 인간 세포 배양 기능의 손실을 초래할 못하고있다. 더 높은 관련성 생리 티슈 모델은 임상 시험으로 시인 전에 화합물의 유효성과 안전성을 예측할 필요가있다. 최근 생체 외 세포 배양 기술의 표준 생체 내 미세 조직을 모방하는 것을 목표로, 입체 모델 다세포 향해 이차원 단층 배양에서 진화 해왔다. 이러한 시스템은 이미 1,2- 화합물의 작용 모드의보다 정확한 예측을 향해 크게 개선을 보여 주었다. 또한, 셀들의 요구에 고도로 전문화 된 시험 관내 배양 조건에 적응하는 것은 특히 중요하다.
시험관 조건에서 표준, 중요한 막 다른 다양한종종 세포에 작용하는 이러한 영양소 및 산소 공급, 축적 제품의 제거, 및 기계적 힘 등 스트럭처 파라미터들은 대부분의 경우에 충분히 제어 할 수 없다. 많은 기관은 물질과 용존 산소의 생리 학적으로 관련 농도 구배를 가지고있다. 그러나, 이러한 엄격한 규제 및 최적화 조건은 매우 불안정한 환경에 선도적 및 세포 개발 (3) 제한, 체외 조건에서 조직 주변의 통제 확산 그라디언트 분명 반대에 있습니다. 따라서, 꾸준하고 시험관 조건에서 특히 더 정량화는 장시간에 걸쳐 생존 및 분화 세포를 보관해야합니다. 배지 성분을 제거하고, 정기적으로 치환되고 관류하는 시스템은 종종 조직의 직접적인 주변 관한 정적 배양보다 제어 가능한 것이 특징이다. 정적 조건, 셀 분비물 확산 그라디언트 및 배양 배지에서 영양소배양 된 세포 3을 둘러싸고 있습니다. 조직 주변 등장 잘 특성화 매체 유속 세포 분비물 관류 통해 풍부한 매질과 혼합 할 수있다. 이것은 안정한 세포 표현형을 보장하고 전체 시험 기간에 걸쳐 4 효소 발현 대사, 세포 미세 환경 규정의 생성을 가능하게한다.
다기관 칩 (MOC)의 최근 발전 시스템 테스트 중에 필요한 물질의 양이 감소로 이어지는 주변 마이크로 바이오 리액터의 작은 매체 균체 요구 조직 공학적 제어 매체 유동의 장점을 결합 기반. 조직 문화에 대한 몇 가지 마이크로 유체 시스템은 지금까지 5,6 설명 하였다. 이러한 시스템 내에서 조직 간 유체 비율은 생리 학적으로 관련 세포의 크로스 토크를 시뮬레이션에 특히 중요한 역할을한다. 그러나, 이러한 외부 펌프 및 미디어 저장소를 사용하는 등 기술적 한계로, 일대부분의 시스템에서 E 전체적인 순환 매체 볼륨은 볼륨 티슈에 비해 너무 크다. 슐러 등.의 그룹은 세포 배양 구획 내 및 생체 조직에 관련된 유체 비율의 7,8에서 물질의 적절한 체류 시간을 보장하는 시스템을 개발했다 제. 이것은 또한 "다른 조직"구획을 나타내는, 96 웰 플레이트에 아래 외부 저장조를 스케일링함으로써 달성되었다. 우리 MOC 플랫폼 내 순환 매체 볼륨을 최소화하기 위해, 우리는 외부 미디어 회로에 대한 필요성을 제거 연동 온칩 마이크로 통합. 이것은 마이크로 미디어 유량 속도 및 전단 응력 비율 (9)의 선택 가능한 개수에서 시스템을 작동 할 수있다. 500 μm의 폭 및 높이 100 ㎛의 마이크로 유체 시스템은 각각이 96 웰 플레이트의 한 웰의 크기를 갖는 두 개의 표준 조직 배양 공간을 상호 접속. 업계 표준 잘 플레이트의 크기 준수S는 트랜스 웰 형식으로 생성 기존 조직 모델의 통합을 허용한다. 또한, 트랜스 웰 세포 배양 삽입물의 수직 위치에만 직접적인 유체 흐름에 노출되지 조직 모델의 재배를 가능하게 조정 가능하지만, 또한 올려 기본 전류로부터 보호 될 수있다. 유사하게, 공기 - 액체 계면이 배양 시스템을 이용 가능하다.
MOC 플랫폼은 폴리 디메틸 실록산 (PDMS) 층 2mm 높은 영구적 액밀 미세 유체 회로를 형성하기 위해 저압 플라즈마 산화에 의해 접합 75 X 25mm (2)의 풋 프린트와 유리 현미경 슬라이드 제조된다. 각 채널 및 세포 배양 물을 함유하는 구획 PDMS 층은 표준 소프트 리소그래피 및 복제본 9 성형함으로써 제조된다. 이 연구 기간 동안 사용되는 MOC의 마이크로 유체 설계는 각 두 개의 셀 (C)을 들고, 칩 당 두 개의 분리 된 미세 유체 회로 구성100 ㎛ 높은 채널 시스템에 의해 상호 구획 ulture. 이것은 하나의 다기관 칩을 사용하여 두 개의 개별 티슈 - 공 배양의 성능을 허용했다. 펌핑 주파수는 40 μL / 분의 중간 유량을 수득하도록 조절 하였다.
이러한 2 티슈 MOC 디자인은 생리적 조건 하에서 유동 매체 결합 회로이라도 별도 배양 공간에 간 타원체 및 피부 생검 펀치를 공동 배양하는 기능을 제공했다. 균질 스페 로이드를 형성하도록 1 : 차별화 HepaRG 셀 (24)의 비율로 인간 간 성상 세포 (HHSteC)과 함께 응집시켰다. 비록, 간세포의 약 두 배는 생체 내 상황에 비해 사용 된 이전의 실험에서 관찰 된 바와 같이 열이 비율은 최적 인 것으로 밝혀졌다. 따라서 피부 국소 약물 노출을 가능 트랜스 웰 세포 배양 인서트 내부 공기 - 액체 계면에서 재배 하였다. 이러한 조직 모델은 28 일 동안 cocultivated했다MOC에 AYS는이 시스템의 포괄 성을 입증한다. 또한, 미세 유체 칩의 채널 회로는 충분히 더 밀접 혈관 시스템을 시뮬레이션하기 위해 인간 진피 미세 혈관 내피 세포 (HDMEC)으로 덮여 있었다.
프로토콜
참고 : 인간 청소년 포피가 일상 할례 후 소아 수술, 관련 법규를 준수, 동의서 및 윤리 승인 (윤리위원회 샤리 테 대학 의학, 베를린, 독일)를 얻었다.
MOC에서 재배를위한 조직 등가물 1. 생산
- 간 타원체를 생성하는 드롭 플레이트 걸려 HepaRG 및 HHSteC를 집계.
- , 합류로부터 매체 차별화 단층 배양 물을 제거 (2 75cm)를 세포 배양 플라스크에서 성장 HepaRG 세포 트립신 처리를 달성하기 위해, PBS로 2 회 세척하고, 0.05 % 트립신 / EDTA 3ml를 추가한다. 37 ° C에서 3 분에서 5 분 동안 배양하고, 트립신 억제제, 6㎖를 첨가하여 반응을 정지.
- 5 분 동안 150 XG, 상등액을 제거 HepaRG 세포 배양 배지 1 ㎖에 세포 펠렛을 재현 탁하고, 세포를 원심 분리기 카운트 HepaRG 셀. 세포 생존 능력은> 90 %이어야한다.
- 에, HHSteC 세포의 트립신을 달성 단층 문화 매체를 제거 PBS로 2 회 세척하고, 0.05 % 트립신 / EDTA 3 ㎖를 추가하려면. 37 ° C에서 5 분 동안 배양하고, 트립신 억제제, 6㎖를 첨가하여 반응을 정지.
- 원심 분리기에서 5 분 동안 150 XG, 상등액을 제거 HepaRG 세포 배양 배지 1 ㎖로 세포 펠렛을 재현 탁하고, 세포를 카운트에서 HHSteC 셀.
- (24)의 비율과 HepaRG HHSteC 수확기 : 1 HepaRG 세포 배양 배지. 이렇게 HepaRG 세포 배양 배지에서 세포 현탁액을 희석하여 세포 수를 조정하고 4.8 × 10 6 세포 / ㎖ HepaRG 세포 1 × 10 5 세포 / ㎖ HHSteC를 추가합니다. 조심스럽게 섞는다.
- 매달려 드롭 및 수신기 판에 PBS 2 ㎖를 추가하여 매달려 드롭 플레이트를 준비합니다.
- 피펫 매달려 드롭 플레이트의 각 웰에 세포 현탁액 20 μL. 항상 약 10 % 더 매달려 일부 집계 두리를 손실됩니다대로 집계를 검색하기 위해 필요한 것보다 떨어진다 준비절차 겨. 조심스럽게 37 ° C 배양기에서 접시를 놓습니다. 타원체가 형성하는 48 시간을 기다립니다.
- 타원체를 검색하기 위해, 다양한 팁 엔딩과 피펫 팁을 사용하거나 약 2 ~ 3 mm의 개방을 확대하기 위해 멸균 칼 1 ML의 피펫 팁의 끝을 잘라해야합니다. 그들을 방해하지 않고 타원체를 처리하기 위해이 피펫 팁을 사용합니다.
- 반복적 피펫을 사용하여 매달아 놓기 플레이트의 웰 위로 용지 1 ㎖를 첨가하여 매달려 드롭 판으로부터 신중 타원체 씻어. 모든 타원체가 떨어 졌 때까지 접시를 씻으십시오. 스페 로이드 약간 디스크 형 300㎛ 인 (400)의 중간 직경이 점에서 200 내지 300 ㎛의 높이이다.
- 수신기 판에 회전 타원체를 수집하고 잘 준비된 피펫 팁을 사용하여 당 20 타원체의 최대 24도 매우 낮은 부착 플레이트로 전송. 0.5 ml를 잘 각각의 미디어 볼륨을 조절합니다. 이노 20 골재를 사용하여생체 세포 수에 대한 1 / 100,000의 소형화 레이트를 수득 한 MOC 회로 culate.
- MOC의 추가 사용까지 CO 2를 37 ° C에서 타원체를 품어 5 %. 비교를 보장하기 위해 사용 전에 타원체에게 이상 3 일 이상 보관하지 마십시오. 균일 한 회전 타원체를 검색하는 데 매우 낮은 부착 판에 적어도 하루에 대한 집계를 양성.
- 피부 조직 등가물을 생성하는 두 가지 방법 중 하나를 추구 : 펀치 생검 (1.2.1) 또는 기성품 체외 조직 모델 (1.3.1)에서의 사용 용도.
- 추가로 사용할 때까지 무균 조건 하에서 96 웰 세포 배양 삽입 및 저장을 제조 브래킷 아래 백열 칼 트랜스 웰을 잘라.
- 30 초 80 % 에탄올에 포피 샘플을 소독 열어 반지를 잘라. 샘플은 2mm의 평균 높이를 가져야한다.
- 동일한 miniaturiza을 얻기 위해 4.5 mm 직경의 조직 검사를 잘라 생검 펀치를 사용하여간 및 피부 모두에 대한 기 비율. 집게로 삽입 트랜스 웰 제조 된 96 웰에 조직 검사를 넣습니다. 표피면이 위쪽으로 향하도록 생검의 위치를주의하십시오.
- 도시는 세포 배양에서 상기 MOC HepaRG 사용시까지 세포 배양 배지 및 저장 37 ℃에서 5 % CO 2를 함유하는 수용기 판에서 생검 삽입한다. 3 시간에 2 이상의 매장 샘플이 더 마십시오.
- , MOC에, 여러 공급 업체에서 구입 한 그들이 96 웰 트랜스 웰 형식인지 확인하고, 기성 체외 피부 모델에 통합 할 수 있습니다. 벤더 나 다른 조직과 공동 배양이 상기 단계에서 고찰하면, 양쪽 조직을지지하는 최소 배지를 사용하여 제공되는 세포 배양 배지를 사용한다. 조직을 지원할 수있는 용량을 이전의 정적 실험에서 각각 최소 배지를 테스트합니다.
- 홀더 플레이트에서 피부 모델을 검색하고 백열 칼로 브래킷 아래 96 웰 인서트를 잘라.
- MOC의 추가 사용까지 CO 2를 37 ° C에서 다시 수신기 판과 저장소로 삽입을 놓고 5 %. 일일 이상 저장하지 샘플 작업을 수행합니다.
2. MOC 제작
- 10/1 PDMS와 경화제를 혼합 : 1 (V는 / v)이고, 기포를 제거하기 위해 15 분 동안 진공 하에서 혼합물을 배치.
- 한편, 20 분 동안 80 ° C에서 실리콘 고무 첨가제 폴리 카보네이트 커버 플레이트를 취급한다.
- 마이크로의 500 μm의 두께 네 PDMS없는 세포 배양 구획과 여섯 PDMS 막을 만들 커버 플레이트의 각각의 구멍에 테플론 나사를 삽입합니다.
- 두 미세 혈관 회로의 마스터 금형 제조 된 커버 플레이트를 연결하고 가스가 제거 된 PDMS를 주입. 시스템에 공기 방울을 통합하지 않도록주의하십시오. 거품이 등장하면, 틸팅 장치에 의해 제거하려고합니다.
- PDMS 층을 경화시키기 위해 60 분 동안 80 ℃에서 인큐베이션 시스템.
- 마스터 주형 및 디바이스로부터 테플론 나사를 제거하고 저압 플라즈마 산화를 이용하여 75 × 25 ㎜ × 2 풋 프린트를 가진 유리 슬라이드에 PDMS 층의 접합.
- 커버 플레이트의 네 세포 배양 구획에 특별한 스레드 MOC 어댑터 나사.
- 여성 루어 X ¼-28 남성 어댑터에 배양액을 포함하는 주사기를 연결하고 커버 플레이트의 MOC 어댑터 나사.
- 반복적으로 아래로 누른 다음 주사기 플런저를 잡아 당겨 미세 유체 회로에 매체를 주입한다.
- 현미경 매체와 채널의 적절한 충전을 확인합니다.
MOC 3. 내피 세포
- 내피 세포 성장 배지 MOC, 플러시 각 MOC 회로 endothelializing CO 2 및 37 ° C에서 사흘 동안 정적으로 배양 한 5 %에 앞서.
- 에탄올을 사용하여 MOCS가 닦아 소독 및 층류 벤치 아래에 배치합니다. 나는n 개의 추가, 집게 두 쌍의 추가 사용에 대한 두 개의 육각 키를 소독.
- 육각 키를 사용하여 MOC의 조직 문화 실의 캡을 풀고 집게를 사용하여 캡을 제거합니다. 매체를 삽입 한 후, 동일한 방식으로 MOCS에 다시 캡 스크류.
- 인간 피부 미세 혈관 내피 세포 (HDMEC)를 트립신 처리를 달성하기 위해, 단층 배양에서 배지를 제거 PBS로 2 회 세척하고, 0.05 % 트립신 / EDTA 3ml를 추가한다. 37 ° C에서 5 분 동안 배양하고, 트립신 억제제, 6㎖를 첨가하여 반응을 정지.
- 원심 HDMEC을 5 분 동안 220 XG 제거한 상등액에서, 내피 세포 성장 배지 1 ㎖로 세포 펠렛을 재현 탁하고, 세포를 카운트. 세포 생존 능력은> 90 %이어야한다.
- 내피 세포 성장 배지로 희석하여 2 × 107 세포 / ㎖의 최종 농도로 세포 현탁액 중의 세포 수를 조절하고 그것의 250 μl를 전송할1 ML의 주사기. 모든 기관에 대한 1 / 100,000의 소형화 속도를 유지하기 위해 MOC에 셀이 농도를 적용합니다.
- , 여성 루어 X ¼-28 남성 어댑터에 주사기를 연결이 피팅에서 공기를 추방하고는 특별한 스레드 MOC 어댑터에 나사. 각 MOC 회로의 두 구획 중 하나에 어댑터를 연결합니다.
- MOC 회로의 두 번째 칸에 같은 방법으로 빈 주사기를 연결합니다.
- 연속 방식으로 수회 밀어 내려 개의 주사기 플런저 당겨 고르게 세포를 주입한다. 현미경으로 세포의 주입을 제어합니다.
- 세포가 채널 벽에 부착 할 수 있도록 3 시간 동안 정적 조건에서 CO 2, 37 ° C에서 MOC 부화 5 %.
- 인큐베이터에서 칩을 제거 층류 벤치 아래에 배치, 특수 나사 MOC 세포 배양 챔버와 주사기와 MOC 어댑터를 교체합니다.
- 한 COM에 신선한 매체의 400 μl를 추가각 MOC 회로의되는 구획하고 수압에 의해 채널을 통해 세척 할 수 있습니다. 그 후, 신선한 매체의 300 μL와 두 구획 매체를 교체합니다.
- 3.1.2에 설명 된 바와 같이, 캡을 사용하여 구획습니다.
- 펌프 제어부에 칩을 연결한다. 0.475 Hz의 주파수로 펌핑 속도를 조정하고 CO 2를 37 ° C에서 배양 칩을 5 %.
- 각 MOC 구획의 매체 이일에 모든 사람을 교체하고 광학 현미경으로 세포 형태를 모니터링 할 수 있습니다.
4. 칩 불러오는
- 층류 벤치에서 MOC를 놓고 단계 3.1.2에 설명 된대로 엽니 다.
- 조직 배양 구획에서 용지를 제거하고 신선한 HepaRG 세포 배양 배지 300 μL로 교체합니다.
- 넓은 개방과 피펫 팁을 사용하여 각 MOC 회로의 하나의 조직 배양 함 20 미리 형성된 회전 타원체로 이동 (단계 참조 1.1.8 / 9). C를 닫습니다AP는 집게와 육각 키를 사용하여.
- 집게를 사용하여 각 MOC 회로의 나머지 조직 배양 구획 피부 등가물을 포함하는 전송 96- 웰 세포 배양 인서트. 피부 상당의 막 아래의 거품 형성을 방지하기 위해주의하십시오. 이를 위해, 약간 기울어 진 각도에서 트랜스 웰을 넣고 부드럽게 아래로 누른다. 트랜스 웰 주위 초과 매체를 제거는 피펫 아래에서 위로 추진되고.
- 집게와 육각 키를 사용하여 뚜껑을 닫습니다.
5. 펌프 제어부 칩 연결
- 값 제어 장치 동작 파라미터의 설정이 요구. 0에서 8,000 밀리바, 0 ~ -800 mbar의 진공, 0.24에서 2.4 Hz로 주파수를 펌프로 공기 압력을 수정합니다. 시계 방향 또는 시계 반대 방향으로 펌핑 방향을 설정합니다.
- 층류 벤치 아래에서 MOC 당량 함유 조직을 제거하고, 펌프 제어 장치에 연결.
- numerat 다음튜브에 이온, MOC에 각 피팅 공기 압력 튜브를 삽입합니다.
- 37 ° C에 칩을 가열 인큐베이터 외부 칩을 육성하기 위해 MOC 지원을 사용, 살아있는 조직 이미징의 경우, 37 ° C에서 MOC를 육성하고 5 % CO 2 인큐베이터 나. 표준 현미경 MOC에서 세포를 배양하기 위해 가열 지원을 사용합니다.
6. 물질로 미디어 교류, 샘플링 미디어 노출을 수행
- 조직 배양 및 세포의 대사 활동의 유형을 고려하여, 매일 또는 격일 루틴 미디어 교환을 수행.
- 인큐베이터에서 MOC를 검색 및 미디어 유량을 제어하고 오염을 확인하기 위해 현미경으로 관찰한다.
- 공기 압력 배관을 분리하여 펌프 제어 장치에서 MOC를 분리합니다. 에탄올 물티슈를 사용하여 MOC를 소독하고 층류 벤치 밑에 넣고.
- 조직 배양 미리보기를 엽니 다단계 3.1.2에서 설명 된 바와 같이, 간을 포함하는 타원체 artment.
- 타원체를 방해하지 않고 피펫을 사용하여 구획에서 200 μL까지 제거하고 깊은 웰 플레이트의 빈에 잘 매체를 저장합니다. 직접 미디어 샘플을 분석하거나 깊은 웰 플레이트를 닫고 추가 분석을 위해 -80 ° C에서 미디어 샘플을 저장합니다.
- 최대 250 μL 신선한 세포 배양 배지와 MOC의 매체를 교체하고 뚜껑을 닫습니다. 인해 시스템을 닫을 때 칩의 새어 소량 중간 제거 손실 계좌 대체의 양의 차이.
- 조직 intactness를 확인하기 위해이 시점에서 피부 등가물을 들고 조직 문화 실의 뚜껑을 엽니 다. 시스템에 공기 방울을 소개 않도록주의하십시오. 뚜껑을 닫습니다.
- 5.3 공정과 인큐베이터 MOC 배치에있어서, MOC에 펌프 제어 유닛의 호스 연결한다.
7. 매일 미디어 샘플을 분석하고 수행 온라인 분석
- 온라인 생균 또는 오프라인을 촬상하여, 매일 미디어 샘플을 분석함으로써 조직 배양 성능을 분석. 표준 루틴 효소 분석 (예 : 젖산 탈수소 효소 (LDH) 활동) 또는 ELISA (예를 들어 알부민 농도)에 의해 후자를 수행합니다. 온라인 분석은 이하에 설명된다.
- (희석 6.1.1 6.1.4에 단계에 설명 된대로, endothelialized MOC의 용지를 제거하고 10 μg의 200 μL로 두 조직 배양 구획 / ㎖ 형광 아세틸 결합 저밀도 지단백 (LDL) 솔루션을 교체 세포 배양 배지).
- 뚜껑을 닫습니다. 5.3 단계에있어서, 펌프 제어 유닛 MOC 연결하고 미세 유체 회로 내에 균일 용액을 분배 0.475 Hz에서 30 분 동안이를 펌프.
- 펌핑을 중지하고 37 ° C에서 3.5 시간, 5 % CO 2 정적 MOC를 품어.
- 유사 t오, 7.2 단계 모두 구획에서 아세틸 화 LDL 솔루션을 제거하고 두 개의 구획 중 하나에 신선한 매체의 400 μL로 교체합니다.
- 3 ~ 5 분 정수압은 미세 유체 채널 회로를 통해 매체를 구동 할 때까지 기다립니다.
- 신선한 매체의 300 μL로를 통해 흘러 또한 신선한 매체의 300 μL로 두 번째 조직 배양 함을 채우기 한 매체를 교체합니다.
- 단계 3.1.2에 따라, MOC를 닫습니다. 형광 현미경을 넣고 세포의 성장과 생존을 관찰합니다.
- 재배를 계속 인큐베이터에서 스테인드 MOC를 놓습니다. 다음 각 미디어 교체와 세포 밖으로 유출 얼룩을 제거합니다.
8. MOC에서 조직 등가물을 검색하고 엔드 포인트 분석을 수행
- 엔드 포인트가 분석을위한 실험의 끝에 MOC로부터 티슈 당량 검색.
- 간, 즉 피부를 검색하기 위해단계 6.1.4에 6.1.1에 설명 된대로 MOC에서 quivalents은 각 조직 배양 함에서 용지를 제거합니다.
- 집게를 사용 MOC으로부터 피부를 함유하는 96- 웰 세포 배양 삽입물을 제거. 집게로 한쪽에 창과 아래로 당겨 삽입 상태에서 조심스럽게 막을 벗겨. 이 시점에서 피부 상당을 잃지 않도록주의하십시오.
- 극저온 포함 화합물의 피부 상당을 들고 막 동결하고 추가 분석 할 때까지 -80 ° C에서 보관합니다.
- 컷 피펫 팁을 사용하여 피펫 팅하여 조직 배양 실로부터 마찬가지로 간 균등를 제거한다 (단계 1.1.8 / 9 참조).
- 극저온 포함 화합물에 간 타원체를 포함합니다. 너무 많은 액체를 전송하고 피펫 초과 액체를 제거하지 않도록주의하십시오. 포함 화합물에 타원체를 배치하고 매체를 제거한 후, 그들을 완전히 둘러싸 타원체의 상단에 추가 크라이 화합물을 추가합니다.
- 간 등가물을 동결하고 추가 분석 할 때까지 -80 ° C에서 보관합니다.
- 이전 프로토콜 10에 기술 된 바와 같이, 조직 - 특이 적 마커 8 μm의 섹션 및 염색 크라이 마이크로톰에서 조직을 절단함으로써 당량 끝점 분석을 수행한다.
결과
표준 시험 관내 조직 배양 조직에 산소와 영양분의 공급의 확산을 제한 정적 조건하에 수행된다. 개선 공급 유체 특성을 도시하는 시스템은 종종 조직 비율로 비 - 생리 높은 매체를 갖는, 그들의 큰 매질 요구에 의해 방해된다. 따라서, 대사 산물 희석 세포는 주변 환경을 컨디셔닝 할 수 없습니다 있습니다. 본 연구에 제시된 MOC는 마이크로 유체 관 시스템에 의해, 두 개의 분리 된 조직 배양 구획, 표준 96 웰 플레이트의 각 웰의 단일 크기를 연결한다. 시스템 및 칩상의 펌프의 통합 소규모 시스템 만 200-800 μL의 매체 볼륨에서 동작 할 수있다. 1 ~ 31 : 8이 조직의 비율 총 전신 매체에 대응 한 각각 (약 26 μL의 전체 조직 부피를 갖는) 간 및 피부 조직에 대한 공 배양. 남자가 7 무게의 총 세포 외 유체 볼륨intercapillary 유체 볼륨이 하나의 조직 비율 생리 세포 외액으로 이어지는, 5.1 L입니다 무엇에 3kg은 14.6 L입니다 : 4. 따라서, MOC의 전체 순환 시스템에서 매체의 양이 생리적 상태에 비해 여전히 크다; 그럼에도 불구하고, 그것은 다중 기관계 5 지금까지보고 된 조직 비가 작은 매체를 나타낸다. 업계 표준 조직 문화 형식이 유지되기 때문에, 연구자들은 공통의 유체 흐름 내에서 기존의 이미 검증 된 정적 조직 모델을 결합 할 수있다. (1)가 가능 MOC 하나의 조직 또는 다중 조직 공 배양의 실험 장치의 개략도를 보여줍니다. 주 조직 생검 체외에서 세포주 또는 일차 세포로부터 조직 당량 96 웰 세포 배양 삽입물을 사용하거나 또는 재배 조직 배양 구획에 직접 배치하여 수 -generated. 세포 배양 구획을 도통 채널 시스템은 100 μ이므로m 높이는 이러한 차원을 초과하는 조직 등가물 문화 구획 내에서 유지됩니다. 차 HDMECs와 MOC 회로의 내피 세포는 생물학적 혈관 구조를 제공함으로써 앞으로 더 생리적 배양 조건에서 한 단계 더 도약 할 수 있습니다.
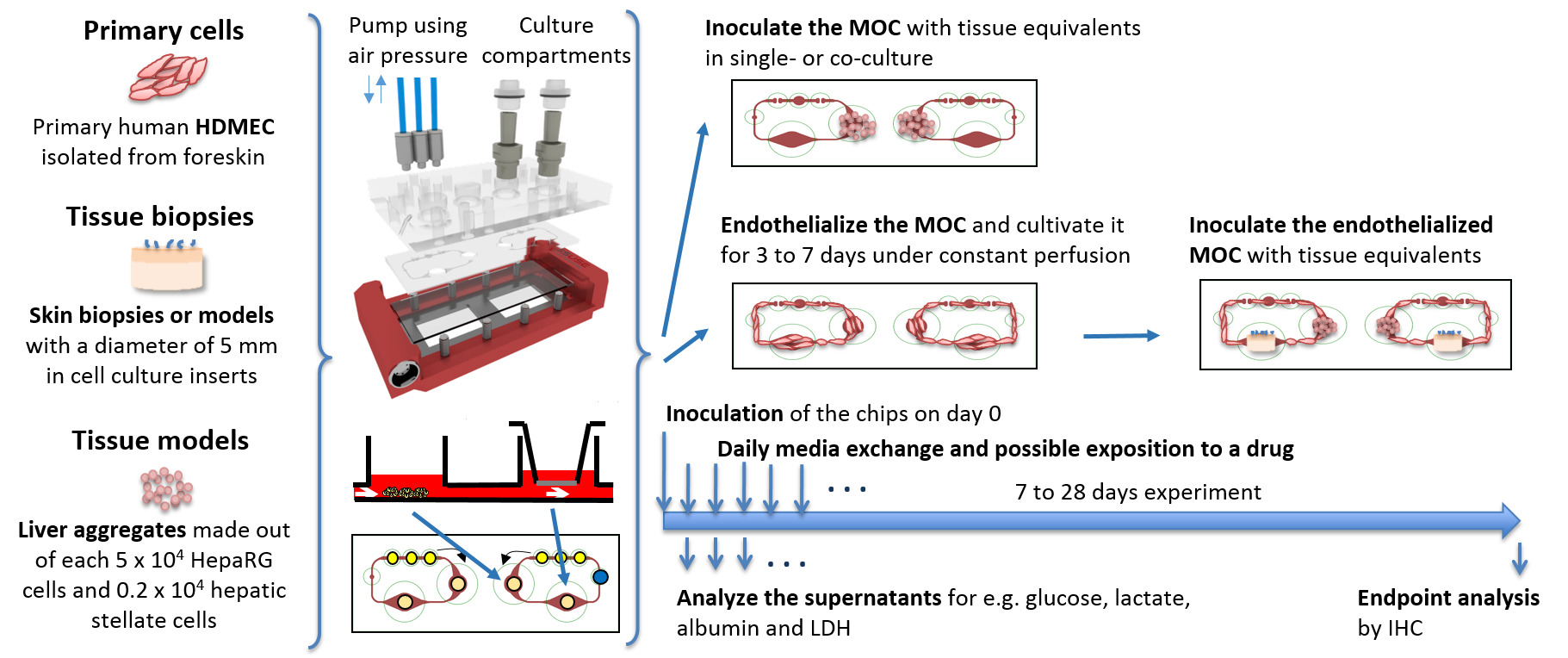
그림 1 :. MOC 문화의 도식 표현 조직 등가물은 MOC에 접종 및 동적 조건에서 하나의 문화 또는 공 배양으로 재배, 표준 시험관 조건에서 제조된다. 매일 미디어 샘플 및 엔드 포인트 분석이 수행됩니다. 펌프를 구동하는 공기 압력이 위에서 MOC에 연결된 세 개의 파란색 튜브를 통해 적용된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
도 2에 도시 된 바와 같이 내피 세포의 프로토콜에 따라, 마이크로 유체 회로의 합류 HDMEC 커버리지 동적 배양 나흘 내에 얻어진다. 세포를 용이 MOC 채널의 벽에 부착 합류 단층을 생성하고, 전단을 따라 기다란 스트레스 (그림 2B). 이전에보고 된 9 더욱이, 셀은 채널의 전체 둘레를 커버. 내피 세포의 형태에 더 이상의 변화는 문화가 끝날 때까지 재배 네 일 후에 관찰되지 않았다.
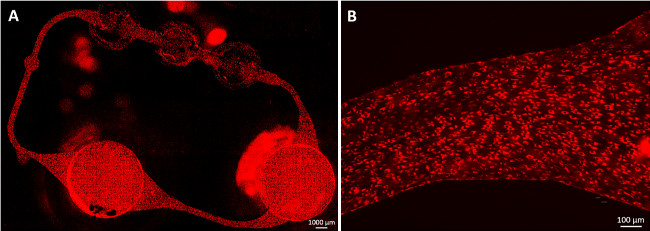
그림 2 :. Endothelialized MOC 채널 인간 피부 미세 혈관 내피 세포 (HDMEC)는 미세 유체 회로에 합류 단층을 형성했다. 세포 MOC 문화 23 일 후 아세틸 화 LDL 염색 하였다. (A) 전체 microvascular 회로는 전단 응력 따라 신장 세포 (B) 세포를 덮었다. 스케일 바 : (A) 1000 μm의 (B) 100 ㎛.
또 다른 실험에서, 일관성있는 디스크 모양의 간세포 구 상체는이 모델 시스템이 이전에 약물 대사에 적합한 것으로보고되면서 매달려 드롭 문화 이틀 동안 HepaRG 및 HHSteC 형성 (11) 연구 아르 - (13). 설명을 위하여, 각각의 MOC 회로의 조직 배양 구획은 96 웰 세포 배양 삽입물 20 타원체 시딩하고, 조직은 비 endothelialized MOCS를 사용하여 동적 조건에서 14 일 이상 배양 하였다. 응집체 또는 기본 물질의 양이 임의의 개수의 격실 내로 직접 또는 세포 배양 물 삽입물을 사용하거나 통합 될 수있다. MOC에서 검색 후 타원체의 면역 염색은 리튬에 대한 강한, 균일 한 식을 보여줍니다VER 전형적인 아세포 8/18 및 위상 나는 효소 사이토 크롬 P450 3A4과 7A1 대사 (그림 3A 및 3B). 누소관 수송 다중 약제 내성 단백질 (2)의 염색 (MRP-2) 편광 된 표현형 및 초보 담즙 누소관 같은 네트워크의 존재 (도 3c)을 밝혔다.
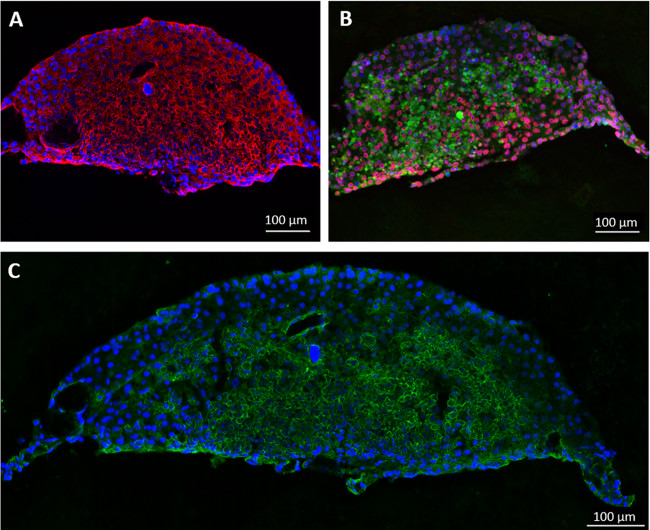
그림 3 :. MOC에 14 일 동안 재배 MOC. 간 집계 인간의 인공 간 마이크로 조직의 재배는 (A) 아세포 8/18 (빨간색)와 (B) 사이토 크롬 P450의 3A4 (적색) 및 7A1 (녹색)에 대한 염색 하였다. 눈물 소관 수송 MRP-2 (녹색)의 (C) 식, 블루 핵 염색. 스케일 바 : 100 μm의.
알부민 생산은 간 조직 배양 중 하나 필수적인 전제 조건이기 때문에, 그것은 벌을 갖는다n은 MOC에 간 전형적인 활동을 감시하기 위해 선택. 알부민 생산을 위해 매일 미디어 샘플을 분석하는 것은 정적 문화 (그림 4)과 문학 (11)에보고 된 값에 비해 MOC 문화 생산 속도의 상당한 증가를 보여줍니다. 알부민 합성 속도의 증가는 MOC 문화의 증가 산소와 영양 공급에 기인 할 수 있습니다. 따라서, MOC는 알부민 생산과 같은 간 전형적인 동작을 향상 대사 활성 상태에서 14 일 배양 기간 동안 간 응집을 유지할 수있다.

그림 4 : MOC에서의 14 일 간 회전 타원체 성능 MOC와 정적 문화 간 단일 조직 문화의 알부민 생산.. 데이터는 평균 ± SEM이다 (N = 4).
체의 Subsystemic 반복 투여 독성 시험OECD 가이드 라인에 의해 정의 된 동물에서 micals 화장품, 아니 노출 21-28일이 필요합니다. (410)는 "용량 피부 독성을 반복 : 28분의 21 일 연구."장기 피부 간 공 배양 규제 요구 사항에 대처하기 위해 최대 28 일 동안 여기에 예시된다. 공기 - 액체 계면은 96 웰 세포 배양 삽입물 피부 생검을 배양하여 나중에 경피 약물 노출이 제공된다. 공 배양 실험이 결합 된 미디어 회로의 세 조직의 공동 배양이 가능한 28 일 대사 활성 유지 될 수 있는지 여부를 증명하기 위해 endothelialized MOCS에 예시 적으로 수행된다.
미디어 상층 액의 LDH 활성을 분석 한 후 약 80 U / L (그림 5)에서 일정 숙박 문화의 첫 8 일 동안 꾸준히 감소 레벨을 밝혔다. 이것은 나중에 지점에서 시스템의 인공하지만 안정된 조직 회전율을 나타냅니다. 간 하나에 세 조직의 공동 배양을 비교-tissue 간-내피 세포 공 배양 실험은 유의하게 감소 LDH 레벨은 특히 피부를 포함하지 않는 문화에서 첫 번째 일 동안 볼 수 있습니다. 단일 피부 조직 배양 MOC 밝혀 높은 LDH 활성이 제 시간 내에 세포 사멸 (데이타 미기재), 피부 배양 구획에서 주로 일어났다. 이것은 피부의 펀치 생검 결과로서 부상을 둘러싼 영역에 기인 할 수도있다.
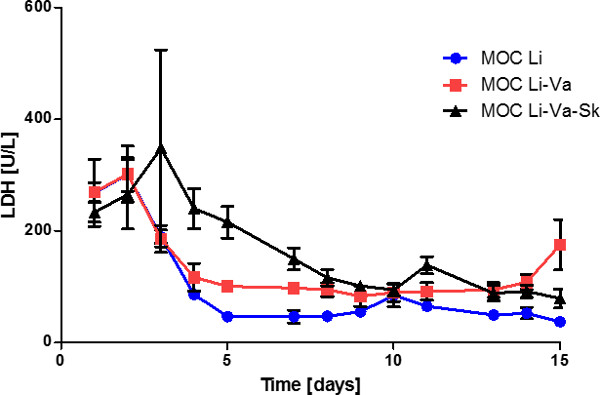
그림 5 :. endothelialized MOC에 endothelialized MOCS (MOC 리튬 VA) 간 피부의 공 배양 간 단일 조직 문화 (MOC 리), 간 문화 미디어 상층 액의 MOC LDH 활성 다섯 일 조직의 성능 (MOC 리 -Va - Sk를). 데이터는 평균 ± SEM이다 (N = 4).
28 일의 배양 기간 동안 간 스페 로이드 MOC의 하단에 부착차 셀은 인접 타원체 간의 다층 연결을 형성, 밖으로 증가했다. 이는 조직의 기능을 방해하지 않았다. 종점에 의한 면역 형광 분석은 사이토 크롬 P450 3A4 염색법 (도 6A)에 의해 도시 된 바와 같이 간 스페 로이드는, MOC 공 배양 28 일 이후에 여전히 활성 대사 것으로 나타났다. 염색 멘틴 (도 6B)에 의해 도시 된 바와 같이 HHSteC는 전간 당량에 걸쳐 분산 하였다. 멘틴 염색 강도의 증가는 세포가 타원체에서 성장한 영역에서 관찰 될 수있다. 폰 빌레 브란트 인자 (vWF의) 발현이 관찰은 내피 세포는 조직에 깊이 침투하지 않은 것으로 나타났다하지만, 외부 간세포 (그림 6C)와 직접 세포 - 세포 접촉에 있었다.
정적 컨트롤의 염색 elevat을 보였다 동안 피부 생검의 면역 조직 화학 염색, 테네 스틴 C와 기저막 (그림 6D)에서 콜라겐 IV의 표현을 보여 주었다테네 스틴의 C (그림 6E)의 에드 수준. C는 테나 신 (tenascin), 상처 치유, 염증 및 섬유화 공정 중에 상향 조절되는 것으로 밝혀졌다 동적 14,15 배양에서 섬유화 과정에서 정전기가 아니라 유도 제안.
안정한 세포 생존 및 MOC에서 28 일간 공동 배양 후에 조직의 기능은 시스템이 일반적인 미디어 회로에서 최대 세 조직의 결합을 유지할 수 있다는 것을 증명한다. 일차 전지뿐만 아니라, 모델 및 조직 생검, MOC 시스템에서 동시에 배양 할 수있다.
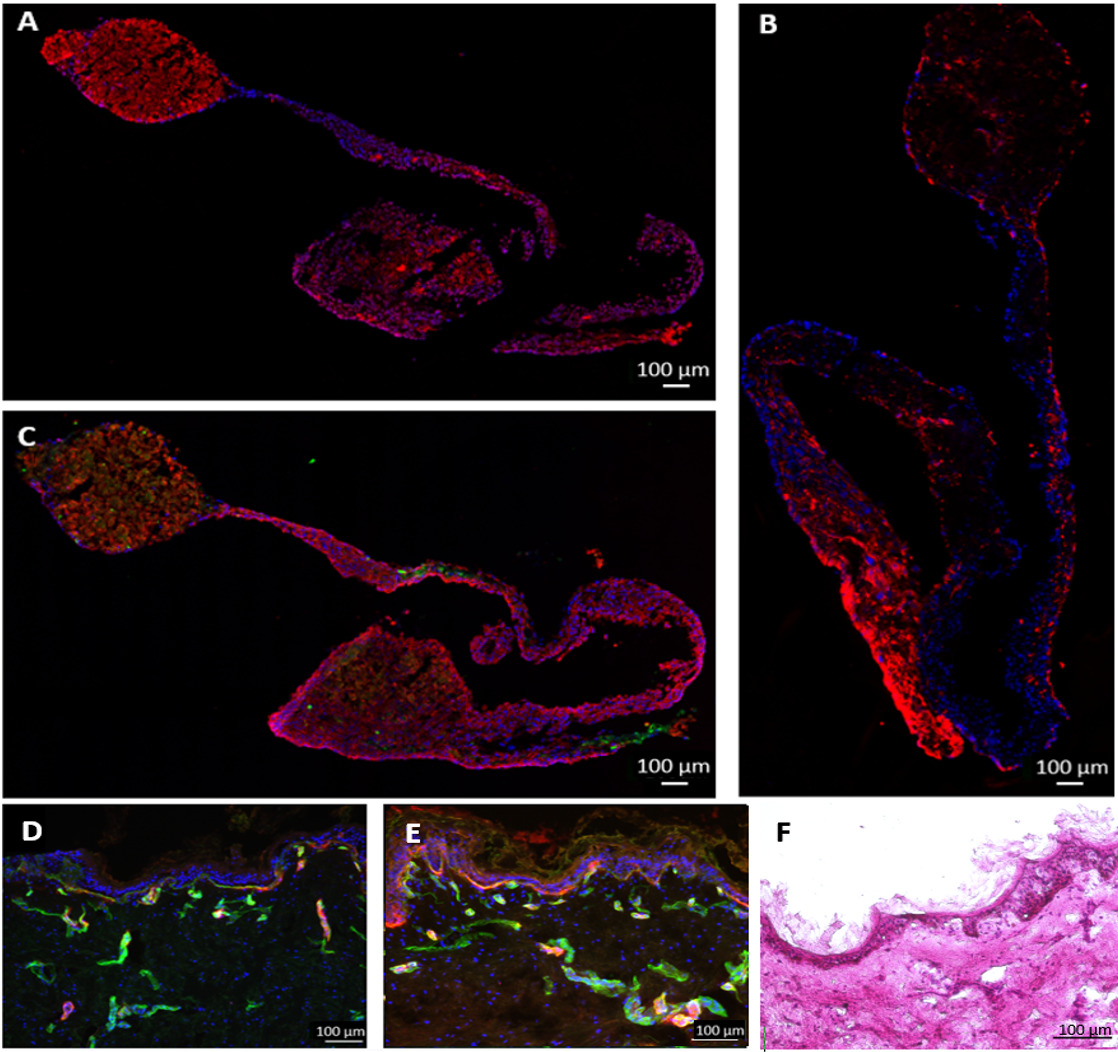
그림 6 :. 멀티 조직 문화의 성능 28 일 이상 간 등가물 및 피부 조직 검사가 endothelialized MOC 및 세포 기능에서 재배되었다가 (A) 단계의 면역 염색에 의해 표시되었다 나는 사이토 크롬 P450 효소3A4 간 조직에서 (적색), (B) 비 멘틴 (적색), (C) 아세포 8/18 (적색)과는 vWF (녹색). 정적 조건에서 MOC 또는 (E)에 이십팔일 (D)에 대한 cocultivated 피부 생검 테네 스틴의 C (빨간색)과 콜라겐 IV (녹색), 블루 핵 염색을 위해 염색 하였다. MOC 문화 28 일 후 피부의 (F) H & E 염색. 스케일 바 : 100 μm의.
토론
여기에 설명 된 MOC 플랫폼은 장기간의 배양 기간 10,16 통해 동적 매체 흐름 조건에서 다양한 기원의 조직을 배양하기위한 안정적이고 강력한 도구를 나타냅니다. 이 예에서, 플랫폼은 일차 세포 (HDMEC) 세포주로부터 생성 된 조직 당량 (간 응집) 및 조직 생검 상술의 공 배양을 배양하는 데 사용 하였다. MOC는 결합 된 매체 회로에서 28 일 동안 세 조직의 공동 배양을 지속 할 수 있었다. 저자가 아는 한, 생검은, 일차 전지 및 세포주를 포함하는 여러 조직의 공동 배양 네 주 동안 수행 된 처음이다.
마이크로 유체 시스템의 주요 단점 중 하나는 유체 회로의 표면에 접착 재료 작은 분자의 친화이다. 체적비 표면 미세 유체 시스템에서 특히 높을 것으로,이 효과는 더욱 두드러진다 17 까지. 여기에서 소개 채널들의 안정한 HDMEC 커버리지는, MOC 분자로의 부착을 방지하는 장벽으로 작용 생물학적 것이다. 또한, 혈액 응고를 방지 전혈 순환 hemocompatible 용기로서 기능 할 수있다. 장기 당량 전체 혈관 아직 달성되지 않은 그러나 매체 교체 전혈의 사용은 불가능하다. 체외 -generated 조직의 혈관에 작업을 존재하는 유망 및 추가 연구 (18, 19)의 길을 안내합니다.
이것은 간세포 체외 정적 이차원 배양 조건 하에서 20 시간에 걸쳐 간 - 특정 기능을 상실하는 경향이 잘 알려져있다. 특정한 약물의 대사 연구 될 경우 그러한 사이토 크롬 P450 군 대사 효소 등은, 특별한 중요하다. 시토크롬 P450 3A4, 많은 생체 이물질의 생물 전환에 관련된 효소 인 사이토 크롬 P450에 7A, wHICH 14 일 동안 간에서 발현되었다, 담즙산 합성에 MOC에서 배양 응집체 참여하고있다. 이 약물 대사 연구를 허용, 대사 활성 표현형의 보존을 나타냅니다. 정적 배양에 비해 MOC 응집체 증가 알부민 생산 속도는 적절한 배양 조건에 대한 추가의 표시이다. (23) 그러나,이 값 차 인간 간세포 배양 물 (24)들에 도달하지 않았다 - 본 연구 동안 관찰 알부민 생산 속도가 21 인 HepG2 세포를 포함한 미세 유체 칩에 의해 얻어진 이전에보고 된 값보다 비슷하거나 심지어 더 높았다. 또한, MOC 시스템은 임시 레이아웃, 담즙의 별도의 분리를 허용하지 않습니다. MRP-2 염색에 의해 도시 된 바와 같이 편광 된 골재 형성된 담즙 누소관 같은 구조의 셀. 그러나, 그 누소관은 담즙을 수집 기술 채널에 연결되지 않았다. 이러한 비 생리적 믹스혈액 구획 담즙의 보내고하면 시스템의 미래를 재 설계에서 해결되어야한다.
흐름 특성의 조정은 특히 간암과 같은 전단 응력 민감한 조직에 대하여, 중요도가 높은 25이다. 조직에 의해인지 전단 응력의 양은 두 가지 방법으로 변형 될 수있다 : 첫째로, 펌프의 세포막을 내리면 사용 공기압이 저하 될 수 있고, 시스템에서 최대 전단 응력 값을 감소시킨다. 둘째, 조직은 세포 외 매트릭스에 매립 또는 레이어드 트랜스 웰 배양 인서트에서 배양 될 수있다. 후자는 다공성 막과 전류로부터 하부 조직을 보호. 이러한 조정 MOC 실험을 시작하기 전에 각 장기 등가물 개별적으로 수행 될 필요가있다. 144 비트의 높은, 여전히 생리학, 심장 활동에 대응하는 예컨대 2.4 Hz의 맥동 동작, / 분은 인간에서, 전단 응력 측정미세 혈관 회로의 채널은 약 25 DYN / ㎠에 이른다. 이는 채널을 포함한 내피 세포 실험에 따라서, 미세 혈관에서 잘 적용 규모의 높은 단부에서 생리적 전단 응력에 대응하고있다. 제시된 MOC 시스템의 현재의 마이크로 유체 레이아웃 두 기관 구획을 연결하는 한 개의 매체 회로로 구성하지만, 하나의 펌핑 속도 및 전단 응력 비율은 전체 시스템을 위해 선택되어야한다. 따라서, 각각의 단일 기관의 요구 유량 특성의 정확한 조정이 항상 가능하지 않다.
또한, 치료는 일반 배지에 세포를 조정에주의가 필요하다. 시험 관내 세포 배양 물에 대한 표준이기 때문에 전지가 결합 된 미디어 회로 MOC에서 재배되고, 따라서, 각각의 세포 배양 배지는, 각 조직 모델에 사용될 수 없다. 최소 결합 된 미디어 제제는 미리와 t 정의 될 필요가그 셀이 새로운 미디어를 단계적으로 조정되어야한다. 이틀 동안 새로운 미디어 구 80 % / 20 %의 조절 절차는 다음, 50 % / 50 % 20 % / 80 %이어서, 그리고 전체 교환은 항상 손에 문화의 적절한 세포 생존 및 기능되었다.
MOC 시스템의 현재 미세 유체 레이아웃은 최대 세 조직의 공동 배양 할 수 있습니다. 인체의 적어도 10 개의 가장 중요한 장기의 공 배양은 항상성에 도달하는데 필요하다. 따라서, 표시 시스템은 특정 조직 - 조직 상호 작용 아니지만 물질 진정한 전신적 반응을 예측할 수있다. 더 장기 충치를 포함하는 MOC의 발전이 예상된다. 또한, 시스템의 유효성은 기준 화합물의 세트를 사용하여 도시한다. 바람직하게는, (예 : 트로글리타존) 임상 시험 동안 실패 화합물은 MOC에서의 성능 시험을하여야한다. 반면, 복잡한 시스템의 진정한 검증은 여전히 b를 방해한다Y 이것과 유사한 시스템의 성능에 대한 독성 학적 데이터 수집 기능 평가를위한 바이오 마커 및 끝점에 관한 표준화의 부족, 신뢰성 및 응용 분야를 확장 할 것이다.
공개
우베 마르크스가 문서에서 사용되는 멀티 오르간 칩 플랫폼을 생산하고 판매 TissUse GmbH의의 CEO입니다. 본 자료는 코닝사에 의해 부여 된 수상에 의해 융자되었다
감사의 말
이 연구는 GO-바이오 부여 번호 0315569을, 교육 및 연구를위한 독일 연방 정부에 의해 자금을 지원하고있다.
자료
| Name | Company | Catalog Number | Comments |
| HepaRG cells | Biopredic International | undifferentiated cells | |
| HHSteC | ScienCell Research Laboratories | cells and all culture supplements | |
| HepaRG Medium | Sigma-Aldrich | William's Medium E 10% FCS 100 U/ml penicillin 100 µg/ml streptomycin 5 µg/ml human insulin 2 mM L-glutamine 5 x 10-5 M hydrocortisone hemisuccinate | |
| HDMEC Medium | PromoCell | Endothelial Cell Growth Medium MV2 with Supplement-Pack MV2 and 1% penicillin-streptomycin | |
| Dimethyl sulfoxide | Carl Roth | add 2% to HepaRG media | |
| Trypsin/EDTA | Biowest | ||
| Trypsininhibitor | Carl Roth | ||
| MAXYMum Recovery Tips | Corning | 1,000 µl Pipet Tips Wide Bore | |
| 384-Well Hanging Drop Plate | 3D Biomatrix | Perfecta 3D 384-Well Hanging Drop Plate | |
| Tissue culture flasks | Corning | 75 cm2 | |
| Ultra-low attachment plate | Corning | 24-well | |
| Transwell cell culture inserts | Corning | 96-well unit, 0.4 µm pore size | |
| Deep well plates | Corning | 96-well, 1 ml | |
| Biopsy punch | Stusche | 4.5 mm | |
| Glass microscope slide | Menzel | footprint of 75 x 25 mm | |
| Polydimethylsiloxane | Dow Corning | Sylgard 184 | |
| Silicon rubber additive | Wacker Chemie | Wacker Primer G790 | |
| Tubes for air pressure | SMC Pneumatik GmbH | Polyurethan-Schlauch, metrisch | |
| Alumin ELISA | Bethyl Laboratories | Human Albumin ELISA Quantitation Set | |
| Lactate dehydrogenase assay | Stanbio Laboratory | LDH Liqui-UV kit | |
| Alexa Fluor 594 acetylated LDL | Invitrogen | 1 mg/ml |
참고문헌
- Kelm, J. M., Fussenegger, M. Microscale tissue engineering using gravity-enforced cell assembly. Trends in biotechnology. 22 (4), 195-202 (2004).
- Marx, U., Walles, H., et al. Human-on-a-chip Developments: A Translational Cutting-edge Alternative to Systemic Safety Assessment and Efficiency Evaluation of Substances in Laboratory Animals and Man. ATLA. 40 (5), 235-257 (2012).
- Baudoin, R., Griscom, L., Prot, J. M., Legallais, C., Leclerc, E. Behavior of HepG2/C3A cell cultures in a microfluidic bioreactor. Biochemical Engineering Journal. 53 (2), 172-181 (2011).
- Dash, A., Inman, W., et al. Liver tissue engineering in the evaluation of drug safety. Expert opinion on drug metabolism & toxicology. 5 (10), 1159-1174 (2009).
- Materne, E. -. M., Tonevitsky, A. G., Marx, U. Chip-based liver equivalents for toxicity testing--organotypicalness versus cost-efficient high throughput. Lab on a chip. 13 (18), 3481-3495 (2013).
- Huh, D., Torisawa, Y., Hamilton, G. a., Kim, H. J., Ingber, D. E. Microengineered physiological biomimicry: organs-on-chips. Lab on a chip. 12 (12), 2156-2164 (2012).
- Sin, A., Chin, K. C., Jamil, M. F., Kostov, Y., Rao, G., Shuler, M. L. The design and fabrication of three-chamber microscale cell culture analog devices with integrated dissolved oxygen sensors. Biotechnology progress. 20 (1), 338-345 (2004).
- Tatosian, D. a., Shuler, M. L. A novel system for evaluation of drug mixtures for potential efficacy in treating multidrug resistant cancers. Biotechnology and bioengineering. 103 (1), 187-198 (2009).
- Schimek, K., Busek, M., et al. Integrating biological vasculature into a multi-organ-chip microsystem. Lab on a chip. 13 (18), 3588-3598 (2013).
- Wagner, I., Materne, E. -. M., et al. A dynamic multi-organ-chip for long-term cultivation and substance testing proven by 3D human liver and skin tissue co-culture. Lab on a chip. 13 (18), 3538-3547 (2013).
- Vieira, U., et al. HepaRG human hepatic cell line utility as a surrogate for primary human hepatocytes in drug metabolism assessment in vitro. Journal of pharmacological and toxicological methods. 63 (1), 59-68 (2010).
- Abu-Absi, S. F., Hansen, L. K., Hu, W. -. S. Three-dimensional co-culture of hepatocytes and stellate cells. Cytotechnology. 45 (3), 125-140 (2004).
- Leite, S. B., Wilk-Zasadna, I., et al. Three-dimensional HepaRG model as an attractive tool for toxicity testing. Toxicological sciences. 130 (1), 106-116 (2012).
- Chiquet-Ehrismann, R. Tenascins. The international journal of biochemistry & cell biology. 36 (6), 986-990 (2004).
- Sidgwick, G. P., Bayat, A. Extracellular matrix molecules implicated in hypertrophic and keloid scarring. Journal of the European Academy of Dermatology and Venereology JEADV. 26 (2), 141-152 (2012).
- Ataç, B., Wagner, I., et al. Skin and hair on-a-chip: in vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a chip. 13 (18), 3555-3561 (2013).
- Wu, M. -. H., Huang, S., Lee, G. -. B. Microfluidic cell culture systems for drug research. Lab on a chip. 10 (8), 939-956 (2010).
- Schanz, J., Pusch, J., Hansmann, J., Walles, H. Vascularised human tissue models A new approach for the refinement of biomedical research. Journal of Biotechnology. 148 (1), 56-63 (2010).
- Holnthoner, W., Hohenegger, K., et al. Adipose-derived stem cells induce vascular tube formation of outgrowth endothelial cells in a fibrin matrix. J Tissue Eng Regen Med. , (2012).
- Dunn, J. C. Y., Yarmush, M. L., Koebe, H. G., Tompkins, R. G. Hepatocyte function and extracellular matrix geometry: long-term culture in a sandwich configuration. FASEB Journal. 3, 174-177 (1989).
- Leclerc, E., Sakai, Y., Fujii, T. Microfluidic PDMS (polydimethylsiloxane) bioreactor for large-scale culture of hepatocytes. Biotechnology progress. 20 (3), 750-755 (2004).
- Kim, M. S., Yeon, J. H., Park, J. -. K. A microfluidic platform for 3-dimensional cell culture and cell-based assays. Biomedical microdevices. 9 (1), 25-34 (2007).
- Prot, J. -. M., Aninat, C., et al. Improvement of HepG2/C3A Cell Functions in a Microfluidic Biochip. Biotechnology and bioengineering. 108 (7), 1704-1715 (2011).
- Riccalton-Banks, L., Liew, C., Bhandari, R., Fry, J., Shakesheff, K. Long-term culture of functional liver tissue: three-dimensional coculture of primary hepatocytes and stellate cells. Tissue engineering. 9 (3), 401-410 (2003).
- Powers, M. J., Domansky, K., et al. A Microfabricated Array Bioreactor for Perfused 3D Liver Culture. Biotechnology and Bioengineering. 78 (3), 257-269 (2002).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유