Method Article
의 시금 혈액 세포 집단
요약
Drosophila blood cells, or hemocytes, cycle between resident sites and circulation. In the larva, resident (sessile) hemocytes localize to inductive microenvironments, the Hematopoietic Pockets, while circulating hemocytes move freely in the hemolymph. The goal of this protocol is the standardized isolation and quantification of these two, behaviorally distinct but interchanging, hemocyte populations.
초록
척추 동물에서 조혈는 유도 미세 환경 (틈새)에 의해 조절된다. 마찬가지로, 무척추 동물 모델 생물 초파리에서 애벌레 조혈 포켓 (HP의)로 알려진 유도 미세 환경은 자기 갱신 식세포 혈통 특히 개발 및 혈액 세포 (혈구)의 규제 해부학 사이트로 확인되었다. HP의이 6063과 같은 말초 신경계의 감각 뉴런을 포함 유충의 표피와 근육층 사이 주머니를 반복했다. 유충에서, 상주 (고착) 혈구 세포는 항 세포 사멸, 접착제이 감각 신경 세포에서 증식 단서 및 라이닝 근육과 상피 층과 HP의 잠재적으로 다른 구성 요소에 노출되어있다. HP의 연료에서 정상적인 개발, 주민 혈구 세포의 점진적 해제하는 동안 개월의 릴리스에서 절정 순환 혈구 세포의 인구,변태의 시작 부분에 상주 혈구의 일. 면역 공격, 부상 또는 기계적 장애는 혈액 순환에 상주 혈구 세포의 조기 석방을 트리거합니다. 거주 장소와 순환 사이 유생 혈구 세포의 스위치를 선택적으로 분리하고 단일 초파리 유충으로부터 혈액 세포의 이러한 두 집단을 정량화하는 표준 공통 / 절차에 대한 필요성을 제기한다. 따라서,이 프로토콜은 해제하고 하나의 유충에서 주민과 순환 혈구 세포를 정량화 할 수있는 자동화 된 방법을 설명합니다. 상기 방법은 생체 외 접근법을 용이하게하고, 초파리 발달 단계 및 다른 무척추 동물 유기체의 다양한 서비스를 제공하도록 적응 될 수있다.
서문
무척추 동물 모델 초파리 melanogaster의 연구는 선천성 면역 (1)의 검색을 구동하고 있으며, 2-4. 초파리 조혈은에 유래 배아 / 유생 혈구 세포의 혈통로 분할 될 수 혈액 세포 발달의 여러 측면의 이해를 용이하게했다 배아 및 유충에 확장 한 임파선의 혈통은 4,5 혈구. 여기, 우리는 초파리 유충에 주로 plasmatocytes (대 식세포) 거의 결정 세포 (4)을 포함 애벌레 / 배아 혈구 세포의 혈통에 초점을 맞춘 프로토콜을 제시한다. 표피와 애벌레 몸 벽 5,6의 근육 층 사이에있는 유충에서 배아의 혈구가 지속 및 식민지 6063 반복 터미널 조혈 포켓 (HP의). 자기 갱신 대 식세포 (6), 지방 조직의 미세 환경 (6)에서의 주된 거주지로 그 성격을 바탕으로개발 중에 6,8- 나오는 초기 혈액 세포에서 7 일 및 그 혈통,이 혈액 세포 집단은 척추 자기 갱신 조직 대 식세포, 최근 종 4,9,10 다양한 식별 독립적 골수성 리니지 유사한 것으로 간주된다. 하지만, 초파리에서, 이러한 일부 또는 모든 셀 거주자 또한 소성은 액정 셀 (11, 12)과 같은 다른 혈액 세포 유형을 야기 할 나타낸다.
유생 혈구 세포는 주로 상주 (고착)이지만, 다양한 HP의 사이의 동적 안정 상태에있다. 3 차 령 유충이 pupariation 5-7에 접근 그들은 점진적으로 특히, 순환으로 방출된다. 체액 4,6,13에 면역 가역 후자의 경우에 도전, 조기 부상 또는 기계적 교란 납, 주민 혈구 세포의 동원.
이전의 연구는 주민 제안 및 순환 한애벌레 혈구 세포는 같은 혈통이지만, 자신의 접착제 또는 유도 속성 6,7,13,14 다르다. 상주 혈구 대 순환의 선택적 분리는 말초 신경계의 감각 신경 세포 클러스터를 표피와 근육 층으로 지어 더욱 항구 된 HP의 6. 초파리 애벌레 HP의에서 유도 단서에 노출을 제안, 주민 혈구 인구에 확산의 높은 수준을 보여 (PNS) 및 간 기능은 oenocytes 6 닮은. 기능적으로, 돌연변이와 유전자 세포 제거 실험은 HP의에 존재하는 감각 뉴런이 애벌레 혈구 6의 영양 생존과 현지화를 지원하는 것을 증명하고있다.
여기에서 우리는 특정 고립과 주민의 정량화 및 단일 초파리 유충에서 순환 혈구 세포 및 기계 혈구 동원을위한 프로토콜하는 방법을 설명합니다. 방법은 생체 외에서 사용될 수있다그리고 혈구 세포의 연구는 또한 이러한 번데기 성인 및 다른 시스템과 같은 다른 무척추 초파리 발달 단계에 적용 할 수있다. 이전의 연구는 거주자 순환 혈구 세포를 구별하지 않았기 때문에,이 프로토콜은 상주 혈액 세포의 연구를위한 공통 표준을 제공하고 무척추 혈액 세포 연구의 일관성을 증가시키는 것을 도울 것이다.
우선, 혈구 블리드 / 긁 세이 차동 분리 및 형광 단백질 표시된 거주자 단일 초파리 유충 혈구 집단 순환 자동 정량 설명; 프로토콜은 일반 타일 스캔 갖춘 현미경을위한 두 가지 옵션 (그림 1)를 제공합니다. 결과적으로, 순환 혈구 세포의 백분율 및 애벌레 당 혈구 세포의 총 수를 얻을 수있다. 방법은 혈액 세포 중에서 형광 단백질을 발현 형질 전환 초파리 유충에 의존인구. 혈구 드라이버 또는 리포터의 선택은 혈액 세포의 집단을 가시화하고 정량하는, 즉 결과를 판정한다. 주로 레이블을 지정하려면 대 식세포 주민과 초파리 유충 (6)의 순환 혈구 인구의 대다수를 포함한다 (plasmatocytes)는, 적합한 유전자는 (기준 HML Δ-을 DsRed 6 HmlΔ -GAL4 15 Pxn -GAL4 16 Crq-GAL4 포함 H. Agaisse 16), 또는 먹는-GAL4 (17); 액정 셀의 비교적 작은 모집단을 표지 용, 적합한 라인 BcF6-CFP 및 -GFP (18), 또는 (J. 폴록 19) LZ-GAL4이고; 라벨링 lamellocytes 위해 특화된 세포 유형은 주로 면역 도전 부상 (13)에 의해 유도는, 예를 들면, MSNF9mo mCherry-17을 사용할 수있다. 일부 형질 드라이버는 차별화 된 혈액의 범위로 표현되는유생 모든 혈액 세포 (20)의 약 80 % 레이블 GAL4 20, - 예컨대 그와 같은 세포 및 전구 세포. GAL4 드라이버가 사용되는 경우 UAS-GFP 또는 다른 형광 단백질 UAS - 유전자와 결합이 필요하며, 모든 경우에주의하시기 바랍니다. 결과 섹션에서,이 방법은 유충 발달의 과정을 통해 혈액 세포 수 및 순환 동작을 모니터링하기 위해 사용된다.
(- 60 분 30) (6) 둘째, 혈구 방해 분석 이후에 다시 부착하고 집에 HP의에 제한된 시간 내에 혈구의 능력에 대한 평가를 할 수 있습니다 외부 조작에 의해 주민 혈구 세포를 분리하도록 설계 이전 단계에 대해 설명합니다. 일반적으로 상기 분석은 당 유충 혈구 세포 순환의 비율을 결정하기 위해 블리드 / 긁 분석으로 이어진다. 우리는 소용돌이로 교반 재치에 의해 방해를 사용하여이 분석 (그림 1D)에 대한 단순화 된 프로토콜을 제시H 유리 비드보다는 페인트 브러시 단일 유충의 조작 이전에 설명 된 바와 같이 6. 결과 섹션에서,이 분석은 체액에 그 일시적으로 분리 된 혈구 세포 부유물을 입증하기 위해 사용되며, 순환 혈구 세포의 분획에서 회수 할 수있다. 분석은 예를 들어, 다양한 유전 적 배경이 나 자극 조건을 비교 상주 사이트에 자신의 유도 / 접착 혈구의 차이를 정량화하는 것이 유용하다. 이 기계 조작 가역 과정을 반영하고 일반적으로 짧은 시간 4,13에 되돌릴 수없는 infection-이나 부상에 의한 주민 혈구 동원, 구별됩니다.
프로토콜
1. 혈구 블리드 / 긁 분석
- 슬라이드의 준비 :
- 타일 스캔 기능이없는 현미경 옵션 1 : 각각의 유충을 분석 할 경우, 현미경의 분야의 관찰 영역에 대응하는 2mm 사각형 각각 약 5 자궁암 펜 웰으로 한 유리 슬라이드를 준비; 각 (그림 1A)에 S2 미디어의 10 μL - 약 5를 추가합니다. 마르지 우물을 방지하기 위해 습기 챔버에서 슬라이드를 유지합니다.
- 타일 스캔 기능을 가진 현미경 옵션 2 : 각각의 유충을 분석 할 경우, 3 ~의 3 ~ 4 팹 펜 우물 하나의 유리 슬라이드 준비 - 4 mm의 사각형을 각각; 각 웰 (그림 1B)에 S2 미디어의 20 μL - 약 15를 추가합니다. 마르지 우물을 방지하기 위해 습기 챔버에서 슬라이드를 유지합니다.
참고 : 우물 위의 권장 수 ~ 2.5, 유충 당 최대 3,000 혈구의 합계 (후반 2 차의 령 유충에 충분하다 - larv의 대부분을 라벨 3mm 길이, 형질 전환 유전자알 혈액 세포). 큰 혈액 세포 수를 평가하는 경우, 더 웰 위에 크라우 딩을 피하기 위해 필요할 수도있다.
- 유충의 컬렉션 :
- 페트리 접시에 애벌레와 플러시 유충을 포함하는 비행 유리 병에 물을 분출, 또는 페트리 접시에 애벌레가 들어 약간의 음식을 특종과 물총 병을 사용하여 물을 희석.
- 조심스럽게 붓을 사용하여 페트리 접시에서 유충을 선택하고 공동 접시에 또는 감기 블록에서 슬라이드에 물에 배치합니다.
참고 : 유충은 물이나 차가운 블록에 제한된 시간 동안 유지 될 수있다; 애벌레 사망 또는 혈구에 원치 않는 효과를 방지하기 위해 45 분 이내에 시료를 사용합니다.
- 해부:
- 차가운 금속 블록에 형광 현미경으로 유충을 선택합니다. 원하는 경우 크기와 이미지 유충을 측정합니다.
- ( "블리드") 혈구 세포를 순환의 분리 :
- 유충이 선택되면, 최초의 자궁 펜도 (그림 1C 한 유충을 배치2A).
- 유충의 후방 및 전방 양쪽 끝에서 절개를 2 깨끗한 바늘 또는 해부 가위와 집게를 사용합니다. 상주 혈구 세포를 방해하지 않도록하기 위해, 유충의 복부 측면에서 이러한 절개를하게하는 것이 가장 좋습니다. 일관된 결과를 들어, 모든 유충에 대해 동일한 위치에 절개를합니다. 1 차 령 애벌레를 들어, (복부 앞쪽에) 1 절개는 충분하다.
- 유충은 어떤 압력이나 물리적 교반 (그림 2A)없이 몇 초 동안 피하도록 허용합니다.
참고 : 여러 유충에서 작업하는 경우는 샘플 '무결성에 영향을 미칠 수있는 너무 오래 얼음에 유충을 유지 피하기 위해 다음 단계를 진행하기 전에 각각에 대해이 절개를 확인하는 것이 좋습니다. - 조심스럽게 바늘이나 집게로 유충을 들어 올려 남아있는 순환 혈구 세포를 씻어 두 번째 우물에 그것을 찍어. 그 후, 상주 혈구 세포의 출시와 함께하십시오.
- 상주 혈구의 분리 ( "다 쳤어요") :
- 조심스럽게 다음 잘 (그림 2C)에 유충을 전송합니다.
- 일반적으로 유충의 앞쪽 끝에서 약 1/3있는 유충의 임파선을 확인하고, 애벌레 몸 벽을 통해 등쪽으로하는 형광 수 있습니다. (그림 2C)을 천공 피하기 위해 임파선에 가능한 한 가까운 바늘로 유충을 달아하여 주민 혈구 세포를 해제하면서 임파선을 피하십시오.
참고 : 임파선 혈구 세포의 성숙이 애벌레 혈구 세포에 비해 지연되고, 차별화 된 혈구 세포의 형광 기자는 어린 유충의 임파선의 신호가 표시되지 않을 수 있습니다 정상적인 개발하는 동안. 이러한 경우, 덜 관심이 예상된다 임파선 혈구 세포로 분화 형광 표지 애벌레 혈구없이 오염으로 임파선에 지불해야합니다. - dissecti에 거주하는 혈액 세포를 분리긁어 및 / 또는 찌르는 과정에. 필요에 따라 효과적으로 림프 글 랜드 근처 유충 (위 참조) 또는 다른 신체 부분을 아래로 핀 하나의 바늘을 사용합니다. 혈구 세포를 분리하는 것을 목표로, 애벌레 몸 벽 (그림 2C, E)를 통해 볼 수 있습니다 혈구의 클러스터에서 잽을 다른 바늘을 사용합니다. 혈구는 스크 레이 핑 운동에 출시 할 수 있습니다. 그러나, 초기에 표피를 찢어하면 자동 계산이 더 도전 할 수있는 혈액 세포의 큰 클러스터를 공개 할 수 있습니다.
참고 : 유충의 연령과 유전자형에 따라, 전체 혈구 세포의 수는 달라질 수 있습니다. 단일 세포 이미지 분석을 더 어렵게 만들 수있는 혈액 세포와 일부 웰의 혼잡을 피하기 위해 여러 웰 위에 상기 박리 공정을 배포한다. - 몇 혈구 세포가 최종 시체에 남아있는 경우, 수동 집계 카운터 (그림 2E)의 현미경 사용을 통해 관찰하여 이러한 혈구 세포를 계산합니다. 카운팅, P를 용이같은 슬라이드 청정 영역에, 카 커스를 레이스와 광학면의 개수를 감소시키기 위해 가능한 한 얇게 확산.
- 세포가 우물 이미징 전에 정착 (그러나 반드시 준수되지 않음)에 대해 10 분 - 해부가 완료되면, 5 ~ 기다립니다. 건조를 방지하기 위해 습기 챔버에서 슬라이드를 품어 및 정착 혈구 세포를 방해 할 수있는 슬라이드의 거친 취급을 피하십시오.
주 : 결정 혈구 계수는, 세포를 고정 해제되지 않고, 세포가 바람직 유충으로부터 해제 후 30 분 이내에, 곧 박리 후에 묘화해야 할 때. 웰에서 매질의 광학면을 중심으로 확인해야 10 분, - 중간 및 셀 특성의 부피에 따라, 세포의 대부분은 5 내에 정착된다. 하지만, 혈액 세포의 분획은,이 시간에 의해 슬라이드면에 고려 될 필요가 사실을 부착 한 경우 세포의 고정 기반 approache 본 프로토콜 수정의.
- 부량:
- 형광 현미경 (그림 2B, D, F)에서 정착 혈구의 이미지를 가져 가라. ImageJ에 소프트웨어를 사용하여 혈구의 정량화에 따릅니다.
- ImageJ에 셀 계산 알고리즘에 대한 이미지를 준비합니다
- 잘 사용 ImageJ에 열기 이미지 : → → 열기를 (파일을 찾아 선택) 파일.
- 이미지 (들)은 8 비트 또는 16 비트인지 확인합니다. 이미지를 선택하여 이미지에 대한 임계 값을 조정 한 후 조정을 선택 임계 값을 누릅니다. "임계 값 창"(그림 3A)를 관찰한다.
- "어두운 배경"옵션을 선택합니다. "레드"를 선택하고 이미지의 각 셀이 빨간색 점 (그레이 스케일로 알 수있다 적용되지 않는 세포도 3B)가 표시 될 때까지 (검은 색 화살표 참조) 낮은 임계 값 레벨을 증가시킨다. 낮은 임계 값으로일부 세포가 표시되지 않은이 될 것 증가한다. 이 낮은 임계 값을 설정하는 방법까지에 대한 지표가 될 수 있습니다.
주 : 때때로 세포의 클러스터가 해결 될 수 없으며, 입자 계수기에 의해로 계산 한 것이다. 그러한 경우에, 클러스터에있는 세포 수는 이미지를 검사 (필요한 경우 줌) 및 수동 카운팅 탤리 계수기를 사용하여 추정 될 수있다. 대안 적으로, 낮은 임계 셀 클러스터를 해결하기 위해 증가 될 수있다; 이 조작으로 인한 표시되지 않은 세포를 집계 카운터를 사용하여 계산 될 수있다.
- ImageJ에를 사용하여 세포 수를 분석 :
- 세포 (그림 3C)를 계산하는 입자 분석기를 시작합니다. 분석 선택과 입자 분석을 클릭합니다. 선택적으로 입자에게 알고리즘 수 (그림 3D)를 참조하기 위해 "오버레이 개요"를 선택합니다. 또는, 장치의 크기 나 화소 영역에 제한을 설정 (예,., 휴대폰, 알고리즘 세포 등)의 덩어리가 계산합니다.
- 확인을 클릭합니다. 수 (그림 3E)와 요약 창을 준수하십시오.
2. 혈구 장애 분석
- 혈구 세포를 선택 유충을 방해하고 유리 구슬 (212-600 μm의) 약 0.5 g을 2 ML의 microcentrifuge 관에 배치하고, 0.5 ml의 물을 추가합니다.
- 1 분 동안 속도 10, 손으로, 튜브를 소용돌이.
- 페트리 접시에 microcentrifuge 관의 내용을 유출하고 붓으로 유충을 선택하여 유리 구슬의 유충을 검색합니다.
- 복구 단계의 경우, 플라이 음식의 소량 이전에 제조 된 배양 접시에 애벌레를 놓습니다. 유충은 45 분 또는 원하는 기간 동안 자신의 혈구 패턴을 다시 설정하도록 허용합니다.
주 :이 과정에서 사망 한 바와 같이, 이동을 중지 어떤 유충을 폐기하십시오. 그러나, 우리는 일반적으로 L 참조ittle 손상 텍싱의 1 분 후 (아래 참조 및 보충 그림 1). - 제 1 절에서 상술 한 바와 같이 회복 기간 후, 블리드 / 긁 분석을 계속합니다.
결과
설명 방법의 전형적인 결과를 설명하기 위해, 우리는 먼저 애벌레 혈구 수의 진행과 애벌레 개발의 과정을 통해 자신의 기숙사 (그림 4) 윤곽을 혈구 블리드 / 쳤어요 분석을 사용했다. 주민과 애벌레 혈구 인구 순환이 하나의 유충에서 분리 하였다 (HML Δ-GAL4, UAS-GFP, 그는-GAL4는 레이블을 광대 한 애벌레 혈구의 대부분)와 ImageJ에를 사용하여 정량화. 유충의 동료는 (~ 48 시간의 AEL 또는 1 차 령), 2.5 mm (~ 80 시간의 AEL 또는 늦게 2 차의 령), 3.5 mm (~ 96 시간의 AEL 또는 3 차 령)을 조사 하였다 (그림 4) 1.2 mm의 크기 . 혈구의 숫자와 상관 염료 염색 유충 7 애벌레 표피 (6)을 통해 형광 단백질 표지 혈구의 라이브 계수의 광학 현미경을 기반으로 기존 추정치를 상회 애벌레 개발의 과정을 통해 확대. 1 차 기능에순환 혈구 세포의 분획은 점진적 이전 공보 -6,7- 부합 유충 발달 과정 (도 4B, C) 위에 증가하면서 타르 유충 거의 모든 혈구 세포가 상주했다.
다음으로 우리는이 방법은 충실하게 주민과 순환 인구 사이의 혈구 세포의 변화를 모니터링 여부를 조사했다. 거주자 혈구 세포가 일시적으로 기계적 교란에 의해 분리 될 수 있고, 그들의 상주 사이트 자발적 6-부착 재한다는 현상을 활용, 우리는 혈구 장애 분석에서 기술 된 바와 같이, 유리 비드 텍싱하여 거주자 혈구 세포를 분산. 실제로, 유충의 기계적인 방해가 상주 혈구의 비용 (그림 5)에서 혈구 세포를 순환의 인구의 급격한 증가로했다. 45 분간의 회복 기간 후, 혈구 세포는 주로 시각적 검사와 같은 양으로, 그들의 접착 상태로 돌아왔다순환 세포에 규정하는 비율 (그림 5D, E). 예상 한 바와 같이, 전체 혈구 번호는 순환 및 집단 거주 혈구 세포 사이의 이동에도 불구하고, 시간이 지남에 안정적이었다.
몇 가지 추가 고려 사항이 고려되었다. 유리 구슬이 다양한 시간주기들 (1, 5, 20 분)에 대한 트립 판 블루 (시그마)의 존재하에 수행 하였다 텍싱하여, 주요 조직 손상을 유발하지 않았다 텍싱을 확인하는 방법. 20 분 텍싱이 양성 대조군 (보충 그림 1)으로 사용 바늘 바늘로 인한 손상을 닮은, 손상의 작은 영역의 결과 동안 모두 1과 5 분 볼텍스, 명백한 조직의 파괴가 발생하지 않았다. 표피 또는 표피 손상없이 다른 조직의 내부에 손상을 배제 할 수는 없지만,이 시나리오는 애벌레 무결성 타협하지 않았다 제안, 1 분, 5 분 처리 유충 재 부착 된 예상 패턴 및 시간 프레임에서의 혈구 오히려 가능성이 보인다D (보충 그림 1). 대조적으로, 유충 재 부착의 부족으로 고통을 20 분 동안 볼 텍싱하고, 14 이전에 설명 된 바와 같이, 심지어, 표피 창상 부위에 순환 혈구 세포의 부착을 나타내지 않았다.
마지막으로, 방법의 재현성을 입증하기 위해, 우리는 서로 다른 실험자에 의해 수행되었다 위의 두 실험에서 2.5 mm의 유충의 생물 복제를 비교했다. 기업도 2에 도시 된 바와 같이, 모두 비교 코호트는 총 애벌레 당 혈구 세포의 숫자 및 순환 혈구 세포의 백분율을 보여 주었다. 스튜던트 T 테스트 방법은 재현성 넓게 적용될 수 있다는 것을 시사 통계적으로 유의 한 차이가 없었다.
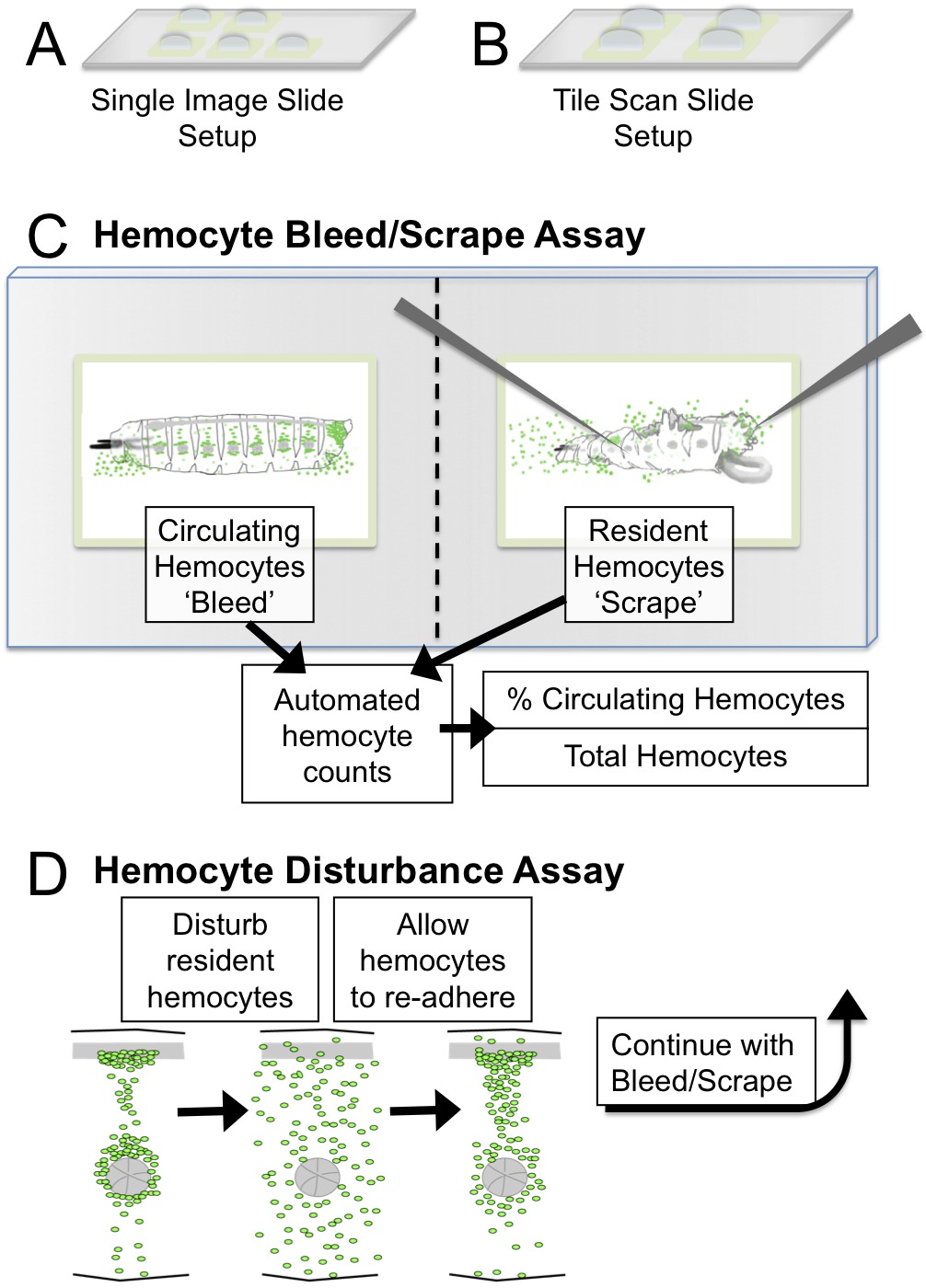
그림 1. 혈구 블리드 / 긁고 장애 분석의 etup 및 회로도. (A) 단일 이미지 슬라이드 설정 : 5 배 목적으로 이미징을위한 다섯 2mm 사각형 (B) 타일 스캔 슬라이드 설정 :. 영상 블리드 네 3mm 사각형 / 타일 스캔 현미경 ≤2.5 MM 유충의 긁힌 자국. 이미징을위한 권장 목표 5 배 또는 10 배. (C) / ImageJ에를 사용하여 긁어 분석 회로도와 결과 정량화 블리드. (D) 장애 분석에 있으며, 혈구 패턴을 기계적으로 유리 구슬과 유충을 텍싱에 의해 파괴된다. 애벌레는 혈구 세포는 조혈 포켓에 다시 부착하는 동안 45 분의 기간 동안 복구 할 수 있습니다. 혈구 세포의 접착 특성 외란 후 순환 혈구 세포의 비율을 정량화,이 방법에 의해 평가 될 수있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
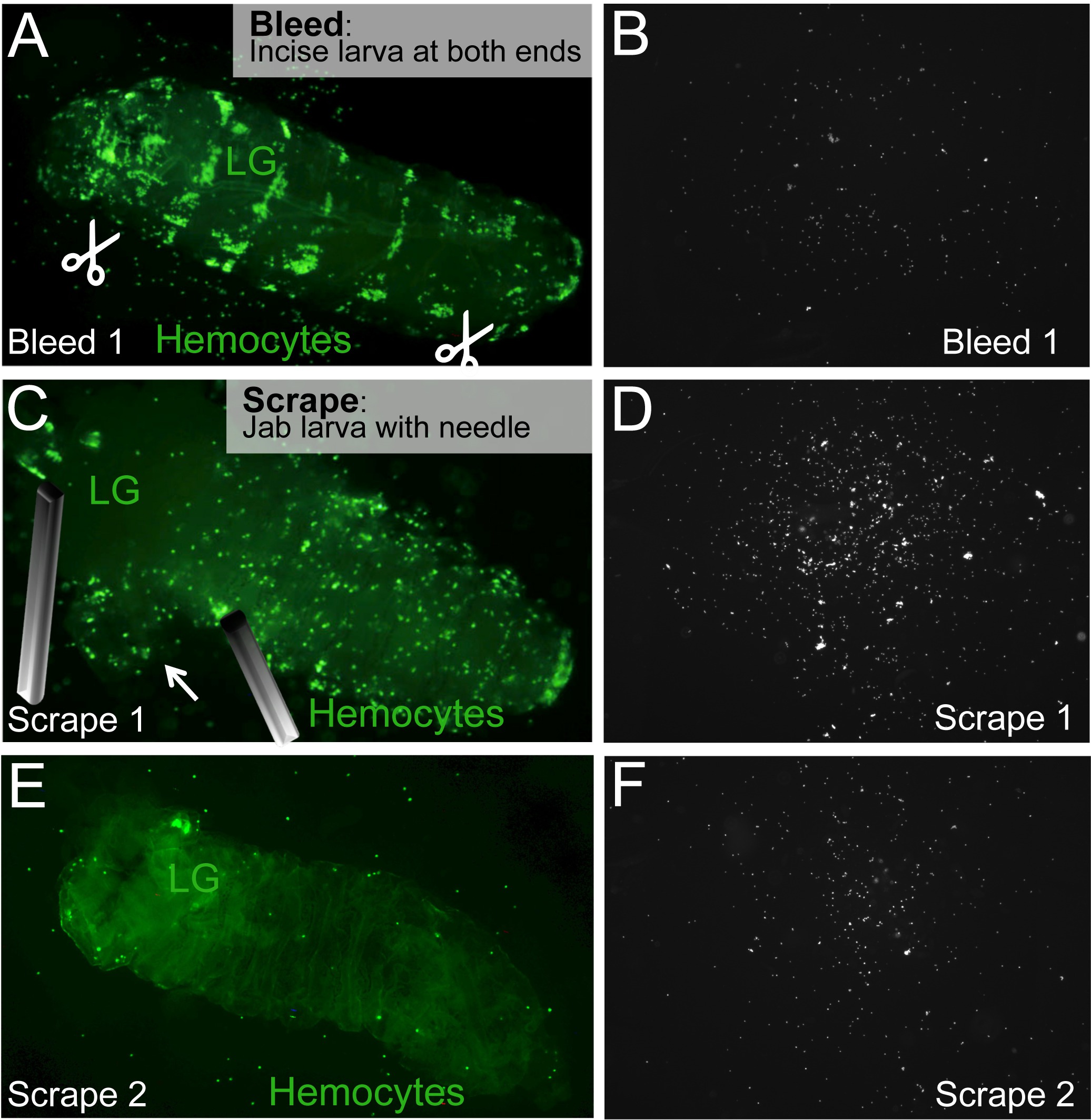
그림 2. 블리드 / 긁 분석은 순환과 주민 혈구 분리합니다. (A) 유충을 피가 유충의 후방 및 전방 단부에서 복부 절개 (위 기호) 제조된다. (B) 혈구 절개 유출과 슬라이드의 표면에 정착된다 순환한다. (C) 림프 글 랜드 (LG 전자)에 위치하고 천공하지 않고, 아래로 고정됩니다. 주민의 혈구 세포를 찌르고 및 / 또는 바늘로 유충을 긁어에 의해 방출된다. 슬라이드 (D) 주민 혈구. (E, F)의 모든 거주자의 혈구 세포가 해제 될 때까지 긁어 과정이 반복된다. 그대로 림프 글 랜드를 포함하는 애벌레 시체가 남아있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
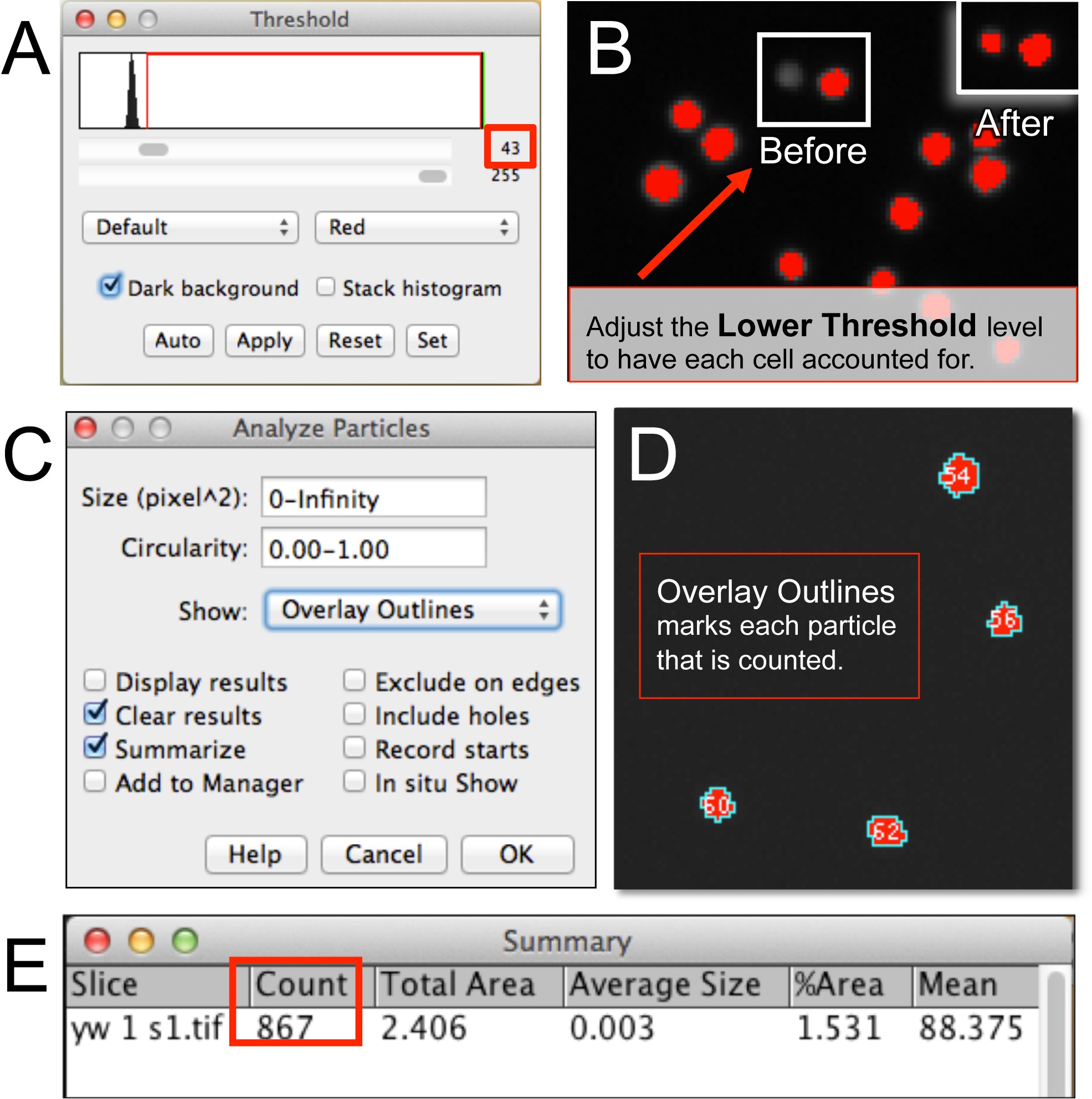
그림 3. ImageJ에를 사용하여 혈구 세포의 정량을 자동화. (A는, B) ImageJ에에서 혈구 이미지 파일을 연 후, 하한 임계 레벨은 이미지의 모든 셀을 고려하여 조정된다. (C, D) 입자는 셀 픽셀 크기, 원형, 그 결과 판독 설정 요구 분석 형식 (예를 들어, 오버레이 개요). (E) 혈구의 수를 표시하는 요약 창. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4. 대표 결과 (1). 혈구 번호 위에 상주 상태 애벌레 개발의 과정. (A)를 사용 애벌레 단계의 개요; 1 차 령 (48 시간의 AEL; ~ 1.2 mm의 길이); 2 차 령 (80 시간의 AEL 2.5 mm의 길이); 3 차 령 (96 시간 AEL; ~ 3.5 mm의 길이). 유전자형은 HML Δ-GAL4, UAS-GFP이다 그는-GAL4. 단계가 애벌레 mouthhooks를 평가하여 확인 하였다. 각각의 애벌레 단계에서 순환 및 주민 혈구 번호 (B) 바 다이어그램. 혈구 순환 (C) 비율입니다. 순환 혈구 세포의 비율이 애벌레 개발의 과정을 통해 불균형이 증가합니다. (D) 총 혈구 세포를, 유충 당 순환과 주민 혈구의 합으로 인한. 혈구는 블리드 / 쳤어요 방법을 사용하여 정량 하였다 N ≥ 6 유충 / 조건은, 오차 막대는 표준 편차, 3 독립적 인 복제 실험에서 확인 된 결과를 보여줍니다.JPG "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
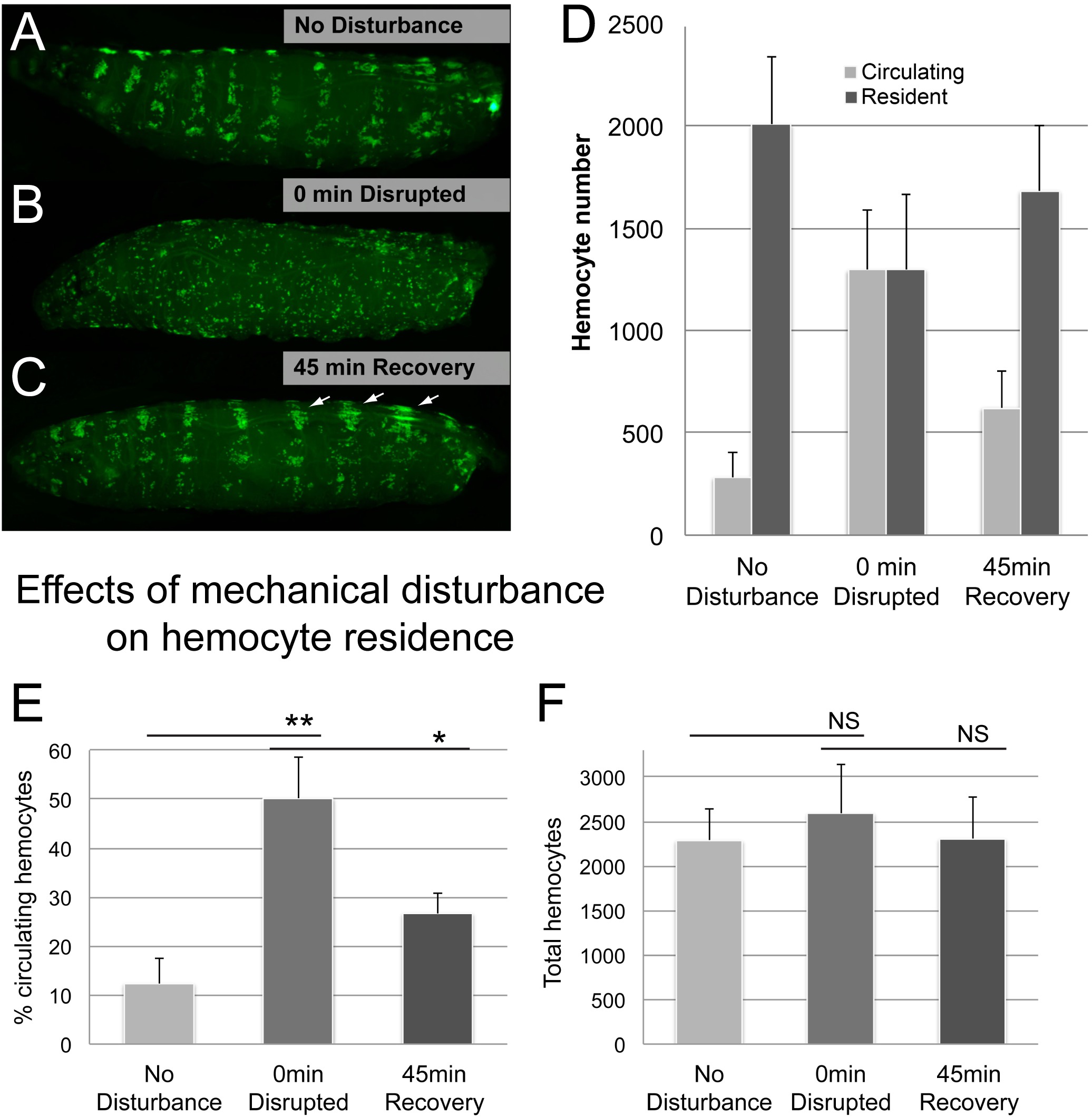
그림 5. 대표 결과 (2). 혈구 기숙사에 기계적인 교란의 효과. (AC) 전 45 분 복구 한 다음 유리 구슬과 텍싱 후 유충의 예 () 아니오 방해 제어 할 수 있습니다.; 혈구 세포는 조혈 주머니에 지역화 (B) 혼란 혈구 패턴을 0 분에서 유리 구슬과 물 현탁액에 유충을 텍싱 후 복구 후 장애의 45 분의 (C) 혈구 패턴..; 많은 혈구 세포는 조혈 포켓에 이전했다; 확대 등의 혈관 관련 클러스터와 초 후 방해 축적 (화살표)의 지배적 인 위치이다 등의 줄무늬를 확인합니다. 유전자형은 HML Δ-GAL4, UAS-GFP입니다; 그는-GAL4의 X YW. 블리드 / 긁 방법에 의해 정량화 혈구 순환 (D) 비율입니다. (E) 총 혈구, 유충 당 순환과 주민 혈구의 합으로 인한. N ≥ 4 유충 / 조건은, 오차 막대는 표준 편차, 3 독립적 인 복제 실험에서 확인 된 결과를 보여줍니다. 학생의 t- 테스트가 의미를 확인하기 위해, NS (중요하지), ** (0.05 ≤ P), ** (0.01 ≤ P)는. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기서는 정량적 단일 초파리 유충으로부터 거주자 순환 혈액 세포를 회수하고, 이들 두 혈구 개체군을 정량화하는 첫 번째 방법을 설명한다. 프로토콜은 촬상 및 자동 셀 카운팅 하였다 순환 주민 혈구 연속 방출을 포함한다. 60 분간의 회복 기간을 6 - 유충 상주 혈구 세포는 일시적으로, 기계적 교란에 의해 순환에 주로 30에서 반전 될 것으로 알려진 프로세스를 동원 할 수있다. 따라서,이 프로토콜은 두 가지 방법으로 시험 하였다 (1) 유충 및 유충 발달의 과정 혈구 세포 순환 분획 당 총 혈구 수를 평가함으로써, (2) 실험적으로 자동화 된 방법을 사용하여 상주 혈구 세포를 빠지 의해 확정 된 혈구의 현지화 및 주민의 혈구 수와 순환 인구의 긴밀한 상관 관계. 또한, 본 방법의 재현성이 입증되었다 CO생물 복제의 두 데이터 세트를 mparing.
과거에는, 실험실 유생 6,13,21 혈구 세포를 정량화하는 방법의 범위를 사용 하였다. 이 프로토콜은 검색하고 쉽게 적응할 플랫폼을 제공 초파리 유충으로부터 거주자 순환 혈액 세포 집단을 정량화하는 공통 표준을 정한다. 설명하는 방법은 상주 혈구과 미세 환경의 역할에 초점을 연구에 중요하다, 조혈 4-6 포켓, 형광 단백질 야생 타입 유전자 운반 초파리 균주 및 유전자 변형 배경을 연구하기에 적합합니다. 이 프로토콜은 또한 거주자 혈구 세포 또는 (4 검토) 총 혈구 수의 변화 동원을 유발 면역 도전이나 부상, 유전 또는 환경 적으로 유도 신호 후 혈구 동원에 초점을 연구 관련이있다. 이는 조기 디 경우에 주목해야한다임파선 계통 대 배아 / 애벌레를 구별 fferentiation과 임파선에서 혈구 세포의 방출은, 사용 된 형광 혈구 기자의 발현 패턴에 의해 제한 될 수 있습니다.
여기에 제시된 프로토콜은 영상 라이브, 형광 표지 된 혈구 세포에 의존한다. 향후, 이는 면역 세포 화학을 이용하여, 예를 들어, 고정 해제 후 세포의 검출을 허용하도록 변형 될 수있다. 방법은 혈구 세포의 검색과 그 조작 EX 할 수 있으므로이 경우, 프로토콜은 접착 배양 시간을 증가 및 콘 카나 발린 A의 같은 접착제 슬라이드 코팅을 추가하여, 예를 들어 혈구의 완전한 접착 성을 보장하도록 구성 될 필요가있다 생체, 그것이 발달, 세포 생물학, 생화학 적 연구의 다양한 혜택. 주민과 순환 혈액 세포는 모든 초파리의 postembryonic 발달 단계 및 기타 무척추 동물 (22), suggesti 동안 발견NG이 방법의 적응은 초파리 애벌레 조혈 시스템 연구 이후 다양한 혜택.
공개
The authors have nothing to disclose.
감사의 말
우리는 플라이 주식에 대한 제스퍼 Kronhamn 댄 Hultmark, 마이클 Galko 및 블루밍턴 증권 센터 감사합니다. 통계 분석과 조언을 코트니 오노 데라 특별 감사. 우리는 원고의 중요한 읽기 카트리나 골드, 그리고 칼 파나 마히 자니, 카트리나 골드, Derynck 실험실의 구성원, 그리고 원고에 대한 토론과 의견 Nystul 실험실의 구성원을 감사드립니다. 이 작품은 혁신적인 생물 의학 연구 (PBBR), 넓은 센터, 헬만 재단, 미국 암 학회 (American Cancer Society) RSG DDC-122595, 미국 심장 협회 (American Heart Association) 13BGIA13730001, 국립 과학 재단 (National Science Foundation) 1326268, 건강 1R01GM112083-01의 국립 연구소와의 UCSF 프로그램에서 보조금에 의해 지원되었다 (KB에) 1R56HL118726-01A1.
자료
| Name | Company | Catalog Number | Comments |
| 6 cm/9 cm Petri dishes | One for each genotype to be evaluated | ||
| Water squirt bottle | |||
| Metal spoon/spatula | |||
| Thin paintbrush | e.g., a "liner" | ||
| Glass cavity dish | |||
| PAP pen: Super PAP PEN IM3580 | Beckman Coulter | ||
| Glass slides | Each slide will have 5 or more PAP PEN squares drawn on them. Size of squares depends on the imaging objective and magnification of the microscope camera; e.g., 2 mm squares. | ||
| Moist chamber | This will be used to prevent slides and wells from drying out: sealed container with wet paper towels lining the sides/bottom | ||
| Schneider’s Drosophila cell culture media | Invitrogen | ||
| Cold block | This is a metal block (a.k.a. heating block) chilled in bucket containing ice; preferably black-colored or other dark, non-reflective color | ||
| 2 x 1 ml syringes with needles (27 G ½") | Becton Dickinson | For dissections. | |
| Optional: Surgical spring scissors (cutting edge 2 mm) | Fine Science Tools | ||
| Glass beads, 212 - 600 μm | Sigma | ||
| 2 ml Eppendorf tubes | Eppendorf | One per genotype evaluating | |
| Vortex mixer | Fisher Scientific | ||
| Transgenic Drosophila larvae with fluorescently marked hemocytes. | Suitable transgenes include: HmlΔ-DsRed (Makhijani et al., 2011), MSNF9mo-mCherry (Tokusumi et al., 2009), BcF6-CFP and -GFP (Gajewski et al., 2007), or HmlΔ-GAL4 (Sinenko and Mathey-Prevot, 2004), Pxn-GAL4 (Stramer et al., 2005), He-GAL4 (Zettervall et al., 2004), Crq-GAL4 (by H. Agaisse (Stramer et al., 2005)), or eater-GAL4 (Tokusumi et al., 2009) combined with UAS-GFP or other fluorescent protein transgenes. | ||
| Fluorescence dissecting microscope | Leica | Here: Leica M205, optional with camera, imaging software and measuring module | |
| Inverted fluorescence microscope with camera attachment | Leica or Keyence | With or without tile scanning function (e.g., Leica DMI series, Keyence BIOREVO BZ-9000 series) |
참고문헌
- Lemaitre, B., Hoffmann, J. The host defense of Drosophila melanogaster. Annu Rev Immunol. 25, 697-743 (2007).
- Evans, C. J., Hartenstein, V., Banerjee, U. Thicker than blood: conserved mechanisms in Drosophila and vertebrate hematopoiesis. Dev Cell. 5, 673-690 (2003).
- Wood, W., Jacinto, A. Drosophila melanogaster embryonic haemocytes: masters of multitasking. Nat Rev Mol Cell Biol. 8, 542-551 (2007).
- Gold, K. S., Brückner, K. Drosophila as a model for the two myeloid blood cell systems in vertebrates. Experimental hematology. 42, 717-727 (2014).
- Makhijani, K., Brückner, K. Of blood cells and the nervous system: Hematopoiesis in the Drosophila larva. Fly. 6, 254-260 (2012).
- Makhijani, K., Alexander, B., Tanaka, T., Rulifson, E., Brückner, K. The peripheral nervous system supports blood cell homing and survival in the Drosophila larva. Development. 138, 5379-5391 (2011).
- Lanot, R., Zachary, D., Holder, F., Meister, M. Postembryonic hematopoiesis in Drosophila. Dev Biol. 230, 243-257 (2001).
- Holz, A., Bossinger, B., Strasser, T., Janning, W., Klapper, R. The two origins of hemocytes in Drosophila. Development. 130, 4955-4962 (2003).
- Sieweke, M. H., Allen, J. E. Beyond stem cells: self-renewal of differentiated macrophages. Science. 342, 1242974 (2013).
- Davies, L. C., Jenkins, S. J., Allen, J. E., Taylor, P. R. Tissue-resident macrophages. Nature immunology. 14, 986-995 (2013).
- Bretscher, A. J., et al. The Nimrod transmembrane receptor Eater is required for hemocyte attachment to the sessile compartment in Drosophila melanogaster. Biology Open. 1-9, (2015).
- Leitao, A. B., Sucena, E. Drosophila sessile hemocyte clusters are true hematopoietic tissues that regulate larval blood cell differentiation. eLife. , (2015).
- Markus, R., et al. Sessile hemocytes as a hematopoietic compartment in Drosophila melanogaster. Proc Natl Acad Sci U S A. 106, 4805-4809 (2009).
- Babcock, D. T., et al. Circulating blood cells function as a surveillance system for damaged tissue in Drosophila larvae. Proc Natl Acad Sci USA. 105, 10017-10022 (2008).
- Sinenko, S. A., Mathey-Prevot, B. Increased expression of Drosophila tetraspanin, Tsp68C, suppresses the abnormal proliferation of ytr-deficient and Ras/Raf-activated hemocytes. Oncogene. 23, 9120-9128 (2004).
- Stramer, B., et al. Live imaging of wound inflammation in Drosophila embryos reveals key roles for small GTPases during in vivo cell migration. J Cell Biol. 168, 567-573 (2005).
- Tokusumi, T., Shoue, D. A., Tokusumi, Y., Stoller, J. R., Schulz, R. A. New hemocyte-specific enhancer-reporter transgenes for the analysis of hematopoiesis in Drosophila Genesis. 47, 771-774 (2009).
- Gajewski, K. M., et al. Identification of a crystal cell-specific enhancer of the black cells prophenoloxidase gene in Drosophila. Genesis. 45, 200-207 (2007).
- Lebestky, T., Chang, T., Hartenstein, V., Banerjee, U. Specification of Drosophila hematopoietic lineage by conserved transcription factors. Science. 288, 146-149 (2000).
- Zettervall, C. J., et al. A directed screen for genes involved in Drosophila blood cell activation. Proc Natl Acad Sci USA. 101, 14192-14197 (2004).
- Shim, J., Mukherjee, T., Banerjee, U. Direct sensing of systemic and nutritional signals by haematopoietic progenitors in Drosophila. Nature cell biology. 14, 394-400 (2012).
- Hartenstein, V. Blood cells and blood cell development in the animal kingdom. Annu Rev Cell Dev Biol. 22, 677-712 (2006).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유