Method Article
생체 외 및 생체 내 모델에서 혈관 벽에서 흐름 조건에 세균 부착을 연구하기 위해
요약
To study the interaction of bacteria with the blood vessels under shear stress, a flow chamber and an in vivo mesenteric intravital microscopy model are described that allow to dissect the bacterial and host factors contributing to vascular adhesion.
초록
혈관 감염 심내막염 발생할하기 위해, 박테리아는 흐르는 혈액의 전단 응력에 노출 된 상태로 혈관 벽에 부착 할 수 있어야한다.
미생물의 부착에 기여하는 혈관 박테리아 및 숙주 요인을 파악하기 위해, 전단 생리적 조건 하에서 이러한 상호 작용을 연구 적절한 모델이 필요하다. 여기서, 우리는 세포 외 기질의 서로 다른 컴포넌트에 세균 밀착성을 조사하기 위해 또는 내피 세포 받을수 관내 유동 챔버 모델을 설명하고 개발 된 생체 내에 현미경 모델이 직접 생체 내에 내장의 순환에 박테리아의 초기 밀착성을 시각화 . 이러한 방법은 기류 하에서 박테리아의 부착에 필요한 박테리아 및 숙주 요인을 파악하기 위해 사용될 수있다. 우리는 전단 응력의 관련성과 Staphy의 접착 폰 빌레 브란트 인자의 역할을 도시lococcus 구균 모두 시험 관내 및 생체 내 모델에서 사용.
서문
To establish endovascular infections, pathogens require a mechanism to adhere to the endothelium, which lines the vessel wall and the inner surface of the heart, and to persist and establish an infection despite being exposed to the shear stress of rapidly flowing blood. The most frequent pathogen causing life-threatening endovascular infections and infective endocarditis is Staphylococcus aureus (S. aureus)1.
Various bacterial surface-bound adhesive molecules mediate adhesion to host tissue by interacting with extracellular matrix components. These MSCRAMMs (microbial surface components recognizing adhesive matrix molecules) recognize molecules such as fibronectin, fibrinogen, collagen and von Willebrand factor (VWF). MSCRAMMs are important virulence factors of S. aureus and are implicated in the colonization and invasion of the host2. Most studies on these virulence factors have been performed in static conditions, and thus may not be representative for human infections where initial adhesion of the bacteria occurs in flowing blood.
In the case of bloodstream infections, bacteria need to overcome the shearing forces of flowing blood in order to attach to the vessel wall. Models that investigate the interaction between bacteria and endothelium or subendothelium under flow conditions are therefore of particular interest.
A recent study showed that the adhesion of S. aureus to blood vessels under shear stress is mediated by VWF3. VWF, a shear stress-operational protein, is released from endothelial cells upon activation. Circulating VWF binds to collagen fibers of the exposed subendothelial matrix. Our group reported that the von Willebrand factor-binding protein (vWbp) of S. aureus is crucial for shear-mediated adhesion to VWF4.
In this article, we present an in vitro flow chamber model where bacterial adhesion to different components of the extracellular matrix or to endothelial cells can be evaluated. To validate the findings from in vitro data, we have developed an in vivo model that visualizes and quantifies the direct interaction of bacteria with the vessel wall and the formation of bacteria-platelet thrombi in the mesenteric circulation of mice, using real-time intravital vascular microscopy.
프로토콜
동물 실험은 KU 루벤의 윤리위원회에 의해 승인되었다.
체외 관류 및 생체 실험 1. 준비 박테리아
- 우리는 미 사용 구균이 원고에 설명 된 모든 실험 변형 뉴먼을. S. 구균 뉴만는 -80 ° C에서 10 % 글리세롤로 뇌 심장 주입 (BHI)에 저장 하였다.
- 37 ° C (OD> 3 600)에서 / N을 얼어 붙은 박테리아를 긁어 5 ㎖의 트립신 간장 국물 (TSB) O에 접종 멸균 루프를 사용합니다.
- 원심 분리 (2,600g, RT, 5 분)에 의해 박테리아를 세척하고 5 ml의 PBS (인산염 완충 식염수)에있는 박테리아 펠렛을 재현 탁.
- 에탄올 5 (6) 카르복시 - 형광 N-히드 록시 숙신 에스테르 (카르복시 - 형광)의 1 ㎎ / ㎖ 솔루션을 준비합니다. 실험실 등급 물에 150 μg의 / ㎖로 1 ㎎ / ㎖ 카르복시 플루오 레세 인 용액 (예를 들어, 한 MilliQ 워터) 희석. 빛의 튜브를 보호-20 ° C에서 알루미늄 포일과 함께 가게.
- (2600 XG, RT, 5 분) 박테리아를 원심 분리기. 800 μL PBS에 박테리아 펠렛을 재현 탁하고 200 μL 또는 150 μg의 / ㎖ 카르복시 형광 용액 400 μL (최종 농도 생체 실험 50 ㎍ / ㎖) (관류 실험 30 ㎍ / ml의 최종 농도)를 추가합니다. 알루미늄 호일로 광으로부터 튜브를 보호하고 쉐이커상에서 RT에서 30 분 동안 배양한다.
- 표지 한 후, PBS에서 6 % 소 혈청 알부민 (BSA) 용액 블록.
- 광학 농도계를 사용하여 박테리아 (OD), OD 시험관 실험 0.65 600 희석 (과 외경 생체 실험 1.8 600 (약 3 × 10 8 콜로니 형성 단위 (CFU) 황색 포도상 구균에 대한 / ㎖에 해당) PBS에서 황색 포도상 구균 약 1 × 109 CFU / ㎖)에 해당. 알루미늄 호일로 빛으로부터 튜브를 보호하고 얼음에 둡니다.
2. 체외 관류 실험
- 유리 Coverslips는의 코팅
- 실험실 등급 물 폰 빌레 브란트 인자 (VWF) (P Haemate 재고 μg의 농도가 2400 / ml)로 희석를 50㎍ / ㎖의 최종 농도 (증류 된 탈).
- 160 μg / ML의 최종 농도로 (제조자에 의해 공급되는 SKF 용액의 pH 2.7-2.9) 등장 글루코오스 용액에 콜라겐을 희석.
- 파라 필름에 코팅 200 μL 적하하고 액적 위에 커버 슬립을 배치함으로써 VWF 또는 콜라겐 코트 커버 글라스 (24 × 50mm). 액 커버 슬립의 표면을 따라 확산된다.
- 실온에서 4 시간 동안 가습 용기에 커버 슬립을 품어. 조심스럽게 무딘 바늘로 파라 필름에서 된 커버를 들어 올립니다. 유량 용기의 바닥 부분에 커버 슬립을 탑재합니다.
- 플라스틱 코팅 내피 세포로 미끄러
- 코트 플라스틱 전표(1 PCA 웰 세포 배양 챔버, Sarstedt의, 독일) PBS에 1 % 젤라틴 용액 1 ㎖와 37 ° C에서 30 분 동안 배양한다. 젤라틴 코팅 된 플라스틱 전표에 씨앗 인간 제대 정맥 내피 세포 (HUVECs를) 및 70~80%의 포화 상태로 성장한다. 유량 용기의 바닥 부분에 플라스틱 슬립을 탑재합니다.
- 관류 실험
참고 : 체외 관류 모델의 개략도는 그림 1에 표시됩니다.- 다른 생리 학적 유동 조건을 시뮬레이션 2.5 다인 / cm 2 및 20 다인 / cm (2) 사이에 층류 전단 응력에서 마이크로 - 평행 판 유량 용기에 시험관 세균성 유착 과정을 수행한다.
- 유량 용기 (자체 설계) 금속 프레임과 유기 유리로 만든 관류 실 (폴리 (메틸) 메타 크릴 레이트 (PMMA))로 구성되어 있습니다. 고정밀 주입 펌프 (2000 PHD 주입 하버드있어서, USA)에 연결하여, 우리는 플로우 (RA)를 생성 할 수있다0.0001 μL / 분, 220.82 ml / 분 사이 TES.
- 유량 용기의 상부에 튜브를 연결하고 튜브에 매체를 삽입. 부드럽게 저부 위에 유동 챔버의 상부를 배치하고 유동 챔버를 조립한다. 공기 방울을 피하기 위해주의해야합니다. 챔버가 누출되지 않았는지 확인하고 여분의 코팅 용액을 제거 챔버를 통해 매체의 1 ml에 주입한다. 공기 방울을 피하십시오.
- 현미경 트레이에 37 ° C에서 열 제어 가열 패드에서 마우스를 놓습니다. 이 절차는 단말이기 때문에, 엄격한 asceptic 절차가 필요하지 않다. 경정맥 근처 절개를 부드럽게 자궁 근육의 오른쪽 측면을 제거하고 주변 조직으로부터 경정맥을 분리.
- 주입 펌프 및 형광 현미경을 설정합니다. 주입 펌프 설정은 주사기의 직경과 원하는 유량 (2.4 절 참조)에 따라 달라집니다. 지금부터, 어두운 방에서 작동합니다.
- VWF 코팅 :
- 형광 표지 된 세균을 채우고 주사기 주입 관에 연결. 공기 방울을 피하십시오. 10 분 동안 주입 펌프를 시작합니다. 주입 시간이 사용 전단 속도 및 코팅, 박테리아 배지에 따라 밀착성의 정상 상태를 표현한다.
- 10 분 후, 주입 관을 PBS와 주사기를 연결하고 주입 펌프를 개시하여 결합되지 않은 세균을 씻어.
- 세척 과정 후 다른 위치에서 적어도 15 이미지 나 동영상을 가져 가라. 박테리아에 초점을 작은 잠재적으로 어렵습니다. 시험 관내 유동 실험에 앞서, 적절한 초점면은 커버 슬립에 형광 표지 된 박테리아의 드롭을 배치하고 유동 챔버 커버 슬립을 배치하여 검색 될 수있다. 이어서, 적절한 초점 평면을 검색하고 설정을 저장한다.
주 : 시험 관내 유동 실험 기간 동안, 세정 공정 중에 이미지를 캡처 (± 시작 후 5 분) 만 보장 그런부착 세균에 대한 신호가 포착된다.
- 콜라겐 코팅 :
- 단지 관류를 시작하기 전에 형광 표지 된 박테리아에 60 μg의 / ㎖의 VWF를 추가합니다. 60 μg의 / ㎖로 보충 VWF 형광 표지 또는 형광 표지 된 박테리아 박테리아를 채우고 주사기 주입 관에 연결. 공기 방울을 피하십시오. 반복 2.3.5.2 2.3.5.3에 단계
- 내피 세포 :
- 칼슘 -ionophore A23187의 0.1 mM의 용액으로 관류에 의해 내피 세포를 활성화하여 관류에 의해 10 분 동안 박테리아 관류 동일한 전단 속도에서 DMEM에서 (원액을 디메틸 설폭 사이드 (DMSO)에 용해 된 10 mM) 0.1 mm이다. 반복 2.3.5.3에 2.3.5.2 단계를 반복합니다.
- 다음과 같이 전단 속도와 전단 응력을 계산합니다.
전단 속도 = 6Q / WH 2
: Q는 : W ml / 분의 속도, 흐름 : CM에서 폭, H : CM 높이
전단 응력 (τ) = 전단 쥐예 점도 (μ)
여기서 μ : 중간 : 0.01 다인 X 초 / ㎠, 전체 혈액 : 0.04 다인 X 초 / ㎠ - 이미지 분석
- 흑백 카메라와 거꾸로 형광 현미경을 사용하여 라이브 영상을 얻기 및 이미징 소프트웨어를 사용하여 개발할 수 있습니다. 1.5 초의 노출 시간을 사용합니다. 무작위로 유량 용기의 코팅 된 표면에 걸쳐 여러 스냅 샷 (이상 15)을 가지고 해당 파일 형식으로 저장할 수 있습니다.
- ImageJ에와 이미지 분석을 수행합니다. 관심의 기능에 그레이 스케일 이미지를 분할, 하부 및 상부 임계 값을 설정하는 임계 값을 정의 - 이미지 (빼기 배경 프로세스)에서 부드러운 연속 배경을 제거하는 배경을 뺍니다. 임계 값에 한정되는 영역을 측정한다.
- 박테리아 부착을 비교 통계 분석 소프트웨어를 사용하여, 예를 들면 형광 영역으로 표현. 일방향 ANOVA 또는 t를 사용하여 그룹을 비교WO 꼬리 학생의 T- 테스트를. 평균 (SEM)의 평균 ± 표준 오차로 모든 값을보고합니다. 중요한 <0.05의 P- 값을 고려 (* P <0.05, ** P <0.01, *** P <0.001).
생체 장간막 관류 모델 3.
- 마우스의 제조 / 수술
- 대변을 제한하기 위하여 실험 전날 밤 마우스를 빠르게.
- 부 프레 노르 핀의 피하 주사 수술 전에 (0.1 ㎎ / ㎏ 체중 (BW)) 20 ~ 30 분으로 6-8 주 이전 마우스 (C57BL / 6) 수술 전 진통제를주십시오.
- 복강 내 케타민 주사 (125 ㎎ / ㎏ BW)과 자일 라진 (12.5 ㎎ / ㎏ BW)에 의해 마우스를 마취. 페달 반사에 의해 확인합니다. 건조를 방지하기 위해 수의사 연고를 적용합니다.
- 현미경 트레이에 37 ° C에서 열 제어 가열 패드에서 마우스를 놓습니다. 이 절차는 단말이기 때문에, 엄격한 ascepti 필요 없다C 절차. 경정맥 근처 절개를 부드럽게 자궁 근육의 오른쪽 측면을 제거하고 주변 조직으로부터 경정맥을 분리.
- 형광 표지 된 세균이나 다른 솔루션의 주입에 적합한 경정맥에 2 프랑스어 정맥 카테터를 삽입합니다. 중간 선 복부 절개를 통해 복강을 열고 mesenterium를 확산하기 위해 면봉을 사용하여 장간막 동맥과 세정맥 순환을 시각화 할 수 있습니다.
- 투명 플레이트에 오른쪽 마우스를 놓고 테이프로 캐 뉼러를 고정. 저체온증을 방지하기 위해 뜨거운 팩을 사용합니다. 조직의 탈수를 방지하기 위해, 창자에 500 μL 0.9 % NaCl을 놓습니다.
- 장간막 순환 세균의 유착 형광 현미경
- 어두운 방에서 작업 할 수 있습니다. 혈관을 고정하고 거꾸로 현미경을 시각화하기 위해 면봉을 사용합니다.
- 국소 10 mM의 솔루션 O 5 μl를 적용F 칼슘 -ionophore A23187 DMSO에 용해. 10 초 후, 경정맥 카테터를 통해 박테리아를 분류 100 μL (단계 1 참조)에 주입. 시간 경과 이미지를 가져 가라. 실험이 종료 된 후, 승인 기관 가이드 라인에 따라 마우스를 안락사.
- 이미지 분석
- 흑백 카메라를 이용하고 이미징 소프트웨어를 사용하여 개발 캡처 반전 형광 현미경을 이용하여 실시간 화상을 얻기. 자동 노출 시간과 사용되는 장비에 특정 대비 최적화를 적용합니다.
- 1,000 이미지 / 초 40주기를 사용하여 - 도구 모음의 '취득'도구 (시간 다차원 취득)를 사용하여 시간 경과 이미지를 획득. 해당 이미지 파일 포맷으로 이미지를 저장한다.
- 이미지 당 형광 신호의 영역을 측정하는 ImageJ에 분석 소프트웨어를 사용하여 이미지를 처리. F에 그레이 스케일 이미지를 분할하는, 상부 및 하부 임계 값을 설정하는 임계 값을 정의관심 eatures. 이자 (혈관)의 영역을 식별하고 상기 임계 관심 영역에 한정되는 영역을 측정한다. 세균 부착을 비교, 어떤 통계 나 그래프 소프트웨어를 사용하여 형광 영역으로 표현했다.
결과
VWF에 황색 포도상 구균의 접착, 피하 매트릭스와 내피 세포는 전단 응력 의존 현상이다
S. 사이의 상호 작용에 전단 응력의 역할을 강조 구균과 VWF, 우리는 다른 전단 속도로 코팅 된 커버 (체외 관류 모델의 개략적 인 개요 황색 포도상 구균의 1. 접착이 250 초에서 증가 전단 율 증가 VWF하는 그림에 제시되어있다 -1 2,000에 VWF을 통해 관류를 수행 초 -1 (도 2), 높은 전단력이 억제되지만 VWF에 박테리아의 부착을 강화하지 않는 것을 나타낸다.
콜라겐 세균성 유착 VWF의 기여도를 조사하기 위해, 피하 행렬의 주성분은, 우리는 형광 표지 된 관류 S. VWF의 존재 또는 부재하에 콜라겐 위에 구균. VWF, S.의 부착이없는콜라겐 ureus는 전단 속도가 증가함에 따라 감소 하였다. 그러나 VWF는 배지에 존재하는 경우이며, S.의 밀착성 아우 레 우스는 전단 율을 (도 3)가 증가함에 따라 증가 하였다.
체외 흐름 모델은 또한 흐름 하에서 내피 세포 박테리아의 부착을 조사있게 해준다. 우리는 HUVECs를가와 형광 S.을 표시 관류 전단 속도 500에서 2,000 초 구균 -1. 표시된 경우, HUVECs를가 VWF의 방출을 유발하는, 칼슘 -ionophore으로 활성화되었다. 내피 세포의 활성화 및 후속 VWF 자료, S의 증가 접착 전형적인 "문자열 형"패턴을 형성 구균 (도 4a)의 형광 선형 연신 VWF 분자 따라 박테리아의 결합을 제안하는 전단력 (도 4b)의 방향으로 정렬 된 박테리아 클러스터를, 표지.
초기 생체내장의 혈관에 세균 부착이 VWF에 의해 매개된다
S. 이후 생체 내에서 활성화 된 혈관 벽에 세균 부착을 조사하기 위해 (- - / VWF) 구균은 VWF을 준수 할 수 있습니다, 우리는 (VWF + / +)와 VWF 결핍 생쥐 야생형 마우스를 사용했다. 내장의 혈관의 실시간 videomicroscopy은 형광 S. 표시 순환 생체 시각화를 허용 구균 (생체 관류 모델의 개략도 개요는 그림 5에 표시됩니다).
칼슘 -ionophore 의한 내피 세포의 약리 활성 후, 우리는 WT 마우스의 혈관 벽에 개별 박테리아와 세균의 집합체의 신속한 로컬 축적을 관찰 (보조 비디오 1, 2). 박테리아 부착은 거의 VWF의 -deficie의 활성화 혈관벽에서 관찰되지 않았다NT 마우스 (보충 비디오 3) WT 마우스에 접착과 비교 (그림 6). VWF의 부재는 S.의 능력을 저하 구균이 활성화 된 혈관 벽에 부착합니다.
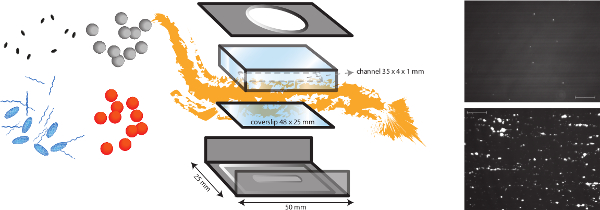
그림 1. 체외 흐름 모델의 개략도. 관내 유량 모델은 피하 행렬 세균 밀착성 상이한 전단 의존성 기전 연구를 허용 다기능 모델이지만 또한 혈전 형성. 마이크로 병렬 흐름 챔버는 단백질과 내피 세포의 다른 코팅과 커버 슬립 (플라스틱 또는 유리)에 배치됩니다. 다른 박테리아 (오렌지색 및 회색 도트)의 밀착성을 분석 할 수 있고, 혈장 단백질, 혈소판 및 전혈의 존재의 영향을 평가할 수있다. 혈소판 (파란색 타원) 또는 fibrinog에 대한 형광 마커EN (블루 문자열) 세균성 및 호스트 요소를 구별하기 위해 다른 억제제 (블랙 타원)과 조합하여 사용될 수있다. S의 세균 유착의 대표 이미지 VWF의 존재 (아래)에서 콜라겐 코팅 유무 (상) 구균은 (스케일 바는 100 μm의 경우) 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
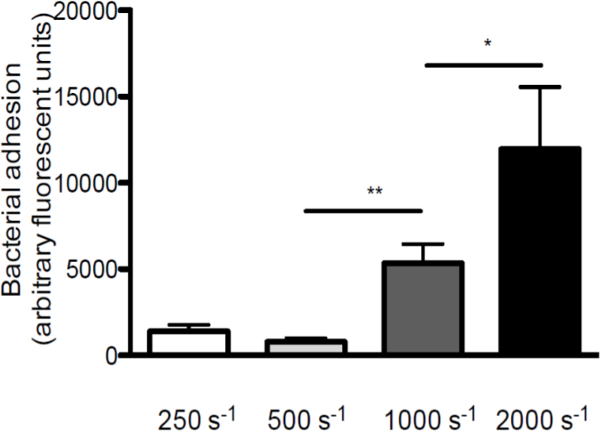
S의 그림 2. 접착 전단 속도를 증가 VWF 증가에 구균. 코팅 VWF를 통해 마이크로 병렬 흐름 챔버 관류 (/ ㎖ 50 μg의가)와 형광 S. 표시 매체에서 250 초 -1 (초 -1) 2,000의 전단 속도 (n은> 5)에서 구균 뉴먼. 모든 결과는 평균 ± SEM으로 표현된다. * p <0.05, ** p <0.01.
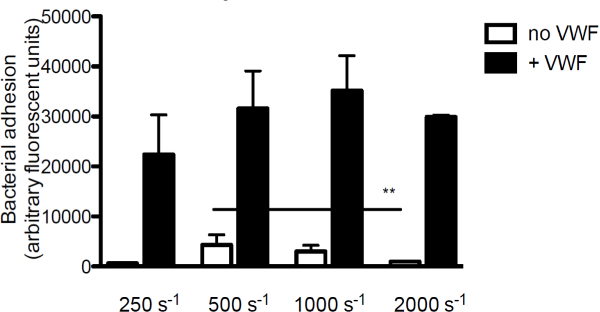
S의 그림 3. 접착 내피 밑층에 구균은 전단 및 VWF 따라 달라집니다.와 형광 S. 표지 코팅 된 콜라겐 (160 μg의 / ㎖)를 통해 마이크로 병렬 흐름 챔버 관류 매체에서 250 초 2,000 -1의 전단 속도 (n은> 5)에서 구균 뉴먼. 여기서 나타낸 VWF (60 μg의 / ml)을 매질 중에 존재 하였다. 모든 결과는 평균 ± SEM으로 표현된다. ** P <0.01.
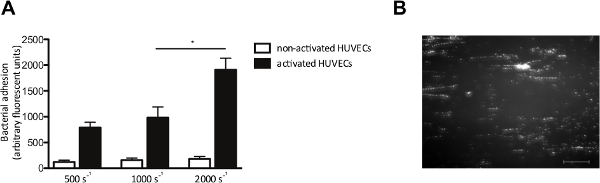
S의 그림 4. 접착 활성화 된 내피 세포에 구균은 내피 세포를 통해 전단에 의존. 마이크로 병렬 흐름 챔버 관류입니다. (가) 인간 제대 정맥 내피 세포는 칼슘 -ionophore로 활성화되었다의 형광 미 표시 10 분 관류 다음에 23,187 (0.1 mM)을 매체에서 500 초 2,000 -1의 전단 속도 (n은> 5)에서 구균 뉴먼. 모든 결과는 평균 ± SEM으로 표현된다. * P <0.05. S.와 활성화 HUVECs를 통해 마이크로 병렬 흐름 챔버 관류의 (B) 이미지 1000 sec의 전단 속도 -2. S.에서 구균 구균이 VWF의 다량에 접착 (스케일 바는 100 ㎛이다) 제안, ± 200 마이크론 길이의 문자열을 형성한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5. 생체 장간막 관류 모델의 개략도. 우측 경정맥 카테터 (노란 선) 불소의 관리에 삽입escently 표시 박테리아 (오렌지 도트), 추가 마취제 또는 제약 억제제 및 항체 등의 다른 구성 요소. 복강 열리고 mesenterium는 형광 현미경으로 혈관 (정맥과 동맥)을 시각적으로 확산된다. VWF의 방출을 유도하는 칼슘 -ionophore에 의한 내피 세포의 약리 활성화 한 후, 박테리아는 경정맥 카테터를 통해 주입 할 수있다. 실시간 혈관 비디오 현미경 형광 표지 된 박테리아를 순환의 생체 내 시각화 및 박테리아 혈소판 혈전의 결과로 형성. 수 있습니다 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
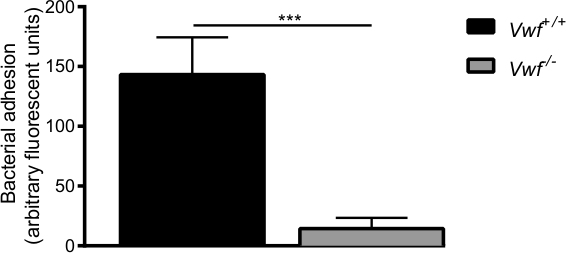
도 6 S.의 초기 접착력 구균- / - 마우스. 생체 내에서 활성화 된 내피 세포는 C57BL / 6 VWF + / +와 C57BL가 / 6 VWF와 VWF 생체 정맥 장간막 관류 모델에 의해 매개되는. 접착이의 형광 S. 표시 - / - 마우스 로컬 활성화 혈관 벽에 구균은 VWF 크게 낮다. 모든 결과는 평균 ± SEM으로 표현된다. *** P <0.001, N> 7.
비디오 1 : S의 실시간 접착 구균 VWF + / + 마우스의 활성화 혈관 벽에. 이 비디오를 보려면 여기를 클릭하십시오.

비디오 2 : 실시간 집계 형성과 S의 색전술 구균은 VWF + / + 마우스에. 이 비디오를 보려면 여기를 클릭하십시오.

비디오 3 : S의 실시간 접착 - / - 마우스 - / -. VWF + / +와 VWF와 쥐 생체 내 장간막 관류 모델 구균 VWF 활성 혈관 벽에. 칼슘 -ionophore (10 mM)을 다섯 μL는 어플리했다시각 혈관 침대의 지역 에디션. 카르복시 플루오 레세 인 - 표지 S.의 현탁액 구균 경정맥 카테터를 통하여 주입 하였다. 장간막 순환이 거꾸로 현미경으로 시각화했다. 이 비디오를 보려면 여기를 클릭하십시오.
토론
전단 응력은 혈관 벽에 초기 세균 접착 및 혈관 내 또는 심 내막 식생 및 전이성 감염 4,5의 다음 세대를위한 중요한 요소이다. 우리는 생리적 전단 응력에 따라 혈관 내 감염의 발병 기전을 연구하기 위해 생체 외 및 생체 내 모델에서 보완 설명했다. 이 모델은 우리가 주요 S.으로 폰 빌레 브란트 인자 결합 단백질 (vWbp)를 식별 할 수있다 구균 단백질은 VWF 4 노출 부상 혈관 벽 흐름에서 상호 작용할 수 있습니다.
혈관 내 감염, 특히 감염성 심내막염뿐만 아니라, 때문에 로컬 및 원격 ( '전이') 합병증뿐만 아니라, 때문에 패혈증에 의한 장기 부전 및 사망의 우려이다. 심내막염과 전이성 감염을 일으키는 세균이 혈관 벽에 부착함으로써 흐르는 혈액의 전단 응력에 저항해야한다. 가장세균에 대한 연구는 요인 정적 조건에서 수행 된 독성. 그러나 이러한 설립 상호 작용은 세균 호스트 상호 작용의 새로운, 이전에 인식 할 수없는 요인을 밝힐 수 유량 조건에서 전단력과 연구를 견딜 수 있습니다.
마이크로 병류 챔버를 사용하여, 그리고 다른 혈관 접착 VWF의 중요성을 보여준다. 전단 응력에서 점진적가 전개 될 그 휴식 구형 구조에서 VWF하고는 GPIB 수용체 (6)를 통해 혈소판과 상호 작용 A1 도메인을 제공합니다. 흐름 챔버 광범위 혈소판 기능 (7)을 연구하기 위해 사용되었다.
놀랍게도, 또한 S. 유동하 구균 밀착성 전단에 노출 A1 도메인 VWF 필요하며, 특히. 우리는 vWbp는 VWF 바인딩 중재 확인했다. vWbp은 S.에 기여하는 응고 효소이다 호스트의 프로트롬빈을 활성화하여 구균의 병태 생리. Staphylothrombin, 입술세균 응고 효소와 프로트롬빈의 복잡한을 ulting, 불용성 섬유소 8,9에 피브리노겐을 변환합니다. 우리의 연구 vWbp 만 프로트롬빈을 활성화시키지 않는 것을 도시하지만, 유동 4,10,11 하에서 혈관 밀착성을 향상 박테리아 피브린 혈소판 집합체의 형성을 유발 하였다.
체외 유량 용기 모델은 세포 또는 매트릭스 구성 요소에 세균 부착에 다른 선수를 연구 할 수 있습니다. 박테리아 병원성 인자는 특정 표면 단백질을 발현하는 돌연변이 또는 무해한 균을 이용하여 연구 될 수있다. 대안으로, 약물 억제제 또는 차단 항체는 유동 챔버 내의 매질에 첨가 될 수있다. 그러한 세포 외 기질의 다른 구성 성분으로서 숙주 인자의 역할은 서로 다른 코팅으로 커버 슬립을 이용하여 연구 될 수있다. 커버 슬립은 활성화 상태가 특정한 자극을 추가하여 변조 될 수있는 내피 세포로 피복 될 수있다. 아파혈관벽에서 RT는, 숙주 세포 및 혈액 혈장 단백질의 기여는 유동 매체에 이들 인자를 첨가하여 연구 될 수있다. 따라서, 증가하는 복잡성의 다른 조건은 세균이 생체 내에서 혈관 벽에 부착 할 수 있도록 상호 작용을 해명 층류의 표준화 된 조건에서 연구 될 수있다.
체외 모델에서 확인 된 상호 작용은 이후 복잡한 유기체의 관련성을 테스트하기 위해 동물 모델에서 공부하고 있습니다. 흐름에 따라 동적 상호 작용을 연구하는 생체 내 모델에서 다른 하나는 같은 햄스터의 지느러미 피부 집계 챔버 (12)와 cremaster 모델 (13)로, 기술되었다. 이에 비해, 여기에서 설명 장간막 관류 모델 가능성 마우스의 유전 적 배경을 호스트 다양하고 약리 개입을 평가하기 때문에 사용의 용이성의 여러 가지 이점을 제공한다.
결론적으로, 모델 바와S의뿐만 아니라 표면 단백질을 연구 할 수있는 가능성을 제공합니다 구균,하지만 다른 호스트 배경에 다른 많은 미생물의 더 나은 혈관 감염의 발병 기전을 이해합니다.
공개
저자가 공개하는 게 없다.
감사의 말
이 작품은 퐁 voor Wetenschappelijk Onderzoek (FWO) 데런 G0466.10, 11I0113N에 의해 지원되었다; 소아 심장과, UZ 루벤, 벨기에 "에디 멕스 연구비"와 "SPORTA 연구 그랜트"(JC); 분자 및 혈관 생물학 센터는 루벤 대학에서 "Geconcentreerde Onderzoeksacties"(GOA 13분의 2,009)과 베링거 인 겔 하임의 연구 보조금에 의해, Programmafinanciering KU 루벤 (PF / 10 / 014)에 의해 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| Brain Heart Infusion (BHI) | BD Plastipak | 237500 | |
| Tryptic Soy Broth (TSB) | Oxoid | CM0129 | |
| Phosphate Buffered Saline (PBS) | Invitrogen | 14190-169 | D-PBS |
| 5(6)-carboxy-fluorescein N-hydroxysuccinimidyl ester | Sigma-Aldrich | 21878-25MG-F | fluorescent labeling |
| Bovine Serum Albumin Fraction V (BSA) | Roch | 10 735 086 001 | |
| Haemate-P | CSL Behring | PL 15036/0010 | VWF |
| Horm collagen | Takeda | 10500 | collagen |
| 1-well PCA cell culture chambers | Sarstedt | 94.6140.102 | plastic slips |
| Temgesic | Reckitt Benckiser | 283716 | bruprenorphine |
| Anesketin (Ketamin hydrochloride 115 mg/ml (100 mg/ml ketaminum)) | Eurovet | BE-V136516 | ketamin |
| XYL-M 2% (xylazine hydrochloride 23.32 mg/ml (20 mg/ml xylazine)) | VMD Arendonk | BE-V170581 | xylazine |
| 2 french intravenous catheter green | Portex | 200/300/010 | |
| 0,9% Sodium chloride (NaCl) | Baxter Healthcare | W7124 | |
| cotton swabs | International Medical Product | 300230 | |
| Ca2+-ionophore solution A23187 | Sigma-Aldrich | C7522-10 MG | |
| 26 gauge 1 ml syringe | BD Plastipak | 300013 | |
| 26 gauge 1 ml syringe with needle | BD Plastipak | 300015 | intra-peritoneal injection |
| Centrifuge 5810-R | Eppendorf | 5811 000.320 | |
| Glass cover slips (24x50) | VWR | BB02405A11 | Thickness No, 1 |
| PHD 2000 Infusion | Harvard Apparatus | 702100 | High-accuracy Harvard infusion pump |
| Axio-observer DI | Carl-Zeiss | Inverted fluorescence microscope | |
| ImageJ | National Institute of Health | Analysis software | |
| Graphpad Prism 5,0 | Graphpad Software | Analysis software | |
| AxioCam MRm | Carl-Zeiss | Black and white camera |
참고문헌
- Vanassche, T., Peetermans, W. E., Herregods, M. C., Herijgers, P., Verhamme, P. Anti-thrombotic therapy in infective endocarditis. Expert Rev Cardiovasc Ther. 9 (9), 1203-1219 (2011).
- Heying, R., van de Gevel, J., Que, Y. A., Moreillon, P., Beekhuizen, H. Fibronectin-binding proteins and clumping factor A in Staphylococcus aureus experimental endocarditis: FnBPA is sufficient to activate human endothelial cells. Thromb Haemost. 97 (4), 617-626 (2007).
- Pappelbaum, K. I., et al. Ultralarge von Willebrand factor fibers mediate luminal Staphylococcus aureus adhesion to an intact endothelial cell layer under shear stress. Circulation. 128 (1), 50-59 (2013).
- Claes, J., et al. Adhesion of Staphylococcus aureus to the vessel wall under flow is mediated by von Willebrand factor–binding protein. Blood. 124 (10), 1669-1976 (2014).
- Thiene, G., Basso, C. Pathology and pathogenesis of infective endocarditis in native heart valves. Cardiovasc Pathol. 15 (5), 256-263 (2006).
- Sixma, J. J., Schiphorst, M. E., Verweij, C. L., Pannekoek, H. Effect of deletion of the A1 domain of von Willebrand factor on its binding to heparin, collagen and platelets in the presence of ristocetin. Eur J Biochem/FEBS. 196 (2), 369-375 (1991).
- Theilmeier, G., Lenaerts, T., Remacle, C., Collen, D., Vermylen, J., Hoylaerts, M. F. Circulating activated platelets assist THP-1 monocytoid/endothelial cell interaction under shear stress. Blood. 94 (8), 2725-2734 (1999).
- Bjerketorp, J., Jacobsson, K., Frykberg, L. The von Willebrand factor-binding protein (vWbp) of Staphylococcus aureus is a coagulase. FEMS Microbiol Lett. 234 (2), 309-314 (2004).
- Friedrich, R., et al. Staphylocoagulase is a prototype for the mechanism of cofactor-induced zymogen activation. Nature. 425 (6957), 535-539 (2003).
- Vanassche, T., et al. Fibrin formation by staphylothrombin facilitates Staphylococcus aureus-induced platelet aggregation. Thromb Haemost. 107 (6), 1107-1121 (2012).
- Vanassche, T., et al. The role of staphylothrombin-mediated fibrin deposition in catheter-related Staphylococcus aureus infections. J Infect Dis. 208 (1), 92-100 (2013).
- Buerkle, M. A., Lehrer, S., Sohn, H. Y., Conzen, P., Pohl, U., Krötz, F. Selective inhibition of cyclooxygenase-2 enhances platelet adhesion in hamster arterioles in vivo. Circulation. 110 (14), 2053-2059 (2004).
- Kim, K. H., Barazia, A., Cho, J. Real-time imaging of heterotypic platelet-neutrophil interactions on the activated endothelium during vascular inflammation and thrombus formation in live mice. J Vis Exp. 2 (74), (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유