JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
평면 그라데이션 확산 시스템은 3D 콜라겐 매트릭스에 화성을 조사하기 위해
요약
Cell migration is an important part of human development and life. In order to understand the mechanisms that can alter cell migration, we present a planar gradient diffusion system to investigate chemotaxis in a 3D collagen matrix, which allows one to overcome modern diffusion chamber limitations of existing assays.
초록
The importance of cell migration can be seen through the development of human life. When cells migrate, they generate forces and transfer these forces to their surrounding area, leading to cell movement and migration. In order to understand the mechanisms that can alter and/or affect cell migration, one can study these forces. In theory, understanding the fundamental mechanisms and forces underlying cell migration holds the promise of effective approaches for treating diseases and promoting cellular transplantation. Unfortunately, modern chemotaxis chambers that have been developed are usually restricted to two dimensions (2D) and have complex diffusion gradients that make the experiment difficult to interpret. To this end, we have developed, and describe in this paper, a direct-viewing chamber for chemotaxis studies, which allows one to overcome modern chemotaxis chamber obstacles able to measure cell forces and specific concentration within the chamber in a 3D environment to study cell 3D migration. More compelling, this approach allows one to successfully model diffusion through 3D collagen matrices and calculate the coefficient of diffusion of a chemoattractant through multiple different concentrations of collagen, while keeping the system simple and user friendly for traction force microscopy (TFM) and digital volume correlation (DVC) analysis.
서문
화학 주성으로 공지 된 농도 구배를 향해 세포의 바람직한 움직임, 신체의 병리 생리 학적 과정에 중요한 역할을한다. 이러한 예로는 피부와 점막 상처 치유 1, 2 형태 형성, 염증 3 및 종양 성장 4,5-이다. 또한, 암세포가 모두 개인과 단체 셀 마이그레이션 전략 1-6 이주 할 수 있다는 것으로 알려져있다. 또한, 확산 불안정성 메커니즘 영양소 원을 향해 이민 따라서 넓은 영역 및 조직 7 침입 수 후 종양 바디 / 물체로부터 단일 클러스터 또는 세포의 분리를 유도하고있다.
또한, 다양한 이동 메커니즘으로 인해 부착 분자 (8)의 다른 역할로, 2 차원에서 3 차원으로 활성화 될 수 있음을 보여왔다. 따라서, 체외 분석에 생리 학적으로 관련에 이동 measureabl에서 세포 운동성을 조사하기 위해즉 간단한 방법은 세포 이동 현상 이해 9에 중요하다. 불행히도, 세포 이동을 분석하는데 어려움이 광범위한 정량 화성 분석은 일반적으로 공평한 세포 운동성 및 이동 현상 모델의 측정에 기초하고 긴 힘드는 방법을 필요로한다.
세포의 화학 주성을 조사하기 위해 과거의 실험 방법은 보이든 챔버 (10)와 아래 아가로 오스 분석 (11)를 포함한다. 그러나, 이러한 초기 분석에서, 세포 이동 실험은 시간에 관하여 움직임을 모니터하지 않았다. 더 중요한 것은, 실험에 사용 된 농도 기울기는 잘 정의되지 않은 또는 몇 시간보다 더 대한 시그널링을 유지하면서 완전히 이해했다. 또한, 초기 화성 챔버 시도는 두 가지 차원으로 세포의 이동을 제한 한 마이그레이션 (12)의 반응 속도를 모니터링하는 것을 허용하지 않았다. 보이든 챔버를 보면, 엔드 포인트 분석연구원은 시각적으로 마이그레이션을 관찰하는 것을 허용하지 것이다 직접 chemokinesis (랜덤 이동)에서 화성 (방향 이동)를 구별 할 수 없습니다. 또한, 기공의 크기와 두께의 여러 변수-차이 쉽게 재현하는 것은 매우 어렵다 챔버 막은 제 13, 14 및 케모카인에 세포 이주 반응을 은폐.
마이크로 유체의 새로운 이해와 함께, 새로운 챔버 및 마이크로 디바이스는 간질 흐름 조건 하에서 세포의 운동을 조사하기 위해 수단으로 조사 또는 15, 16 화학 주성되었다. 이 새로운 디바이스에서 새로운 셀 메트릭스 도입 및 셀 (17, 18)에 전단 응력의 효과처럼, 조사했다. 불행하게도, 과거와 현재의 미세 유체 화성 챔버는 종양 세포의 침윤과 전이, 메신저 등 많은 생물학적 과정, 이후 2D 기판-중요한 후퇴로 세포 이동의 연구를 제한무네 세포 이동은, 3D 이동을 포함한다.
직접적인 관찰 챔버 - 여기서, 화학 유인 물질 용액은 세포를 포함하는 3 차원 겔과 접촉하고 또한도 19, 20를보고되었다. 이 챔버는 수평으로 서로 (21) 옆에 또는 동심 링 (22)로 결합되어, 두 개의 구획, 화학 유인 물질을 함유 한 세포를 포함하는 하나 있습니다. 이러한 시스템은 오른쪽 방향으로 지적되지만, 장기간의 화학 주성 시스템을 유지하지 않는다.
또한, 연구진은 투석 셀뿐만 아니라 정수압 23-25 실시 콜라겐 샘플 트레이서 통해 분자의 확산 콜라겐 막을 통해 확산 성을 조사 하였다. 콜라겐 겔 일부 확산 실험은 자기장과 화학 결합 (26)을 이용하여 겔의 물리적 및 화학적 변형에 의존한다. COLLA에 확산 모델링을위한 인기있는 방법genous 조직 연속 포인트 광표백의 형광 이미징을 사용합니다. 이 방법은 중심의 콜라겐 조직에서 거대 분자의 확산 계수의 이방성을 밝혔다. 그러나, 광표백은 관절 연골에서 사용되지 행렬 콜라겐되었다. 유사하지만, 필요한 모델 실험은 특히 콜라겐 겔의 확산 계수의 이해를 통해 수행되어야한다. 더 중요하게, 시스템은 셀 구동력 발생을 측정하는 방법을 이용하지 않는다.
불행히도, 대부분의 시스템은 이상적인 시스템에 대한 하나 또는 두 핵심 요소가 누락 될 것 같다 : 셀 추적, 매트릭스, 재현성 용이 비교적 간단한 셋업의 최소화를 통해 화성 인자와 확산 그라데이션 이해의 허용 상호 작용 세포 - 세포, 및 치수 정량 단위 (즉, 속도, 힘, 특정 농도)를 측정 할 수있다. Moghe 등은. 27 세포가 초기에 겔을 통해 분산보다는 필터 표면에 농축 된 대부분의 요구 사항을 충족하는 시스템을 제안하지만, 세포가 생성하는 힘을 측정하는 것이 곤란했다.
이 목적을 위해, 우리는 하나의 셀을 측정하는 영상 분석 기술과 결합 경과 현미경에 기초 기존 분석법, 현대 확산 실 한계를 극복 할 수있는 3D 콜라겐 매트릭스의 주 화성을 조사하는 평면 구배 확산 시스템을 제시 3D 환경에서 힘. 이 프로토콜은 서로 다른 셀에서 3D 화성을 조사하는 데 사용될 수있는 간단한 3D 확산 실을 만드는 간단하면서도 혁신적인 방법을 제공한다.
프로토콜
1. 3 차원 금형 설계 및 부품
- 곰팡이
- 작업을 시작하기 전에, 실리콘 엘라스토머 키트 생균 촬상 챔버 22mm 유리 커버 슬립, 및 치수 10.07 mm X 3.95 mm X 5.99 mm와 가공 알루미늄 금속 큐브를 얻었다. 바닥 홀더 커버 슬립을 배치하고 공급 업체의 지시에 따라 실의 나머지 부분을 조립하여 성형 용 라이브 세포 이미징 챔버를 준비합니다.
- 다음에, 집게를 사용하여, 생균 촬상 챔버 하우징의 중간과 커버 슬립 위에 가공 된 알루미늄 금속 덩어리를 배치 한 다음 방치.
- 엘라스토머 5 mL로 제조자의 프로토콜에 따라 실리콘 엘라스토머 솔루션을 섞는다.
- 일회용 랩 주걱을 이용하여, 생균 촬상 설정 챔버로 실리콘 엘라스토머 용액을 부어 배치 가공 된 알루미늄 금속 큐브를 이동하지 않도록 보장한다. 경화 안전한 위치 O / N에서, 실험실 벤치에 시스템을 놓습니다.
- 다음날 아침, 해체라이브 세포 이미징 챔버는, 제조업체가 권장하고 집게를 사용하여 곰팡이를 잡아 당깁니다. 집게를 사용하여 조심스럽게 금형에서 가공 된 알루미늄 금속 큐브의 압축을 풉니 다. 싱크대로 가서 탈 이온수로 금형을 씻어. 건조 종이 타월에 금형을 놓습니다.
- 일단 드라이, 취미 유틸리티 나이프를 사용하여, 금형을 통해 슬릿을 잘라 실리콘 몰드의 내부에, 각각의 길이 방향 끝에서 2.34 mm의 이격. 당신이 실험을 위해 시스템을 구축 할 준비가 될 때까지 안전하고 건조한 장소에 금형 숙박을 보장합니다.
- 친수성과 소수성 유리 Coverslips는 준비
- 콜라겐 매트릭스, 표면에 부착 친수성 된 커버를 만들 수 있도록 :
- 일회용 피펫을 사용하여, 3- 아미노 프로필 - 트리 메 톡시 실란 150 μL를 측정하고 50 ML 튜브에 솔루션을 붓는다. 두 번째 일회용 피펫으로 50 ㎖ 튜브에 100 % 에탄올 30 ML을 추가하고 뚜껑을 닫습니다. 완전한 혼합을 보장하는, 2 분 동안 용액을 소용돌이. 피우리의 유리 페트리 접시에 솔루션과는 별도로 설정.
- 두 번째 페트리 접시에 100 % 에틸 알코올 15ml를 붓고 따로 설정 (요리 레이블을해야합니다).
- 새로운 일회용 피펫을 사용하여 탈 이온수 30 ㎖를 측정하고 50 ㎖ 튜브에 용액을 붓는다. 다음으로, 글루 타르 알데히드의 1875 μl를 새로운 일회용 피펫 측정을 사용하고 동일한 50 ㎖ 튜브에 솔루션을 부어 뚜껑을 닫습니다. 완전한 혼합을 보장하는, 2 분 동안 용액을 소용돌이. 세 번째 페트리 접시에 혼합물을 붓고, 따로 설정합니다.
- 집게 사용하여, 하나의 22mm 둥근 유리 커버 슬립을 꺼내 일회용 피펫을 사용하여 100 % 에탄올 혼합물 양면을 씻어.
- 100 % 에탄올 용액 30 ㎖ 접시에 3- 아미노 프로필 - 트리 메 톡시 실란으로 세정 된 유리 커버 슬립을 넣고 5 분 동안 용액에 앉아 있도록.
- 집게로, 유리 커버 슬립을 꺼내 일회용 피펫 100 % 에탄올 용액 다시 헹군다.
- 1875로 세척 유리 커버 슬립을 드롭글루 타르 알데히드의 μL와 증류수 30 ml의 혼합물을 30 분 동안 방치.
- 30 분 후, 집게로 유리 커버 슬립을 제거하고 탈 이온수로 씻어 실온에서 건조 건조 조직 O / N에 배치합니다.
- 반복 coverslip에 찍기와 같은 생성 된 솔루션을 필요한만큼 커버 슬립을 위해 이동.
- 지정된 프로토콜에 의해 소수성 된 커버를 확인합니다.
- 트리 데카 - 1,1,2,2- tetrahydrooctyl 500 μL, 아세트산 100 ㎕, 2 분 50 ML 튜브와 소용돌이에 헥산 19.4 ML을 추가합니다. 유리 페트리 접시에 솔루션을 붓고 따로 설정합니다.
- 깨끗한 집게 사용하여, 하나의 유리 커버 슬립을 꺼내 2 분간 준비 혼합 용액에 놓습니다. 2 분 경과 후, 집게로 유리 커버 슬립을 꺼내 실온에서 건조 건조 조직 O / N에 일회용 피펫과 장소 커버 슬립을 사용하여 탈 이온수로 씻어. 사용 할 때까지 플라스틱 페트리 접시에 보관 커버 슬립.
- 반복 커버 슬립의 DIPP보내고과 같은 생성 된 용액에 필요한만큼의 이동을위한 커버 슬립.
- 콜라겐 매트릭스, 표면에 부착 친수성 된 커버를 만들 수 있도록 :
2. 금형 조립
- 일회용 피펫 화학 폐기물 용기 위에 90 %의 에틸 알코올로 린스하여 금형, 금형을 사용하기 전에. 다음, 탈 이온수 가득 페트리 접시에 금형을 배치하고 O / N 앉아 할 수 있습니다.
- 금형 조립을 시작하기 전에 건조 공기에 수건에 핀셋과 장소를 사용하여 용액으로부터 금형을 가져 가라.
- 주형은 공기를 건조시키는 동안, 고정밀 스크라이브 다이아몬드 공구를 사용하여 5.99 mm X 3.95 mm보다 약간 크게 두 사각형으로 사각형 친수성 커버 슬립을 잘랐다. 실리콘 몰드로 잘라 슬롯에 각각의 컷 사각형 커버 슬립을 밀어 넣습니다.
- 거꾸로 금형 플립과 일회용 피펫을 사용하여 실리콘 몰드 하단에 진공 그리스를 적용합니다. 다음, 다시 오른쪽을 위로 금형을 뒤집어 원형 친수성 유리 커버에 금형의 바닥을 눌러도장을 만들 입술.
- 일회용 장갑, 조립 형을 선택하고 일회용 페트리 접시에 다음 바이오 후드에 배치합니다. 실험이 발생하기 전에 금형을 소독하기 위해 1 시간 동안 자외선 바이오 후드 램프를 켭니다.
3. 콜라겐 혼합물 및 3D 매트릭스
- 콜라겐 혼합물, 얼룩을 준비하고 표준 프로토콜 (28)에 따라 이미징 세포를 준비하기 전에.
- 바이오 후드에서 표준 실험실 기술 및 프로토콜들 (29, 30)을 사용하여, 원하는 화학 유인 물질 농도에 15 ㎖의 튜브에 세포 화학 유인 물질 및 매체를 혼합한다. 피펫 5 15 ML 튜브에 특정 세포 미디어 화학 유인 물질 농도의 용액 ㎖의 가열 된 물을 욕조에 솔루션을 이동합니다.
- 피펫을 사용하여, 현미경 실험에 대한 솔루션을 가열하는 가열 된 물을 욕조에 두 번째 15 ML 튜브 제자리에 바로 세포 미디어 5 ml의 압축을 풉니 다.
- 배 인산염 완충액 바이오 후드, 30 μL 피펫마이크로 원심 분리기 튜브에 에드 솔루션 (PBS). 15 초 동안 동일한 마이크로 원심 분리 튜브 및 소용돌이에 1 N 수산화 나트륨 (NaOH) 6 μL를 추가한다.
- 냉장고에서 콜라겐 나는 쥐의 꼬리 솔루션을 확보하고 표준 실험실 기술 및 프로토콜 29을 사용하여 바이오 후드로 이동합니다. 콜라겐은 여전히 차가운 확인합니다. 같은 마이크로 원심 분리기 튜브에 콜라겐 168.3 μl를 피펫.
- 다음, 같은 마이크로 원심 분리기 튜브에 피펫을 사용하여 노란색 - 녹색 형광 카르 복실 레이트 수정 마이크로의 18 μl를 추가합니다. 소용돌이 30 초에 대한 모든 솔루션을 마이크로 원심 분리기 튜브.
- 마이크로 원심 분리기 튜브에 원하는 셀 미디어 세포 혼합물 (약 2 × 10 6 세포 / ㎖ 농도)의 77.7 μl를 추가하고 20 초 동안 피펫 팁을 사용하여 섞는다. 필요에 따라서, 형광 비드와 세포 생존율 테이블 (표 1)의 첨가에 적합한 맞춤형 콜라겐 혼합물을 수행하여 밀도 행렬을 변경.
- 피펫 (300) & #181 웰 중심으로 콜라겐 세포 혼합액의 L 준비된 몰드 어셈블리 (도 2). 일회용 페트리 접시 위에 주형을 배치하고, 5 % CO 2, 37 ℃에서 20 분 동안 표준 인큐베이터로 이동.
- 인큐베이터에서 시스템을 제거하고 바이오 후드에 다시 배치합니다. 집게를 사용하여 각 coverslip에의 상단에 클램핑 멀리 금형에서 당겨에 의해 모두 소수성 커버 전표를 제거합니다.
- 콜라겐 주형면이 평면 확산법 있도록 직선 여전히 보장하기 원하는 현미경과 화상 전체 시스템을 이동.
- 100 μL 단일 채널 피펫을 사용하여 현미경 여전히 시스템으로 잘 # 1에 세포 미디어 100 μl를 추가합니다. 이어서, 100 ㎕의 단일 채널 피펫을 사용하여 잘 # 3에 원하는 화학 유인 물질 농도와 세포 배지 100 ㎕를 추가한다.
- 즉시 모두 우물에 솔루션을 추가 한 후, 영상을 시작.
4. 이미징 및 확산모델링
- 하나의 특정 농도를 계산하기위한 특정 콜라겐 밀도 확산 계수를 발견하고자하는 경우, 이하의 프로토콜을 따르
- 대신 원하는 화학 유인 물질 농도와 세포 미디어를 생성하는 "콜라겐 배합 및 3D 매트릭스"위의 제목의 주어진 프로토콜을 따라 표준 계산 및 프로토콜 30을 사용하여 15 ML 튜브에 5 μm의 로다 민을합니다.
- 공 촛점 이미지 시스템과 3D 콜라겐 매트릭스는 형광을 포착 아르곤 레이저 (488 nm의)을 사용하여 거꾸로 현미경에 장착. 이미지 최대 7 시간 동안 매 2 또는 3 초.
- 확산 모델링의 경우 : 아래의 수학적 모델을 사용하여, 다음과 같은 일반적인 단계를 처리 및 분석을위한 전산 소프트웨어 코드를 작성합니다.
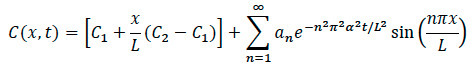
- 최대 INTEN에 의해 스케일링 및 정상화를위한 전산 소프트웨어로 가져 오기 이미지SITY. 모서리를 선택하는 이미지의 회색 색상 맵 이미지를 변환합니다. 중앙 우측과 중앙의 왼쪽에, 이미지의 중심 축을 따라 선택.
- 연산 소프트웨어 코드를 이용하여, 진정한 강도 둘 사이의 차이와 함께 정규화 강도를 플롯.
- 피팅 (농도, 시간 및 길이)에 필요한 다음, 입력 매개 변수.
- 시간에 대한 농도 및 정규화 데이터를 다항식으로 X 축에 걸쳐 농도 프로파일 플롯.
- 연산 소프트웨어 코드를 이용하여 확산 계수를 계산한다.
5. 실험 측정
- 다시 확산 방정식을 참조하면, 아래에 도시 된 바와 같이, 시스템 내의 임의의 위치에 특정 농도를 찾는 방정식을 다시.
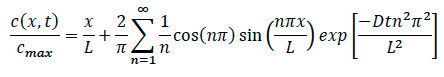
장소 :
일의 L = 길이전자 콜라겐 매트릭스
조사에서 X = 위치
확산 D는 = 계수
T = 경과 시간 - 화성 실험 동안, 순간 케모카인가 시스템에 추가 된 특정 시간을 기록 할 수 있도록. 세포 이동 운동이 발견되면, 공 초점 저속 기록을 기록하고, 영상 발생 가장자리에서 특정 시간 및 위치를 기록하도록 보장한다.
- 데이터 분석 중에 확산 및 세포 실험 모두 콜라겐 내의 임의의 지점에서 정규화 특정 농도를 찾는 방정식으로 특정 셀에 대한 언급 경과 시간, 위치 및 확산 계수 플러그.
TFM을 활용 6. 추적 세포 이동
- TFM / DVC 기술은 아래의 프로토콜을 수행하여 세포 이동을 추적 할 수 :
- 잘 # 3에 원하는 화학 유인 물질의 농도를 첨가 한 후, 반전 MICR에 장착 공 초점 시스템 3D 콜라겐 매트릭스 촬상 시작할oscope는 셀이 조사를 찾을 수 있습니다.
- 이동하는 세포가 발견되면, 시야의 중앙에 세포를 놓고 (Z 축에서 이미지), 압전 모터, 화상마다 1 또는 2 분을 이용한다.
- 셀 구동력 발생 및 변형을 산출, TFM / DVC 프로토콜 31 다음 형광 비드의 변위를 찾는 연산 코드를 생성한다.
결과
정확하게 세포의 이동을 평가하기 위해이 분석의 능력은 시스템의 좋은 설정에 의존한다. 따라서, 정확하게 확산 시스템 금형을 설계하고,도 1에 도시 된 바와 같이, 소수성과 친수성을 모두 커버 슬립을 배치에 상당한주의를 기울 반드시 중요하다. 시스템이 적절하게 설계하고 매우를 찾을 보장 확산 모델링 단계에서되면 시스템의 확산을 분석하기 위해,도 2에 도시 된 ...
토론
또는 세포없이 성공적으로 확산 실험을위한 가장 중요한 단계는 다음과 같습니다 올바르게 금형 조립을 설정하는 단계; 소수성 커버 슬립의 추출시 파손을 방지하기 위해 필요한 손재주를 현상하는 단계; 올바르게 확산 계수를 계산하기 매우 좋은 선형 시작 라인을 찾을 수 있도록; 콜라겐과 화학 유인 물질 모두의 실험적인 계산을 수정; 제대로 건조하지 않는 행렬을 보장하기 위해 라이브 세포...
공개
The authors declare that they have no competing financial interests.
감사의 말
The authors would like to acknowledge Drs. Jonathan Reichner and Angle Byrd for cell experiment insight. The National Science Foundation Graduate Research Fellowship Program (GRFP) supported this work.
자료
| Name | Company | Catalog Number | Comments |
| Silicone elastomer kit | Dow Corning Corp | 182 SIL ELAST KIT .5KG | a two-part misture with a 10:1 mix |
| Live cell imaging chamber | Live Cell Instrument | CM-B18-1 | CMB for 18 mm round coverslips |
| 22 mm Glass Coverslip | Fisher Scientific | NC0180281 | Neuvitro Corp. cover slip 22 mm 1.5 |
| Machined aluminum metal cube | |||
| Hobby utility knife | X-Acto | X3201 | |
| 3-(aminopropyl) trimethoxysilane | Sigma-Aldrich | 281778-5ML | |
| Glutaraldehyde | Polysciences, Inc | 00216A-10 | Glutaraldehyde, EM Grade, 8% |
| 50 ml tube | Fisher Scientific | 14-432-22 | Standard floor model and tabletop centrifuges |
| Glass Petri dish | Fisher Scientific | 08-747A | Reusable Petri Dishes: Complete (60 x 15 mm) |
| Forceps | Fisher Scientific | 22-327-379 | Fine Point Forceps |
| Cover glasses | Fisher Scientific | 12-518-105A | Rectangle; 30 x 22 mm; Thickness No. 1 |
| Tridecafluoro-1,1,2,2-tetrahydrooctyl | Gelest | SIT8174.0 | |
| Acetic acid | Sigma-Aldrich | 320099 | Acetic acid ACS reagent, ≥99.7% |
| Hexane | Sigma-Aldrich | 296090 | anhydrous, 95% |
| Ethyl alcohol | Sigma-Aldrich | E7023 | 200 proof, for molecular biology |
| High-precision diamond scribing tool | Lunzer | PV-081-3 | Straight extended tip scribe, .020" (.50 mm) diameter by .200" (5.0 mm) tip length |
| Vacuum grease | Dow Corning | 14-635-5C | High-Vacuum Grease |
| 15 ml tube | Fisher Scientific | 14-959-49D | 15 ml conical centrifuge tubes with hydrophobic, biologically inert surface |
| 10x phosphate buffered solution | Fisher Scientific | BP399-500 | 1.37 M Sodium Chloride, 0.027 M Potassium Chloride, and 0.119 M Phosphate Buffer |
| 1 N sodium hydroxide | Sigma-Aldrich | 38215 | Sodium hydroxide concentrate |
| Collagen I, rat tail | BD Biosciences | 354236 | Rat tail |
| Micro centrifuge tube | Fisher Scientific | 02-681-332 | Volume: 2.0 ml; O.D. x L: 13 x 40 mm; sterile; single-wrapped |
| [header] | |||
| Carboxylate-modified microspheres | Invitrogen | F-8813 | Carboxylate-modified microspheres, 0.5 µm, yellow-green fluorescent (505/515), 2% solids |
| Rhodamine | Sigma-Aldrich | 83689 | Rhodamine B for fluorescence |
참고문헌
- Adzick, N. S. The Molecular and Cellular Biology of Wound Repair. Ann Surg. 225 (2), 236 (1997).
- Reddi, A. H. Bone morphogenetic proteins: an unconventional approach to isolation of first mammalian morphogens. Cytokine Growth F. R. 8 (1), 11-20 (1997).
- Coussens, , Werb, Z, L. M., Werb, Z. Inflammation and cancer. Nature. 420 (6917), 860-867 (2002).
- Vital-Lopez, F. G., Armaou, A., Hutnik, M., Maranas, C. D. Modeling the effect of chemotaxis on glioblastoma tumor progression. AIChE J. 57 (3), 778-792 (2011).
- Hughes-Alford, S. K., Lauffenburger, D. A. Quantitative analysis of gradient sensing: towards building predictive models of chemotaxis in cancer. Curr. Opin. Cell Biol. 24 (2), 284-291 (2012).
- Friedl, P., Gilmour, D. Collective cell migration in morphogenesis, regeneration and cancer. Nat. Rev. Mol Cell Bio. 10 (7), 445-457 (2009).
- Cristini, V. Morphologic Instability and Cancer Invasion. Clin. Cancer Res. 11 (19), 6772-6779 (2005).
- Lammermann, T., et al. Rapid leukocyte migration by integrin-independent flowing and squeezing. Nature. 453 (7191), 51-55 (2008).
- Parent, C. A., Devreotes, P. N. A cell's sense of direction. Science. 284 (5415), 765-770 (1999).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. J. Exp. Med. 115, 453-466 (1962).
- Nelson, R. D., Quie, P. G., Simmons, R. L. Chemotaxis under agarose: a new and simple method for measuring chemotaxis and spontaneous migration of human polymorphonuclear leukocytes and monocytes. J. Immunol. 115 (6), 1650-1656 (1975).
- Rosoff, W. J., McAllister, R., Esrick, M. A., Goodhill, G. J., Urbach, J. S. Generating controlled molecular gradients in 3D gels. Biotechnol. Bioeng. 91 (6), 754-759 (2005).
- Wells, A., Kassis, J., Solava, J., Turner, T., Lauffenburger, D. A. Growth factor-induced cell motility in tumor invasion. Acta Oncol. 41 (2), 124-130 (2002).
- Wilkinson, P. C. Assays of leukocyte locomotion and chemotaxis. J. Immunol. Methods. 216 (1-2), 139-153 (1998).
- Bonvin, C., Overney, J., Shieh, A. C., Dixon, J. B., Swartz, M. A. A multichamber fluidic device for 3D cultures under interstitial flow with live imaging: development, characterization, and applications. Biotechnol. Bioeng. 105 (5), 982-991 (2010).
- Noo, L. J., et al. Neutrophil chemotaxis in linear and complex gradients of interleukin-8 formed in a microfabricated device. Nat. Biotechnol. 20 (8), 826-830 (2002).
- Shao, J., et al. Integrated microfluidic chip for endothelial cells culture and analysis exposed to a pulsatile and oscillatory shear stress. Lab Chip. 9 (21), 3118-3125 (2009).
- Haessler, U., Kalinin, Y., Swartz, M. A., Wu, M. An agarose-based microfluidic platform with a gradient buffer for 3D chemotaxis studies. Biomed. Microdevices. 11 (4), 827-835 (2009).
- Friedl, P., Wolf, K. Tumour-cell invasion and migration: diversity and escape mechanisms. Nat. Rev. Cancer. 3 (5), 362-374 (2003).
- Sixt, M., Lammermann, T. In vitro analysis of chemotactic leukocyte migration in 3D environments. Methods Mol. Biol. 769, 149-165 (2011).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. J. Cell Biol. 75 (2 Pt 1), 606-616 (1977).
- Zicha, D., Dunn, G. A., Brown, A. F. A new direct-viewing chemotaxis chamber. J. Cell. Sci. 99 (Pt 4), 769-775 (1991).
- Gilbert, D. L. Macromolecular diffusion through collagen membranes. Int. J. Pharm. 47 (1-3), 79-88 (1988).
- Ramanujan, S., et al. Diffusion and convection in collagen gels: implications for transport in the tumor interstitium. Biophys. J. 83 (3), 1650-1660 (2002).
- Weadock, K., Silver, F. H., Wolff, D. Diffusivity of 125I-calmodulin through collagen membranes: effect of source concentration and membrane swelling ratio. Biomaterials. 7 (4), 263-267 (1986).
- Erikson, A., Andersen, H. N., Naess, S. N., Sikorski, P., Davies, C. d. L. Physical and chemical modifications of collagen gels: impact on diffusion. Biopolymers. 89 (2), 135-143 (2008).
- Moghe, P. V., Nelson, R. D., Tranquillo, R. T. Cytokine-stimulated chemotaxis of human neutrophils in a 3-D conjoined fibrin gel assay. J. Immunol. Methods. 180 (2), 193-211 (1995).
- Sundd, P., et al. Live cell imaging of paxillin in rolling neutrophils by dual-color quantitative dynamic footprinting. Microcirculation. 18 (5), 361-372 (2011).
- Sanders, E. R. Aseptic Laboratory Techniques: Volume Transfers with Serological Pipettes and Micropipettors. J. Vis. Exp. (63), 2754 (2012).
- Stephenson, F. H. . Calculations for Molecular Biology and Biotechnology: A Guide to Mathematics in the Laboratory 2e. , (2010).
- Bar-Kochba, E., Toyjanova, J., Andrews, E., Kim, K., Franck, C. A Fast Iterative Digital Volume Correlation Algorithm for Large Deformations. Exp. Mech. In press, (2014).
- Shenoy, V., Rosenblatt, J. Diffusion of Macromolecules in Collagen and Hyaluronic Acid, Rigid-Rod-Flexible Polymer Composite Matrixes. Macromolecules. 28 (26), 8751-8758 (1995).
- Leddy, H., Guilak, F. Site-Specific Molecular Diffusion in Articular Cartilage Measured using Fluorescence Recovery after Photobleaching. Ann. Biomed. Eng. 31 (7), 753-760 (2003).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유