JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
미세 패턴 혈관 근육 박막의 확장 문화 미세 유체 Genipin 증착 기술
요약
We present a method for microfluidic deposition of patterned genipin and fibronectin on PDMS substrates, allowing extended viability of vascular smooth muscle cell-dense tissues. This tissue fabrication method is combined with previous vascular muscular thin film technology to measure vascular contractility over disease-relevant time courses.
초록
The chronic nature of vascular disease progression requires the development of experimental techniques that simulate physiologic and pathologic vascular behaviors on disease-relevant time scales. Previously, microcontact printing has been used to fabricate two-dimensional functional arterial mimics through patterning of extracellular matrix protein as guidance cues for tissue organization. Vascular muscular thin films utilized these mimics to assess functional contractility. However, the microcontact printing fabrication technique used typically incorporates hydrophobic PDMS substrates. As the tissue turns over the underlying extracellular matrix, new proteins must undergo a conformational change or denaturing in order to expose hydrophobic amino acid residues to the hydrophobic PDMS surfaces for attachment, resulting in altered matrix protein bioactivity, delamination, and death of the tissues.
Here, we present a microfluidic deposition technique for patterning of the crosslinker compound genipin. Genipin serves as an intermediary between patterned tissues and PDMS substrates, allowing cells to deposit newly-synthesized extracellular matrix protein onto a more hydrophilic surface and remain attached to the PDMS substrates. We also show that extracellular matrix proteins can be patterned directly onto deposited genipin, allowing dictation of engineered tissue structure. Tissues fabricated with this technique show high fidelity in both structural alignment and contractile function of vascular smooth muscle tissue in a vascular muscular thin film model. This technique can be extended using other cell types and provides the framework for future study of chronic tissue- and organ-level functionality.
서문
이러한 뇌 혈관 경련, 2, 3, 고혈압, 동맥 경화증 및 4와 같은 혈관 질환은 서서히 발전 전형적으로 사실상 만성적이며, 혈관 평활근 세포 (혈관 평활근 세포)로 역기능 힘 발생을 수반한다. 우리의 생체 내 모델보다 실험 조건의 미세한 제어 체외 방법에서 사용이 느리게 진행 혈관 장애를 연구하는 것을 목표로하고 있습니다. 시험관의 기능 수축력을 측정하는 우리는 이전에 개발 한 혈관 근육 박막 (vMTFs)은 심장 혈관 조직 (5)를 설계하지만,이 방법은 상대적으로 단기 연구에 제한되어있다. 여기서는 장기 측정 이전 vMTF 기술을 확장 기판 개질 기술을 제시한다.
혈관 내피 세포는 전체 기능에도 중요하지만, 설계 라멜라 동맥 혈관의 변화를 평가하는데 유용한 모델 시스템을 제공하는질병의 진행 동안 수축. 기능적인 혈관 질환 조직 모델 구조 및 동맥 라멜라의 기능을 모두 엔지니어, 용기의 기본 수축 부, 고 충실도로 효과적으로 요약되어야한다. 동맥 라멜라 6 엘라스틴의 시트로 구분 수축 혈관 평활근 세포의 동심, 원주 방향으로 정렬 시트입니다. 폴리 디메틸 실록산 (PDMS) 기판 상에 세포 외 기질 (ECM) 단백질의 마이크로 콘택트 프린팅 이전 심혈관 조직 5,7-10 정렬 모방 조직 조직 유도 신호를 제공하기 위해 사용되어왔다. 그러나 조직은 만성 연구에서 자신의 적용을 제한, 문화 3-4 일 후에 무결성을 잃을 수 미세 접촉 인쇄를 사용하여 패턴. 이 프로토콜은 새로운 미세 증착 기술로 기존 미세 접촉 인쇄 기술로 대체함으로써이 문제에 대한 해결책을 제공한다.
genipin와 f와 Genchi 등. 수정 된 PDMS 기판운드, 문화 (11)에 1 개월 심근 세포의 생존을 연장. 여기서는 PDMS에 패터닝 된 혈관 평활근 세포의 배양을 확장하는 유사한 접근법을 사용한다. Genipin, 치자 나무 열매의 천연 가수 유도체는 유사한 가교제 및 조직 복구 12,13 및 ECM 수식 (14)의 분야에서 생체 재료로서의 사용이 증가에 비해 인해 비교적 낮은 독성 기판 변형위한 바람직한 후보 15. 이 프로토콜에서, 피브로넥틴은 이전 미세 접촉 인쇄 방법에서와 같이, 셀 안내 큐로서 이용되고; 그러나 genipin 피브로넥틴은 패터닝 이전에 PDMS 기판 상에 증착된다. 세포가 패턴 매트릭스 저하로 따라서, 첨부 된 혈관 평활근 세포에서 새로 합성 된 ECM은 genipin 코팅 된 PDMS 기판에 바인딩 할 수 있습니다.
이 프로토콜은 두 단계 genipin과 ECM 증착을위한 미세 유체 전달 장치를 이용한다. 미세 유체 장치 모방 microco의 디자인이전의 연구 (16)에서 설계 동맥 박편에 사용 ntact 인쇄 패턴. 따라서,이 프로토콜이 성공적으로 구조 및 생체 동맥 박편의 수축 기능에 고도로 정렬 요점을 되풀이 동맥 라멜라 모방을 수득 할 것으로 예상. 우리는 또한 genipin 시험관 혈관 질환 모델에서 장기에 적합한 기판 수정 화합물 확인하기 위해 조직의 수축력을 평가.
프로토콜
주 :이 프로토콜의 목적은 구성 및 PDMS 기판 상 혈관 평활근 세포 (혈관 평활근 세포)의 배양 중에 확장 수축성을 평가도 1에 도시 된 구조와 혈관 근육 박막 (vMTF)을 이용하는 것이다. 혈관 평활근 세포의 생존을 연장하기 위해, 우리는 가교제 화합물 genipin을 사용한다. Grosberg 등. (8) 기타 vMTF 방법 5도 제시 기판 제조 프로토콜에 미묘한 변화가 사용될 수있다 개발 한 이러한 vMTFs 용 기판은 조직 수축성을 분석하도록 설계된다.
1. 기판 제작
- 커버 슬립 청소
- coverslip에 염색 랙에 25mm 직경의 커버 글라스를 놓습니다. 큰 비커 또는 용기에 선반을 두십시오 (예를 들어, 빈 (100) -. 1000 μL 피펫 팁 컨테이너).
- 완전히 된 커버를 체험하기 위해 컨테이너에 70 % 에탄올을 추가합니다. 적어도 30 분 동안을 초음파 처리.
- 에탄올 용액에서 coverslip에 랙을 제거합니다. 1 - 2 시간 (커버 슬립에 입자의 축적을 방지하기 위해) 멸균 문화 후드에서 랙을 매달아 건조 공기로 된 커버를 허용합니다.
주 : 커버 슬립 전에 다음 단계를 완전히 건조해야합니다.
- 커버 슬립에 폴리 (N- 이소 프로필 아크릴) (PIPAAm) 스트립 격리
- 커버 슬립 (그림 1A)을 중심으로 노출 된 지구를 떠나, 청소 커버 슬립의 측면 떨어져 접착 테이프, 테이프를 사용. 응용 프로그램 및 / 또는 미세 유체 디자인을 기반으로이 노출 스트립의 폭을 수정합니다.
- 마크 나중에 참조 (그림 1A)에 대한 실험실 마커를 사용하여 커버 슬립 테이프 스트립의 가장자리.
- 접시 (그림 1A, 빨간 점선 라인)에서 해제 커버 슬립의 둘레 잘라.
- 폴리 (N- 이소 프로필 아크릴) (PIPAAm) 코팅
- 분석 저울을 사용하여, PI 1 g의 무게PAAm 분말. 발암 물질의 비중 합 N 이소 프로필 아크릴을 사용하지 마십시오.
- 50 ML의 원심 분리기 튜브에 PIPAAm을 전송합니다. 10 % w / V 수용액을 수득 화학 후드 안쪽 1- 부탄올 10ml의 추가. 주의 : 1- 부탄올의 인화점이 37 인 O C. 가연성 캐비닛에 생성 된 용액을 저장하고 가열을 피하십시오.
- PIPAAm 10 분 동안 용해하도록 허용합니다. 분말이 여전히 표시되는 경우, 모든 분말 용해 될 때까지 소용돌이 믹서를 사용하여 솔루션을 섞는다.
주 : 다음 단계가 스핀 코터의 사용을 필요로한다. 각 커버 슬립의 경우 : - 집게와 스핀 코터 척에 테이프 커버 슬립을 놓습니다.
- 커버 슬립의 중심에 따라 노출 된 유리 방울을 배치하여 커버 슬립 상 PIPAAm 용액 150 μl를 옮긴다. 노출 된 영역의 전체 범위를 확인합니다.
- 스핀 코트 PIPAAm 다음과 같은 조리법을 사용하여 :
- 3,000 rpm으로 10 초 램프. 5 초 동안 드웰.
- 램프 10 초에 6,000 RPM. 60 초 동안 드웰.
- 3,000 rpm으로 10 초 램프. 5 초 동안 드웰.
- 이 위를 향하도록 PIPAAm으로 덮여 페트리 접시에 coverslip에 배치합니다. 적어도 15 분 동안 공기 건조 할 수 있습니다.
- 조심스럽게 중심 띠의 PIPAAm 코팅의 얇은 층으로 노출 된 전체 커버 슬립을 떠나는 모든 커버 슬립에서 접착 테이프를 제거한다.
- PDMS 코팅
- 믹스 10 PDMS의 15g를 드가 : 1베이스 : 가교제 비율. 이전의 혼합에 초음파 0.2 μm의 형광 마이크로 비드의 8 방울 - 7을 추가합니다. PDMS를 오염 먼지 나 다른 입자를 방지하기 위해 사용하지 않을 때 알루미늄 호일로 PDMS의 컵을 커버.
주 : 다음 단계가 스핀 코터의 사용을 필요로한다. 각 커버 슬립의 경우 : - 집게와 스핀 코터 척에 PIPAAm 코팅 커버 슬립을 놓습니다.
- 커버 슬립 영역의 적어도 1/3를 덮고, 커버 슬립 상에 PDMS를 옮긴다.
- 다음 RECIP를 사용하여 스핀 코트E :
- 500 rpm으로 5 초 램프. 5 초 드웰.
- 1,000 rpm으로 5 초 램프. 5 초 드웰.
- 3,000 rpm으로 10 초 램프. 10 초 드웰.
- 4,000 rpm으로 10 초 램프. 60 초 드웰.
- 2,000 rpm으로 10 초 램프. 15 초 드웰.
- 1,000 rpm으로 10 초 램프. 10 초 드웰.
- 500 rpm으로 5 초 램프. 5 초 드웰.
- PDMS가 위로 향하게 덮여 페트리 접시에 coverslip에 배치합니다. coverslip에 스핀 코팅 된 시간을 기록한다. PDMS 기판 두께를 결정하는데 이후의 사용을위한 실험을하는 동안 각 커버 슬립과 관련된 시간을 추적.
- PDMS 적절한 경화를 보장하기 위해 적어도 1.5 시간 동안 90 ° C의 오븐에서 커버 슬립을 함유하는 페트리 접시를 놓는다. 오븐을 사용할 수없는 경우, 커버 슬립을 실온에서 적어도 48 시간 동안 경화하자.
- 오븐에서 된 커버를 제거하고 사용할 준비가 될 때까지 어두운 서랍에 보관하십시오.
- 매 4 번째 coverslip에 f를 따로 설정또는 프로파일로와 스핀 코팅 시간의 함수로서 기판 두께의 측정 후에,.
- 믹스 10 PDMS의 15g를 드가 : 1베이스 : 가교제 비율. 이전의 혼합에 초음파 0.2 μm의 형광 마이크로 비드의 8 방울 - 7을 추가합니다. PDMS를 오염 먼지 나 다른 입자를 방지하기 위해 사용하지 않을 때 알루미늄 호일로 PDMS의 컵을 커버.
엔지니어링 조직 2. 미세 유체 패터닝
- 미세 유체 장치의 제작
- 조직 미세 유체 포토 마스크의 디자인
- 미세 패턴을 설계하는 적절한 컴퓨터 지원 설계 프로그램을 사용하십시오. 인간 제대 동맥 혈관 평활근 세포로 구성된 라멜라 동맥 들어, 10 μm의 벽과 10 μm의 채널들의 교번 패턴을 사용한다.
- 17 분기 가능한 경우 이진 채널을 사용하지만, 다른 분기 설계가 사용될 수있다. (벽과 채널, 그림 1B)를 간격 원하는 조직 패턴을 달성 할 때까지 각 분기 반복에 대한 채널의 폭과 길이를 줄입니다.
- 표면 처리 액을 배치하고, 진공의인가를위한 단일 배출구를위한 단일 유입구를 갖는 장치를 디자인.
- 팹이전에 기술 된 바와 같이 18, 미세 유체 디자인 (들)을 함유하는 포토 마스크 ricate.
- 포토 리소그래피 웨이퍼 제조
참고 : 적절한 클린 룸 또는 유사한 시설에 포토 리소그래피를 수행합니다. 조직 미세 유체 장치 (~ 20-25 μm의 채널 높이)의 소프트 리소그래피 제작을위한 패턴 실리콘 웨이퍼를 만들려면 사용하여 포토 리소그래피 :- 각각 1 분, 아세톤, 메탄올, 이소 프로필 알코올, 실리콘 웨이퍼를 청소한다. 질소 총을 가진 웨이퍼를 건조.
- 과량의 수분을 제거하고 115 ℃에서 5 분 동안 핫 플레이트에서 프리 베이크 웨이퍼.
- : 높이 25 μm의 - 스핀 코트 산출하기 위해 다음과 같은 조리법을 사용하여 SU-8 3025 포토 레지스트와 웨이퍼 (20)를 갖추고 있습니다
- 500 rpm으로 5 초 램프. 5 초 드웰.
- 4,000 rpm으로 15 초 램프. 15 초 드웰.
- 소프트 베이크와 15 분 동안 95 ℃에서 핫 플레이트상에서 웨이퍼.
- T 포토 마스크를로드 및 노출그 접촉 마스크 얼 라이너에 진공 접촉 프로그램을 사용하여 16 초 동안 웨이퍼 검사.
- 하드 4 분 동안 95 ℃에서 핫 플레이트상에서 웨이퍼를 굽는다.
- 개발자의 6 분의 웨이퍼를 개발한다. 그런 다음, 신선한 개발자 2 초 동안 두 번 웨이퍼를 세척하고 이소 프로필 알코올로 웨이퍼를 씻어.
- 진공 데시 케이 터 내에서 빈 접시에 트리 데카 - 트리클로로 실란의 3 방울 - (2)를 배치하여 패턴 웨이퍼 O / N을 Silanate. 웨이퍼의 하부 및 상부 모두 노출되도록 배양 접시를 사용하여 웨이퍼를 지탱.
주의 : Tridecafluro - 트리클로로 실란은 가연성 및 부식성 액체이다. 적절한 개인 보호 장비 및 국소 배기 장치를 사용할 필요가있다.
- 조직 미세 유체 소자의 제작
- 페트리 접시에 silanated, 패턴 웨이퍼 기능 측면을 놓습니다.
- 믹스 10 PDMS의 100g을 드가 : 1베이스 : 가교제 비율. 완전히 균등 웨이퍼를 덮고, 접시에 PDMS를 따르십시오.
- 모든 기포, 비경 PDMS에서 약 30 분을 제거 할 때까지, 진공 데시 케이 터 내에서 요리를 놓는다. 적어도 1.5 시간 동안 90 ° C에서 접시 PDMS 큐어. 완전한 경화를 얻기 위해 제조 지침에 의해 지시 같이 시간과 온도를 조절할 수있다.
- PDMS가 치료되면, 면도날로 웨이퍼 주변 PDMS를 잘라 조심스럽게 접시에서 PDMS 덮인 웨이퍼를 놓습니다. 웨이퍼 아래에 초과 PDMS를 제거하고 천천히 웨이퍼의 상단에서 멀리 PDMS 껍질.
- 깨끗한 접시에 PDMS 디스크 기능 측면을 놓고 사용 후 빛으로부터 웨이퍼를 저장합니다.
- 면도날을 사용하여 패턴 주위에서 초과 PDMS를 버려야. 직사각형 형태 (그림 1C)로 절단 장치는 이후 단계에서 기판에서 장치의 박리 용이합니다. 정확한 삭감만큼 충분한 공간이 입구, 출구, 및 조직 패턴 영역 (도 1C)에 대해 존재하는, 불필요하다.
- 펀치1mm 외과 생검 펀치를 사용하여 입구 및 출구 구멍 (도 1C).
- 조직 미세 유체 포토 마스크의 디자인
- 미세 유체 소자의 증착
주 :이 프로토콜에서, 마이크로 유체 전달 패터닝 genipin, 장기 조직 배양 키 가교제뿐만 아니라 피브로넥틴을 증착하는데 사용된다. 페니실린 / 스트렙토 마이신 살균 (2.2.3) 이전 단계는 무균 상태에서 장소를 취할 필요가 없습니다, 그러나 제한 오염 및 먼지 수집 프로토콜을 통해 권장합니다. 페니실린 / 스트렙토 마이신 (2.2.3)와 coverslip에 살균 후 발생하는 모든 단계는 무균 기술을 활용해야한다. 참고 : 프로토콜의이 부분은 이전에 셀 시드로 하루를 시작해야합니다.- 기판과 미세 유체 장치 준비
- 적어도 30 분 동안 70 % 에탄올에서 초음파 처리 미세 유동 장치.
- 압축 공기 또는 질소를 사용하여 초음파 미세 유체 장치를 건조하고, 페트리 접시 (WI)에 배치제 채널은 기능에 불필요한 마모를 방지하기 위해 페이스 업을 갖추고 있습니다.
- 8 분 동안 UVO 청소기 (표면 기능화되도록 커버를 접시에 제거) 10 vMTF 기판 된 커버까지 놓습니다.
- UVO 처리 된 커버를 제거하고 한 번에 각 슬립 하나에 내려 미세 유체 장치 기능 측을 배치 (방향 1C 그림과 유사해야합니다). 단단히 장치에 눌러 PDMS 코팅 된 커버에 단단히 밀착을 보장합니다.
- Genipin 및 피브로넥틴의 증착
- 동결 건조 genipin의 5 mg을 멸균 용기에 DDH 2 O 1 ㎖를 첨가하여 5 ㎎ / ㎖ genipin 용액을 준비한다. 볼텍스 혼합기를 사용하여 용액을 섞는다. 적어도 30 분 동안 RT에서 따로 설정한다.
주 : 분말은 적어도 분간, 실온에서 매우 반복적 혼합 용해하기 어려운 것이 종종 필요하다. - 신속 장치 프라이밍 각 장치의 입구에서 70 % 에탄올 방울을 놓는다. 참고 : ETH을anol는 장치를 통해 심지한다.
- 후 5 - 10 분, 신중 바로 입구 1X 인산 완충 생리 식염수 (PBS)로 교체, 입구에서 과량의 에탄올을 대기음. 이 시점에서, 입구는 장치에 공기의 도입을 피하기 위해 완전히 건조 될 수 없습니다해야합니다.
- 각 디바이스의 출구에 진공 흡인기 팁을 놓는다. 에탄올을 멀리 씻어 장치를 통해 1X PBS를 그립니다. 입구에서 1X PBS의 작은 금액을 남겨주세요. 참고 : 입구가 거의 건조 나타나면 더 1X PBS를 추가합니다.
- 단지 소량 genipin 용액의 도포 전에 입구에서 유지되도록 과잉의 1X PBS을 대기음.
- 각 입구 (그림 1D)에서 5 ㎎ / ㎖ genipin 솔루션의 60 μl를 놓습니다. 출구 (도 1D)의 진공 흡인기 팁을 배치하여 장치를 통해 genipin 용액을 그린다. 입구에서 솔루션의 작은 금액을 떠나 통해 솔루션의 모든 그릴 않도록주의하십시오.
- 장소 (약 다임 크기) 1X PBS의 입구 및 배양 동안 습윤을 유지하기 위해 콘센트에서 떨어진다. 37 ° C로 설정 가습 오븐이나 인큐베이터에 장치 (무균 환경이 필요하지 않습니다)이 포함 된 요리를 이동, 4 시간 동안 배양한다. 요리는 적용 할 필요가 없습니다.
- 배양하는 동안, 종래의 마이크로 유체 장치 애플리케이션에 적어도 30 분 동안 얼음에 멸균 DDH 2 O 50 ㎍ / ml의 농도로 재현 탁을 피브로넥틴.
- genipin의 인큐베이션 후, 장치 출구에서 나머지 모든 1X PBS 대기음. 입구에 남아있는 1X PBS를 통해 당기는 각 장치 출구에 진공 흡입기를 계속 적용.
- 입구에서 나머지 1X PBS의 최소한의 (그림 1D)에 추가, 각 입구에서 50 μg의 / ml의 피브로넥틴 용액 100 ㎕를 놓습니다.
- (출구에 진공 흡인기 팁을 사용하여 장치를 통해 피브로넥틴 용액을 그리 그림 1D). 를 통해 솔루션을 모두 그릴 수 없습니다해야합니다. 참고 : 피브로넥틴 드롭 인해 표면 장력의 차이로 1X PBS와 genipin 다르게 보일 것입니다.
- 37 ° C로 설정 오븐이나 인큐베이터에 장치를 포함하는 발견 요리를 이동하고 24 시간 동안 배양한다. 주 : 피브로넥틴 단계 1X PBS와 입구 및 출구의 젖음성을 필요로하지 않는다. 입구에서 피브로넥틴의 나머지 풀은 건조합니다. 이는 예상된다.
- 동결 건조 genipin의 5 mg을 멸균 용기에 DDH 2 O 1 ㎖를 첨가하여 5 ㎎ / ㎖ genipin 용액을 준비한다. 볼텍스 혼합기를 사용하여 용액을 섞는다. 적어도 30 분 동안 RT에서 따로 설정한다.
- 셀 시드를위한 살균 및 준비
- 패턴 vMTF의 커버 슬립의 살균 페니실린 / 스트렙토 마이신의 솔루션을 준비합니다. 멸균 1X PBS 500 ml의 페니실린 / 스트렙토 마이신 5 ㎖ (10,000 μg의 / ㎖ 10,000 단위 / ㎖)를 첨가.
- 멸균 바이오 안전성 후드에있는 장치를 포함하는 요리를 놓습니다.
- 조심스럽게 가볍게 반대 손에 커버 슬립을 파악하면서 천천히, 모서리에 박리 장치로 된 커버에서 장치를 제거합니다.주 :이 단계는 제거 과정에서 커버 슬립의 손상을 줄이기 위해 연습이 필요하다. 대안적인 장치는 방출을 돕기 위해 입구 및 / 또는 출구에서 1X PBS를 주입 주사기를 사용한다.
- 멸균 여섯 잘 요리 된 커버를 놓습니다. 각 웰에 페니실린 / 스트렙토 마이신 용액의 적어도 5 mL를 추가한다. 적어도 30 분 동안 37 ℃에서 무균 인큐베이터에서 접시를 놓습니다.
- 멸균 후, 페니실린 / 스트렙토 마이신 용액을 흡인하고, 배양 된 인간 제대 동맥 혈관 평활근 cells19 (도 1D)와 커버 슬립을 시드. 혈관 평활근 세포의 시드 농도는 ~ cm 2 당 80,000 세포입니다. 각 샘플에 필요한 세포의 수를 줄이기 위해, 시드 면적을 감소시키는 감속기를 사용한다. 감속기의 일례는 파종 전에 멸균 진공 그리스와 커버 슬립에 부착 15ml의 원뿔형 튜브의 절단 톱이다.
- 37 ° C와 5 % CO 2에서 무균 인큐베이터에서 시드 된 커버를 품어 과는 시드 세포가 정렬 동맥 라멜라 모방을 연결하고 형성 할 수 있도록 O / N (그림 2A-B).
- 장기 vMTF 조직 배양
- 어느 날 파종 후, 셀 매체 및 감속기를 제거합니다. 1X PBS로 조직을 씻어. 혈관 평활근 세포 (20)에 수축 표현형을 유도하는 무 혈청 세포 배지 4 ML을 추가합니다.
- 장기 문화 원하는대로 매일 1X PBS 린스와 신선한 무 혈청 배지를 첨가를 반복합니다.
- 기판과 미세 유체 장치 준비
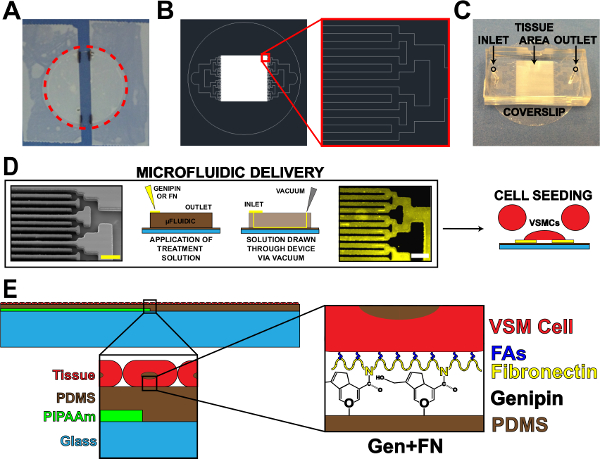
1. 미세 유체 단백질 전달 장치 그림. (A)는 PIPAAm 코팅 커버 슬립을 녹화. 빨간색 점선 원 : 커버 슬립을 해제 경로를 절단 (B) 조직 미세 유체 마스크 패턴의 대표 AutoCAD 도면.. 삽입 : 이진 분기의 세부 altern하기입구와 출구와 커버 슬립 기판에 미세 유체 장치의 10 μm의 × 10 μm의 조직 패턴. (C) 배치를 체제상에서 것은 지적했다. 미세 단백질 패턴 및 배달의 (D) 도식. 왼쪽에서 오른쪽 : 미세 유체 채널의 주사 전자 현미경 이미지 (스케일 바 : 50 μm의); 단백질 증착 방법의 상세한 설계도; 면역 조직 화학 염색 피브로넥틴 (스케일 바 : 50 μm의); 혈관 평활근 세포와 세포 시딩. 제작 된 조직 (E) 도식. 1 차 삽입 : 계층 구조의 세부 사항. 2 차 인세 : 미세 증착 후 PDMS 기판의 genipin 변경의 세부 사항. © 안압 출판. 재현 및 / 또는 허가를 수정했습니다. 모든 권리 보유. (19)는 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
vMTF 수축성 분석 3. 조직의 기능 분석
참고 : 여기에 제시된 MTF의 수축력 분석이 Grosberg 등에서 개발 된 기술을 모델로 8.
- vMTF 수축성 실험
- 100mm 접시에 조직 샘플을 놓습니다. pH가 7.4에서 멸균 1X 타이로드의 solution8 추가 샘플을 충당하기 위해 37 ℃로 가온.
- PIPAAm 가장자리에 수직 여러 병렬 컷을 만들기 위해 면도날을 사용합니다. 얇은 스트립 (그림 3A, 사이드 컷)와 교류 vMTFs (폭 ~ 2mm와)입니다 넓은 조직 섹션을 산출하는 방식으로 상처를 확인합니다. 깨끗한 삭감하기 위해, 샘플과 접촉하는 면도기 면도날을두고 측면에 단단히 드래그.
- 접시 90 ° 회전하고, 조직의 중간에 두 개의 직선, 평행 삭감을, PIPAAm의 스트립 (그림 3A, 최종 삭감)에 평행. 제거하고이 컷 사이에 조직의 느슨한 스트립 처분s와 vMTFs 사이 (이전 단계에서 컷)의 얇은 스트립은 접촉에서 인접 영화를 방지합니다.
- 샘플을 실온에서 10 분 동안 휴식을 허용 할 때까지 또는 모든 PIPAAm 용해했다. 참고 : PIPAAm 미래의 단계로 남아있는 경우, 샘플은 잔류 PIPAAm을 용해 절단 접시에 반환 될 수 있습니다. 필요에 따라 vMTF의 밑면의 부드러운 스크래핑, PIPAAm 제거에 도움이 될 수 있습니다.
- 깨끗한 35mm 페트리 접시에 진공 그리스의 작은 점을 놓습니다. 37 ° C에서 신선한, 멸균 1X 타이로드의 솔루션의 5 ML을 추가합니다. 커버 슬립의 이동을 방지하기 위해 진공 그리스에 100mm에 35mm 접시에 요리를 누르에서 잘라 필름과 커버 슬립을 전송합니다.
- 실체 현미경 무대에서 온도 제어 플랫폼에서 접시를 놓습니다.
- 캡처 시간 경과 전송 원하는 간격으로 형광 이미지 (예. 30 초) 처리 분석을 통해.
- 연속적으로 (20 분 동안 50 나노 엔도 텔린 1 vMTFs 치료유도 수축)과 30 분 (조직 휴식을위한 100 μm의 HA-1077). 5 ㎖ 부피 원하는 치료 농도 산출 지정된 시점에서 멸균 1X 타이로드의 용액 5 ㎖를 함유하는 실험용 접시, 각 처리의 농축 용액을 추가한다. 이미지에 피펫을 캡처 방지하기 위해 시간 경과 영상 획득 사이의 간격 동안 치료를 추가합니다.
- vMTF 수축성 분석
- 1.4.8에 방치 된 커버를 사용 profilometer21와 PDMS 기판의 두께를 측정한다. 커버 슬립의 각 세트에 대한 스핀 시간 곡선 대 두께를 만듭니다. 수축 실험에 사용 된 각 coverslip에 대한 vMTF 두께를 추정하는이 곡선을 사용합니다.
- 실험 기간 동안 각 시점 용 vMTF 투영 길이를 측정하고, 이전에보고 된 방법을 사용하여 8 곡률 반경 관련된 (도 3b)을 계산한다.
- 때마다 포에 vMTF 스트레스를 계산이전 vMTF 방법 (5)를 사용하여 int로.
참고 : 3.2.1에서 계산 된 추정 vMTF 두께를 사용합니다. 이전에 9를보고, 공 촛점 이미지를 사용 VSMC 두께를 측정한다. 회사의 데이터 시트에서 PDMS 탄성 계수를 얻습니다.
결과
이 작품의 주요 목표는 소수성 PDMS 기판에 미세 패턴 혈관 평활근 세포의 생존을 연장했다. 이 패턴 genipin 및 PDMS에 피브로넥틴 (그림 1) 입금 미세 유체 전달 시스템을 통합하여 수행되었다. 미세 유체 전달을 사용하여 ECM 단백질의 침착 genipin 및 피브로넥틴 (그림 1D)의 선 사이의 벌거 벗은 PDMS와 채널 패턴의 높은 충실도 전송을 얻었다. 이전의 마이크로 콘택트 인쇄 법
토론
여기서 우리는 만성 혈관 질환 경로 1,23,24의 확장 된 실험 시간은 전형적인 수 있도록 이전에 개발 된 vMTF 기술을 기반으로 구축하는 프로토콜을 제시한다. 이를 위해, 우리는 이전 MTF 수축력 실험에 사용하기위한 개선 된 혈관 조직 생존력과 엔지니어링 동맥 박편을 수득 미세 증착 기술을 이용하여 PDMS 기판 (11)의 장기간의 작용을 제공하는 것으로 나타났다 genipin를 미세 패턴. ?...
공개
The authors have nothing to disclose.
감사의 말
We acknowledge financial support from the American Heart Association Scientist Development Grant, 13SDG14670062 (PWA) and the University of Minnesota Doctoral Dissertation Fellowship (ESH). We also acknowledge the microfabrication resources of the Minnesota Nano Center (MNC) and the image processing resources of the University Imaging Centers (UIC), both at the University of Minnesota. Parts of this work were carried out in the Characterization Facility, University of Minnesota, which receives partial support from NSF through the MRS program.
자료
| Name | Company | Catalog Number | Comments |
| Coverslip staining rack | Electron Microscopy Sciences | www.emsdiasum.com/ | 72239-04 |
| Microscope cover glass - 25 mm | Fisher Scientific, Inc. | www.fishersci.com | 12-545-102 |
| Poly(N-iso-propylacrylamide) (PIPAAm) | Polysciences, Inc. | www.polysciences.com/ | #21458 |
| 1-butanol | Sigma-Aldrich | www.sigmaaldrich.com | 360465 |
| Spincoater | Specialty Coating Systems, Inc. | www.scscoatings.com | |
| Polydimethylsiloxane (PDMS) | Ellsworth Adhesives (Dow Corning) | www.ellsworth.com | 184 SIL ELAST KIT 0.5KG |
| Fluorescent microbeads | Polysciences, Inc. | www.polysciences.com/ | 17151 |
| Silicon wafers | Wafer World, Inc. | www.waferworld.com | 2398 |
| Photoresist | MicroChem Corp. | www.microchem.com | |
| Contact mask aligner | Suss MicroTec | www.suss.com | |
| Developer | MicroChem Corp. | www.microchem.com | |
| Tridecafluro-trichlorosilane | UCT Specialties, Inc. | www.unitedchem.com | T2492 |
| Surgical biopsy punch | Integra LifeSciences Corp. | www.miltex.com | 33-31AA-P/25 |
| Genipin | Cayman Chemical | www.caymanchem.com | 10010622 |
| 1X phosphate buffered saline | Mediatech, Inc. | www.cellgro.com | 21-031-CV |
| Fibronectin | Corning, Inc. | www.corning.com | 356008 |
| Penicillin/streptomycin | Life Technologies, Inc. | www.lifetechnologies.com | 15140-122 |
| Umbillical artery smooth muscle cells | Lonza | www.lonza.com | CC-2579 |
| Tyrode's solution components | Sigma-Aldrich | www.sigmaaldrich.com | various |
| Stereomicroscope | Zeiss | www.zeiss.com | 4350020000000000 |
| Temperature-controlled platform | Warner Instruments | www.warneronline.com | 641659; 640352; 641922 |
| Endothelin-1 | Sigma-Aldrich | www.sigmaaldrich.com | E7764-50UG |
| HA-1077 | Sigma-Aldrich | www.sigmaaldrich.com | H139-10MG |
참고문헌
- Humphrey, J. D., Baek, S., Niklason, L. E. Biochemomechanics of cerebral vasospasm and its resolution: I. A new hypothesis and theoretical framework. Ann. Biomed. Eng. 35, 1485-1497 (2007).
- Hald, E. S., Alford, P. W. Smooth muscle phenotype switching in blast traumatic brain injury-induced cerebral vasospasm. Transl. Stroke Res. 5, 385-393 (2014).
- Olivetti, G., Anversa, P., Melissari, M., Loud, A. V. Morphometry of medial hypertrophy in the rat thoracic aorta. Lab. Invest. 42, 559-565 (1980).
- , Atherosclerosis. Nature. 407, 233-241 (2000).
- Alford, P. W., Feinberg, A. W., Sheehy, S. P., Parker, K. K. Biohybrid thin films for measuring contractility in engineered cardiovascular muscle. Biomaterials. 31, 3613-3621 (2010).
- Rhodin, J. A. G., ed, B. e. r. n. e. ,. R. .. ,. Architecture of the vessel wall. Physiol. Rev. , (1979).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc. Natl. Acad. Sci. U. S. A. 108, 19943-19948 (2011).
- Grosberg, A., Alford, P. W., McCain, M. L., Parker, K. K. Ensembles of engineered cardiac tissues for physiological and pharmacological study: heart on a chip. 11, 4165-4173 (2011).
- Alford, P. W., Nesmith, A. P., Seywerd, J. N., Grosberg, A., Parker, K. K. Vascular smooth muscle contractility depends on cell shape. Integr. Biol. (Camb). 3, 1063-1070 (2011).
- Win, Z., et al. Smooth muscle architecture within cell-dense vascular tissues influences functional contractility). Integr. Biol. (Camb). , (2014).
- Genchi, G. G., et al. Bio/non-bio interfaces: a straightforward method for obtaining long term PDMS/muscle cell biohybrid constructs). Colloid Surface B. 105, 144-151 (2013).
- Fessel, G., Cadby, J., Wunderli, S., van Weeren, R., Snedeker, J. G. Dose- and time-dependent effects of genipin crosslinking on cell viability and tissue mechanics - Toward clinical application for tendon repair. Acta Biomater. , (2013).
- Lima, E. G., et al. Genipin enhances the mechanical properties of tissue-engineered cartilage and protects against inflammatory degradation when used as a medium supplement. J. Biomed. Mater. Res. A. 91, 692-700 (2009).
- Madhavan, K., Belchenko, D., Tan, W. Roles of genipin crosslinking and biomolecule conditioning in collagen-based biopolymer: Potential for vascular media regeneration. J. Biomed. Mater. Res. A. , (2011).
- Satyam, A., Subramanian, G. S., Raghunath, M., Pandit, A., Zeugolis, D. I. In vitro evaluation of Ficoll-enriched and genipin-stabilised collagen scaffolds. J. Tissue Eng. Regen. Med. , (2012).
- Alford, P. W., et al. Blast-induced phenotypic switching in cerebral vasospasm. Proc. Natl. Acad. Sci. U. S. A. 108, 12705-12710 (2011).
- Song, H., Tice, J. D., Ismagilov, R. F. A microfluidic system for controlling reaction networks in time. Angew. Chem. Int. Ed. Engl. 42, 768-772 (2003).
- Whitesides, G. M., Ostuni, E., Takayama, S., Jiang, X., Ingber, D. E. Soft lithography in biology and biochemistry. Annu. Rev. Biomed. Eng. 3, 335-373 (2001).
- Hald, E. S., Steucke, K. E., Reeves, J. A., Win, Z., Alford, P. W. Long-term vascular contractility assay using genipin-modified muscular thin films. Biofabrication. 6, 045005 (2014).
- Han, M., Wen, J. K., Zheng, B., Cheng, Y., Zhang, C. Serum deprivation results in redifferentiation of human umbilical vascular smooth muscle cells. Am. J. Physiol. Cell Physiol. 291, C50-C58 (2006).
- Feinberg, A. W., et al. Muscular thin films for building actuators and powering devices. Science. 317, 1366-1370 (2007).
- Volfson, D., Cookson, S., Hasty, J., Tsimring, L. S. Biomechanical ordering of dense cell populations. Proc. Natl. Acad. Sci. U. S. A. 105, 15346-15351 (2008).
- Intengan, H. D., Schiffrin, E. L. Vascular remodeling in hypertension: roles of apoptosis, inflammation, and fibrosis. Hypertension. 38, 581-587 (2001).
- Kayembe, K. N., Sasahara, M., Hazama, F. Cerebral aneurysms and variations in the circle of Willis. Stroke. 15, 846-850 (1984).
- McCain, M. L., Agarwal, A., Nesmith, H. W., Nesmith, A. P., Parker, K. K. Micromolded gelatin hydrogels for extended culture of engineered cardiac tissues. Biomaterials. 35, 5462-5471 (2014).
- Weir, B., Grace, M., Hansen, J., Rothberg, C. Time course of vasospasm in man. 48, 173-178 (1978).
- McCain, M. L., Sheehy, S. P., Grosberg, A., Goss, J. A., Parker, K. K. Recapitulating maladaptive, multiscale remodeling of failing myocardium on a chip. Proc. Natl. Acad. Sci. U. S. A. 110, 9770-9775 (2013).
- Agarwal, A., Goss, J. A., Cho, A., McCain, M. L., Parker, K. K. Microfluidic heart on a chip for higher throughput pharmacological studies. Lab. Chip. 13, 3599-3608 (2013).
- Huh, D., Torisawa, Y. S., Hamilton, G. A., Kim, H. J., Ingber, D. E. Microengineered physiological biomimicry: organs-on-chips. Lab. Chip. 12, 2156-2164 (2012).
- Meer, A. D., van den Berg, A. Organs-on-chips: breaking the in vitro impasse. Integr. Biol. (Camb). 4, 461-470 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유