Method Article
초기 Postimplantation 마우스 배아로 세포 나 DNA를 정확하게 현지화 전송하는 방법
요약
We demonstrate a method for grafting cultured cells into defined sites of early mouse embryos to determine their in vivo potential. We also introduce an optimized electroporation method that uses glass capillaries of known diameter, allowing the precise delivery of exogenous DNA into a few cells in the embryos.
초록
초기 마우스 배아의 조작과 문화는 강력하면서도 크게 과소 활용이 모델 시스템의 가치를 향상시키는 기술이다. 반대로, 세포 배양 널리 발생 생물학 연구에서 사용되어왔다. 그러나, 시험 관내 배양 된 세포는 진정 생체 세포 종류를 대표 여부를 결정하는 것이 중요하다. 개발하는 동안 그들의 기여 평가 하였다 배아에 세포를 이식하는 체외 배양 된 세포의 잠재력을 결정하는 유용한 방법이다. 본 연구는 생체 외 배양 하였다 이른 postimplantation 마우스 배아의 정의 부위에 세포를 이식하는 방법을 설명한다. 또한 높은 형질 전환 효율과 낮은 세포 사멸 모두 외인성 DNA를 수신하는 셀의 수의 정확한 정위 및 조정을 허용 공지 직경 유리 모세관을 사용하여 최적화 된 전기 천공 방법을 소개한다. 모든 SP를 필요로하지 않는 이러한 기술,ecialized 장비, 낭 배기 초기 기관 형성 단계 마우스 배아 수의 실험 조작, 배양 세포의 소집단의 헌신과 세포 분화에 현장에서 유전자 조작의 효과의 수 분석을 렌더링합니다.
서문
세포 배양에 널리 발생 생물학 연구에서 사용되어왔다. 마우스 배아 줄기 세포 (는 ESC)와 epiblast 줄기 세포 (EpiSCs)는 체외에서 세 가지 배엽으로 분화 초기 포유 동물의 배아에서 세포 분화에 유용한 모델입니다 수 있습니다. 이러한 세포 라인의 유도는 체외 조작 및 초기 배아 패턴 동안 운영 지역화 신호 이벤트 및 전사 네트워크의 자세한 조사를 위해 기회를 열었습니다. 그러나, 배양에서 수행되는 조작의 생체 적합성을 결정하는 데 중요한 남아있다. 착상 전 배아 유래 마우스는 ESC의 생체 전위는 착상 전 배아 (morulae 또는 배반포) (1)에 다시 도입하여 평가하고있다. 그러나 postimplantation 배아의 epiblast 세포를 나타냅니다 EpiSCs는 착상 전 배아 2,3에 효율적으로 통합 할 수 없습니다. 우리 previo우리의 연구 결과는 postimplantation 배아 4에 이식 할 때 EpiSCs 효율적으로, 키메라를 생성하고 모든 배엽에 기여할 수있는 것으로 나타났습니다. 따라서, 생체 외 배양 된 세포를 평가하는 가장 좋은 방법은 생체 내에서 해당 환경으로 도입하는 것이다.
전기는 생체 내 및 생체 외 실험 모두에서 표적 세포에 외래 분자를 제공하기 위해 널리 사용되는 방법이다. 전기 에너지는 외인성 디옥시리보 핵산 (DNA) 또는 세포를 입력하는 리보 핵산 (RNA)를 허용 세포막에 다수의 구멍을 생성 할 수있다. 이 기술의 가장 큰 과제 중 하나는 높은 electrotransfection 효율 5,6 최적의 세포 생존 능력을 결합하는 것입니다. 배아 조직에서의 핵산의 전기 천공을 위해, 금 넓은 공간 범위 7-9의 셀 타겟팅 있도록 전극이 가장 일반적으로 사용되어왔다 도금. 더 LOCA를 달성하기 위해유전자 전달하게 안정적는 침상 전극은 전계 10,11 초점을 달성하기 위해 이용되었다. 이 방법을 사용하여, 저자는 일렉트로 후 약 30-60 세포 (11)를 구성하는 DNA를 흡수 한 것으로 나타났다. 그럼에도 불구하고, 정확 일렉트로 세포의 수를 조정하는 고정 폭 전극과 유지 어려운 것으로 보인다. 모세관 전기 기술은 단일 세포에 플라스미드 12-14를 전달하는데 사용되어왔다. 그러나,이 기술은 생체를 배아 플라스미드 electroporating 적용되지 않았다. 최근 마이크로 디바이스는 초기 postimplantation 마우스 배아 15 로컬 electroporate 몇 말단 내장 내배엽 세포 (이하 4 셀)로보고되었다. 그러나,이 장치가 효율적으로 타겟팅 외배엽과 중배엽 생체 수 있는지 아직 알려져 있지 않다.
이 연구에서 우리는 초기 게시물에 세포 및 유전자 기능을 평가하는 두 가지 새로운 방법을 설명-implantation 배아. 우리는 먼저 자신의 생체 내 잠재력을 평가하기 위해 초기 마우스 배아에서 정의 된 사이트에 체외 배양 된 세포를 이식하는 방법을 보여줍니다. 이식 세포와 그 후손의 통합이 모든 유전 태그 (예를 들어, 녹색 형광 단백질 (GFP)에 의해 표시, 추가로 조직 특이 적 단백질의 면역 염색으로 검사 할 수있다 (4). 둘째, 우리는 정확하게 DNA를 제공하는 개선 된 방법을 설명 오히려 침상 전극을 사용하는 대신 전기를 통한 배아 국부 사이트. 우리는 뾰족한 유리 모세관 안에 세선을 삽입하고, 이러한 변형은 높은 효율과 제한과 셀의 소수의 DNA를 제공 할 수 있음을 입증 세포 죽음. 또한, 우리는 상이한 개구 크기를 갖는 유리 모세관을 이용하여, 우리는 일렉트로 세포의 수를 제어 할 수 있음을 보여준다. 따라서, 우리는 O이 방법은 적은 수를 포함하는 초기 배아 패턴을 연구하기 위해 아주 유용하게 사용될 수 있다고 생각F 세포.
프로토콜
동물 (과학적인 절차)에 규정 된 모든 동물 실험은 프로젝트 라이센스 번호 4천4백35분의 60에서 영국 홈 오피스 규칙에 따라 (1986) 법을 수행 하였다. 특정 발달 단계에서 배아를 수집하려면 시간이 초과 교배는 O / N을 설정했다. 질 플러그를 찾는 일에 정오 배아 일 (E) 0.5를 지정되었다.
1. 전의 VIVO 문화 E7.5 또는 E8.5 Postimplantation 배아를 해부
- 자궁 전위에 의해 임신 여성 쥐를 희생.
- 집게로 잡고, 가위를 사용하여 자궁을 분리하고, M2 매체로 가득 30mm 접시에 배치합니다.
- 조심스럽게 미세 집게 두 쌍을 사용하여 근육층을 떨어져 눈물.
- 배외 (extraembryonic) 충치 구멍을 뚫거나 않도록 조심하면서 탈락을 벗겨.
- 집게로 곤란 천천히 배아에서 분리하여 라이 헤르의 막을 제거합니다.
- 해부에서 배아를 확인실체는 난황, 양막과 ectoplacental 콘이 그대로 있는지 확인합니다.
- 얼음에 30mm 플라스틱 페트리 접시 뚜껑에 ( '얼음 플랫폼')에 부분적으로 진정 배아를 피펫과 장소를 사용하여 M2의 깨끗한 접시에 배아를 전송합니다.
- 필요한 경우, 최대 1.5 시간 동안 얼음 플랫폼, 예를 들어., 미디어 준비 또는 작은 배치의 조작시에 M2에 저장 배아 ~ 실온에서 3-4 배아.
참고 : 복구 및 설치류 배아의 해부는 이전에 7,8,16 상세하게 설명하고있다.
2. 배아 문화 미디어를 준비
- 갓 시판 쥐의 혈청 중 하나를 해동 (사양 Glanville 존스 등. 13 참조), 또는 쥐의 혈청 열은 56 ℃에서 30 분 동안 불 활성화 및 1 ml의 고정 된 COPP과 Cockroft (16)에 따라 자체 준비 -80 ℃에서 분취
참고 : 시판 래트 혈청이 허용 혈청 사내 준비하지만, 24 ~ 36 시간의 배양 기간을위한 48 시간까지 배양 기간 동안 우수한 우리의 경험에서. - 갓 과잉 준비 (예., 10 ㎖) 글래스 최소 필수 중간 (GMEM), 1 % 비 필수 아미노산 (NEAA), 2 mM L- 글루타민 및 1 mM의 피루브산 나트륨으로 이루어진 정의 보충한다.
- 배양하려는 각 단계의 배아의 개수에 따라 필요한 배양 배지의 부피를 계산한다 (섹션 3 참조). 50 % 배지를 만들기 위해 정의 보충제 래트 혈청을 혼합 (1 : 1 (v / v)의 래트 혈청 : 정의 첨가제) 및 / 또는 75 % 배지 (3 : 1 (v / v)의 래트 혈청 : 정의한 보충).
- 0.45 μm의 필터를 통해 배아 배양 배지를 전달하고 10,000 IU / ml의 페니실린 및 10 μg의 / ㎖ 스트렙토 마이신을 추가합니다.
참고 : 갓 해동 L- 글루타민 나트륨 피루 베이트 솔루션은 체외 배양시 배아의 개발에 매우 중요합니다.
- 24 시간 동안 37 ℃ 공기 중에서 5 % CO 2와 함께 제공 인큐베이터에서 4 웰 플레이트를 사용하여 정적 문화 : E7.5 배아하십시오. 1 ml의 50 %의 배양 배지에서 잘 당 두 개의 배아까지 문화.
- E8.5 배아의 경우 : 24 시간 (배아 당 1 ml의 50 %의 배양 배지)에 대한 37 ℃ 공기 중에서 5 % CO 2를 연속 가스 처리를 포함 35 회전 속도를 올린다 / min으로 회전하는 롤러 배양 장치 (8)를 사용합니다.
- E9.5 배아의 경우 : 24 시간 (당 1 ml의 75 % 배지 35 속도를 올린다 37 ℃에서 5 % CO 2, 40 % O 2 55 % N 2와 함께 공급 / 분의 혼입 기체를 회전 롤러 배양 장치를 사용 태아).
참고 : 3 시간 이내 문화 배아를 불리하게 개발에 영향을 미칠 M2에 장기간으로 쥐를 안락사 후. 체외 배아 문화의 방법에 대한 COPP과 Cockroft (16)을 참조하십시오.
4. GraftinE7.5 또는 E8.5 마우스 배아에 들어 배양 세포
- 물리적 20-200 μL 피펫 팁을 사용하여 6 웰 배양 접시에서 보편적으로 GFP를 발현 EpiSCs을, 긁어 배아를 함유 30mm 접시에 배치
참고 : 배아의 세포 덩어리를 삽입하려면 세포를 물리적으로 폐기보다는 트립신해야합니다. - 입 피펫을 만들기 위해 흡인기 튜브에 손으로 뽑아 접목 모세관을 연결합니다.
- 조심스럽게 이식 모세관에 크기의 하나 또는 그 이상의 세포 덩어리> 20 세포를 그릴 입 피펫을 빨아.
- 부드럽게 부분적으로 큰 덩어리를 분산, 세포를 날려.
- 모세 혈관의 개통에 그것을 가까이 유지, ~ 10-20 세포를 포함하는 하나의 세포 덩어리를 선택하고 다시 이식 모세관에 빨아. 에 반복적으로 모세 혈관에서 세포 덩어리를 이동하지 않도록주의, 작은 조각으로 해체를 방지 할 수 있습니다.
- 포셉 한 쌍의 장소에서 느슨하게 배아를 잡고 이식을 삽입관심의 영역으로 모세관 개구부를 만들 수 있습니다.
- 조심스럽게 배아에 박혀 10-20 세포의 짧은 문자열을 떠나, 이식 모세관에서 덩어리를 추방.
- 배아의 원하는 번호를 이식 절차를 반복합니다. 편의를 위해 3-4 배아의 배치 크기를 사용합니다.
- 과도한 빛과 열에 배아 노출을 방지하기 위해 최소로 촬상 시간 유지 M2 매체, 화상 카메라를 해부 현미경 형광 화합물을 사용한 그래프트 배아 같은 접시에 배아를 이탈.
주의 : 이러한 카메라와 현미경뿐만 아니라 형광체의 형광 특성과 강도의 사양에 의존하므로 실험적 촬상 시간을 결정한다. - M2 매체의 최소한의 볼륨 pastette에서 배아를 이동시켜 배양 배지 (섹션 3 참조) 즉시 이미징 후를-평형 사전.
참고 : 조심스럽게 이식 후 배아의 형태를 검사합니다. intac 만 문화T 배아.
5. 제 일렉트로 재료 및 장치 설치 (Electroporation에 실험에 앞서 다음을 준비) :
- DNA를 주입 피펫의 경우 : 수평 마이크로 피펫 풀러를 사용하여 DNA를 주입 피펫을 잡아 당깁니다. 주입 피펫은 배아 캐비티 내로 DNA를 주입 할 때 조직 손상을 방지하기 위해 개구 10 ㎛ 미만으로 미세한 팁을 가져야한다.
- 유리 모세관 전기의 경우 : 20 ~ 30 μm의 하나의 내부 직경에 DNA를 주입 피펫의 개통을 잘라 microforge를 사용합니다. 모세관 전기 대한 배아와 접촉 할 때 세포 손상을 방지하기 위해, 유리 모세관의 선단이 깨끗하게되지 날카로운 깨진 절단 에지를 포함해야한다.
- 수제 모세관 전극 (양극) (그림 1)의 경우 : 차기에 초점을 맞 춥니 다 20 ~ 30 μm의 직경의 고정 구멍에 전기 유리 모세관에 0.2 mm 직경 백금 와이어를 삽입현재 RIC와 배아에 대한 관심의 작은 영역으로 플라스미드 DNA를 제공합니다.
- 수제 L 자형 전극 (음극) (그림 1)의 경우 : "L"길이 약 1mm의 수평 부분과, "L"모양을 만드는 0.2 mm 직경의 백금 와이어를 구부리.
- 얇은 절연 전선에 각각의 백금 전극을 부착하고 절연 테이프로 덮여 미세 주사 바늘 홀더에 삽입합니다.
- 표준 미세 조작기구 홀더에 바늘 홀더를 탑재합니다.
- 도 1에 도시 한 바와 같이 회로를 연결 : 전원 공급 장치의 양극에 모세관 연결 전극; 멀티 미터의 양극에 L 자형 전극을 연결; 전원 공급 장치의 음극에 mulimeter의 음극을 연결한다.
6. Electroporation에 E7.5 또는 E8.5 마우스 배아
- 상단의 1-2mm 내 PBS로 전기 유리 모세관을 채우기 및 strai를 삽입유리 모세관으로 GHT 백금 전극 (양극)은 또한 모세관의 바닥에 도달 할 때까지.
- PBS로 채워진 30mm 페트리 접시의 표면에 L 자형 전극 (음극)을 고정.
- PBS 채워진 전기 접시에 M2 매체로부터 배아를 전송합니다.
- 태아의 양수 공동으로 측면 epiblast에서 주사 바늘을 삽입합니다. 완전히 꽉 찰 때까지 공동으로 : 공기 피코 펌프를 사용하여, DNA 용액 (GFP 또는 pCAG-GFP 0.01 % 녹색 식용 색소 염료와 1.5 ㎍ / ㎖의 pCAG-Cre 호텔)을 주입. E7.5-E8.5 배아를 들어, 이하의 5 μL의 DNA 용액을 한 배아 요구된다. 지표로 녹색 염료를 사용하여 배아를 폭발하지 않도록주의.
- 신중 전극 사이 배아를 놓고 DNA가 전달 될 정확한 위치에 캐 필러 리를 이동 전극.
주 : 배아의 방향이 DNA는 전기 천공 될 영역에 따라 달라진다. - Electropo각 펄스 사이에서 1 초 간격으로, 6에서 50 밀리 초 펄스 지속 시간을 각각 200 볼트 (V)를 이용하여 배아 평가.
- 하기 배아를 전송 일렉트로 직후 배지 미리 평형화. 원하는 경우, 다음 배아 대한 프로세스를 반복한다.
참고 : 멸균 용기에 배지를 추가하고 매체를 미리 평형 문화 인큐베이터에 넣어. - 문화 후 일렉트로 세포에게 2 시간을 감지 pastette를 사용하여 M2 매체의 깨끗한 30mm 페트리 접시에 배아를 전송합니다. 화상 해부 현미경 형광 화합물을 이용하여 단계 5.9에서와 배아.
- 촬영 직후 pastette을 사용 문화에 다시 배아를 전송합니다.
- 원적외선 세포막 투과성 핵 염료로 배아를 얼룩, 전기에 의한 죽은 세포를 감지 : 전기 후 10 분 2 시간 동안 37 ℃에서 (1 배아 배양 배지 200) (선택 사항)
- 엠브리를 수정, 일렉트릭 세포를 계산하려면4 ℃에서 2-4 시간 동안 4 % 파라 포름 알데히드 (PFA)의 OS는, 자외선 또는 원적외선 Counterstain과 형광 핵 및 공 촛점 현미경 이미지 (선택)를 이용하여 배아 핵을 염색.
참고 : PBS에 너무 오래 방치하면 배아 성장에 부정적인 영향을받습니다. 따라서, 각각의 배아를 electroporate하는 데 걸리는 시간을 최소화하는 (배아 당 <5 분)을 보장한다.
결과
접목
보편적으로 EGFP (mESCs에서 체외에서 유래 E6.5의 epiblast에서 파생 된 R04-GFP, 및 C2, 4) 표현 EpiSCs 수동으로 배양 접시에서 긁어 E7.5 배아의 다른 사이트 (그림 2A)로 이식되었다. 배아는 체외 배양하고 24 시간 후에 분석 하였다. 공여 세포의 분포는 형광 현미경에 의해 평가 하였다. 공여 세포가 혼입하는 경우, 이들은 증식 및 이들의 유도체는 호스트 배아 (도 2b) 내에 분산. 이는 호스트 배아 (도 2A 및 2B)에 효율적으로 통합 10-16 세포를 포함하는 이식은, 그러나, 더 많은 세포를 이식하는 것이 잘 chimaerism 초래하지 않는 것으로 관찰되었다. 대신, 이식 세포 비법 덩어리 (그림 2C 및 2D)를 생산했다.
전기
로배아의 특정 사이트에 : ssess 우리의 전기 시스템의 효율성, 우리는 GFP를 발현하는 플라스미드 (GFP pCAG-GFP 및 pCAG-Cre 호텔)을 전달했다. 이전의 연구 (11)과 일치, GFP + 세포는 배아에서 전기 (그림 2E와 2G) 후 1 ~ 2 시간을 검출되었다. 후반 원시적 인 행진 단계 배아에서 말초 epiblast 세포를 전기 천공 때, 라벨 세포는 배양 24 시간 (그림 2E와 2 층) 후 신경 외배엽에 기여했다. 이 결과는 낭 배기 단계의 배아 17 epiblast 세포의 알려진 운명의지도에 잘 대응한다. GFP 발현 플라스미드가 E8.5 (2-5 somites)의 원시적 인 행진에 전기 천공 때 마찬가지로, GFP + 세포는 후반 원시적 인 행진 18 알려진 운명의지도와 일치 근축 중배엽 (그림 2G 및 2H),에 기여 . 또한, 우리는, 일렉트로 세포에서 세 가지 배엽 (그림 2I-K)에 기여를 관찰전기 천공 절차가 생체 내에서 세포의 동작을 손상하지 않는다는 것을 시사한다. 그러나, 우리는 또한 epiblast (E7.5) 또는 원시 행진 세포 (E8.5)을 대상으로 한 반면, 일부 내배엽 세포는 (그림 3C 및 표 1) 전기 천공 된 것으로 나타났습니다.
모세관 전극을 사용하는 주요 장점 중 하나는 일렉트로 세포의 수는 단순히 그 개구부의 직경을 변화시킴으로써 제어 될 수 있다는 것이다. 일렉트로 세포의 수를 결정하기 위해, 배아는 전기 후 2 시간 고정 및 공 초점 현미경에 wholemount에 몇 군데 있었다. GFP + 세포 수는 수동 촛점 Z-스택에서 카운트 하였다. 표 1은, 그 이상의 셀에 의해 DNA 흡수를 20 내지 30 μm의 결과로부터 유리 모세관의 개구 크기를 증가 주어진 단계에 대한. 하나의 개구 크기 (E8.5 대 E7.5) 단계를 비교했을 때 더 많은 세포를 전기 천공 후단 것으로 나타났다. 이 효과는 E8.5에서 양수 캐비티에 존재하는 DNA의 높은 농도로 인해 수 있습니다. DNA 용액을 녹색 식품 염료와 혼합 이었으므로 양막 캐비티 내에 DNA 농도를 평가하는 그린 컬러를 사용할 수있다. 현미경에서는 E8.5 배아와 비교하여, DNA 주입 후 녹색 색상 E7.5 배아 캐비티 훨씬 가볍고, 분명하다. DNA 용액의 농도가 동일한 E7.5 및 E8.5 배아 주입되었지만, 더 많은 DNA 용액은 대형화 때문에 완전히 채우기 위해서 E8.5 배아의 공동 양수이었다. 주사 바늘을 철수 한 후 항상 양수 캐비티로부터 DNA 용액의 누출이 어느 정도 존재하고, 천공 구멍 이전 배아 양막 공동의 크기에 비해 크기 때문에, 그것에 비례 더 리크가 있다고 보인다 낮은 DNA 농도에 이르는 E8.5 배아보다 E7.5에서. 형질의 다른 개수세포는 다른 단계에서 세포의 다른 직경 또는 유도 막 횡단 전압 (ITV) 임계 값으로 인해 수 있습니다.
일렉트로 포 레이션의 단점은 관련 세포사이다. 전통적인 금 유사한 도금 또는 침상 전극은 모세관 전극을 사용하여 전기 천공은 또한 세포 사멸을 야기한다. 전기 천공 후, 타겟 영역은 세포 사멸 과정의 일부가이 영역에 발생해야한다는 것을 나타내는, 인접한 영역들 (도 3A 및 3B)에 비해 진한 색으로 보였다. 상기 전기 천공 절차에 의한 죽은 세포의 수를 결정하는, 배아는 형광 세포막 액성 핵 염색으로 염색 하였다. 죽은 세포의 핵은 막 불 투과성 원적외선 형광 염료로 표지 하였다. 염색이 모세관 전기 천공 법은 단지 일렉트로 사이트 근처 사균 (도 3D 및 타행 소수의 결과를 확인BLE 1).
우리는 죽은 세포가 전기 사이트에 표시하지만, GFP + 세포와 죽은 세포는 서로 (그림 3E 및 3 층)에서 가장 배타적 인 것으로 나타났습니다. E8.5에 꼬리가 횡 epiblast pCAG-GFP 및 20 ㎛의 유리 모세관 개구, GFP + 세포의 다수 일렉트로 때 또한, 배양 48 시간 (도 3G 및 3H) 후 검출되었다. 함께 찍은, 이러한 결과는 대부분의 GFP + 세포가 더 문화 동안 여전히 실행 가능한 있습니다 전기 후 2 시간을 감지 좋습니다.
우리는 24 시간 체외 배양 후 GFP + 세포의 수를 얻었습니다. 여섯 배아는 20 ㎛ 직경의 모세관 개구를 이용하여, E7.5에 pCAG-GFP로 전기 천공 하였다. GFP + 세포 / 배아 검출되었다 107 ± 31 (SD는 평균 ±). 배양 (2 시간)의 시작 이후, 9 세포 당 평균 배아에 전기 천공 하였다 ( trong> 표 1), 이는 전기 천공 세포가 2 시간 이내에 3-4 분열을받은 것을 의미한다. E8.5 배아에 E7.5에서 시간을 두 배로 평균 셀이 떨어져 복부 노드 (19, 20)에 그 모든 세포에서 약 6 ~ 7 시간입니다. 이것은 전기 천공 절차는 정상 세포 성장을 방해하지 않는다는 것을 시사한다.
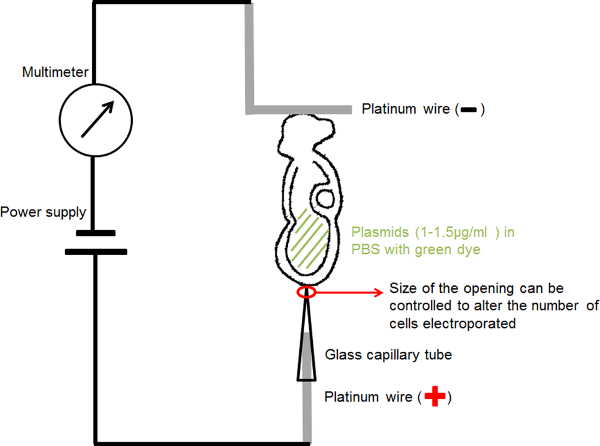
일렉트로 설정을 나타내는도 1 회로도. 그 공동 양수에서 태아 DNA 함유 용액을 두 전극 사이에 위치시켰다. 선택된 파라미터에 전류가 구형파 펄스 발생기 (전력 공급 장치)에 의해 제공되었다. 멀티 미터는 배아를 통과하는 전류를 검출하는 직렬로 연결되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
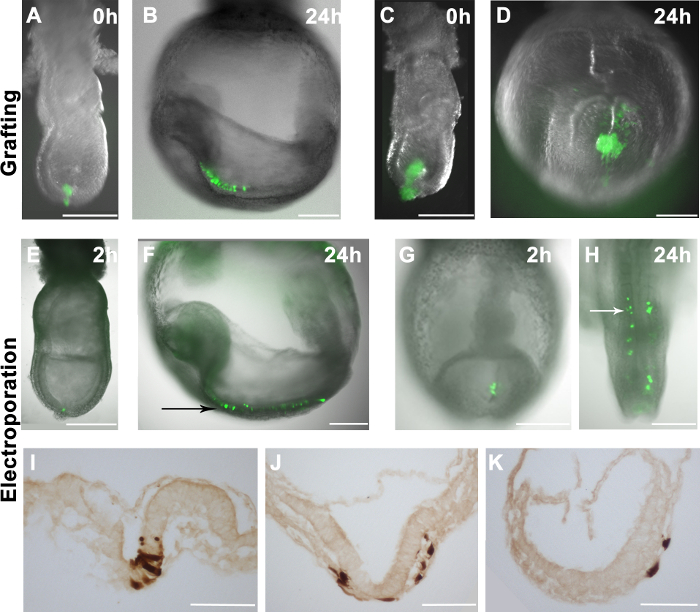
그림 2. 호스트 배아에 이식 또는 일렉트로 세포의 분포. wholemount 배아 (그레이 스케일) (A)의 명 시야 이미지에 (AH) GFP의 형광 오버레이 (녹색) 10-16 GFP + EpiSCs는 후반의 말단 부위에 이식되었다 -streak 단계 배아. (C) GFP + EpiSCs의 큰 덩어리는 중간 킬 단계 배아의 원위 영역에 그래프트 하였다. (B 및 D)에 도시 된 호스트 배아 EpiSCs 유래 세포 (녹색)의 분포 ( 및 배양 24 시간 후에 C). 공여 세포의 정확한 적분을 제안 호스트 배아 분산 (B) GFP + 세포. (D) 그라프 트화 큰 세포 덩어리는 호스트 배아 비법 덩어리 형성을 초래. (EK) pCAG-Cre 호텔 : GFP 플라스미드 ELE 야생형 배아의 특정 영역에 ctroporated. 초기 꽃 봉오리 단계 배아 (E) 또는 2-5 체절 단계 배아 (G)의 원시적 인 행진의 말단 영역을 Electroporating은 2 시간 시술 후이 지역에서 GFP + 세포의 결과. (F와 H) 문화의 24 시간 후 호스트 배아에서 GFP + 세포의 분포, 일렉트로 세포가 neuroectoderm (검은 색 화살표)에 기여하는 것을 보여주는 (F) 및 근축 중배엽 (흰색 화살표) (H). (IK) 일렉트릭 세포가 neuroectoderm (I)을 야기 할 수 있음을 보여주는 GFP + 세포에 대한 DAB의 면역 염색, 중배엽 (J)와 문화 24 시간 후 내배엽 (J 및 K). 스케일 바 (AH) = 250 μm의; 스케일 바 (IK)는 100 ㎛를 =. 참고 : 그림 1A와 1B가 이전 출판물 (4)에서 다시 인쇄됩니다.= "https://www.jove.com/files/ftp_upload/53295/53295fig2large.jpg"대상 = "_ 빈"HREF>이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
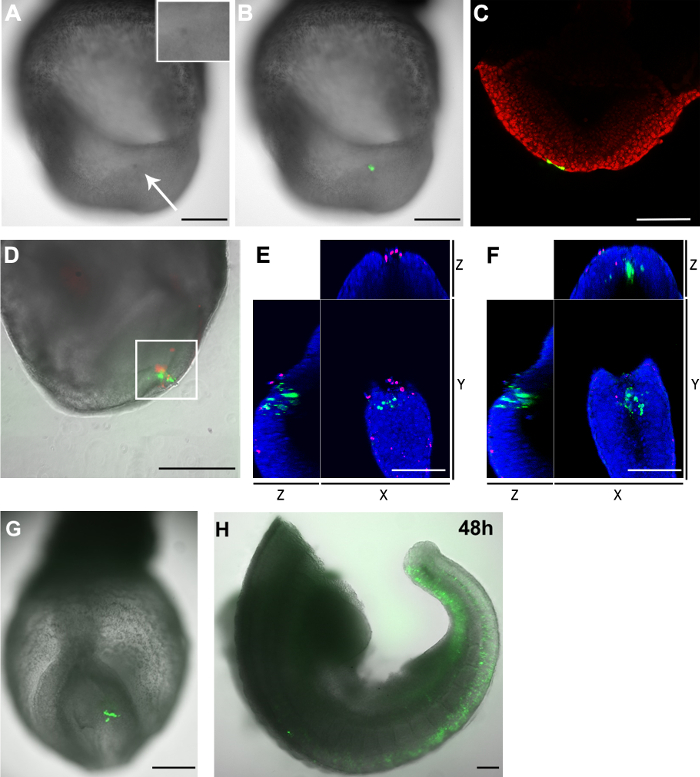
GFP + 세포와 전기 후 배아에서 죽은 세포의 그림 3. 유통 (AC) pCAG-Cre 호텔 :. GFP 플라스미드 E8.5의 꼬리 측면 epiblast 세포에 전기 천공 (2-5 체절 단계) 배아 (모세관 구멍 크기 :. 20 μm의) (A) 2 시간 후 절차, 대상 영역은 태아의 다른 부분에 비해 진한 색 (백색 화살표)을 보여준다. 삽입 된 일렉트릭 영역의 확대를 보여줍니다. (B) 브라이트 이미지 (그레이 스케일) 일렉트릭 세포 (녹색)을 나타내는 녹색 형광 채널을 입혔다. (C) 공 초점 Z 슬라이스가 보여주는꼬리 횡 epiblast 세포를 표적으로 하였을 때 두 내배엽 세포 (녹색)과 같은 플라스미드를했다. . 세포핵은 (DF) pCAG-Cre 호텔 빨간색으로 표시된다 : GFP 플라스미드 E8.5 배아 노드의 꼬리 양태에서 전기 천공 하였다 (모세관 눈 크기 : 30 μm의). 배아가 2 시간 동안 배양 하였다. 일렉트로 세포는 빨간색, 녹색, 죽은 세포에 표시됩니다. (D)는 일렉트로 지역은 GFP + 세포뿐만 아니라 죽은 세포 모두 포함되어 있습니다. 흰색 상자에이 지역은 또한 공 초점 현미경으로 분석 하였다. Z-스택의 수동 계수는 33 GFP + 세포와이 지역에서 23 죽은 세포가 것으로 나타났다. 만 개의 세포는 모두 형광 양성 모두 있었다. (E와 F) GFP + 세포가 죽은 세포에서 분리되어 보여 D의 흰색 박스 지역에서 공 초점 Z 슬라이스의 XYZ보기. 핵은 파란색으로 표시됩니다 (G와 H) pCAG-Cre 호텔 :. GFP 플라스미드는 몇 CEL에 전기 천공 된E8.5 배아의 꼬리 측면 epiblast에서 LS (모세관 구멍 크기 : 20 μm의) 두 (G) 및 48 (H) 시간 체외 배양 주 후 이미징 (H) 배아 배양 후 2 년 단절되었다. 머리와 가슴 지역은 제거되었다. 스케일 바 (A, B, D, G 및 H) = 250 μm의; 스케일 바 (C, E와 F) = 100 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 모세관의 개구의 직경 | 배아 단계 | 전기 효율 : 없음. 2H / 총 아니오 후 GFP + 세포를 포함하는 배아. 의 전기 천공 배아 (NO. 24 또는 48 시간 배양 한 후 일반적으로 개발 + 배아 GFP) | SD ± 배아 당 GFP의 평균 수는 + 세포 (N = 아니오. 조사 배아) | 의 제SD ± 각 배아 당 GFP + 내배엽 세포 (N = 아니오. 조사 배아) |
| 20 ㎛ | E7.5 (LS-LB) | 9분의 7 (7) | 9 ± 3 (N = 4) | 4 ± 2 (N = 4) |
| 30 ㎛ | E7.5 (LS-LB) | / 15 (12) 13 | 17 ± 2 (N = 4) | 6 ± 1 (N = 4) |
| 20 ㎛ | E8.5 (2-5 somites) | / 13 (10) (12) | 21 ± 4 (N = 4) | 11 ± 4 (N = 4) |
| 30 ㎛ | E8.5 (2-5 somites) | 이분의이 (2) | 33, 26 (N = 2) | 14, 16 (N = 2) |
pCAG-Cre 호텔의 표 1 Electroporation에 효율 : 마우스 배아에서 GFP 플라스미드.
약기 : LS, 늦게 원시적 인 행진 단계; LB : 늦게 꽃 봉오리 단계. 배아에 따라 준비됩니다다운스와 데이비스 (12)
토론
접목
세포 이식 실험에서 중요한 단계 덩어리의 분열을 방지하기 위해, 이상적으로는 하나의 동작의 셀 간섭 문자열의 삽입이다. 이 기술은 입 피펫을 조절하는 연습이 필요합니다. 공여 세포는 숙주에서 잘 통합하면, 이들의 유도체는 배아에 분산시키는 것이다. 상기 분산 도너 유래 세포는 숙주에서 적절히 분화 여부를 확인하기 위해, 면역 염색은 배아 부에서 수행 될 수있다. 공여 세포는 숙주 환경과 호환되지 않을 경우, 이들은 어느 검출 (이들이 배아로부터 토출되는 바와 같이) 또는 배양 후에 배아 비법 덩어리를 형성 할 수 없다. 분산 된 세포 및 세포 덩어리가 모두 관찰 된 경우, 이는 너무 많은 세포가 그래프트 된 나타낼 수 있고, 주변의 숙주 세포와 상호 작용할 수없는 과도한 공여 세포는 덩어리 형성을 초래. 이 경우, 추가로 함유 그라프셀들의 작은 수를 행할 수있다.
세포 이식 기술의 주요 한계는 48 시간 이상이 달성되어 있지 않은 기간 동안 마우스의 생체 외 배양 세포를 사람의 전체 생체 전위를 결정하는 것이 가능하지 않다는 것이다. 초음파 유도 세포 주입과 결합 된 경우, 이는 자궁 내 태아에 배양 된 세포를 전달하는 것이 가능할 수있다. 세포 이식 실험이 광범위하게 우리 그룹에 사용 된 우리에게 다양한 세포 유형 4,21,22의 생체 가능성에 대한 중요한 단서를 제공 한 요약. 그것은 초기 postimplantation 배아에서 체외 배양 된 세포의 생체 내 잠재력을 평가하는 일반적인 유틸리티의 기술이다.
전기
이 연구에서 우리는 단지 표시했지만 그것은 내가, epiblast을 대상으로 모세관 전기 기술을 사용하는 것이 효율적이다t는 의도적으로 이러한 내배엽 세포와 같은 다른 배엽을 대상으로하는 것도 가능하다. 모세관 전기 천공 법을위한 중요한 단계는 초기 PBS 마우스 배아에 매우 차선 때문에 각각의 태아 (태아 당 <5 분) electroporate하는 데 걸리는 시간을 최소화하는 것이다. 우리의 데이터는 위의 배아에서 대부분의 지역에서 전기가 배아의 성장에 영향을 미치지 않는 것으로 나타났습니다. 그러나, 노드에 전기가 이상 발생시 원인 및 배아의 조기 사망을했다. 이는 중요한 시그널링 센터 (23)를 형성하는 세포의 손상 또는 사망 가능성이 높다. 따라서,이 영역은이 기술 회피되어야 할 것이다. 또주의해야 할 점은 결과 섹션에서 언급 한 바와 같이 epiblast 또는 원시 행진 세포를 대상으로 한 반면, 일부 내배엽 세포는 또한 전기 천공 된 점이다. DNA는 epiblast 상피 아래 간극을 통해 내배엽에 도달 때문일 수있다. 내배엽은 상피 세포의 구성과 일 우리의 경험에ESE 세포는 DNA를 차지하기 위해 더 높은 경향이있다. 운명 매핑에이 기술을 적용 할 때 따라서, 그것은 처음에 DNA를 가지고있는 세포를 평가하는 것이 중요하다.
GFP 플라스미드 효율적이 연구에 도시 된 전기 매개 변수를 사용하여 전달 될 수 있고, 다른 DNA 구조체의 효율이 변할 개별 최적화를 필요로 할 수있다 : 또한 pCAG-GFP 및 pCAG-Cre 호텔이 있지만 주목해야한다. 플라스미드 형질 어려운 것으로 발견되면 DNA 농도, 전기 전압 또는 펄스의 수의 변화는 이루어질 수있다.
제한된 세포 사멸과 배아에서 거의 세포에 GFP 플라스미드 : 요약하면, 우리의 최적화 된 모세관 전기 시스템은 효율적이고 재현성 GFP 또는 Cre 호텔을 제공 할 수 있습니다. 이 방법은 고가의 또는 고도의 전문 장비를 필요로하지 않기 때문에, 셀 추적 연구 또는 이소성 발현 또는 조건부 삭제 (O)의 효과를 시험에 아주 유용하게 사용될 수있다초기 배아에서 F 유전자는 경우 전기는 floxed 조건부 돌연변이 대립 유전자를 운반하는 배아에서 수행된다. 따라서,이 기술은 전기 천공 지역화 야생형 배아 환경의 컨텍스트에서 셀별로 셀 고유 인자의 역할을 이해하는데 유용한 기능성 도구를 제공한다.
공개
The authors have no conflicts of financial or other interest to declare.
감사의 말
We thank Filip Wymeersch and Anestis Tsakiridis for comments on the manuscript, staff in the SCRM animal unit for help with animal maintenance and Prof. Stuart Forbes for immunohistochemistry reagents. This work was supported by MRC grant Mr/K011200/1 and the China Scholarship Council
자료
| Name | Company | Catalog Number | Comments |
| Forceps | Dumostar | T5390 | |
| Dissecting stereomicroscope | Zeiss | Stemi 2000-C | |
| Stereomicroscope system with fluorescence | Nikon | AZ100 | |
| Inverted microscope with a digital camera | Olympus | Olympus BX61 | |
| Inverted confocal microscope | Leica Microsystems | Leica TCS SP8 | |
| Low melting point agarose | Life Technologies | 16520-050 | |
| Pasteur pipettes | Fisher Scientific | 11397863 | |
| 30mm Petri dishes | Fisher Scientific | 121V | |
| 4-well plates | Thermo scientific | 179820 | |
| M2 medium | Sigma-Aldrich | M7167 | |
| Phosphate Buffered Saline (PBS) | Life Technologies | 10010015 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | P6148 | |
| Pipettes | NICHIRYO | Nichipet | |
| tips | Greiner Bio One | 685280 | |
| Cell culture incubator | SANYO | MCO-17AIC | |
| Roller culture apparatus | BTC Engineering | ||
| Syringe filters 0.45µm, sterile | Sigma-Aldrich | 10462100 | |
| Glasgow Minimum Essential Medium (GMEM) | Sigma-Aldrich | G5154 | |
| non-essential amino acids (NEAA) | Life Technologies | 11140050 | |
| L-glutamine | Fisher Scientific | SH30549.01 | |
| Sodium pyruvate solution | Fisher Scientific | SH30239.01 | |
| Penicillin and Streptomycin 10.000UI/ml | Lonza | DE17-602E | |
| Gas Cartridge for Portable Meker Burner | COLEMAN | COLEMAN 250 | |
| Thin Wall Borosilicate Capillary Glass with Fillament, OD 1.0 mm, ID 0.78 mm | Harvard Apparatus | 640798 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma-Aldrich | A5177-5EA | |
| Flaming/Brown micropipette puller | Sutter Instrument Company | P-97 | |
| Microforge | De Fonbrune | BS030301 | |
| Pneumatic pico pump | World Precision Instruments | PV830 | |
| Microloader tips | Eppendorf | 5242956.003 | |
| ECM 830 square wave pulse generator | BTX | 45-0002 | |
| Green food coloring dye | Sigma-Aldrich | C.I. 42053 | |
| A far-red cell membrane-impermeable nuclear dye | Biotium | 40060-T | |
| pCAG-Cre:GFP | Addgene | #13776 | |
| pCAG-GFP | Addgene | #16664 | |
| Multimeter | Excel | XL830L | |
| Micromanipulators | Leitz | ||
| 0.2mm diameter platinum wire | Agar Scientific | E404-2 | |
| Anti-GFP antibody | Abcam | ab13970 | |
| Goat anti-Chicken IgY, HRP | Santa Cruz | sc-2428 | |
| Liquid DAB+ Substrate Chromogen System | Dako | K3467 | |
| 4',6-diamidino-2-phenylindole (DAPI) | Life Technologies | D21490 | |
| A far-red fluorescence nuclear counterstain | Life Technologies | T3605 |
참고문헌
- O'Hagan, A. R., Morton, R., Eid, N. Loss of asthma control in pediatric patients after discontinuation of long-acting Beta-agonists. Pulmonary med. , 894063 (2012).
- Brons, I. G., et al. Derivation of pluripotent epiblast stem cells from mammalian embryos. Nature. 448, 191-195 (2007).
- Tesar, P. J., et al. New cell lines from mouse epiblast share defining features with human embryonic stem cells. Nature. 448, 196-199 (2007).
- Huang, Y., Osorno, R., Tsakiridis, A., Wilson, V. In Vivo differentiation potential of epiblast stem cells revealed by chimeric embryo formation. Cell rep. 2, 1571-1578 (2012).
- Sadik, M. M., et al. Scaling relationship and optimization of double-pulse electroporation. Biophys. J. 106, 801-812 (2014).
- Kaestner, L., Scholz, A., Lipp, P. Conceptual and technical aspects of transfection and gene delivery. Bioorg. Med. Chem. Lett. , (2015).
- Soares, M. L., Torres-Padilla, M. E., Zernicka-Goetz, M. Bone morphogenetic protein 4 signaling regulates development of the anterior visceral endoderm in the mouse embryo. Dev. Growth Differ. 50, 615-621 (2008).
- Pierreux, C. E., Poll, A. V., Jacquemin, P., Lemaigre, F. P., Rousseau, G. G. Gene transfer into mouse prepancreatic endoderm by whole embryo electroporation. JOP. 6, 128-135 (2005).
- Falk, J., et al. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC Dev. Biol. 7, 107 (2007).
- Davidson, B. P., Tsang, T. E., Khoo, P. L., Gad, J. M., Tam, P. P. Introduction of cell markers into germ layer tissues of the mouse gastrula by whole embryo electroporation. Genesis. 35, 57-62 (2003).
- Khoo, P. L., Franklin, V. J., Tam, P. P. Fate-Mapping Technique: Targeted Whole-Embryo Electroporation of DNA Constructs into the Germ Layers of Mouse Embryos 7-7.5 Days Post-coitum. CSH protocols. 2007. , pdb.prot4893 (2007).
- Tawk, M., Bianco, I. H., Clarke, J. D. Focal electroporation in zebrafish embryos and larvae. Methods Mol Biol. 546, 145-151 (2009).
- Haas, K., Jensen, K., Sin, W. C., Foa, L., Cline, H. T. Targeted electroporation in Xenopus tadpoles in vivo--from single cells to the entire brain. Differentiation. 70, 148-154 (2002).
- Nolkrantz, K., et al. Electroporation of single cells and tissues with an electrolyte-filled capillary. Anal. Chem. 73, 4469-4477 (2001).
- Mazari, E., et al. A microdevice to locally electroporate embryos with high efficiency and reduced cell damage. Development. 141, 2349-2359 (2014).
- Copp, A. J., Cockroft, D. L. . Postimplantation mammalian embryos : a practical approach. , (1990).
- Tam, P. P., Behringer, R. R. Mouse gastrulation: the formation of a mammalian body plan. Mech. Dev. 68, 3-25 (1997).
- Wilson, V., Beddington, R. S. Cell fate and morphogenetic movement in the late mouse primitive streak. Mech. Dev. 55, 79-89 (1996).
- Tzouanacou, E., Wegener, A., Wymeersch, F. J., Wilson, V., Nicolas, J. F. Redefining the progression of lineage segregations during mammalian embryogenesis by clonal analysis. Dev Cell. 17, 365-376 (2009).
- Bellomo, D., Lander, A., Harragan, I., Brown, N. A. Cell proliferation in mammalian gastrulation: the ventral node and notochord are relatively quiescent. Dev. Dynam. 205, 471-485 (1996).
- Tsakiridis, A., et al. Distinct Wnt-driven primitive streak-like populations reflect in vivo lineage precursors. Development. 141, 1209-1221 (2014).
- Gouti, M., et al. In vitro generation of neuromesodermal progenitors reveals distinct roles for wnt signalling in the specification of spinal cord and paraxial mesoderm identity. PLoS biology. 12, e1001937 (2014).
- Beddington, R. S. Induction of a second neural axis by the mouse node. Development. 120, 613-620 (1994).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유