JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
치과 바이오 필름에 세포 외 pH를 비례 영상
요약
pH 민감성 염료 비율 적 실시간 치과 생물막의 세포 외 pH를 모니터링하는 공 초점 레이저 주사 현미경, 디지털 화상 분석과 조합하여 사용된다.
초록
치아에 세균 바이오 필름의 pH는 충치, 높은 전 세계적으로 유병률과 질병에 대한 중앙 중요하다. 영양 및 대사 산물은 치과 바이오 필름에 균일하게 분포되지 않습니다. 바이오 필름의 유기 물질과에 흡착 및 반응의 복잡한 상호 작용은 용질의 확산 경로를 줄이고 바이오 필름을 통해, 유기산을 포함하여 반응성 분자의 가파른 경사를 만듭니다. 이러한 형광 수명 이미징 또는 산도 ratiometry 정량적 형광 현미경 방식은 치과 생물막 상이한 미세 환경에서의 pH를 시각화하는데 이용 될 수있다. 산도 ratiometry는 pH 민감성 염료의 형광 방출의 pH에 따라 변화를 이용한다. 두 개의 서로 다른 파장에서 방출 비율의 계산에 관계없이 염료의 농도, 미세한 이미지의 로컬의 pH를 결정 허용한다. 실시간에서 수직 및 수평의 pH 구배를 모니터링 허용 기법을 미소 전극 반대로아웃 기계적으로 바이오 필름을 방해. 그러나주의 바이오 필름의 역외 및 세포 내 구획 사이에 정확하게 구분하기 위해주의해야한다. 여기서, 비율 적 색소 seminaphthorhodafluor-4F -5- (및 -6) 카르 복실 산 (C-가 SNARF-4)는 알 수없는 종류의 조성물의 생체 내 성장 치과 생물막의 세포 외 pH를 모니터링하는데 사용된다. 염료를 포도당에 노출시까지 농축 생물막의 모든 박테리아 세포 안에; 그것은 따라서 보편적 인 세균 오염으로와 세포 외 pH를 마커로 모두 사용된다. 공 촛점 현미경 이미지 획득 후, 균체 매스 독점적 세포의 pH를 계산하도록 허용하는 디지털 영상 분석 소프트웨어를 사용하여 모든 이미지로부터 제거된다. 비율 계량 염료의 pH ratiometry 최대 75 μm의 두께의 얇은 생물막에서 세포 외 pH가 공부를 잘 적합하지만, 4.5 및 7.0 사이의 pH 범위로 제한됩니다.
서문
여기에 설명 된 방법은 비율 적 색소 (및 -6) 카르 복실 산 (C-SNARF-4) 공 초점 레이저 주사 현미경과 결합하고 seminaphthorhodafluor-4F -5-을 사용하여 4.5 내지 7의 범위 치과 생물막의 세포 외 pH를 모니터링 허용 디지털 이미지 분석. 사용되는 형광 염료는 pH에 민감하고 양성자의 상태에 따라 그 형광 방출의 변화를 표시합니다. 580 nm에서의 양성자 분자 피크 발광 형광체 및 640 nm의 1로 탈 분자의 방출. 두 개의 방사 피크를 포함하는 두 개의 검출 창에서 형광체 발광 강도의 비는 (576 - 608 nm의 629-661 나노 미터)는 이에 관계없이 염료의 농도, 액상의 pH를 반영한다. ~ 6.4의 약동학와 염료 적당히 산성의 pH 환경에서 시각화하는 것이 적합하다.
세균 바이오 필름의 PH는 모든 대사 과정에 대한 중앙 중요하다.치과 생물막의 경우, 세포 외 기질의 pH는 우식의 개발을위한 중요한 독성 인자이다. 생물막 치아 인터페이스 리드에서 낮은 pH와 연장 기간은 기본 에나멜 2의 탈회 속도가 느려질 수 있습니다. 때문에 유기산을 포함하여 생물막, 대사 산물의 복잡한 3 차원 구조로, 균일 바이오 필름에 분산되지 않습니다. 매우 적은 acidogenic 미세 환경은 가까운 공간 근접 3에서 찾아 볼 수있다.
수십 년 동안, 바이오 필름에 수직의 pH 구배는 마이크로 전극 4-6의 도움으로 기록되었다. 그들은 그들의 작은 팁 크기에 좋은 공간 해상도를 제공하지만, 그들은 수평 기울기를 모니터에 적합하지 않습니다. 또한, 상기 전극 삽입 기계적 생물막을 방해. 정량적 형광 현미경 기술은 기계적 간섭없이 생물막의 다른 영역에서의 pH 변화를 시각화하는 장점을 제공한다NCE. 보기의 다른 미세한 필드를 자유롭게 선택하여 장시간 1,7-9에 걸쳐 반복적으로 이미지화 할 수있다. 현미경 생물막 화상 해석하지만,이 세포 외 공간으로부터 도출 미생물 바이오 매스로부터 유래 형광 형광을 구별하는 것이 중요하다. 박테리아 적극적 아데노신 삼인산 (10)의 비용들이 세포막을 가로 질러 양성자를 수송 산성 조건에서 균체 내부 pH는 세포 외 기질의 pH가 다르다. 낮은 세포 외 pH를 탈회 리드 반면 우식의 맥락에서, 박테리아 세포 내 pH는 기본 에나멜에 직접적인 영향을 미치지 않는다. 박테리아가없는 지역과 박테리아를 모두 포함 현미경 이미지에서 pH가 평균하면 잘못된 결과로 이어집니다. 세균 바이오 매스를 시각화하고 역외 및 세포 내 영역을 구분하기 위해 pH 민감성 염료와 함께 다른 얼룩의 사용은 AB을 제공합니다세포 외 공간의 형광 오염과 거짓 측정 (11)의 위험 아웃.
본 원고 따라서 이중 기능에 대해 비율 염료의 사용을 설명한다; pH를 마커로하고 보편적 인 박테리아 얼룩 등 모두. 염료 균체 농축 업 바와 같이, 공 초점 현미경 영상의 조합 정확한 디지털 영상 분석 방법은 얇은 치과 생물막 4.5 내지 7.0 범위 내에서 세포 외 pH를 판정 할 수 있습니다.
프로토콜
실험 프로토콜을 검토하고 아후 스 카운티의 윤리위원회 (M-20100032)에 의해 승인되었다.
비례 염료의 1. 공 초점 현미경 교정
- 이미지 수집을 위해, 배양기를 갖춘 반전 공 초점 현미경, 63X / 1.2 수치 조리개 침수 목표, 543 nm의 레이저 라인 및 META 검출기를 사용합니다.
- HEPES이 스톡 용액 (pH가 0.1 단위 씩 pH를 4.5-8.5로 조정 한 50 밀리미터) 버퍼를 준비한다. 형광 현미경 클리어 바닥 96 웰 플레이트에 각 용액 100 ㎕를 피펫.
- 비율 계량 염료 C-SNARF-4를 처리 할 때 니트릴 장갑을 착용 할 것. 디메틸 설폭 시드의 염료 1 mM의 스톡 용액을 제조 하였다. 잘 HEPES 버퍼와 각 원액의 5 μl를 추가합니다. 현미경의 96 웰 플레이트를 놓습니다.
- 현미경을 켭니다. 현미경 소프트웨어를 엽니 다. 다음 패널을 클릭 → 레이저 획득; → M 획득icro; → 구성 획득; → 스캔 획득; → 무대를 획득. 37 ° C에 인큐베이터를 따뜻하게.
- "레이저 제어"창에서 543 nm의 레이저 버튼을 "On"으로 클릭하여 543 nm의 레이저 라인을 켭니다. "현미경 제어"창에서 63X / 1.2 수치 조리개 침수 목표를 선택합니다.
- 동시에 576-에 608 나노 미터 (녹색) 및 629- nm의 661에 (적색) 간격 ( "구성 관리"→ "CHS") 내에서 형광을 모니터링하는 META 검출기를 설정합니다. 레이저 파워 ( "구성 관리"→ "여진")을 조정합니다. ( "핀홀"→ "스캔 제어") 1.6 μm의의 광학 슬라이스 두께를 산출하기 핀홀을 설정합니다.
- 5 ㎛의 96- 웰 플레이트의 바닥 위에 유리 각 HEPES 완충액의 화상을 취득. 참고 : 초점면이 유리 바닥 아래에 위치해 즉시로, 더 형광 빛은 볼 수 없습니다화면. 모든 세 번째 이미지 후, 제로 및 배경 공제 이미지를 취할 수있는 레이저 파워를 설정합니다.
- 세중의 교정 실험 (1.2-1.7)을 수행합니다.
- 모든 빨간색과 녹색 이미지의 평균 형광 강도와 표준 편차를 결정합니다.
- 수학 식에 따라 각각의 이미지에 대해, 비 R 및 평균의 표준 오차를 계산 R S (1) 및 (2)
(1)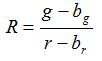
(2)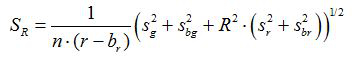
G, R, S g과의 r은 각각 녹색과 빨간색 이미지의 평균 및 표준 편차. ㄴ G, B의 r은 BG와의 BR은 배경 이미지에 해당하는 값은 N. 아르 s의입니다 2 군데 픽셀의 수입니다. - (SigmaPlot 소프트웨어 (13)를 사용하는 예) 도면에서 세 개의 복제 검정 실험에서 각 pH 값에 대해 계산 된 비율을 플롯 및 데이터 포인트의이 일련의 피팅 곡선을 구성. pH 값 (10)에 비율을 변환 할 수 있습니다 장착 곡선에서 수학적 기능을합니다.
- 수학 식에 따라 각각의 이미지에 대해, 비 R 및 평균의 표준 오차를 계산 R S (1) 및 (2)
제자리에서 재배 치과 바이오 필름 샘플 2. 컬렉션
- 연구를위한 관련 포함 및 제외 기준을 충족 자원 봉사자를 선택합니다. 자신의 상부 및 하부 치과 아치 알지네이트 인상을합니다. 이러한 노출의 캐스트 모델을 확인하고 아래턱에 아크릴 부목을 생산하고 있습니다. 자원 봉사가 정상 교합 (12)에 물린 할 수있는 언어 교정 와이어로 연결 구강 아크릴 플랜지와 부목을 디자인합니다.
- 아크릴 부목의 구강 플랜지에 드릴 경기 침체 (그림 1 ) 치과 아크릴 버의 도움으로는 바이오 필름 컬렉션 유리 석판의 삽입을 허용합니다. 침체의 폭과 길이가 삽입되는 유리 슬라브의 수에 따라 달라질 수 있지만 침체의 깊이가 1.5 mm 이상이어야한다.
- 바이오 필름 수집을 위해 천연 에나멜 (11)의 식민지 패턴을 모방하기 위해 그릿 1200의 표면 거칠기와 맞춤 비 형광 유리 슬라브 (4 × 4 × 1mm 3)를 사용합니다.
- 설치하기 전에 고온 가압 멸균하여 유리 슬라브를 소독. 뺨 (11)의 이동에 의해 가해지는 전단력에서 바이오 필름을 보호하기 위해 약간 아크릴면의 표면에 오목 양쪽의 협측 플랜지의 오목 끈적 왁스 유리 슬라브를 탑재.
주 : 경기 침체에 배치 유리 석판의 수는 연구의 목적에 따라, 3, (14) 사이에 다를 수 있습니다. - 자원 봉사의 입에 기기를 삽입합니다. volun 지시봉사자는 실험 기간 동안 내 구두 제품을 유지한다. 젖은 종이 조직의 조각으로 교정 리테이너 용기에 제품을 저장하기 위해 자원 봉사를 지시 치아 칫솔질과 음식과 물 이외의 음료를 섭취하는 동안 실온에서 (습기를 유지하기 위해). 배치 및 장비를 제거하는 동안 유리 슬라브와 구강 아크릴 플랜지를 만지지하기 위해 자원 봉사를 지시한다.
참고 : 실험 기간은 연구 (몇 주 한 일)의 목표에 따라 달라질 수 있습니다. - 조심스럽게 실험 기간이 끝나면 기기에서 유리 슬라브를 제거합니다. 칼로 석판 주위의 끈적 끈적한 왁스를 제거하고 현미경 분석까지, 밀폐 용기, 위로 향하게 생물막에 핀셋으로 그들을 전송합니다. 젖은 종이 티슈로 습기가 용기를 보관하십시오. 생물막 수집 한 후 몇 시간 이내의 pH 이미징을 수행합니다.
3. 바이오 필름의 pH 영상
- 준비드 종 외. (13)의 방법에 따라 수집 한 타액에 디티 오 트레이 톨을 첨가하여 용액을 침. pH가 7.0 타액 솔루션을 적정 0.4 % (중량 / 부피)의 농도로 포도당을 추가 할 수 있습니다. 생물막 당 피펫 100 μL는 현미경 유리 바닥 96 웰 플레이트로 분석된다. 물론 당 비율 계량 염료의 5 μl를 추가합니다.
- 현미경 무대에서 96 웰 플레이트를 놓습니다. 현미경과 543 nm의 레이저 라인을 켭니다. 37 ° C에 인큐베이터를 따뜻하게. 염료의 보정과 같은 현미경 설정을 사용하여 (단계 1.5-1.6 참조). 96 웰 플레이트가 작동 온도에 도달 할 때까지 30 분 동안 기다립니다.
- 아래로 향하게 생물막과 함께 잘 당 하나의 슬래브를 핀셋의 슬림 한 세트로 하나 이상의 유리 석판을 들고 침 가득한 우물에 배치합니다.
- 하나의 이미지 ( "스캔 제어"→ "싱글") 또는 z-스택을 취득 ( "스캔 제어"→ "시작") spanni상이한 영역에서 생물막의 깊이 겨. Z-스택 조각의 수 ( "스캔 제어"→ "Z 설정"→ "민 조각을") 몇 군데를 선택 취득하고 ( "스캔 제어를 상기 제 1 및 현미경 소프트웨어의 마지막 조각의 Z-위치를 표시하려면 "→"Z 설정 "→"마크 먼저 ";"마크 마지막 ").
참고 : Z-스택을 최대 75 μm의이 세포와 세포 내 영역 사이 좋은 대조로 획득 할 수의 깊이. - ( "스캔 제어"→ "를 현미경 소프트웨어 ("스테이지 초점 제어 "→"마크 순위 ")의 XY 위치를 표시, 시간이 지남에 따라보기의 현미경 분야의 pH 변화를 따라 연속적인 시점에서 반복되는 이미지를 촬영하려면 단일"). 정기적 배경 차감 0으로 설정된 레이저 파워 이미지를 가지고.
4. 디지털 이미지 분석
- 박람회에RT TIF 파일로 현미경 이미지는 현미경 소프트웨어 ( "매크로"→ "파일 일괄 수출")의 파일 일괄 수출을 사용합니다. ( "시작 일괄 내보내기") 파일을 내보낼 수 표시 및 TIF-파일을 별도의 폴더에 빨간색과 녹색 채널 이미지를 저장합니다. 그들에게 일련 번호를주는 두 폴더에있는 파일의 이름을 바꿉니다.
- 이러한 daime (미생물 생태에 디지털 이미지 분석) (14)와 같은 소프트웨어에 빨간색과 녹색 이미지 시리즈를 가져옵니다. 세그먼트 개별적으로 선택 밝기 임계 값 (세그먼트 → 자동 분할 → 사용자 정의 임계 값)와 녹색 채널 이미지. 모든 박테리아 (외 매트릭스보다 밝은) 아니라 매트릭스 중에 분할 오브젝트로 인식되도록, 치료 (통상적으로 20 내지 80)와, 휘도 임계 값을 선택한다. 객체로 인식 영역이 세균 바이오 매스에 잘 대응 시각적으로 확인합니다.
- 분할 g의 목적 층을 이동해당 빨강 채널 이미지를 재 N 채널 이미지 (세그먼트 → 전송 개체 층). 빨간색과 녹색 채널 이미지의 모든 개체를 거부하고 삭제할 개체 편집기 기능을 사용하십시오. 이제 세포 외 기질이 생물막 이미지에 남아 있습니다. TIF 파일로 처리 된 이미지 시리즈를 보냅니다.
- (; v.1.47 http://rsb.info.nih.gov/ij) ImageJ에로 이미지 시리즈를 가져옵니다. (히스토그램 → 분석) 레이저로 촬영 한 배경 이미지의 평균 형광 강도가 꺼져 결정합니다. (수학 → 빼기 → 프로세스) 적절한 빨간색과 녹색 이미지에서 배경을 뺍니다.
- 아직도 ImageJ에에, 그 자체 (공정 → 이미지 계산기)에 의해 녹색 이미지 시리즈 (G1)를 나눕니다. 그리고 녹색 이미지 시리즈 (G1)과 결과 이미지 시리즈 (G2)를 곱합니다. 이 NaN이이 daime의 개체로 인식 된 영역에 속하는 모든 픽셀에 할당 된 이미지 시리즈 (G3)을 얻을 것입니다. t에서 진행그는 빨간색 이미지 시리즈와 동일한 방법으로 (R1 / R1 = R2, R2 X R1 = R3).
참고 : 세균 바이오 매스 단계 4.3 이미지에서 제거 된 바와 같이, 형광 강도가이 분야에서 0입니다. 단계 4.5 단계 4.6의 비율의 계산을 가능하게하는 NaN 값을 0으로 변환하는 것이 필요하다. - 검출기의 잡음을 보상하기 위해 :, '평균'필터 (1 픽셀 반경 평균 → 과정 → 필터)를 적용합니다. 빨간색 이미지 시리즈 (공정 → 이미지 계산기)에 의해 녹색 이미지 시리즈를 나눈다. 이 이미지의 세포 외 공간의 모든 나머지 픽셀 그린 / 레드 비율로 발생합니다. 이미지의 비율의 그래픽 표현 (이미지 → 조회 테이블)에 대해 false 색상을 사용합니다. 각 이미지에 대한 평균 비율을 계산 (히스토그램 → 분석).
- 1.9.2 아래에 장착 된 기능)에 따라 pH 값에 그린 / 레드 비율을 변환합니다. 주 : 교정 데이터와 끼워 곡선 예 Schlafer 등등에서 알 수있는알 2015 년 11.
결과
제시된 방법은 모니터링 세포 외 pH를 실시간으로 4.5-7 pH 범위 치과 생물막 상이한 미세 환경에서 상품 수있다. 전술 한 바와 같이 실험 조건을 선택하는 경우, pH는 곧 포도당에 노출 된 후 생물막의 모든 영역에서 삭제하기 시작한다.
바이오 필름의 pH가 떨어지면 비율 계량 염료 세포 (그림 2A)에 upconcentrated 한, 세...
토론
전극 또는 미세 측정 4-6에 비해 생물막의 pH 현미경 모니터링은 몇 가지 장점을 제공한다. 현미경 기술은 높은 공간 분해능으로 pH를 확인하고 기계적으로 바이오 필름을 방해하지 않고 생물막에서 수평 및 수직 모두의 pH 구배를 캡처 할 수 있도록 허용합니다. 미세한 pH 검사의 이전 시도는, 그러나, 바이오 필름 1,7,9에서 세포와 세포 내 pH를 구별하지 못했습니다. 때문에 세균...
공개
저자는 공개 아무것도 없어.
감사의 말
저자는 유익한 토론 하비에르 E. 가르시아와 기술 지원 레네 키에르 및 Merete K. Raarup에게 감사의 말씀을 전합니다. 이 작품은 오르후스 대학 연구 재단에 의해 자금을 지원하고, 사이먼 재단 스파이.
자료
| Name | Company | Catalog Number | Comments |
| Zeiss LSM 510 META | Zeiss | N/A | |
| C-Apochromat 63X water immersion objective | Zeiss | N/A | |
| XL Incubator | PeCON | N/A | |
| SNARF-4F 5-(and-6)-Carboxylic Acid | Life Technologies | S23920 | |
| Dimethyl sulfoxide | Life Technologies | D12345 | |
| HEPES | Life Technologies | 11344-041 | |
| Costar 96-well black clear-bottom plate | Fisher Scientific | 07-200-567 | |
| Custom-made glass slabs (4 x 4 x 1 mm3; 1,200 grit) | Menzel | N/A | |
| Alginate impression material | GC Corporation | N/A | |
| Acrylic Adjusting Logic Sets/set of acrylic dental burs | Axis Dental | LS-906 | |
| Orthodontic retainer containers | Spark Medical Equipment Co., Ltd | SK-WDTC01 | |
| Sticky wax | Dentsply | N/A | |
| Chewing paraffin wax | Ivoclar Vivadent AG | N/A | |
| Dithiothreitol | Sigma Aldrich | D0632 | Used during preparation of salivary solution |
| 0.45 µm and 0.2 µm syringe filters | Sigma Aldrich | CLS431220; CLS431219 | |
| daime | University of Vienna, Austria | http://dome.csb.univie.ac.at/daime | |
| ImageJ | NIH, Bethesda, Maryland, USA | http://imagej.nih.gov/ij/ |
참고문헌
- Hunter, R. C., Beveridge, T. J. Application of a pH-sensitive fluoroprobe (C-SNARF-4) for pH microenvironment analysis in Pseudomonas aeruginosa biofilms. Appl. Environ. Microbiol. 71 (5), 2501-2510 (2005).
- Takahashi, N., Nyvad, B. Caries ecology revisited: microbial dynamics and the caries process. Caries Res. 42 (6), 409-418 (2008).
- Schlafer, S., et al. pH landscapes in a novel five-species model of early dental biofilm. PLoS. One. 6 (9), e25299 (2011).
- von Ohle, O. C., et al. Real-time microsensor measurement of local metabolic activities in ex vivo dental biofilms exposed to sucrose and treated with chlorhexidine. Appl. Environ. Microbiol. 76 (7), 2326-2334 (2010).
- Revsbech, N. P. Analysis of microbial communities with electrochemical microsensors and microscale biosensors. Methods Enzymol. 397, 147-166 (2005).
- Vanhoudt, P., Lewandowski, Z., Little, B. Iridium oxide pH microelectrode. Biotechnol. Bioeng. 40 (5), 601-608 (1992).
- Franks, A. E., et al. Novel strategy for three-dimensional real-time imaging of microbial fuel cell communities: monitoring the inhibitory effects of proton accumulation within the anode biofilm. Energy & Environmental Science. 2 (1), 113-119 (2009).
- Hidalgo, G., et al. Functional tomographic fluorescence imaging of pH microenvironments in microbial biofilms by use of silica nanoparticle sensors. Appl. Environ. Microbiol. 75 (23), 7426-7435 (2009).
- Vroom, J. M., et al. Depth penetration and detection of pH gradients in biofilms by two-photon excitation microscopy. Appl. Environ. Microbiol. 65 (8), 3502-3511 (1999).
- Bender, G. R., Sutton, S. V., Marquis, R. E. Acid tolerance, proton permeabilities, and membrane ATPases of oral streptococci. Infect. Immun. 53 (2), 331-338 (1986).
- Schlafer, S., et al. Ratiometric imaging of extracellular pH in bacterial biofilms using C-SNARF-4. Appl. Environ. Microbiol. 81 (4), 1267-1273 (2015).
- Dige, I., Nilsson, H., Kilian, M., Nyvad, B. In situ identification of streptococci and other bacteria in initial dental biofilm by confocal laser scanning microscopy and fluorescence in situ hybridization. Eur. J Oral Sci. 115 (6), 459-467 (2007).
- de Jong, M. H., van der Hoeven, J. S., van OS, J. H., Olijve, J. H. Growth of oral Streptococcus species and Actinomyces viscosus in human saliva. Appl. Environ. Microbiol. 47 (5), 901-904 (1984).
- Daims, H., Lucker, S., Wagner, M. daime, a novel image analysis program for microbial ecology and biofilm research. Environ. Microbiol. 8 (2), 200-213 (2006).
- Liu, Y. L., Nascimento, M., Burne, R. A. Progress toward understanding the contribution of alkali generation in dental biofilms to inhibition of dental caries. Int. J Oral Sci. 4 (3), 135-140 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유