Method Article
호흡기 유체의 Equid 헤르페스 바이러스-2 진단에 대한 정량적 PCR 방법의 개발 및 검증
요약
Here, we present a protocol for the development and validation of a quantitative PCR method used for the detection and quantification of EHV-2 DNA in equine respiratory fluids. The EHV-2 qRT-PCR validation protocol involves a three-part procedure: development, characterization of qRT-PCR assay alone, and characterization of the whole analytical method.
초록
The protocol describes a quantitative RT-PCR method for the detection and quantification of EHV-2 in equine respiratory fluids according to the NF U47-600 norm. After the development and first validation step, two distinct characterization steps were performed according to the AFNOR norm: (a) characterization of the qRT-PCR assay alone and (b) characterization of the whole analytical method. The validation of the whole analytical method included the portrayal of all steps between the extraction of nucleic acids and the final PCR analysis.
Validation of the whole method is very important for virus detection by qRT-PCR in order to get an accurate determination of the viral genome load. Since the extraction step is the primary source of loss of biological material, it may be considered the main source of error of quantification between one protocol and another. For this reason, the AFNOR norm NF-U-47-600 recommends including the range of plasmid dilution before the extraction step. In addition, the limits of quantification depend on the source from which the virus is extracted. Viral genome load results, which are expressed in international units (IU), are easier to use in order to compare results between different laboratories.
This new method of characterization of qRT-PCR should facilitate the harmonization of data presentation and interpretation between laboratories.
서문
Equid 헤르페스 바이러스-2 (EHV-2)와 같은 콧물, 인두염 및 부어 림프절 1-3으로 잠재적 인 임상 증상과 함께 호흡 증후군에 참여하고있다. 이 바이러스는 또한 말 산업 2에 대한 중요하고 부정적인 경제적 영향이 발생할 수 있습니다 말의 가난한 성능과 관련된 것으로 의심된다.
지금까지 감마 EHV 대한 금 표준 (γ-EHV) 검출은 세포 배양 방법이었다. 이 절차의 첫 번째 불편 EHV-2와 다른 사이의 차별이없는했다 γ-EHV의 (예를 들어, EHV-5). 두 번째 불편 4,5 명단 12 28 일에서 소요되는 세포 변성 과정의 느린 개발했다.
검증 정규화 정량적 실시간 중합 효소 연쇄 반응의 개발 (QRT-PCR)이 방법은 빠르게 EHV-2 EHV- 구별하는 바이러스를 검출하는 데 도움이 될 것(5) 바이러스 게놈로드 및 정량 비율로 질환 덕분 사이의 관계를 연구.
중합 효소 연쇄 반응 (PCR)을 멀리 스가 (6)에 의해 1986 년에 처음으로 기재된 생물학적 진단 (사람, 환경, 수의학) 분야의 대부분의 새로운 금 표준이 되려고 하였다. 특이도, 민감도 및 신속성 : 병원체의 게놈의 일부의 증폭에 기초하여이 방법은 많은 장점을 제공한다. 또한, 앰플 리콘의 오염의 위험이 QRT-PCR의 출현 및 품질 보증 7 때문에 물러. 그럼에도 불구하고, 새로운 금 표준 PCR 법 등의 인식은 개선 된 성능 데이터뿐만 아니라, 시간 경과에 따른 성능 저하없이 전체 방법의 개발 및 검증 단계의 제어의 데모 이상 필요로.
검출에 사용되는 제 분자 도구는 EHV-2 시간 C 있었다중첩 PCR과 onsuming과 관련 비특이적 증폭 서열 8로 하였다. 헤르페스 바이러스의 표적 유전자는 디옥시리보 핵산 (DNA) 중합 효소와 DNA 포장 (9)이었다. 그러나,이 중첩 PCR 증폭에 의한 오염의 위험을 제공한다. 그 후, 통상의 PCR 시험은 최근 실시간 PCR 특성 EHV-2 (10)의 정량화에 대해 기재되었다. 2009 년 2에서 검토 인터루킨 10와 같은 유전자 또는 당 단백질 B 유전자를 증폭하도록 설계되지만 데이터를 사용할 수 없었다되었습니다 추출 공정을 포함한 전체에있어서의 유효성에 관한.
이 프로토콜에서 개발 및 검증 절차, 협회 프랑세즈 드 정상화에 따라 말의 호흡 유체의 EHV-2 DNA의 검출과 정량 정량적 PCR 방법에 대해 (AFNOR) 표준 NF U47-600 3,11,12 설명되어 있습니다 프랑스 대표의은이다국제 표준화위원회. 이 표준은 NF EN ISO / CEI 17025 2005 년 13 및 OIE (동물 건강을위한 세계기구)에 따르면, (11, 12)은 "동물 건강 분석 방법 수의학 PCR의 구현, 개발 및 검증을위한 요구 사항 및 권장 사항"의 자세한 사항 . QRT-PCR 분석의 (a)의 개발, (b) 형 QRT-PCR 분석의 특성 전체의 (c)의 특성 : 권장 2010 14 EHV-2 QRT-PCR 검증 프로토콜은 세 부분으로 된 절차를 포함 (PCR 분석으로 생물학적 시료로부터 핵산을 추출)에서 분석 방법.
검출 (LOD)의 한계 및 정량 한계 (LOQ) 다음 QRT-PCR 분석의 전체 분석 방법의 특성은이 한계의 정의를 포함한다. LOD의 95 %는 PCR 모든 CA의 95 %에서 발견 될 수 단위 부피당 핵산 사본의 최저 수를 나타낸다에스. 정량 한계는 95 % PCR 고려 불확실성을 가지고 판단 할 수 핵산 사본의 최저 량을 나타낸다.
이 QRT-PCR 방법은 정확한 탐지 및 호흡기 유체의 EHV-2의 신속한 정량화 할 수 있습니다. 또한, 상기 방법은 다른 새로운 QRT-PCR 분석법의 개발을위한 표준화 된 절차와 같은 일반적인 템플릿을 위해 다른 실험실에서 적용될 수있다.
프로토콜
참고 : 그림 1에 예시하는 여러가지 단계를 참조하십시오.
1. 핵산 추출
참고 핵산과기도 오염을 제한하는 흄 후드 추출을 수행한다. 시약 중 어느 것도 원하지 않는 DNA로 오염되지 않도록하기 위해 DEPC 처리 된 물을 추출 음성 대조군을 포함합니다.
- 이전에 설명 프로토콜 (15)와 제조 업체의 프로토콜에 따라 생물학적 시료로부터 핵산을 추출합니다.
- 분해 용액 (AVL 버퍼) 560 μL를 생물학적 시료 140 ㎕를 추가하고 실온에서 10 분 동안 배양한다. 에탄올 560 μl를 추가합니다. 실리카 칼럼과 원심 분리기에이 솔루션 (샘플 + 용해 액 + 에탄올)의 첫 번째 630 μl를 적용합니다.
- 같은 실리카 컬럼 및 원심 분리기에이 솔루션의 나머지 630 μl를 적용합니다. 500 μL와 열을 씻어2 개의 다른 세척 버퍼 (AW1 및 AW2)의.
- 용출 완충액 (AVE 버퍼) 50 μL로 핵산을 용출하고, 실온으로 평형화. 마개를 닫고 1 분 동안 실온에서 배양한다. 1 분 동안 6,000g에서 원심 분리기.
2. 증폭 절차
- 각 반응에 대한 반응 혼합물의 22.5 μl를 준비합니다. PCR 마스터 믹스, X μl를 20 μM 정방향 프라이머의, X μl를 20 μM 역방향 프라이머, 22.5 μl를 도달하기 위해 필요한 초순수 ㎕를 10 μM 프로브 및 z의 Y μL의 12.5 μl를 추가합니다 (X는 Y 및 Z 볼륨을 얻을 수있다 적정 후, 섹션 3.2.3과 3.2.6)를 참조하십시오.
- 분취 웰 96- 웰 플레이트의 각 반응에 대한 적절한 반응 혼합물 22.5 μL.
참고 : 추출에 대한 부정적인 컨트롤을 포함하고 PCR의 시약의 누구도 원하지 않는 DNA로 오염되지 않습니다 보장하기 위해. - 샘플의 2.5 μL, 추출 negativ의 2.5 μl를 추가전자 제어, PCR 음성 대조군의 2.5 μl를 잘 대응하는 반응에 긍정적 인 샘플 (참조 변형 또는 플라스미드)의 2.5 μL. 배포 후, 접착제 플레이트 씰 플레이트를 커버한다. 6,000g에서 10 초 동안 접시를 원심 분리기.
- 실시간 PCR 시스템의 플레이트를 놓습니다. 분석 레이아웃 템플릿을 선택하고 실행을 시작합니다. 95 ° C에서 15 초 45주기 다음 95 ° C에서 10 분, 60 ° C (표 1)에서 1 분 다음 PCR 프로그램 설정을 사용합니다.
- 스프레드 시트 실시간 PCR 시스템에서 원시 데이터를 전송. 기준선 위의 증폭 플롯 임계 값을 설정하고, 지수 성장 영역 내에서 각각의 샘플에 대한 임계주기를 얻었다. 선형성을 얻기위한 표준 곡선으로 설정된 각 점 표준 플롯. 표준 곡선에 기초하여, 상이한 샘플 카피 수를 계산한다.
정량적 RT-PCR 3. 개발
주 : QRT-PCR 시험의 개발 기준 균주 특정 적정 플라스미드와 상이한 제어가 필요하며, 프라이머 및 프로브의 적정을 수반한다.
- 예비 시험
- 이전의 추천 (16)에 따라 특정 소프트웨어와 디자인 프라이머 및 프로브.
- 섹션 1과 참조 균주의 압축을 풉니 다.
- 프라이머를 최종 농도 900 nM의 프로브의 최종 농도는 250nm로 (2)에 기재된 바와 같이 증폭한다. 2.5 절에 설명 된 신호를 분석한다.
- 프로브없이 (3.1.3 절에서 설명한 바와 같이) 동시에, 기준 균주 DNA의 증폭을 수행한다. 상거 법 (17, 18)에 의해 얻어진 증폭 시퀀스. 염기 BLAST (19)을 실행하여 서열을 분석 할 수 있습니다.
- 프라이머 및 프로브의 적정
- 프로브 250 nM의 최종 농도가 다른 최종 CONCENTR로 3 가지 믹스를 준비순방향의 관리 포인트 및 포지티브 샘플과 대조군의 3 회 반복 역방향 프라이머 (50 ㎚ / 50 nM 내지 300 ㎚ / 300 nM 내지 900 ㎚ / 900 ㎚). 각 믹스 (900 nM의 최종 농도를 얻기 위해 300 nM의 최종 농도 4.5 μl를 얻기 위해, 50 nM의 최종 농도를 얻기 위해 0.25 μL 1.5 μL)를 20 μM 정방향 프라이머 같은 적절한 부피 및 20 μM 역방향 프라이머를 추가 , PCR 마스터 믹스를 50 ㎕의 필요에 따라 10 μM 프로브와 초순수 2.5 μl를 90 μl를 달성한다.
- 제 2 항에 기재된 증폭 절차를 수행한다.
- 증폭의 최고 수준을 얻기 위해 가장 좋은 조건을 선택, 빠른 사이클 임계 값 (CT)과 3 조건 사이의 최적의 반복. 최고 농도와 앞으로의 μL 해당 볼륨 X를 결정하고 프라이머를 역방향.
- 4 샘플 5 가지 믹스 (포지티브 샘플 3 회 반복하고, 음성 대조군)를 준비프로브의 5 가지 최종 농도 (50 nM의, 100 nm의, 150 nm의, 200 nm의, 250 nm의)와 함께. 각 조합의 경우를 얻기 위해 0.5 μL, (섹션 3.2.3에서, 이전에 결정된) 20 μM 정방향 프라이머와 X ㎕를 20 μM 역방향 프라이머의 μL PCR 마스터 믹스 50 μL, 10 μM 프로브의 적절한 볼륨을 (추가 x 90 μl를 달성하기 위해 필요한 50 nM의 농도, 1 μL가 250 nM의 농도) 및 초순수를 얻기 위하여, 150 nM의 농도를 얻기 위하여, 200 nM의 농도를 얻기 위해 2 μL 2.5 μl를 1.5 μL을 100 nM의 농도를 얻었다.
- 제 2 항에 기재된 증폭 절차를 수행한다.
- 증폭의 최고 수준을 얻기 위해 가장 좋은 조건을 선택, 빠른 사이클 임계 값 (CT)과 5 조건 사이의 최적의 반복. 최고 농도와 프로브에 해당하는 볼륨 y를 μl를 결정합니다.
양이 정말이에요 4. 특성1- 시간 PCR (QRT-PCR)
주 : 최상의 상태의 발달 단계 및 결정이 사용 후 PCR의 특성화 단계는 특이 검출 한계, 선형성 범위 QRT-PCR의 정량 한계를 포함한다.
- 준비 및 플라스미드의 적정
- PCR을 위해 선택된 DNA 표적 유전자의 관련 단편 함유 상용 플라스미드 예약 (이 프로토콜을 뉴클레오타이드 EHV-2 B 당 단백질 유전자의 2081년부터 2381년까지은 표 1 참조).
합성 DNA와기도 오염의 위험을 제한하기 위해 개발 및 검증 절차의 모든 단계에서 별도의 방에서 흄 후드에서 플라스미드의 연속 희석을 수행하고 희석 DNA 작업 :합니다. - 다시 50 ng를 정지 / ㎖에서 원액을 제조 초순수 플라스미드. 간단히 소용돌이와 원심 분리기 플라스미드 주식 솔루션.
참고 : 플라스미드 석재의 실제 농도를 결정플라스미드의 카피 수를 계산하기 위해 다시 현탁 후 CK 용액. - 분광 광도계에 플라스미드의 1 μl를 추가합니다. 230 nm의, 260 nm의 280 nm에서의 광학 밀도 (OD)를 참조하십시오. 분광 광도계 소프트웨어 (OD 260 ㎚)에 대한 DNA 농도를 읽으십시오.
- 아보가드로 수 (N A) 및 수식을 사용하여 플라스미드의 카피 수를 계산한다 :
복사 번호 / μL = (N A [NG에 플라스미드 / μL]) / (플라스미드 길이 기본 쌍 × 109 X 평균 무게) = (6022 × 10 23 X [플라스미드]) / (플라스미드 길이 × 109 X 660)
- PCR을 위해 선택된 DNA 표적 유전자의 관련 단편 함유 상용 플라스미드 예약 (이 프로토콜을 뉴클레오타이드 EHV-2 B 당 단백질 유전자의 2081년부터 2381년까지은 표 1 참조).
- QRT-PCR의 특이성 (포괄 성 및 독점)를 테스트
- PCR을 시스템의 포괄 성을 테스트합니다. 선택 EHV-2 양성 DNA 샘플, 이전 순서에 의해 특징 (긍정적 인 상태를 설립).
- 제 2 항에 기재된 증폭 절차를 수행한다.
- 분석각 샘플에 대한 PCR 데이터로 2.5 절에 설명. 섹션 4.2.1에서 선택한 모든 샘플에 대한 지수 곡선의 존재를 확인하고 PCR의 포괄 성을 확인합니다.
- 이 경우의 표적 유전자 유사성 병원체로부터 DNA를 추출하여 PCR 시스템의 독점 (시험 예 EHV-1, EHV-4, EHV-3, EHV-5 및 전함 헤르페스 -5- 다른 equid 헤르페스는 바와 같이 표 2)이 경우 호스트의 호흡기 질환에 관여하는 다른 병원균 (에, 말 동맥염 바이러스, 말 인플루엔자 바이러스, Coxiella의 burnetii,로도 코커스 동등, 연쇄상 구균 동등 동등, 연쇄상 구균 동등 zooepidemicus, 한 Chlamydophila 보르 투스와 폐렴 간균, ) 표 2를 참조하십시오.
- 제 2 항에 기재된 증폭 절차를 수행한다.
- 섹션 2.5에 기재된 바와 같이 각각의 샘플에 대한 PCR 데이터를 분석한다. 모든 샘플의 선택에 대한 지수 곡선의 부재를 확인섹션 4.2.4은 PCR의 독점을 확인합니다.
- QRT-PCR 검출의 한계
- 6 튜브에 초순수의 90 μl를 분배.
- 저감 구역 (CT 감지 손실)을 대상으로 플라스미드의 6 10 배 연속 희석을 수행합니다. 전송 초순수 90 μL로 희석 튜브에 작동 플라스미드 10 μL. 소용돌이와 원심 분리기 간단히 튜브. 직렬 희석의 마지막 튜브까지 단계를 반복 4.3.2 플라스미드를 받았다.
- 제 2 항에 기재된 플라스미드 6 10 배 희석액의 증폭을 수행한다.
- 저감 영역 결정 : 긍정적 인 신호 검출이없는 최초의 희석을 제시 플라스미드의 마지막 희석 사이의 영역 (그림 2 참조).
- 6 두 배 연속 희석을 시작하려면 긍정적 인 신호를 (섹션 4.3.4 참조) 제공 플라스미드의 마지막 희석을 선택합니다.
참고 : 3 독립적 인 트라이를 수행ALS는 QRT-PCR (LOD는 95 % PCR)의 검출 한계를 결정 - (6) 튜브에 초순수 25 μL 분주.
- 플라스미드의 6 두 배 연속 희석을 수행합니다. 전송 초순수 25 μL와 튜브 섹션 4.3.5에서 결정된 바와 플라스미드 작업 희석액 25 μL. 소용돌이와 원심 분리기 간단히 튜브. 직렬 희석의 마지막 튜브까지 단계를 반복 4.3.7은 플라스미드를 받았다.
- 절에 설명 된대로 2 반복 6 10 배 각각 8 회 반복 (24 회 반복)로 3 시험판을 얻었다 회 4.3.8 4.3.7하는 단계 플라스미드의 6 개의 배 희석액의 증폭을 수행 플라스미드의 연속 희석.
참고 QRT-PCR 검출 (LOD는 95 % PCR)의 제한의 경우 95 %에서 검출 볼륨 단위로 낮은 DNA 카피 수로서 정의된다. - 플라스미드 집중하고 각 레벨에 대해 24 회 반복에서 긍정적 복제 수를 계산기.
- LOD를 95 % PCR을 결정합니다. LOD를 95 % PCR은 24 복제 중 23 개의 긍정적 인 복제의 검출 결과 수준이다.
- 직선 범위 및 QRT-PCR 정량의 한계
참고 : 범위에 사용 된 가장 낮은 농도가 PCR은 4.3.10 이전에 결정된 LOD 95 %에 해당하는 것을 보장하기 위해 플라스미드의 6 10 배 연속 희석하여 4 독립적 인 시험을 수행합니다.- 6 튜브 초순수의 45 μl를 분배.
- 10 7 LOD 95 % PCR에 해당하는 플라스미드 작업 희석 농도와 6 10 배 연속 희석을 시작합니다.
- 플라스미드의 6 10 배 연속 희석을 수행합니다. 전송 초순수의 45 μL와 튜브에 플라스미드 작업 희석 (섹션 4.4.2에서 결정) 5 μL. 소용돌이와 원심 분리기 간단히 튜브. 직렬 희석의 마지막 튜브까지 단계를 반복 4.4.3 페이지를 받았다lasmid.
- 제 2 항에 기재된 플라스미드 6 10 배 희석액을 증폭.
- 절편 (그림 3)의 기울기와 b에 대한과 선형 회귀 Y = AX + B를 추적합니다.
- 표준 곡선의 기울기 (A)로부터 증폭 효율 (E)을 계산 식을 사용하여 (4.4.5 참조) :
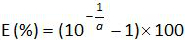 .
.
반복 4.4.1 세 번 4.4.6에 단계를 반복합니다.
주 : 증폭 효율은 각 사이클 이후 PCR 생성물의 증가량을 나타낸다. 이상적인 반응은 100 %에 가까운 효율에 도달한다. 실제로, E (%)은 75 %와 125 % 사이였다. 높은 E가 아닌 특정 제품 또는 일련의 희석에 피펫 오류의 증폭을 표시 할 수 있습니다. 또한 직렬 희석, 가난한 프라이머 디자인 또는 비 최적 반응 조건에서 피펫 오류를 표시 할 수 있습니다 낮은 E. - (표 바이어스를 계산3). 바이어스의 절대 값이 임계 바이어스 값 (0.25 로그 10)보다 작은 각 플라스미드 레벨에 대해 확인한다. 평균 바이어스 각 플라스미드 레벨 (표 3) EHV-2 qPCR에 대한 선형 회귀의 성능을 평가하기 위해 (그림 4)의 선형성 불확실성 (U LINi)를 결정합니다. U LINi 계산 전 수준을 플라스미드 각각에 대해 결정된 선형성 불확실성이다 표준 편차 (SD'i)로부터 바이어스를 의미한다. 공식에 의해 주어진 결합 선형성 불확실성 (U LIN) EHV-2 qPCR에의를 결정합니다 :

(일반 절대 바이어스 0.25 로그 10) 바이어스 수용 실험실에 의해 특정되고, 낮은 값 (로그 10 카피 수 측정 량) 0.5 로그 (10)의 최대 값 사이의 차이에 대응하는 참고. U LIN 값은 다른 실험실에서 qPCR에의 성능을 비교하는 데 도움 수 있습니다. - QRT-PCR (LOQ PCR)의 정량의 한계를 결정 LOQ PCR은 직선 범위 (표 3)에 사용되는 바이어스 0.25 로그 (10)와 가장 낮은 농도이다.
삼라만상 분석 방법 5. 특성 (DNA 추출에서 QRT-PCR 결과에)
참고 : 전체 방법의 특성은 호흡 샘플에서 DNA의 추출에서, 즉 QRT-PCR 데이터를 (취득하기 위해 필요한 모든 단계의 검증이다 (대상의 증폭 및 정량에 섹션 1)을 참조하십시오 (섹션 2 참조 )).
- PCR 반응의 카피 수와 식 생물학적 시료에서 카피 수에 존재하는 사이의 대응 관계를 수립 :
 .
.
그만큼하면 PCR 반응의 플라스미드 카피 수는,
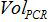 PCR에 추가 된 샘플의 부피가 증폭 동안 혼합하고,
PCR에 추가 된 샘플의 부피가 증폭 동안 혼합하고, 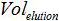 버퍼 AVE의 용적이 핵산을 용출하기 위해 사용되며
버퍼 AVE의 용적이 핵산을 용출하기 위해 사용되며 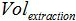 상기 추출 된 샘플의 부피이다.
상기 추출 된 샘플의 부피이다. - 삼라만상 분석 방법의 민감도와 특이도를 테스트
참고 : 알려진 EHV-2 개의 긍정적 인 (또는 네거티브) 샘플은이 절에서 사용된다.- 타겟 (EHV-2) 양성 샘플을 분석하여 QRT-PCR 방법의 "민감도"테스트.
- 선택 EHV-2 양성 DNA 샘플, 이전에 특징 (긍정적 인 상태).
- 제 2 항에 기재된 증폭 절차를 수행 부 (1)에 기재된 핵산을 추출한다.
- 실제 긍정의 수 (양의 샘플을 결정이 RT-PCR) 및 위음성의 수 (알려진이 RT-PCR과 음 양의 샘플)와 긍정적한다.
- 음의 샘플을 분석하여 QRT-PCR 방법의 "특이성"테스트
- 선택 EHV-2 부정적인 DNA 샘플 (음의 상태).
- 제 2 항에 기재된 증폭 절차를 수행 부 (1)에 기재된 핵산을 추출한다.
- 실제 네거티브 (이 RT-PCR에 부정적인 것으로 알려진 부정적인 샘플) 및 오탐 (false positive) (이 RT-PCR에 긍정적 알려진 부정적인 샘플)의 수의 수를 결정합니다.
- 다음과 같이 "진단 민감도"(SE)와 "진단 특이도"전체 방법 (SP) (표 4) 계산 : 괜찮다 = 실제의 SP = 수를 실시간 탐지 번호 / (실제 긍정 + 위음성의 수) 실제 부정의 부정은 / (수S + 오탐 (false positive)) () 표 4를 참조하십시오.
- 라이너 및 가드너 관계 12,20의 수식 전체 방법의 민감도 및 특이성에 대한 95 % 신뢰 구간을 계산한다 :
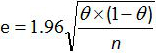
E는 추정 오차이고, θ는 셀레늄 (또는 SP) 및 N 분석 샘플의 수이다.
주의 : 샘플의 수가 적은 경우, 전체 방법의 민감도 및 특이성에 대한 95 % 신뢰 구간을 계산 AFNOR 규범 12에 따른 슈 테이블을 사용한다.
- 타겟 (EHV-2) 양성 샘플을 분석하여 QRT-PCR 방법의 "민감도"테스트.
- 삼라만상 분석 방법의 특성에 대한 부정적인 자원 소재의 제조
주의 : 전체 방법 (LOD 방법 및 LOQ 방법)의 검출 및 정량 한계를 결정 자유로운 것으로 알려진 생물학적 샘플 플라스미드의 공지 농도를 추가하려면대상 (EHV-2이 경우)의. 이들 샘플은, 정량화 된 플라스미드와 함께, LOD 방법 및 LOQ 방법을 결정하는 긍정적 인 기준을 구성한다.- 양의 기준을 구성하는 데 사용되는 생물학적 샘플에서 타겟의 부재 (EHV-2)를 확인한다.
- 다른 알려진 부정적인 생물학적 샘플을 선택합니다.
- 2 절에 설명 된대로 증폭 절차를 수행 부 (1)에 기술 된 바와 같이 생물학적 시료의 압축을 풉니 다.
- 이러한 샘플에서 PCR 신호의 부재에 의한 대상의 부재를 확인합니다.
참고 : 5.4과 5.5 사이의 모든 단계를 같은 음의 자원 소재를 사용합니다.
- 음극 재료 자원 (전체 검증을 위해 필요한 부피) 15 ml의 수득 다른 네가티브 샘플 풀. 100 튜브에 부정적인 자원 소재의 135 μl를 분배. 4 ° C에서 튜브를 유지하거나 장기 저장을 위해 -80 ° C에서.
- 양의 기준을 구성하는 데 사용되는 생물학적 샘플에서 타겟의 부재 (EHV-2)를 확인한다.
- LIMI삼라만상 분석 방법의 검출의 t
- 전체 방법의 저감 영역을 결정합니다.
- 6 튜브 초순수의 45 μl를 분배.
- 플라스미드의 6 10 배 연속 희석을 수행합니다. 트랜스퍼 (섹션 4.3.10에 의해 결정) 초순수 45 μL와 튜브 107 LOD는 95 %에 해당하는 PCR 플라스미드 작업 희석액 5 μL. 소용돌이와 원심 분리기 간단히 튜브. 직렬 희석의 마지막 튜브까지 단계를 반복 5.4.1.2 플라스미드를 받았다.
- (2)를 얻기 위해 부정적인 자원 소재의 135 μL 2 관에 플라스미드의 각 희석에서 전송 5 μL는 6 개의 긍정적 인 표준에 대한 복제합니다. 소용돌이 간단히 원심 분리기.
- 제 2 항에 기재된 증폭 절차를 수행 부 (1)에 기술 된 바와 같이 6 개의 포지티브 표준을 2 회 반복 추출을 수행한다.
- 저감 영역을 결정 : 마지막 진한 사이의 영역을긍정적 인 신호와 아무런 신호를 보여줍니다 처음 농도를주는 플라스미드의 entration.
- 이 방법의 검출 (LOD 방법)의 제한이 독립적 인 시험에 의해 결정
참고 : 전체 방법 (LOD 방법)의 검출 한계를 결정하기 위해 2 독립적 인 시험을 수행합니다.- 4 배 농축 긍정적 인 신호를 준 플라스미드의 마지막 농도 (섹션 5.4.1.5 참조)이다 플라스미드 작업 희석와 6 두 배 연속 희석을 시작합니다.
- (6) 튜브에 초순수 25 μL 분주.
- 플라스미드의 5 두 배 연속 희석을 수행합니다. 전송 초순수 25 μL와 튜브 (섹션 5.4.2.1에서 결정된 바와 같이) 플라스미드 작업 희석액 25 μL. 소용돌이와 원심 분리기 간단히 튜브. 직렬 희석의 마지막 튜브까지 단계를 반복 5.4.2.3 플라스미드를 받았다.
- plasmi의 각 희석에서 전송 5 μL음극 재료 자원의 135 ㎕를 4 개의 튜브 D는 5 포지티브 표준 4 회 반복을 얻었다. 간단히 소용돌이와 튜브를 원심 분리기.
- 제 2 항에 기재된 증폭 절차를 수행 부 (1)에 기재된 바와 같이 5 개의 포지티브 표준 4 회 반복 추출을 수행한다.
- 반복 플라스미드 농도의 각 레벨 8 복제를 얻기 위해 한 번 5.4.2.5에 5.4.2.1 단계를 반복합니다.
- 플라스미드 농도의 각 레벨 8 복제 중 긍정적 인 복제의 수를 계산합니다.
- LOD 방법을 결정합니다. LOD 방법 (섹션 5.4.2.7에 설명 된대로) 8 8 복제 양성의에서 복제되는 마지막 레벨입니다.
- 전체 방법의 저감 영역을 결정합니다.
- 삼라만상 분석 방법의 정량의 직선 범위 및 제한
전체 방법 (LOQ 방법)의 정량 한계를 결정하기 위해 생물학적으로 플라스미드 알려진 농도를 추가합니다알려진 샘플은 대상 (EHV-2이 경우)이 없어야합니다. 이 샘플들은 LOQ 방법을 결정하는 양의 기준을 구성한다.- 6 튜브 초순수의 45 μl를 분배.
- 플라스미드의 6 10 배 연속 희석을 수행합니다. 전송 초순수 45 μL와 튜브 (섹션 5.4.2.8에서 결정된 바와 같이) 107 LOD 방법에 대응 플라스미드 작업 희석액 5 μL. 소용돌이와 원심 분리기 간단히 튜브. 직렬 희석의 마지막 튜브까지 단계를 반복 5.5.2 플라스미드를 받았다.
- 생물 자원 음극 재료 135 μL 2 튜브 플라스미드의 각 희석액 5 μL의 전송은 6 포지티브 기준이 복제를 얻었다. 소용돌이 간단히 원심 분리기.
- 절에 설명 된대로 증폭 절차를 수행 부 (1)에 기술 된 바와 같이 6 개의 포지티브 표준을 2 회 반복 추출을 수행하여 2 반복 단계 5.5.15.5.4 세 번에.
- 평가 및 방법의 정량적 성능을 검증하기 위해 정확도 프로파일을 정의합니다.
- 실험실을위한 전체 방법의 수용 한계를 정의합니다. 이 프로토콜에서, 수용 한계는 LABéO에서 0.75 ±로 로그인 (10)를 정의 프랭크 Duncombe.
- 하나 재판 추적 제 1 선형 회귀 Y = AX + B (A의 기울기와 B는 절편) 코네티컷 값 중 하나를 복제 표준 곡선의 각 추정값에 대응. 이 제 1 선형 리그 레션과,이 제 검량선 사용 코네티컷 값의 복제에 대한 카피 수의 실험적인 값을 계산한다. 코네티컷에 값의 복제와 두번째 단계를 반복 5.5.5.2 제 2 선형 회귀를 수득하고 제 2 기준 곡선 사용 코네티컷 값의 초 복제에 대한 카피 수의 실험적인 값을 계산한다.
- 두 번째와 세 번째 시험과 단계를 반복 5.5.5.2.
- NF U47-600-2 (12)에 따라 각 플라스미드 수준에 대한 정확성, 진위 및 정확성 한계를 계산합니다.
- 모든 기준점 (5.5.5.4)에 대한 정보를 컴파일하고 5.5.5.1에서 이전에 정의 된 수용 한계를 갖는 정확도 프로필과 함께 데이터의 진위를 생성하기 위해 스프레드 시트를 만들고 5.5에서 계산 된 하부 및 상부 정확성 한도 .5.4 (그림 5).
- 정량 한계 방법을 결정 : 5.5.5.5에서 계산 된 직선 범위에서 사용되는이 진위 0.75 로그 (10)와 표준 곡선의 가장 낮은 농도에 해당한다.
- 반복성과 재현성의 평가
주 : 표준 편차의 비율을 측정하고 복제 (변동 계수 CV = 또는 표준 편차의 평균을 사용하여 반복성 및 재현성을 확인 /평균).- 한 애널리스트에 의해 전체 방법의 반복성 평가 :
- (이전에 예를 들어 PCR 시험) 3 별개의 바이러스 게놈로드 3 생물학적 샘플을 선택합니다.
- 제 2 항에 기재된 증폭 절차를 수행 부 (1)에 기재된 바와 같이 3 개의 샘플을 8 회 반복 추출 하였다.
- 평균과 각 샘플 수집 가능한, CT 값의 표준 편차를 계산한다.
- 화학식 CV = 표준 편차를 이용하여 인트라 분석 CV를 계산 / 의미한다.
- 3 분석가에 의해 전체 방법의 재현성을 평가 :
- (이전에 예를 들어 PCR 시험) 3 별개의 바이러스 게놈로드로 3 생물학적 샘플을 선택
- (1 절에 설명 된대로) 5.6.2.1에서 선택한 3 샘플의 2 복제 압축을 풉니 다. 2 독립적 인 분석가 부 (2)를 반복에서 5.6.2.2 단계를 설명한대로 증폭 절차를 수행합니다.
- 평균과 표준 편차를 계산각 샘플 수집 가능한, CT 값.
- 화학식 CV = 표준 편차를 이용하여 간 분석 CV를 계산 / 의미한다.
- 한 애널리스트에 의해 전체 방법의 반복성 평가 :
결과
전술 한 바와 같이 정량적 RT-PCR 방법은, 감지 및 호흡기 체액 equid 헤르페스 -2-을 정량화하기 위해 구현되었다.도 1은 AFNOR 규범 NF에 따른 정량적 RT-PCR 법의 개발 및 검증을위한 개략적 플로 차트를 도시 U47-600. 프라이머 및 프로브의 특이성은 PCR의 단계별 개발 과정에서 확인되었다. 전용 EHV-2 균주는이 시스템에서 증폭 하였다. 이어서, QRT-PCR의 성능을 특징으로 할 수 있었다.
첫째, 6 10 배 연속 희석 저감 영역 (그림 2)를 설정하기 위해 수행 된 LOD PCR을 추정합니다. 이 예에서, 6 10 배 희석액의 LOD PCR을 추정 (26000 0.26 복사 / 2.5 μL 샘플 사이) 10-5 및 10-10 사이에 이루어졌다. 저감 존 리터(2.6 및 0.26 복사 / 2.5 μL 샘플 사이) 10-9 10 -10 희석 사이 이거 야. 이 경우의 LOD PCR 값을 결정하기 위해, 플라스미드를 6 개의 배 희석액이 경감 영역에서 5.2 0.16 복사 / 2.5 μL 샘플 사이에 이루어졌다. LOD PCR 값은 2.6 복사 / 2.5 μL 샘플이었다.
선형성 범위와 LOQ PCR을 결정하기 위해, LOD PCR 값은 2.6 (LOD PCR) 및 26 카피 / 2.5 μL 샘플 사이 6 10 배 희석액의 범위를 시작하는 데 사용 하였다. (3)는 EHV2위한 선형 회귀를 도시한다 한 실험에서 QRT-PCR. 선형 회귀 (도 4)의 성능은 표 3에 기재된 계산하여 4 번씩 검증된다. 계산의 기준에 따라 선형성 범위를 정의하기 위해 수행되는 절대 편차 나 나 브로UE는 플라스미드 부하의 어떤 수준 난을, 10을 기록 ≤0.25. 이 경우, 직선 2.6 내지 26 카피 / 2.5 μL 샘플을 배치 범위. PCR 정량 한계는 선형 범위의 낮은 농도이다 (즉, 260 카피 / 이때 2.5 μL 샘플). U는 LIN 범위 2.6-260,000 복사 / DNA 2.5 μL, 0.12 로그 (10)로 측정되었다.
QRT-PCR (그림 1, 노란색)의 개발 (그림 1, 파란색) 및 특성화 후, AFNOR NF U47-600 규범은 QRT-PCR (그림 1, 오렌지)에 대한 DNA 추출에서 전체 분석 방법의 특성을 권장합니다. (정확도 프로필 표 4에 기재된 바와 같이 진단 민감도와 특이도. 계산 된 전체 QRT-PCR 분석법의 정량 성과를 평가하고, 검증 그림 5).
최첨단 분자 기술을 사용하여이 프로토콜은, 우리가 감지하고 호흡기 질환 및 / 또는 감염의 임상 적 의심과 말에서 얻은 172 비강 면봉 샘플에서 EHV-2 바이러스 게놈로드를 정량화 할 수 있었다. EHV-2 분야 (생물) 샘플에서의 발생률이 인구의 50 % (172분의 86)을했다. 정량적 분석은 EHV-2 바이러스 게놈로드는 젊은 말에서 유의하게 높았다 및 바이러스 게놈로드의 재분할 나이 (그림 6) 감소 것을 보여 주었다. 본 연구에서는 가장 높은 EHV-2 바이러스 게놈로드 (1.9 × 10 (11) 복사 / ml)를 자마에 (그림 6) 검출되었다.
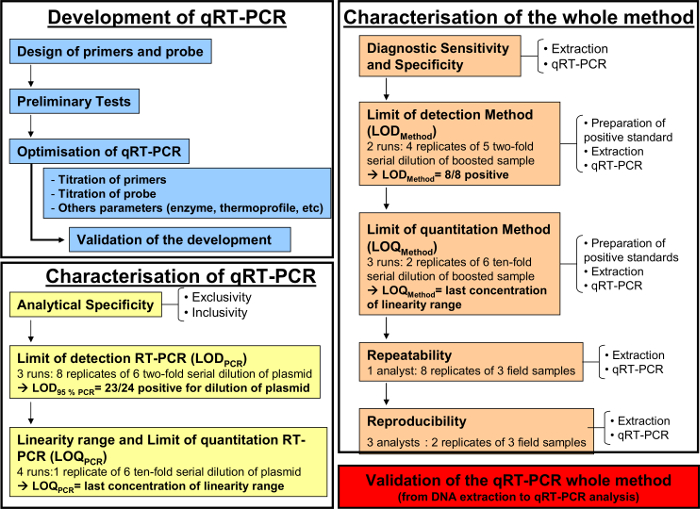
그림 1 : 개발 (파란색)에 대한 워크 플로우 차트, 정량적 RT-PCR의 특성AFNOR 규범 NF U47-600-2에 따라 (노란색)과 QRT-PCR (오렌지)에 대한 DNA 추출에서 전체 분석 방법의 특성. 워크 플로우 차트 개발을위한 여러 단계를 다시 시작, 정량적 RT의 특성 - PCR 및 QRT-PCR로 DNA 추출에서 전체 분석 방법의 특성. 각 단계의 경우, 워크 플로우 차트가 필요한 실행의 수를 나타냅니다, 희석 수행하고 필요한 분석가의 수를 할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
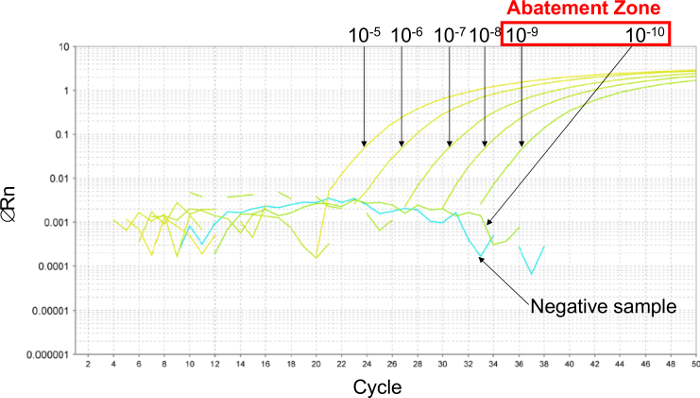
그림 2 : 플라스미드의 6 10 배 연속 희석을 얻을 실시간 PCR 곡선 대표 결과 저감 영역의 결정. 저감 영역을 추정하기 위해, 6 10 배 시리얼희석 10-5 사이 (26,000 복사본 / 2.5 μL 샘플) 및 (10) -10 (0.26 복사 / 2.5 μL 샘플을) 만들어집니다. 저감 영역은 10 -9의 희석 사이 (2.6 복사 / 2.5 μL 샘플) 및 (10) -10 (0.26 복사 / 2.5 μL 샘플)에있다. 이 경우, 플라스미드의 6 두 배 연속 희석은 5.2 및 0.16 복사 / 2.5 μL 샘플 사이의 LOD 95 % PCR을 결정하기 위해이 감소 영역에서 이루어졌다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
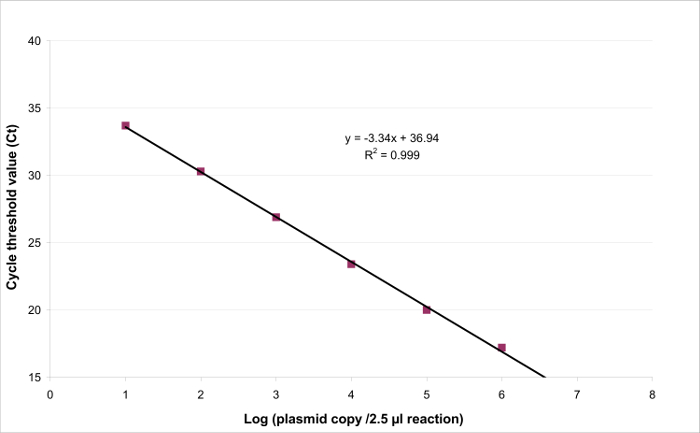
도 3. EHV2 QRT-PCR을위한 선형 회귀 정량 시험의 선형성이 특정 범위 내에 존재하는 타겟 용액의 농도에 비례하는 결과를 생성 할 수있는 능력이다. 이것은 의해 모델링 될 수있다선형 회귀 계기 응답 (사이클 임계 값 또는 코네티컷)와 대상의 양의 로그 사이 (Y = 도끼 + B) (목표 복사 / 2.5 μL 샘플의 수). 여기를 클릭하십시오이 그림의 더 큰 버전을 볼 수 있습니다 .
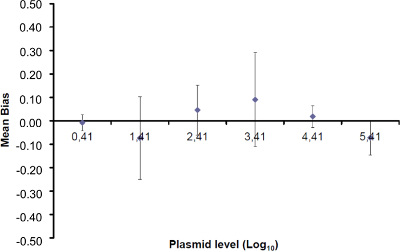
그림 4 :. EHV-2 qPCR에의 선형 회귀의 성능 평균 바이어스 (측정 된 플라스미드 양 사이의 평균 차이를 나타냅니다 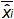 ) 각 플라스미드 수준에 대한 이론적 인 플라스미드 양 (X '내가). 수직 막대는 식에 의한 선형성 불확도 (U LINi)를 나타냅니다
) 각 플라스미드 수준에 대한 이론적 인 플라스미드 양 (X '내가). 수직 막대는 식에 의한 선형성 불확도 (U LINi)를 나타냅니다 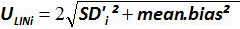
SD'i는 표준 편차 오는 곳 f를 측정 플라스미드 양. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
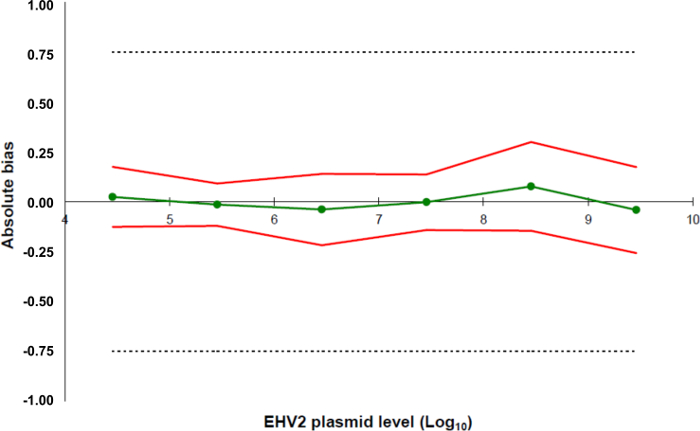
도 5 :. EHV-2 QRT-PCR 방법의 검증 결과에 기초하여 정밀도 정보 녹색 선 (원) 데이터의 진위 (계통 오차 또는 바이어스)를 나타낸다. 수용 한계는 실험실 (점선)에 의해 ± 0.75 로그 (10)에 정의되어 있습니다. 하부 및 상부 정확도 한계 신뢰성 데이터 (레드 라인)의 두 배 표준 편차 ± 평균 바이어스 각 플라스미드 부하 수준을 측정 하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
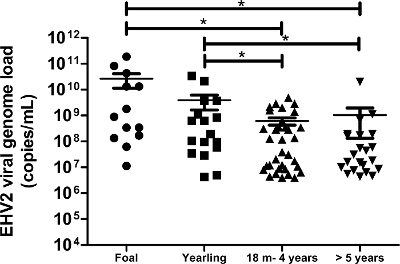
그림 6 :. EHV-2 시대에 따른 바이러스 게놈로드의 정량 EHV-2 비강 면봉 샘플에서 검출의 바이러스 게놈로드 분포는 서로 다른 연령 그룹에 대한 표현된다. 수평 라인은 표준 편차 (m = 개월) 내에서 중간 값을 나타냅니다. * 뉴먼 - Keuls 사후 테스트 (P <0.05)와 ANOVA에 의해 크게 다른. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 표적 유전자 | 프라이머, 프로브 및 plasmide 서열 (5'-3 ') | 염기 위치 | 제품 크기 (뉴클레오티드) | 열 사이클링 조건 | 참조 | |||
| EHV2 GB (HQ247755.1) | 정 : GTGGCCAGCGGGGTGTTC | 2,113에서 2,130 사이 | (78) | 95 ° C 5 분 | (11) | |||
| 역 : CCCCCAAAGGGATTYTTGAA을 | 2,189에서 2,170 사이 | 95 ° C 15 초 | 45주기 | |||||
| 프로브 : FAM-CCCTCTTTGGGAGCATAGTCTCGGGG-MGB | 2,132에서 2,157 사이 | 60 ℃ 1 분 | ||||||
| 플라스미드 : ACCTGGGCACCATAGGCAAGGTGGTGGTCA ATGTGGCCAGCGGGGTGTTCTCCCTCTTTG GGAGCATAGTCTCGGGGGTGATAAGCTTTTT CAAAAATCCCTTTGGGGGCATGCTGCTCATA GTCCTCATCATAGCCGGGGTAGTGGTGGTG TACCTGTTTATGACCAGGTCCAGGAGCATAT ACTCTGCCCCCATTAGAATGCTCTACCCCGG GGTGGAGAGGGCGGCCCAGGAGCCGGGCG CGCACCCGGTGTCAGAAGACCAAATCAGGA ACATCCTGATGGGAATGCACCAATTTCAG | 2081에서 2381 사이 | |||||||
표 1 :.이 프로토콜에 사용되는 프라이머, 프로브 및 긍정적 인 합성 DNA 컨트롤 시퀀스 플라스미드의 순서 (양의 합성 DNA)의 위치를 EHV2gB 시퀀스 (HQ247755.1)의 2081에서 2381 사이 뉴클레오티드에 해당합니다. 이 프로토콜에서 사용되는 프라이머 및 프로브의 설계는 특정 소프트웨어를 이용하여 수득 하였다.
| 병원체 | 참조 (원점) | 균주의 수 | 결과 |
| EHV-2 | |||
| EHV-2 | VR701 (ATCC) | 20 | 양 |
| 20 샘플 (FDL 컬렉션) | |||
| EHV-5 | KD05 (GERC) | (20) | 부정 |
| 20 샘플 (FDL 컬렉션) | |||
| EHV-3 | VR352 (ATCC) | 이 | 부정 |
| T934 WSV (GERC) | |||
| EHV-1 | 켄터키 변형 켄터키 A (ATCC) | 삼 | 부정 |
| 이 샘플 (FDL 컬렉션) | |||
| EHV-4 | VR2230 (ATCC) | 1 | 부정 |
| 나귀 헤르페스 바이러스 AHV5 | FDL 컬렉션 | 1 | 부정 |
| 말인플루엔자 바이러스 | A / 말 / Jouars / / 2006 4 (H3N8) | 1 | 부정 |
| (기탁 번호 JX091752) | |||
| 말 동맥염 바이러스 | VR796 (ATCC) | 이 | 부정 |
| 로도 코커스 동등 | FDL 컬렉션 | 1 | 부정 |
| 연쇄상 구균 동등의 subsp. Zooepidemicus | FDL 컬렉션 | 1 | 부정 |
| 연쇄상 구균 동등의 subsp. 동등 | FDL 컬렉션 | 1 | 부정 |
| Coxiella burnetii의 | ADI-142-100 (Adiagene) | 1 | 부정 |
| 한 Chlamydophila 보르 투스 | ADI-211-50 (Adiagene) | 1 | 부정 |
| 클레 브시 엘라의 PNEUmoniae | FDL 컬렉션 | 1 | 부정 |
표 2 : EHV-2 QRT-PCR의 분석 특이성.
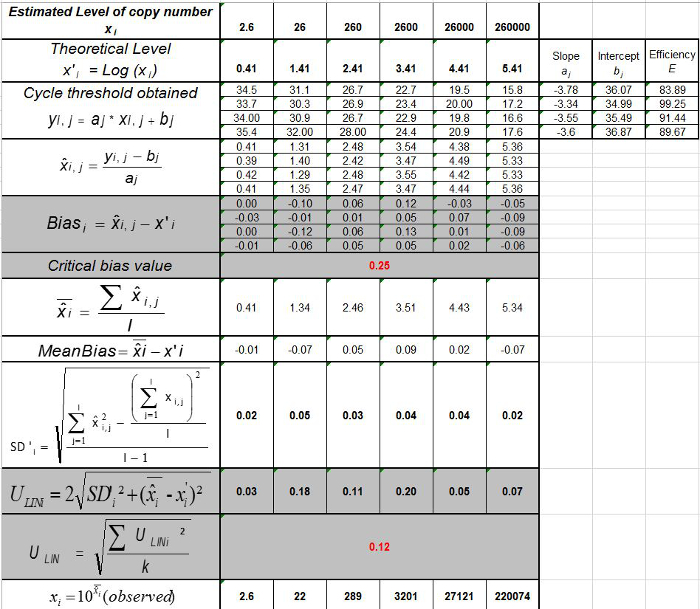
표 3 : (NF U47-600-2 12에서 적응) 바이어스 및 선형성 불확실성의 계산. 각 시험을 위해, 선형 회귀의 성과 (Y = AX는 + b) Y가 얻어지는 사이클 임계 값 테이블을 이용하여 검증 A는 기울기가 얻어진다. X는 플라스미드 레벨이고, B는 절편 나 플라스미드 인 레벨 (I, K는 레벨 1에서 변한다) t에서 K 사용한 플라스미드 레벨의 수이다 (예를 들면, K = 6그의 테이블), j는 (j는 I 시험 1에서 다름) 재판이다는, 나는이 테이블의 예를 들어 I = 4) (3, 6 시험 사이를 포함, 임상 시험의 수 X I는 각각 추정 된 플라스미드 양이다. 나는 수준을 플라스미드. x는 내가 수준을 플라스미드 각각에 대한 전 = 10 로그 (X I) '내가 방정식 X 얻어진 이론적 인 플라스미드 양이다'. 각 J 시험 동안, 사이클 임계 값은 각 I 얻어 플라스미드 레벨은 선형 회귀로 계산된다 y를 난, J는 J의 X I, J + ㄴ J를 =. 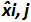 시험 J 동안 측정 된 플라스미드 양이다. 바이어스 전 서브> 측정 된 플라스미드 수량 및 각 시험에 대한 이론적 인 플라스미드 수량과 각 플라스미드 수준 사이에 관찰 된 차이입니다.
시험 J 동안 측정 된 플라스미드 양이다. 바이어스 전 서브> 측정 된 플라스미드 수량 및 각 시험에 대한 이론적 인 플라스미드 수량과 각 플라스미드 수준 사이에 관찰 된 차이입니다. 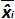 평균 값은
평균 값은 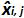 각하여 내가 수준을 플라스미드, SD는 '내가 측정 량의 표준 편차
각하여 내가 수준을 플라스미드, SD는 '내가 측정 량의 표준 편차 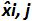 각각의 난에 대한 플라스미드 수준 바이어스 평균은 바이어스 난의 평균이며, U LINi 내가 SD'i 계산 수준을 플라스미드와 편견을 의미 각각에 대해 결정된 선형성 불확실성이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
각각의 난에 대한 플라스미드 수준 바이어스 평균은 바이어스 난의 평균이며, U LINi 내가 SD'i 계산 수준을 플라스미드와 편견을 의미 각각에 대해 결정된 선형성 불확실성이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 4. 전체 진단 방법의 민감도의 계산 (SE)와 특이도 (SP)는 슈 테이블은 confid을 계산 하였다NF U47-600-2에 기재된 전체적인 방법의 민감도 및 특이도는 95 %에서 런스 인터벌.
토론
2000 년대 이래, 실시간 PCR은 실험실 증가 금 표준 기술 (세포 배양 및 세균 배양 방법)을 대체하고있다. 기술의 구현은 비교적 간단합니다. 그러나 실험 방법의 검증은 정확하고 반복 가능하고 신뢰할 수있는 데이터를 확인하기 위해 분자 검출 및 병원균의 정량 필수적이다.
추출 공정은 생체 물질의 손실의 주요 원천이기 때문에, 하나의 프로토콜과 다른 정량의 오차의 메인 소스로 간주 될 수있다. 이와 같이, 주로 문헌에보고 QRT-PCR 동안 DNA 플라스미드의 표준 곡선의 생성은 바이러스 게놈로드를 나타내는하지만 추출 단계를 고려하지 않는다.
AFNOR 규범 NF U47-600-2에서 전체 방법 유효성 검사 프로세스에 대한 드 노보 전략에 대한 설명은이 지역에서 상당한 진전을 나타냅니다. 도시 된 바와 같이EHV-2 마리에서이 논문은, 또는 꿀벌 21에서 다른 사람에 의해,이 개발 단계 전체 방법의 PCR의 특성 및 특성과 검증 단계 사이의 명확한 차별화를 필요로한다. 이 흥미로운 접근 한 제한은 프로토콜의 변화가 매우 비용이 많이 드는 될 수 있습니다 전체 프로세스를 재 검증 할 의무가 발생할 것입니다. 이 제한은 또한 정량의 범위는 바이러스 (예를 들면, 호흡기 유체, 기관, 혈액 또는 소변) 추출되는 소스에 의존한다는 사실에 의해 강조되었다. 사실, 각 행렬은 물리 화학적 특성이 상이한 특이성을 제시하고 독립적 QRT-PCR에 의한 바이러스 검출과 정량에 사용되는 각각의 상이한 행렬을 정의하는 것이 중요하다. 따라서, 각각의 생물학적 샘플의 바이러스 게놈 부하보다 정확하게 추출에서 정량화 할 수있다. 특성화는 계정 열 순환기의 모드로합니다EL 및 이전에 잘 특성화 방법의 사용 (예를 들면, 본 문서에 기재된 EHV-2 qPCR의 방법) 상위 기관 또는 다른 실험실 기계의 새로운 유형을 필요로 할 때, 하나는 그 기기의 성능을 확인한다. 모든 테스트 실험실로 가져에 대한 qPCR에 분석의 성능의 확인은 필수 조건이다. 이는 일반적으로 공지 된 특성을 갖는 기준 샘플을 분석함으로써 달성된다. 이러한 검사는 필수 및 qPCR에 (LOD, LOQ 효율)의 성능 및 전체 방법 (LOD, LOQ)의 안정성을 확인하기 위해 NF 47-600-1 AFNOR 규범 요청에 따라 의무적으로 간주된다. 뿐만 아니라 개발 단계에서 특성화되지만 연구 또는 진단 목적으로 사용될 수도 때 위험 요인 식별 잘 프로토콜의 표준화를 위해 조절 될 수있다. 특히 우려 적절한 직원 교육, 우수한 인력, 소모품의 품질 관리입니다사용 및 저장, 분석에 포함 된 과학 장비의 성능에 영향을 미칠 수있는 즉각적인 환경 조건 및 계량 조건의 인식 제어 할 수 있습니다. 실험실 간 비교를위한 기준 샘플의 사용은 또한 불확실성을 제어 할 수 있도록 할 수 있습니다. 이러한 방식으로, 실험실간에 데이터의 비교를 용이하게 할 수있다. 실제로, 간 실험실 숙련도 시험 평가 방법의 재현성을 확인하는 것이 필수적이다.
분석 된 생물학적 매트릭스의 국제 단위 (IU)로 표현되는 바이러스 게놈로드 결과 (IU는 : 유체 또는 사본 복사 / ㎖ 조직에 대한 / g)을 다른 실험실 사이의 결과를 비교하기 위해 사용하기 쉽다. 정량 한계 이상의 모든 결과는 비 정량 양성 결과로 간주된다 카피 / ㎖ 및 LOD와 LOQ 사이의 결과로서 표현된다. 이러한 방식으로 게놈 quantificational 데이터를 표시하면 사전 처리에 더 정확하게 부합분석의 (게놈의 증폭). 사실상, 세포 배양 실험에서 TCID (50)에 의해 바이러스 하중 식 (중간 조직 배양 감염 량) 세포 및 바이러스 균주의 특성에 따라 달라집니다. 각 변형 라인은 최초의 세포 병변 효과가 명백하기 전에 독특한 감염 역학 및 EHV-2와 같은 일부 바이러스는 몇 일이 걸릴 수 있습니다 보유하고있다.
결론적으로, QRT-PCR의 특성이 새로운 방법은 실험실 간의 데이터 표현과 해석의 조화를 촉진해야한다. 이 질환 상태를 선언하는 대신 단지 병원균의 존재 또는 부재에 대한 컷오프 값의 설정 등 향후 QRT-PCR 잠재적 새로운 애플리케이션에 매우 유용 할 것이다.
공개
저자는 더 경쟁 재정적 이해 관계가 없음을 선언합니다.
감사의 말
The authors would like to thank Sophie Castagnet and Nadia Doubli-Bounoua for their technical support. This work received financial support from the General Council of Calvados and the agreement of Region Basse-Normandie and French Government (CPER 2007-2013; project R25 p3). The authors would like to thank the experts of the AFNOR group and particularly Jean-Philippe Buffereau and Eric Dubois.
자료
| Name | Company | Catalog Number | Comments |
| AB-1900 natural color ABgene 96 well plate | Dutsher | 16924 | |
| Adhesive film qPCR Absolute | Dutsher | 16629 | Adhesive film used for sealing the plate prior to the qRT-PCR run |
| 0.5 ml microtubes, skirted, caps | Dutsher | 039258 | |
| Ethanol 98% | Sodipro | SAF322941000 | |
| Primers | Eurofins | Custom order | |
| Probe | Life Technologies | Custom order | |
| Plasmid | Eurofins | Custom order | |
| QIAamp RNA viral Mini Kit (containing: QIAamp Mini column, AVL buffer, AW1 buffer, AW2 buffer, AVE buffer, collection tubes) | Qiagen | 52906 | AVL buffer: pre-warm 5 min at 72 °C |
| Sequencing by Sanger method | Eurofins | Custom order | |
| Taqman Universal PCR Master Mix | Life Technologies | 4364340 | |
| Tris-EDTA buffer solution | Santa Cruz | sc-296653A | |
| NanoDrop 2000c Spectrophotometer | Thermoscientific | ND-2000C | |
| StepOnePlus Real-Time PCR systems | Life Technologies | 4376600 | pre-warm 15 min |
참고문헌
- Brault, S. A., et al. The immune response of foals to natural infection with equid herpesvirus-2 and its association with febrile illness. Vet.Immunol.Immunopathol. 137 (1-2), 136-141 (2010).
- Fortier, G., Van Erck, E., Pronost, S., Lekeux, P., Thiry, E. Equine gammaherpesviruses: pathogenesis, epidemiology and diagnosis. Vet.J. 186 (2), 148-156 (2010).
- Hue, E. S., et al. Detection and quantitation of equid gammaherpesviruses (EHV-2, EHV-5) in nasal swabs using an accredited standardised quantitative PCR method. J Virol.Methods. 198 (1), 18-25 (2014).
- Diallo, I. S., et al. Multiplex real-time PCR for the detection and differentiation of equid herpesvirus 1 (EHV-1) and equid herpesvirus 4 (EHV-4). Vet.Microbiol. 4 (1-3), 93-103 (2007).
- Williams, K. J., et al. Equine multinodular pulmonary fibrosis: a newly recognized herpesvirus-associated fibrotic lung disease. Vet.Pathol. 44 (6), 849-862 (2007).
- Mullis, K., et al. Specific enzymatic amplification of DNA in vitro: the polymerase chain reaction. Cold Spring Harb.Symp.Quant.Biol. 51 (1), 263-273 (1986).
- EPA Office of Water (4607). EPA-815-B-04-001. Quality Assurance/Quality Control Guidance for Laboratories Performing PCR Analyses on Environmental Samples. , (2004).
- Telford, E. A., et al. Equine herpesviruses 2 and 5 are gamma-herpesviruses. Virology. 195 (2), 492-499 (1993).
- Fortier, G., et al. Identification of equid herpesvirus-5 in respiratory liquids: A retrospective study of 785 samples taken in 2006-2007. Vet.J. 182 (2), 346-348 (2009).
- Brault, S. A., Bird, B. H., Balasuriya, U. B., MacLachlan, N. J. Genetic heterogeneity and variation in viral load during equid herpesvirus-2 infection of foals. Vet.Microbiol. 147 (3-4), 253-261 (2011).
- Association Francaise de Normalisation. NFU 47-600-1. Animal health analysis methods-PCR-Part 1: Requirements and recommandations for the implementation of veterinary PCR. , (2015).
- Association Francaise de Normalisation. NFU 47-600-2. Animal health analysis methods-PCR-Part 2: Requirements and recommendations for the development and the validation of veterinary PCR. , (2015).
- ISO. EN ISO-CEI 17025. General requirements for the competence of testing and calibration laboratories. , (2005).
- Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2010. Chapter1.1.1.4/ 5. Principles and Methods of Validation of Diagnostic Assay for Infectious Diseases. , This thoroughly revised chapter replaces Chapter 1.1.4 Principles of validation of diagnostic assays for infectious diseases and Chapter 1.1.5 Validation and quality control of polymerase chain reaction methods used for the diagnosis of infectious diseases from the sixth edition of the OIE Terrestrial Manual (2009).
- Apaza, S., et al. Detection and genogrouping of noroviruses from children's stools by Taqman One-step RT-PCR. J Vis.Exp. (65), e3232(2012).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J Vis.Exp. (63), e3998(2012).
- Sanger, F., Coulson, A. R. A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase. J Mol.Biol. 94 (3), 441-448 (1975).
- Sanger, F., Nicklen, S., Coulson, A. R. DNA sequencing with chain-terminating inhibitors. Proc.Natl.Acad.Sci.U.S.A. 74 (12), 5463-5467 (1977).
- NCBI. BLAST Homepage and Selected Search Pages. Introducing the BLAST homepage and form elements/functions of selected search pages. , (2015).
- Greiner, M., Gardner, I. A. Application of diagnostic tests in veterinary epidemiologic studies. Prev.Vet Med. 45 (1-2), 43-59 (2000).
- Blanchard, P., Regnault, J., Schurr, F., Dubois, E., Ribiere, M. Intra-laboratory validation of chronic bee paralysis virus quantitation using an accredited standardised real-time quantitative RT-PCR method. J Virol.Methods. 180 (1-2), 26-31 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유