Method Article
여러 색상과 고속에서 구조화 조명 TIRF 현미경에 가이드
요약
This article provides an in depth guide for the assembly and operation of a structured illumination microscope operating with total internal reflection fluorescence illumination (TIRF-SIM) to image dynamic biological processes with optical super-resolution in multiple colors.
초록
구조화 된 조명 현미경 (SIM) 광학 수퍼 - 해상도 이미징은 화학적 및 생의학에서 분자 수준에서 프로세스의 시각화를위한 핵심 기술이다. SIM 상용 시스템을 사용할 수 있지만, 사용자 상용 시스템을 능가 할 수있는 실험실에서 설계 시스템, 후자는 일반적으로 이미징 정확도와 속도 측면에서 모두 사용 범용 애플리케이션의 용이성을 위해 설계. 이 문서는 내부 전반사 (TIR) 조명을 사용하고, 100 나노 미터에 이르는 해상도 세 가지 색상에 10 Hz에서 최대에 이미징 할 수있는 SIM 시스템을 구축에 대한 심도있는 가이드를 제공합니다. TIRF 때문에 SIM과의 조합으로, 상기 시스템은 경쟁 기술보다 더 나은 이미지 콘트라스트를 제공한다. 이러한 사양을 달성하기 위해, 몇몇 광학 요소들은 가능한 모든 음원 WAV 대한 조명광의 편광 상태와 공간 구조를 통해 자동 제어를 가능하게하는 데 사용되는elengths. 하드웨어 구현 및 제어에 관한 자세한 사항은 최대 포착 프레임 율을 달성을 중시 여기 광 패턴 생성, 파장, 편광 상태, 및 카메라 제어 간의 동기화를 달성하기 위해 제공된다. 시스템 조정 및 교정을위한 단계별 프로토콜이 제시되고 달성 가능한 해상도 개선 이상적인 테스트 샘플에 대해 검증된다. 비디오 레이트 초 - 해상도 이미징 능력은 살아있는 세포로 설명된다.
서문
지난 반 10 년간 슈퍼 해상도 현미경 성숙과 생물학의 손에 전문 광학 연구소에서 움직였다. 상용 현미경 솔루션은 광 초 해상도를 달성하기위한 세 가지 변형이 존재 : 단일 분자 지역화 현미경 (SMLM)는, 배출 플리 현미경 (STED) 및 구조화 된 조명 현미경 (SIM) -1,2- 자극. SMLM는 광 활성화 현지화 현미경 (PALM)과 확률 적 광 재건 현미경 (STORM)와 같은 쉽게 아래로 20 나노 미터로, 주로 인해 광 설치의 단순함과 높은 공간 해상도의 약속, 가장 인기있는 기술이었다. 단일 분자 지역화 비아 다만 초해 현미경 본질적인 절충 제공 : 공간적 해상도가 달성 따라서 시간적 해상도 제한, 개인 형광 지역화 충분한 수의 누적에 의존한다. 영상 역동적 인 과정하나 적절히 또한 이미지를 재구성하는 시간을 충분히 파악 이벤트 획득 동안 움직임 아티팩트를 방지하기 위해 관심있는 구조의 움직임을 샘플링해야하므로 생균의 에스 따라서 문제가된다. 이러한 요구 사항을 충족하기 위해, 생균 SMLM 시연 크게 여기 전력을 증가시킴으로써 형광 단 photoswitching 속도에서 원하는 증가를 수득했고, 이에 의해 샘플의 생존 시간 및 생물학적 관련성 3 제한 광독성 및 산화 스트레스에 차례로 이끈다.
SIM 및 SMLM 모두 이상 STED의 명확한 장점은 약 60 나노 미터의 예 측면 해결을위한 두꺼운 샘플 슈퍼 해상도와 이미지가 120 μm의 4까지 깊이의 Organotypic 뇌 조각에 달성되었다 수 있다는 것입니다. SMLM 또는 SIM의 하나의 목적 구현과 같은 깊이의 영상은 실현성이지만, 단일 분자 광 시트 또는 격자 광 시트 마이크 중 하나를 가능하게roscopy 5. 지금까지보기 (6)의 작은 필드 촬상 한정 하였지만 비디오 레이트 STED 또한 입증과 시냅스 소포 이동성을 매핑하는 데 사용되어왔다.
세포 생물학 및 분자 자기 조립 반응 7에서 응용 프로그램 - 그것은 특정 형광의 광 물리 특성에 의존하지으로 많은 시점에서 높은 시간 해상도를 가진 영상을 필요로 (12), 구조화 조명 현미경 (SIM) 매우 적합 할 수있다 조사. SIM이 고유의 장점에도 불구하고, 지금까지의 사용은 주로 고정 된 세포 또는 천천히 움직이는 프로세스를 이미징 할 국한되었습니다. 이는 시판 SIM 시스템의 제한으로 인해 이러한 상품의 포착 프레임 율이 요구되는 정현파 조명 패턴뿐만 아니라 광학 유지 편광을 생성하기 위해 사용되는 격자의 회전 속도에 의해 제한되었다. 상업 SIM의 최신 세대장비는 빠른 이미징 할 수있다 그러나 그들은 중앙 이미징 시설하지만 모든 엄청나게 비싸다.
이 프로토콜은 살아있는 세포의 기저 표면 얇은 시료와 가까이 빠른 프로세스를 영상화하는가요 SIM 시스템의 구성에 대한 지침을 제공한다. 이 크게 포커스 배경 신호의 출력을 감소 샘플 (13)에없는 깊이 약 150 nm 이하를 관통하는 조명 패턴을 생성하기 위해 전반사 형광 (TIRF)를 이용한다. TIRF와 SIM을 결합의 아이디어는 SIM 자체 (14)만큼이나 오래된하지만 2006 15 전에 실험적으로 실현되지 않았다. 2009 년 튜 불린과 키네신을 시각화하는 11 Hz에서 16 달성 프레임 속도를보고되었다 TIRF-SIM으로 얻어진 생체 내에서 첫 번째 이미지 다이나믹 두 색 TIRF-SIM 시스템 (17, 18)를 제시하고있다. 최근 단색 두 SIM 빔 (S)의 구조 및 사용을위한 지침템은 최대 18 Hz에서 19, 20의 프레임 속도를 특징으로 제시했다.
여기에 제시된 셋업 TIRF-SIM에서 동작 할 수있는 두개의 세 가지 색상, 20 Hz에서 SIM 초 - 해상도 이미징 할 수있다. 전체 시스템은 거꾸로 현미경 프레임 주위 구성 및 압전 구동 Z 스테이지와 전동 XY 번역 단계를 사용합니다. TIRF-SIM에 필요한 사인 여기 패턴을 생성하기 위해 제공되는 시스템은 강유전체의 공간 광 변조기 (SLM)를 사용한다. 이진 격자 패턴이 SLM 상에 표시하고, 생성 된 ± 1 차 회절 여과 중계 대물 렌즈의 TIR 고리에 집중된다. 필요한 위상 변화와 격자의 회전은 표시 SLM 이미지를 변경하여 적용됩니다. 이 프로토콜은, 구축 및 여기 경로를 정렬하는 방법을 설명 방출 경로의 정렬을 자세히 설명하고, 최적의 정렬을 보장하기위한 테스트 샘플을 제공합니다. 또한 해제 편광 제어 및 구성 요소의 동기화 관련 문제 및 고속 TIRF-SIM에 특히 어려움을 스크라이브한다.
디자인 고려 사항 및 제한
이 프로토콜에서 제시된 TIRF-SIM 시스템을 조립하기 전에, 광학 구성 요소의 선택을 결정하는 몇 가지 고려 된 설계 제약이있다. 광학 부품의 모든 약어는 그림 1을 참조하십시오.
공간 광 변조기 (SLM)
이 서브 - 밀리 세컨드 패턴 전환이 가능한 경우 이진 강유전체 SLM이 설정에서 사용된다. 계조 네마의 SLM이 사용될 수 있지만, 이들은 스위칭 시간을 크게 감소 제공. 또는 화소 오프 각 이진 위상 SLM은주기적인 격자 패턴이 격자 상 회절로서 동작 할 SLM에 표시되므로 경우, 입사면의 파면 오프셋 중 하나 π 0 위상을 부여한다.
엔트 "> 총 내부 반사 (TIR) TIR을 달성하고 산장을 생산하는 유리 샘플 계면에서의 여기 빔의 입사각이 임계각보다 커야 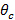 . 이 소멸 조명 패턴의 필요한 최소 입사각, 따라서 또한 최대 간격 또는 기간을 설정한다. 최대 입사각
. 이 소멸 조명 패턴의 필요한 최소 입사각, 따라서 또한 최대 간격 또는 기간을 설정한다. 최대 입사각  (합격 각도)의 정의로부터 계산 될 수있는 대물 렌즈의 개구 수 (NA)에 의해 제한된다
(합격 각도)의 정의로부터 계산 될 수있는 대물 렌즈의 개구 수 (NA)에 의해 제한된다 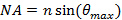 . 이것은 아베 공식에 따라 달성 가능한 최소 간격 패턴을 결정
. 이것은 아베 공식에 따라 달성 가능한 최소 간격 패턴을 결정 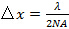 NA 파장을 연결하는
NA 파장을 연결하는 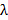 최저 패턴 간격을
최저 패턴 간격을  . 실제로, 1.49 NA 오일 침지 TIRF 목적은 약 79 °의 입사각과의 488 nm의 여기 파장을 사용하여 164 nm 인 샘플 최소 패턴주기의 최대 각도를 산출한다. 이들 두 각도는 악기 TIR 조명 (예. TIR 링)과 한 개의 여진 초점을 정확하게 위치해야 달성 정확하게 각 조명 패턴을 생성하기 위해 회전하는 동안, 대물의 뒤쪽 개구의 환을 정의한다.
. 실제로, 1.49 NA 오일 침지 TIRF 목적은 약 79 °의 입사각과의 488 nm의 여기 파장을 사용하여 164 nm 인 샘플 최소 패턴주기의 최대 각도를 산출한다. 이들 두 각도는 악기 TIR 조명 (예. TIR 링)과 한 개의 여진 초점을 정확하게 위치해야 달성 정확하게 각 조명 패턴을 생성하기 위해 회전하는 동안, 대물의 뒤쪽 개구의 환을 정의한다.
TIRF-SIM 이미지 재구성 패턴 회전 당 세 개의 위상 시프트의 최소의 인수 따라서 SLM 패턴주기가 3의 배수이어야 요구 (도 1 참조). 예를 들어, 488 nm의 조명 9 픽셀과 640 nm의 조명 12 화소의 기간. 쉬어 된 회절 격자를 이용하여 간격 패턴의 서브 픽셀을 포함 최적화 SLM 패턴 디자인의 포괄적 대하여는,은 SLM 파장이에서, 모든 파장의 TIR 링 내부에 있어야 ± 1 주문 그러나 회절 각도를 두 여자의 초점의 Kner 등. (16)와 루 - 발터 등. (20) 위치의 이전 작업을 참조하십시오 매달린. 표준 SIM 들면, 다색 화상이 가장 긴 파장에 대한 격자주기를 최적화하고 짧은 채널 성능의 손실을 용인함으로써 달성 될 수있다. TIRF-SIM의 경우 그러나, 하나의 파장 최적화하면 다른 파장의 초점은 더 이상 TIR 링 내에 있다는 것을 의미합니다. 초점이 후방 개구와 TIR 링 내부 직경의 95 %로되어 예를 들어, 9 화소의 격자주기를 사용하여, 488 nm의 대한 TIRF를 제공하기에 충분하지만, 640 nm 인이 기간은 외부 초점 위치 할 조리개. 이러한 이유로 다양한 화소 패턴의 간격은 각각의 여기 파장에 사용되어야한다.
TIRF-SIM 여기 경로의 정렬극히 현미경 본체 (도 1에 DM4), 다이크로 익 미러의 위치의 작은 변화에 민감하므로 더 이상 종래 SIM이다. 회전 필터 큐브 터릿의 사용 대신에 사용 된 여기 파장에 대해 특별히 고정 위치에 유지되고 설계된 단일, 멀티 밴드 다이크로 익 미러를 사용하여, 권장되지 않는다. 단지 고품질 이색 거울이 사용되는 것이 필수적이다. 이들은 적어도 3mm의 두께의 기판을 필요로하며, 종종 제조사 별 "이미징 평면"으로 지정된다. 다른 모든 기판 TIRF-SIM에 견딜 수차 및 이미지 저하로 이어집니다.
편광 제어
TIRF-SIM을 달성하기 위하여 그것의 광축에 대하여 상기 대물 퓨필 평면 내의 방위각 편광 유지되도록 조명 패턴과 동 기적으로 상기 여기 광의 편광 상태를 회전하는 것이 필수적이다 (즉,. s 편광). 편광 제어 광학 정렬은 모터 회전 스테이지 (22)에 예를 들어, 사용되는 특정의 광학 소자에 포켈 셀 (21) 또는 반파 장판을 의존 할 것이다. 이 프로토콜에서 사용자 지정 액정 변수 지연 (LCVR)이 사용되는 파장 범위에 걸쳐 전파 (2π) 난연성을 제공하도록 설계되었습니다 488이 빠른 (~ 밀리 초) 전환을 허용하는 nm의 640. 액정 위상차 판을 사용하는 경우는 고품질의 부품을 사용하는 것이 필수적이다 표준 구성 요소는 일반적으로 리드 카메라 노출 시간의 길이에 걸쳐 일정한 난연성을 제공하기에 충분히 안정되지 않는 조명 패턴 및 낮은 변조 콘트라스트에서 모호 . 액정 지연 제는 강하게 온도 의존 및 온도 제어에 내장이 필요합니다.
동기화
레이저는 SLM과 동기화해야합니다. 이진 강유전체의 SLM 내부적들로 균형된다상태에와 국가 떨어져 사이의 매혹적인. 화소는 하나 또는 그 오프 상태가 아니라 간 스위칭시기에서와 반파 플레이트 역할을한다. 따라서, 레이저는 의해서만 화소의 중간 상태의 패턴 콘트라스트의 저하를 방지하기 위해 SLM의 인 에이블 신호를 통해 LED의 온 / 오프 상태시에서 스위칭되어야한다. 레이저는 디지털 변조 할 수없는 경우는 음향 광학 변조기 (AOM)은 대안 적으로 고속 셔터로 사용될 수있다.
렌즈의 선택
이러한 제한에 기초하여, 샘플 평면 상에 SLM 평면의 사이즈 축소 요구는 원하는 조명 패턴을 결정할 수있다 생성한다. 이 화상 중계 망원경 여진 집광 렌즈 L5에있는 두 렌즈 L3와 L4의 초점 거리의 계산을 허용한다. 이 시스템에서 100X / 1.49NA 오일 액침 대물 렌즈는 488 nm 내지 640 nm의 여기에 사용되며, 따라서 300 및 140mm의 초점 거리를 사용L3 및 L4, 시료면에서 38 nm 인 SLM의 화소 사이즈에 상당 357X 총 축소율을 부여 L5 300 mm의 대. 렌즈의 조합을 사용하여, SLM은 각각 70 ° 및 67 °의 입사각에 대응하는 488nm의 조명 및 샘플을 172, 229 nm의 패턴 간격을 줄 내지 640 12 화소 9 기간 격자. 유리 물 인터페이스의 임계각 따라서 이들 두 패턴 간격이 두 파장 용 TIRF 여기 있도록 61 °로하고, 파장에 무관하다. 37 ° C에서 동작하는 경우, 또는 교정 용 칼라를 구비 한 대물 렌즈 커버 슬립의 두께의 변화에 의해 도입 된 구면 수차의 보정이 유용하다.
이미지 재건
원시 SIM 데이터를 획득 한 후에는 두 단계에서 슈퍼 - 분해 된 이미지를 생성하기 위해 계산 노력의 문제이다. 우선, 조명 패턴을 결정해야모든 이미지 및 둘째, SIM 스펙트럼의 성분을 분리해야하며 효과적인 OTF 지원 (세트를도 6 참조)를 두배로 적절 재결합.
슈퍼 - 분해 된 주파수 성분이 중첩 요소의 잔여 부분으로 인한 아티팩트를 방지 섞이지 최대한 정확하게 할 필요로 투사 조명 패턴의 정확한 지식이 중요하다. 우리는 조명 패턴이 각각 찾을 수있다 구스타프손 외. 요컨대 23 정규화 이차원 정현파 설명 조명 파라미터들의 세트에 의해 도입 된 절차에 따라, 원시 이미지 데이터로부터 귀납적 파라미터 결정 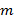 여기 패턴
여기 패턴 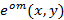 :
:
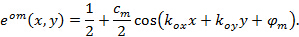
이에 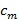 과
과 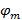 프린지 대비 각각 각각의 이미지 m의 위상을 시작하는 패턴을 설명합니다. 전파 벡터의 성분
프린지 대비 각각 각각의 이미지 m의 위상을 시작하는 패턴을 설명합니다. 전파 벡터의 성분 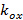 과
과 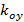 만 다른 방향으로 변경
만 다른 방향으로 변경 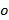 패턴 및 캔의 다른 일정하다고 가정. 조악 오버랩을 최적화하도록 상호 상관 된 이미지 중 하나의 서브 픽셀 시프트를 적용하여 정제 원 화상의 스펙트럼의 교차 상관이 수행되는 웨이브 벡터의 요소를 결정한다. 이는 실제 공간 상 구배의 곱셈을 통해 이루어집니다
패턴 및 캔의 다른 일정하다고 가정. 조악 오버랩을 최적화하도록 상호 상관 된 이미지 중 하나의 서브 픽셀 시프트를 적용하여 정제 원 화상의 스펙트럼의 교차 상관이 수행되는 웨이브 벡터의 요소를 결정한다. 이는 실제 공간 상 구배의 곱셈을 통해 이루어집니다 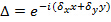 그 FRE의 서브 픽셀 변화를 유도이는 주파수 - 공간. 실제의 패턴을 추정하기 전에 웨이브 벡터의 양호한 추정을하는 것이 유용하며 이것은 형광 비드 층 묘화에 의해 발견 될 수 있습니다.
그 FRE의 서브 픽셀 변화를 유도이는 주파수 - 공간. 실제의 패턴을 추정하기 전에 웨이브 벡터의 양호한 추정을하는 것이 유용하며 이것은 형광 비드 층 묘화에 의해 발견 될 수 있습니다.
시프트 패턴 사이의 위상 단계이므로 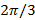 즉.
즉. 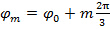 주파수 성분의 분리는 "위상 축"함께 푸리에 변환에 의해 수행 될 수있다. 글로벌 위상
주파수 성분의 분리는 "위상 축"함께 푸리에 변환에 의해 수행 될 수있다. 글로벌 위상 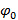 그리고 프린지 대비
그리고 프린지 대비 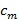 다음, 다른 성분의 복소 선형 회귀를 사용하여 결정될 수있다. 각각의 분리 된 성분은 다음 일반화 위너 필터를 사용하여 결합된다. 일반화 된 위너 필터의 두 파라미터 추출 및 구현에 대한 자세한 설명은 우리가 구스타프손에 독자를 참조등. (23)와 동일한 알고리즘이 사용된다.
다음, 다른 성분의 복소 선형 회귀를 사용하여 결정될 수있다. 각각의 분리 된 성분은 다음 일반화 위너 필터를 사용하여 결합된다. 일반화 된 위너 필터의 두 파라미터 추출 및 구현에 대한 자세한 설명은 우리가 구스타프손에 독자를 참조등. (23)와 동일한 알고리즘이 사용된다.
프로토콜
1. 정리하고 여기 경로를 정렬
- 광학 테이블의 구성 요소의 위치를 표시 (광 설치의 개요 그림 1 참조). 대물 별개 렌즈 L3, L4, L5, 상기 SLM은 SLM면은 대물의 초점 평면에 중계한다되도록 각각의 초점 거리의 합으로 각각.
- 현미경 프레임의 필터 큐브 터렛에 멀티 가장자리 다이크로 익 미러 DM4를 삽입합니다.
- 마운트 1 "광장 운동 거울에 두 번째 다이크로 익 미러 DM3를 삽입하고 하나의 초점 거리 거리에 집광 렌즈 L5에서 그것을 놓습니다.
참고 :이 여기 경로 디자인은 두 개의 동일한 이색이 같은 생산 배치에서 가져 DM3 및 DM4 동일한 광학 특성을 확인하기 위해 거울이 통합되어 있습니다. s- 편광 및 P- 축을 현미경 (DM3)에있는 이색 비교 절환되는 다이크로 익 미러 (DM4는)하여 임의 취소 이러한 위치편파 타원의 복굴절에 의해 도입 (도 1). 이 보상은 각 조명 파장에 대해 동일하게 작동합니다. 이 단계에서는 높은 변조 콘트라스트를 유지하는데 필수적이다. - 여기 경로에있는 렌즈를 삽입하기 전에, 정확한 시스템의 광학 축선을 정의한다.
- 포탑에서 대물 렌즈 (OB)를 제거하고 정렬 도구에서 나사 대신. 이것은 양쪽 끝이 정렬 디스크와 500 mm 길이 광학 케이지 시스템으로 구성되어 있습니다.
- 두 정렬 디스크의 구멍의 중심을 레이저 (1)로부터 시준 된 참조광을 조정하는 이색 미러 DM3 및 SLM의 대략적인 위치에 위치 이후 일시적 배향 미러를 사용한다. 세 개의 이색 미러 및 미러 DM2를 사용하여도 1에 도시 된 바와 같이 임시 미러 (1)로부터 레이저 빔을 지향. 는 SLM 위치에 임시 미러는 광축에 대해 수직에 가까워 야한다.
주 : 1을 사용하여 레이저 빔을 기준으로, 여기 경로 대신에 일단 다른 레이저는 연속적으로 정렬 될 수있다. - 그것이 현미경 본체 들어가기 전에 조대 광축 determined.Insert를 빔 경로에 홍채되면 정렬 공구를 제거하고 상기 빔에 중앙. iris.Reinsert 대물 렌즈 (OB)의 중앙에 작은 구멍 흰색 카드의 조각을 연결합니다.
대물 떠나는 빔이 현재 높은 발산되지만 백색 카드에 표시되며, 렌즈의 후면 표면으로부터 반사 미약있을 것이다 참고. 모든 렌즈들은 코팅 반사 방지하더라도, 동축 정렬을 보장하기 위해 사용될 수있다 약한 다시 반사 할 것이다. 빔이 정확히 렌즈에 수직 인 경우,이면 반사 홍채의 중심을 위로 갈 - 합니다 (SLM 위치에 DM3 및 정렬 미러) 반복 각도 두 개의 거울을 조정할 수에 후면 반사를 중앙에수신 빔 카드. 임시로, 대물 렌즈 (OB)을 제거하고 기준 위치를 만들 천장에 레이저 스폿을 표시한다.
- 테이블의 나사 구멍을 따라 기준 빔의 높이에서 홍채의 쌍을 삽입한다. 빔 광학 테이블의 표면과 평행해야한다. 광축 지금 정의된다.
- 집광 렌즈 (L5) 떨어진 목표에서 약 1 초점 거리를 삽입합니다. 기준 빔의 방향을 따라 번역 선형 변환 스테이지 세트에이 렌즈를 마운트합니다.
- 대물 떠나는 빔 시준 및 천장에 기준 지점을 히트하도록 집광 렌즈의 위치 및 각도를 조정한다. 렌즈 다시 조리개와 흰색 카드로 다시 반사를 확인하여 빔에 수직 있는지 확인합니다. 대물 렌즈 (OB)를 제거하고 이미지 릴레이 망원경 (L4)의 제 2 렌즈를 삽입합니다.
참고 : 수의 적절한 시준 비 편향 보장빔 경로 내의 렌즈들의 수가 짝수 인 경우 오전 쉽게 이루어진다. - 시준을 유지하고, 기준 빔은 여전히 천장에 표시된 지점을 안타 있도록 선형 변환 스테이지를 사용하여이 렌즈의 위치 및 각도를 조정한다.
- 대물 렌즈 (OB)를 교체하고 망원경 (L3)의 제 1 렌즈를 삽입합니다. 이전 단계에서 설명 된 바와 같이, 시준 비 변형을 보장하기 위해 렌즈의 위치 및 각도를 조정한다.
- 칩 표면의 중심에 대한 번역하지 않고 회전을 제공하는 마운트 짐벌의 SLM 칩을 탑재합니다.
참고 : 특정 설치 디자인을 사용하는 SLM에 따라 달라집니다. 는 SLM이 장착하지 않고 공급되는 경우, 그 렌즈 짐벌 마운트에 부착 된 정의 가공 알루미늄 플레이트에 고정한다. - 렌즈 정렬과 함께, 거울 대신에 SLM을 삽입합니다. 기준 빔은 SLM 칩의 중앙에 위치되도록 상기 SLM의 위치를 조정하고, 조정을광이 두 개의 중계 렌즈들 (L3 및 L4)를 통과하도록 GLE. 기준 빔이 여전히 표시된 지점을 중심으로되어 있는지 확인합니다.
- 확장 및 케플러 빔 확장기를 이용하여 상기 기준 빔을 시준.
- 조정의 용이성을위한 케이지 시스템의 두 개의 렌즈 (L1 및 L2)를 탑재.
- 센터 렌즈를 제거하고 홍채로 대체하여 참조광의 케이지 시스템.
- 두 개의 렌즈를 삽입하고 전단 간섭계를 사용하여 확장 된 빔을 시준하는 L2의 축 위치를 조정합니다. L2는 하나의 초점 거리를 멀리 SLM의 표면에서해야한다.
- 확장 된 빔은 여전히 두 릴레이 렌즈 L3 및 L4 후 평행되어 있는지 확인합니다. 시준를 확인하기 위해 단지 DM3 후 전단 간섭계를 사용합니다.
- 여기 경로는 단일 파장, 커플 빔 경로에 다른 두 레이저에 대해 정렬되면. 여기 사용 경로를 중심으로 두 개의 홍채 통해 각 빔 스티어빔 조합 한 다이크로 익 미러 (DM1 및 DM2).
편광 회 전자의 2 정렬
- 입사 편광 45 °에서의 빠른 축으로 LCVR를 탑재합니다.
- 반파 장판 및 교차 편광기 사이 LCVR 삽입함으로써 무채색 반파 장판 (HWP)를 사용하여 LCVR에 입사 한 빔의 미세 조정 편각. 전송 된 전력을 최소화하기 위해 HWP을 돌립니다.
주 : 가변 편광 회 전자의 역할을하기 위해, 액정 지연 기 (LCVR)의 진상 축 정확하게 입사 수직 빔의 편광을 45 °로 정렬되어야한다. LCVR 물리적으로 45 °로 장착되어 있지만, 이것은 거친 정렬된다. 반파 장판은 LCVR 진상 축에 대한 상기 입사 편광 완벽 45 정렬을 보장하기 위해 사용된다. 1/4 파장 판 (QWP)이인가 전압에 의해 제어 각도에서 다시 직선 편광으로 LCVR 의해 유도 된 경사 타원 편광 변환24. - LCVR 후 1/4 파장 판을 삽입하고 교차 편광판 사이의 전송 전력을 최소화하여 들어오는 편광에 느린 축 정렬을 돌립니다.
배출 경로 (3) 정렬
- 조악 스테이지 마이크로 미터 슬라이드 및 투과광을 이용하여 카메라를 배치합니다.
- 현미경의 접안을 사용하여 레티클에 초점이 위치에서 대물 렌즈를 고정합니다.
- 대략 카메라 중앙 스크린에 이미지를 관찰하여 초점에 레티클의 이미지를 가져올 수있는 카메라 위치를 이동한다.
주 : 외부 필터 휠 그때 사용되는 경우 레이저가 켜져 때 필터 큐브 따라서 접안이 사용되어서는 안, 방출 필터를 포함하지 않을 것이다.
- 미세 형광 비드의 샘플을 이용하여 카메라의 위치를 조정한다.
- A # 1.5 커브 글라스에 100 nm의 여러 가지 빛깔의 구슬 한 방울의 확산에 의해 형광 구슬의 단층을 준비합니다. D에 남겨주세요공예는 커브 글라스에 구슬을 흡수하고 물에 다시 젖어있다.
- 침수 오일 목적에 비드 샘플을 놓습니다. 미세 형광 비드 층에 초점이되도록 카메라의 위치를 조정한다. 초점이 발견 된 후 대물 렌즈의 위치를 조정하지 마십시오.
주 : SLM이 시료면에 공역 인면에 있어야 같이, SLM의 위치는 렌즈 릴레이 대물 고정되어야한다. 초점을 조정, 샘플 축 대신 피에조 Z 스테이지를 사용하는 목적을 움직인다.
- 비트 맵 파일과 같은 적절한 SIM 바이너리 격자 패턴을 생성한다.
- (3) 동일하게 이격 된 위상 시프트와 함께 3 각 패턴 방위 : 2D / TIRF-SIM 들어 9 바이너리 격자 이미지의 시리즈를 생성한다. 이어서 이진 화상을 생성하기 위해 임계 화인가 오프셋 위상 회전 된 2 차원 정현파에서 (예를 들어 MATLAB 사용) 이러한 수치를 생성한다. 예제 코드에 대한 보충 코드 파일을 참조하십시오.
- alignmen에 대한t 목적은 또한 윈도우 정렬 격자가 외부에서 발생 될 필요는 없다.도 2에 도시 된 바와 같이, 3 방향 각각에 대해 작은 원형 구멍으로 윈도 윙 된 격자 패턴을 생성하지만, 수동 통해 사용자에 의해 전환 될 수있다 SLM의 소프트웨어.
참고 : 최적의 회전 각도의 토론과 격자 패턴 생성 코드 16, 20의 예 참조를 참조하십시오.
- (예를 들어 MetroCon 용) 제조업체의 소프트웨어를 사용하여 SLM에 비트 맵 이미지를 업로드합니다.
- 은 SLM 제어 소프트웨어를로드하고 "연결"을 클릭합니다.
- 은 "레퍼토리"탭에서 레퍼토리 파일을 열고 파일에 포함 된 주문 실행의 수를 확인하는 "로드"를 클릭합니다. 주어진 예 레퍼토리 파일에서 오 러닝 주문이 있습니다.
- 클릭 SLM의 레퍼토리 파일을 업로드 "이사회에 보내기".
- 비트 맵 이미지가 업로드 될 때까지 기다립니다차 장치가 자동으로 재부팅하기 위해.
참고 : 격자 비트 맵 이미지와 순서를 정의하는 파일이 포함 된 예 레퍼토리 파일은, 보충 코드 파일로 포함되어 있습니다. 은 ".repz"파일은 ZIP 파일 아카이브 소프트웨어를 사용하여 열 수 있습니다.
- (예 : 0 °의 경우) 제 1 방위를위한 SLM에 격자, 윈도우를 정렬을 표시합니다.
- 은 SLM 제어 소프트웨어에서, "상태"탭을 선택합니다 (이 "1"을 주문을 실행하는 예제 파일의 경우) 실행 순서의 번호를 입력합니다.
- 정렬 격자의 실행 순서를 변경하려면 "선택"을 클릭합니다.
참고 :이 샘플 비행기에 작은 원형 영역을 조명합니다. 은 SLM 표면이 올바르게 시료면에 접합 된 경우,이 지역의 가장자리에 초점 크게 될 것입니다. 격자 패턴은 L3의 초점 여러 회절 차수를 생성합니다 : 0 차 반사의 반사 후면 판SLM은 SLM 장치 특정 내부 구성 요소의 회절로부터 발생하는 것을 -1 격자, 또한 약한 고차에 대응 한 명령 (예., 화소 에지의 SLM 픽셀 요철의 내부 배선 반사) . 모든하지만 -1과 +1 주문은 필터링해야합니다.
- 공간 마스크 (SM)이 L3의 초점 위치에 빔 경로 내로는 X의 Y 스테이지를 장착 넣고 만 원하는 제 주문 전달되도록 광축에 대해 그 위치를 번역. 직접 공간 필터 후, 두 개의 원형 빔을 볼 수 있습니다.
주 : 공간 마스크 바늘을 이용하여 알루미늄 박으로 6 구멍을 펀칭에 의해 제조된다. 구멍은 모든 레이저 파장에 대한 1 차 빔을 통과하기에 충분히 커야한다. 공간적 마스크의 상세한 분석은 기준 (20)에 주어진다. - 다시 옆에 정렬 격자의 방향 (60 °, 실행 순서 2)를 표시필요한 경우 첫 번째 주문의 위치를 조정, 공간 마스크를 통해하게되어 있는지 확인합니다.
- 최종 방향 (120 °, 실행 순서 3)에 대해 반복합니다.
- 카메라의 형광 비드 층의 이미지를 확인합니다. 도 2에 도시 된 바와 같이 두 개의 원형 빔이 중첩하지 않은 경우 반복적으로 상기 대물 렌즈와 카메라의 위치를 조절하여 샘플 평면을 재배치.
- 초점이 이미지를 가져올 두 개의 빔을 중첩하는 목표 위치를 조정합니다. 경우에 다시 초점과 미세 조정으로 목표 이미지를 가져 오도록 카메라 위치를 두 개의 원은 여전히 볼 수 있습니다. 두 개의 빔이 겹쳐 하나의 원형 영역의 초점이 될 때까지이 과정을 반복합니다.
- 샘플 평면의 위치가 설정되면, 고정 된 목표 위치를 유지한다.
- 이미지 488 nm의 여기 파장, 예를 들면, 형광 염료 용액을 TIRF 조명을 확인하기 위해 10의 용액을 사용하여81; M 로다 민 6G.
- 초점 염료 샘플을 가져와. 두 개의 빔이 올바른 TIRF 각도로 입사 한 경우 하나의 분자가 높은 배경없이 표시되며, 원형 구멍의 가장자리가 초점이 될 것입니다. 정렬 및 정렬되지 TIRF 빔의 예는 그림 2B-D를 참조하십시오.
- 차례로 윈도우 격자의 각 방향을 표시하고 세 방향이 TIRF 조명을 제공하는 두 빔이 시료면에 겹쳐 있는지 확인합니다. 빔의 위치를 미세 조정은 다이크로 익 미러 DM3을 조정함으로써 이루어질 수있다.
주의 : 다른 파장은 축상 색수차 인해 약간 다른 위치에 집중되어 있지만, 이것은 중요하지 않으며, 적용에 의해 보정 될 수있는 일정한 제 2 파장 여진 전에 샘플 위치 Z 오프셋.
4. 시스템 동기화 및 교정
- 비드 단층의 배치목적에 충분한 및 초점 가져온다.
- 상기 제 1 패턴의 방향 (0 °)에 대해 차례로 3 개의 위상 시프트 된 이미지들의 각각을 표시하기 위해 제어 소프트웨어를 이용하여 SLM 프로그램.
- 는 SLM 제어 소프트웨어를 사용 예 레퍼토리 순서 4를 실행으로 전환.
- 긍정적 인 글로벌 노출 기간 동안 하나의 음의 TTL 트리거 신호 : 출력이 신호를 (예를 들어 HCImage에 대한) 인수 소프트웨어를 사용하여 카메라를 구성합니다. 각각 "노출", 및 출력 트리거 극성 1, 2 "긍정적"및 "네거티브"카메라의 "고급 카메라 속성"에서 소프트웨어, 설정 출력 트리거 종류 1과 2에서.
- 은 "트리거"동축 케이블을 사용하여 각각 SLM의 "마침"입력, 카메라의 출력 1과 2를 연결합니다. 지금은 SLM 카메라에 동기화된다.
- 세 일련의 이미지를 획득.
- 은 "순서"창에서, 선택# 34; 스캔 유형으로 하드 디스크 기록 "및 3 프레임 수를 설정합니다.
- 3 프레임을 획득하기 위해 "시작"을 클릭합니다. 은 SLM 패턴은 각각의 노출에 따라 변경됩니다. 이미지의 형광 구슬은 3 각 이미지 사이에 오프 점멸 표시됩니다. 점멸의 양은 정현파 조명 패턴의 변조 콘트라스트의 개 판독한다.
- 방위각 편광 지정된 패턴 방향 그러므로 높은 변조 콘트라스트를 달성하기 위하여 커스텀 소프트웨어를 사용하여 LCVR로 여기 레이저의 편광을 돌린다.
- LCVR 교정 소프트웨어를로드합니다.
- 각각 최소 및 최대 전압 0, 8을 입력합니다.
- 편광 회전 "LCVR 전압 스윕"을 클릭합니다.
주 : LCVR 난연성이 온도의 함수이며, 심지어 온도 조절 일상 드리프트 할 수있다. 이 단계에서, 최적의 방위각 분극 sweepi 의해 경험적으로 발견시료에 입사 편광 회전의 영향을 최소 및 최대 전압의인가 전압 겨. 변조 콘트라스트 각 전압 피크 (25) 및 콘트라스트가 다음 단계에서 사용된다 달성 전압에 대해 계산된다. - 완료 될 때까지 교정 과정 기다린 측정 된 전압을 확인합니다.
- 나머지 두 패턴의 방향 (60 ° 및 120 °) 및 여기 파장 각각에 대해이 교정 과정을 반복한다.
- LCVR, 레이저, 발광 필터 휠과 피에조 Z 스테이지 (26)와 카메라 노출을 동기화합니다. 이를 위해, 시스템에 대해 마스터 클럭 소스로 고속 데이터 획득 (DAQ) 보드를 사용하고, SLM의이 레이저를 변조 출력 신호를 사용 LED를 사용하여 (도 3b 참조).
주의 : 특정 구현에 사용되는 성분이지만, 디지털 배출량에 대한 고속 DAQ 보드의 사용에 의존gger 동기화 소프트웨어를 통해 제어하는 아날로그 전압을 이용하여 LCVR의 제어는 추천된다. 이 프로토콜에 사용되는 제어 소프트웨어의 요청에 따라 사용할 수 있습니다. - 때문에 축 색수차로, 각 파장에 대해, 또한 Z 오프셋 샘플 단계에 적용 할 수 있습니다.
- 상기 제 1 파장 (예. 488 ㎚) 다음 두 번째로 전환 (예. 640 ㎚)에서 여러 가지 빛깔의 구슬 단층 샘플에 초점을 맞춤으로써 실험적으로 오프셋 (offset)를 결정합니다. 구슬은 지금 초점이 될 것입니다.
- 비드를 집중할 필요 하였다 Z 위치의 변화를 측정한다. 이 후, 압전 Z 스테이지에 여기 파장이 변경 될 때마다 적용될 수 오프셋.
- 는 SLM 제어 소프트웨어를 사용 TIRF-SIM 필요한 9 바이너리 격자 이미지의 전체 시리즈에 SLM 실행 순서를 전환. 이 예제 레퍼토리에 주문 0을 실행합니다.
- 카메라 제어 소프트웨어를 사용하여 비드 샘플 9 화상을 취득.
- 카메라 소프트웨어의 "순서"창에서 스캔 유형으로 "하드 디스크 녹화"를 선택하고 9 프레임 수를 변경합니다.
- 이미지를 수집하기 위해 "시작"을 클릭합니다.
- "저장 버퍼 이미지"창에서 이미지 유형으로 "TIFF"를 선택하고 확인을 클릭하여 TIFF 파일로 획득 된 영상을 저장합니다.
- 표준 TIRF 이상 해상도의 향상을 검증 상업적 또는 커스텀 소프트웨어를 사용하여 원시 TIFF 이미지로부터 초 해상도 영상을 복원.
참고 : 우리는 사용자 정의 재건 코드가 집에서 박사 린 샤오 (27)에 의해 선진국 사용하는 우리의 현미경은.
결과
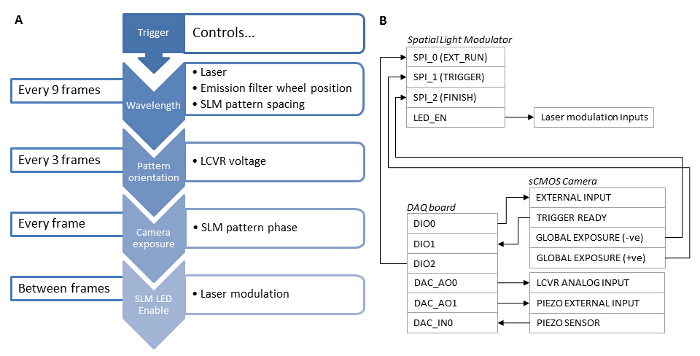
여러 가지 빛깔의 100nm 정도의 직경 형광 구슬은 TIRF-SIM에 표준 TIRF 비교 및 측면 해상도에서 달성 개선 (- B도 4A)를 정량화하기 위해 몇 군데 있었다. 초 해상도 영상으로 원시 프레임 재구성 문헌 27, 28에 요약 된 표준 알고리즘을 이용하여 수행 하였다. TIRF-SIM은 분명히 TIRF에 비해 유의하게 높은 측면 해상도를 가지고 있음을 알 수있다. 현미경의 점 확산 함수 (PSF)가 잘 따라서, 하나의 서브 회절 크기 형광 비드의 형상에 의해 PSF를 근사 해상도는 파장마다 개별적인 비드 차원 가우스 함수 피팅에 의해 정량화 될 수있다. 전체 폭 절반 최대 값 (FWHM)의 평균값에 기초하여 상기 현미경의 분해능은 약 89 nm이고, 각각 488 및 640 nm의 TIRF-SIM (도 4C) 116 ㎚이다. 이것은 2 배에 상당 impro이론적 회절 제한된 경우에 비해 두 파장에 대한 측면 해상도 vement. 형광 표지 된 아밀로이드 원 섬유는 배 해상도 (그림 4D)을 보여주는위한 훌륭한 테스트 샘플입니다. 아밀로이드 원 섬유 10 % 로다 민 유도체 염료 (488 nm의 여기) 일주 및 이후 TIRF-SIM으로 이미징 표지 β 아밀로이드를 배양하여 체외에서 형성되었다. 자세한 내용은 12를 참조하십시오.
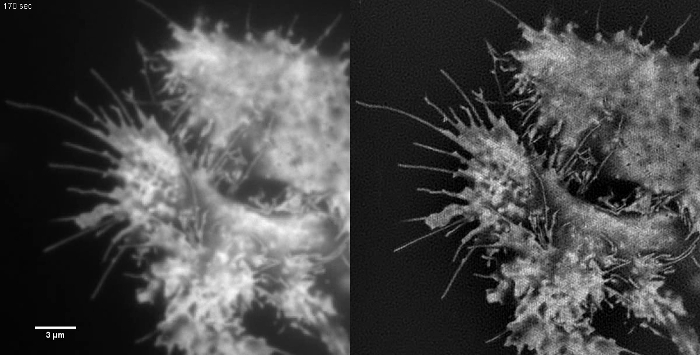
이러한 emGFP 높은 콘트라스트 세포 내 구조는 미세 소관 (그림 5B, G) 또는 LifeAct-GFP (그림 5D) TIRF-SIM 영상에 적합하고 높은 콘트라스트 슈퍼 해상도의 이미지를 얻을 레이블. 이 프로토콜에 상세 설정을 사용 TIRF-SIM 촬상는 기저 세포 외피의 근방에 위치한 미세 소관의 서브 모집단의 관측을 가능하게하고, 미세 소관 중합, 탈 중합은 수 b전자 시간이 지남에 따라 본 (애니메이션 그림 1). 모든 샘플은 분리 된 구조없이, 특히 낮은 콘트라스트 샘플에서, TIRF-SIM으로 이미징 할 의무가있는 것은 아닙니다. 세포질 GFP를 발현하는 세포는 세포막의 에지 (도 5 F, H 및 애니메이션도 2)에서 제외 고해상도 정보가 부족하고, 생성 된 복원 아티팩트 겹쳐 본질적 TIRF 이미지만큼 TIRF-SIM 이미징 따라서 차선이다. 이러한 샘플에서, 콘트라스트의 증가는 종종 재구성 알고리즘의 컨벌루션 단계에 기인 할 수있다.
높은 변조 콘트라스트 성공적인 SIM 촬상 필수적이다. 푸리에 복원 영상의 변환은 SIM 광학 전달 함수 (OTF) (도 6A, 인셋)의 시각화를 허용한다. 방위각 극성 보장함으로써 각 방향에 대한 변조 대비를 극대화 없음심 통과 대역에서의 낮은 신호대 잡음비에 이르는 샘플의 고해상도 정보의 거의 변조가, 편광 회전기로 화. 표준 위너 필터 방식을 사용 재건 알고리즘은 단순히 SIM의 통과 대역의 노이즈를 증폭하고 본질적으로 육각형 (또는 "벌집") 유물 (도 6A, 오른쪽 패널)을 울리는와 겹쳐 표준 TIRF 이미지 인 이미지를 얻을 것입니다. 가능한 향상은 시료의 종류에 따라 이러한 아티팩트를 줄일 수있는 29, 30 반복 또는 블라인드 재구성 알고리즘 (31, 32)의 사용 될 수 있습니다. 우리는 이전과 재건축 (33) 후 SIM 데이터의 품질을 확인하기 위해 SIMcheck를 플러그인 ImageJ에의 사용을 권장합니다.
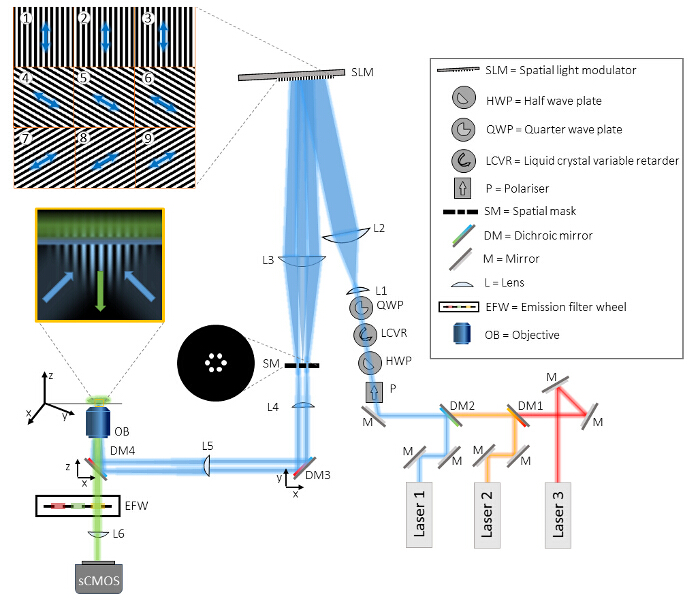
그림 1 :. 여러 가지 빛깔 TIRF-SIM 설정의 레이아웃 TIRF-SIM 마일croscope 세 가지 주요 부품, 빔 발생 부와, 패턴 투영 부와 상기 검출 장치로 구성된다. 빔 발생 장치에있어서, 세 개의 다른 레이저는 이색 미러 (DM1 및 DM2)을 통해 동일한 광 경로 상에 정렬되는 편광 제어 광학 소자를 통해 네 방향. 우선, 편광자 (P)의 레이저 빔의 각각의 직선 편광 상태의 순도를 보장한다. 다음 세 개의 광학 소자는 본문에서 상세히 설명한 바와 같이 빠르고 자동화 된 방식으로 편광을 회전시킬 필요가있다. 이후, 망원경 구성 개의 렌즈 (L1 및 L2)는 공간 광 변조기 (SLM)의 활성 표면과 일치하도록 상기 빔을 확장하여 SLM의 투사 된 바이너리 격자 패턴으로 세 개의 빔렛으로 회절되는 (예 타일 1-에 나타낸다 9). 은 SLM 패턴에 대해서 조명광의 편광 상태는 화살표로 표시된다. 두 번째 망원경 (L3 및 L4) 패턴을 드-확대 및 토륨에 대한 액세스를 제공합니다은 SLM 패턴의 전자 푸리에면. 이 평면에서 공간 마스크 (SM)은 상기 SLM의 픽셀 화 된 구조와 내부 배선에서 핵심 구성 요소 및 기타 원치 않는 회절 요소를 필터링하는 데 사용됩니다. 나머지 두 빔은 집광 렌즈 (L5)를 통해 대물 (OB)의 후면 초점면에 집중되기 전에 두 개의 다이 클로 익 미러 (DM3 및 DM4는) 설정에 포함된다. DM4는 발광 빛에서 별도의 조명에 형광 현미경에서 기존의 다이크로 익 미러 역할을합니다. 그러나,이 미러는 불가피 DM3, DM4 이상적으로 동일한 배치에서 다이크로 익 미러에 의해 보상 될 수 조명광의 편광 상태를 타원율을 유도한다. 오일 침지 TIRF의 목적은 직접 완전히 반영되는 커버 슬립에 두 개의 카운터 전파 파도를 실행하고 coverslip에의 구조화 된 산장을 야기 할 수있는 충분한 NA있다. 샘플은 XYZ 변환 스테이지 상에 장착된다. 검출 반환 한 것입니다송신 동일한 목적 및 DM4 통해 ORMED 플러스 대역 방출 필터에 의해 추가 필터링은 컴퓨터 제어 필터 휠 (EFW)에 장착. 마지막으로, 이미지가 내부 현미경 튜브 렌즈 (L6)에 의해 sCMOS 카메라 상에 투영된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2 :. 중복 빔의 정렬 (A) 원형 조리개, 윈도우를 SLM 격자 패턴을 정렬하는 데 유용합니다. 겹치지 않는 두 빔은 카메라 (왼쪽)에 표시하는 경우, 다음 샘플 평면의 위치는 반복적으로 한 원형의 조명 스폿 (오른쪽)를 제공하기 위해, 대물 렌즈와 카메라의 축 위치를 조정함으로써 재배치되어야한다. 빔은 순으로 하였다 겹쳐 야R은 TIRF-SIM에 필요한 사인 여기 패턴을 생성한다. 빔이 완전히 중첩되지 않는 경우,이 간섭 패턴이 형성되는 위에 시야를 감소시킨다. (B 및 C) 빔의 발생의 정확한 각도는 TIRF-SIM 중요하다. 각도가 정확하지 않은 경우, 빔의 하나 TIRF에 필요한 각도 없으며 형광 염료 용액을 묘화 할 때 쉽게 볼 수있다. 하나의 빔은 원형 스폿을 산출 임계각보다 큰 입사각을 가지고, 다른 하나는 (B)에서 화상의 좌측의 밝은 줄무늬에 이르게하지 않는다. 미러 DM3의 각도 조정 (D)은 두 빔들이 동일한 각도로 입사 보장하고, 이러한 목적을 디 포커스에 의해 검증 될 수 올바르게 정렬되면, 형광 색소 샘플의 Z 스택의 XZ 투영 두 대칭 교차 표시해야 상기 무시할 배경으로 빔초점을 맞추고있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
도 3 :. 다르게 지정 시스템 구성 요소들의 동기화 종속 (A) 빠른 SIM 수집 용은 하드웨어 기반 솔루션을 사용하는 시스템 구성 요소의 동기화가 필수적이다. (B) 데이터 수집 보드 (DAQ)이 마스터 트리거로서 사용되어야한다. 는 DAQ 보드에서 TTL 신호는 sCMOS 외부 입력에 전송하고, 카메라 노출을 트리거하는 데 사용된다. 카메라 글로벌 노출 출력은 격자 패턴을 표시 SLM을 트리거하고, SLM은 출력 디지털 SLM 픽셀이 "ON"상태에있는 경우 상기 레이저 만 방출되도록 레이저 여기를 변조하는 데 사용 가능했다. 노광 후는 공단TE 카메라 노출 글로벌 출력은 다음의 격자 상 또는 각도의 SLM 패턴을 향상시키는 데 사용된다. 는 DAQ 보드는 또한 조명 빔의 직선 편광 상태를 제어하는 컨트롤러 LCVR 아날로그 전압을 출력한다. 이 전압은 각 패턴의 각도에 대한 3 상 이미지의 취득 후 전환됩니다. 단파장 9 화상의 취득 후, DAQ 보드 발광 필터 휠 컨트롤러에 신호를 출력하고, 다음으로 파장 전환한다. 는 DAQ 보드는 또한 Z 오프셋은 z 단 압전 컨트롤러로 아날로그 전압을 출력하여 샘플에가. 적용 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
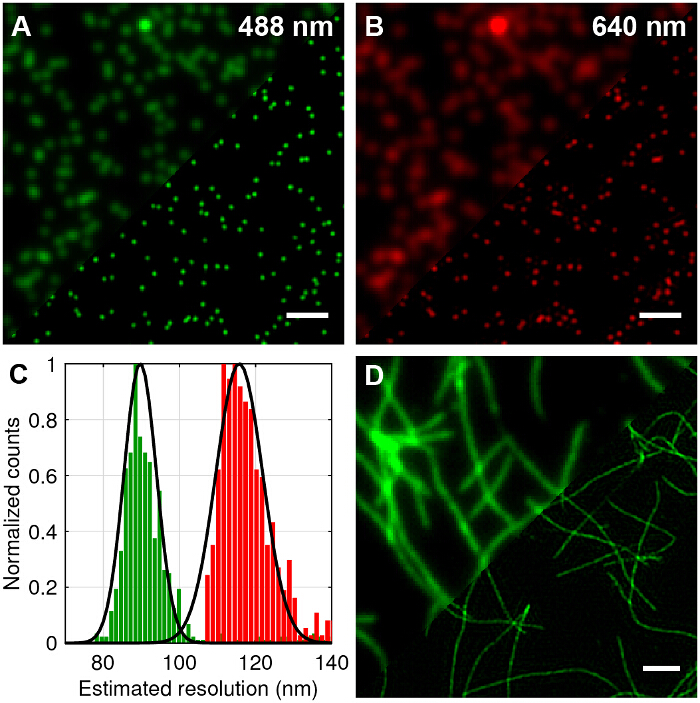
그림 4 : 100 nm의 여러 가지 빛깔의 구슬 및 찬란 L의 테스트 샘플의 TIRF-SIM 영상abelled 아밀로이드 피 브릴. (A와 B) 표준 TIRF의 비교 488 내지 640 nm의 여기에 대한 TIRF-SIM의 복원에 비교했다. 가우스의 반치 전폭 (FWHM)의 (C) 히스토그램 예상 해상도 개선을 도시 TIRF-SIM 비드에 맞는다. 10 % 로다 민 유도체 염료 (488 nm의 여기)로 표지 β - 아밀로이드 원 섬유의 TIRF-SIM 대 (D) TIRF. 스케일 바 = 1 ㎛. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
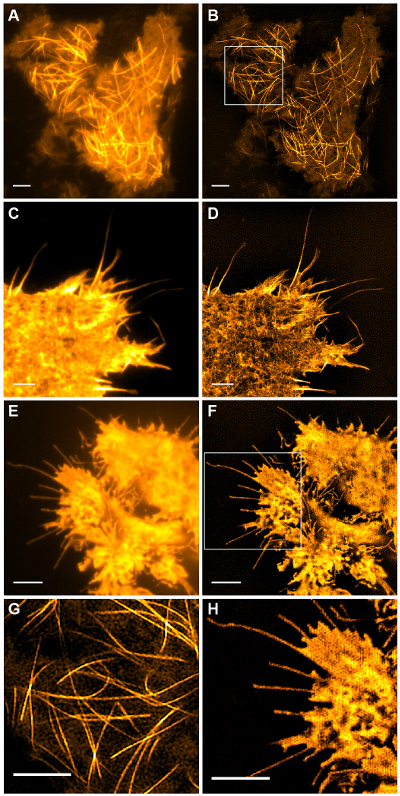
그림 5 :. HEK293 세포에서 (A, B) 미세 소관 (emGFP - 튜 불린)의 라이브 셀 TIRF-SIM 기존의 TIRF의 영상 비교 및 TIRF-SIM 이미지, (C, D ) 사상 굴지 COS-7 셀 (LifeAct-GFP)와 (E, F)를 HEK293 세포의 세포질 GFP. B와 F의 이미지는 영화에서 하나의 시점이다. 박스 영역 (G, H)에 확대 표시됩니다. 스케일 바 = 3 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
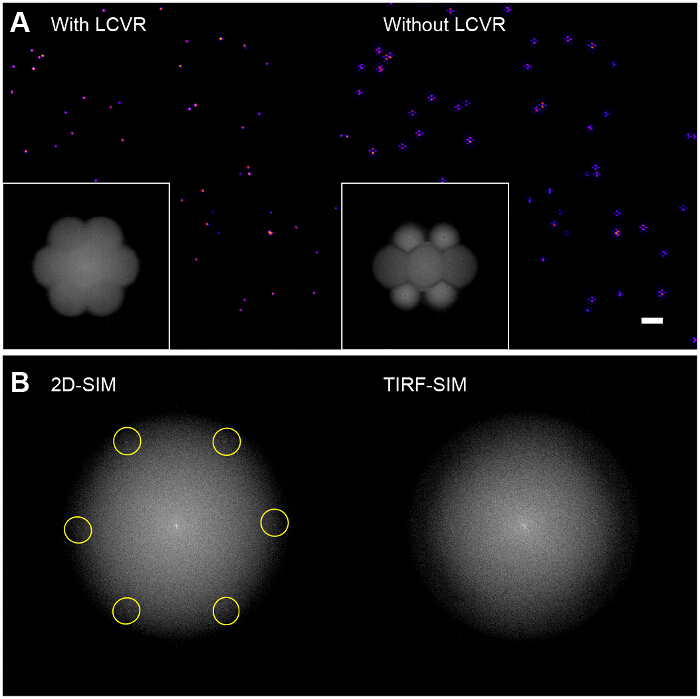
도 6. 복원 된 비드 이미지에 편광 회 전자의 영향 (A)와 같은 LCVR 같은 편광 회전기의 사용없이 SIM 통과 대역에서의 신호 - 대 - 잡음 비율은 재구성 된 SIM의 특성 육방 아티팩트를 초래하는 낮은 사진 (우측), (B), 2D-SIM에서, 구조화 된 조명 패턴을 푸리에 변환에서 직접 볼 수 있습니다TIRF-SIM으로하지만,로 이미지 (왼쪽, 여기 공간 주파수가 강조)가 발광 OTF 지원 반경 내에으로의 변환, 그들은 OTF 지원 외부와 (오른쪽) 따라서 보이지. 프로토콜에 명시된 바와 같이이 경우, 패턴 변조 대비, 스파 스 비드 단층을 사용하여 평가해야합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
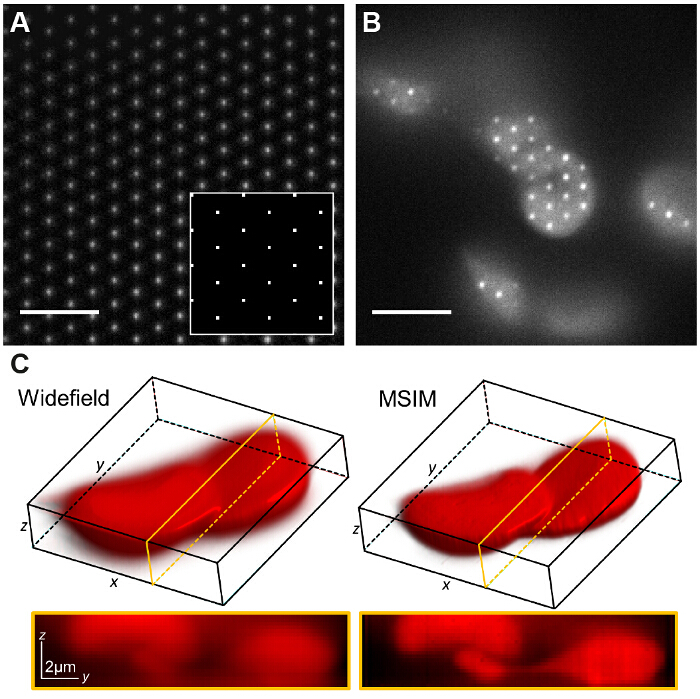
그림 7 :. 공간 광 변조기 기반 패턴 생성이 같은 다 초점 SIM으로 다른 영상 방식의 구현을 허용 (A) MSIM에서, 사각형의 격자가 SLM (삽입)에 pointsdisplayed은 이미지면에서 회절 제한 초점의 격자를 산출한다. 낮은 농도의 로다 민 6G의 박층은 visua에 결상 초점을 발자. 패턴 샘플 (B)를 통해 변환되고, 획득 된 원 영상 (Z) - 스택 포커스 아웃 광 (C)를 환원에 의한 이미지를 생성하도록 재구성된다. 스케일 바 = 5 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
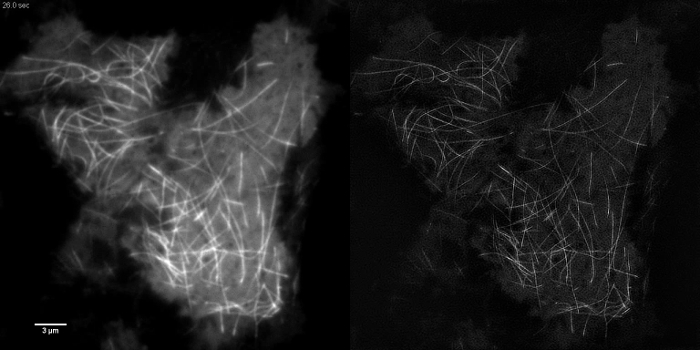
애니메이션 그림 1 :. HEK293 세포에서 EmGFP - 튜 불린의 시계열 영화 빠른 중합 및 emGFP의 해중합는 미세 소관이 TIRF-SIM을 사용하여 관찰 할 수 표시. 이미지는 0.5 초 간격으로 원시 프레임 당 50 밀리 초 노출 시간 (SIM 프레임 당 450 밀리 초)를 사용하여 인수했다. 사용 된 노출 시간이 아닌 카메라 나 SLM의 속도로, 형광의 밝기가 제한되었다. 3988movie1.mov "대상 ="_ 빈 ">이 동영상을 보려면 여기를 클릭하십시오.
애니메이션 그림 2 :. HEK293 세포의 세포질 GFP의 시계열 영화 이와 같은 낮은 콘트라스트 샘플 TIRF-SIM 영상에 적합 샘플 수 없습니다. 레토 막 흐름은 TIRF 화상에서 볼 수 있지만 TIRF-SIM은 셀 가장자리에서 떨어져 추가 정보를 제공하지 않는다. TIRF-SIM 이미지가 5 초 간격으로 원시 프레임 (SIM 프레임 당 450 밀리 초) 당 50 밀리 초 노출 시간을 이용하여 획득 하였다. 이 동영상을 보려면 여기를 클릭하십시오.
기업 코드 파일 : 예 SLM 레퍼토리 파일 (48449_300us_1-bit_Balanced.seq3).D / 53988 / 48449_300us_1-bit_Balanced.seq3 ">이 파일을 다운로드하려면 여기를 클릭하십시오.
기업 코드 파일 :. 예 SLM 레퍼토리 파일 (period9_001.bmp) 이 파일을 다운로드하려면 여기를 클릭하십시오.
기업 코드 파일 :. 예 SLM 레퍼토리 파일 (period9_002.bmp) 이 파일을 다운로드하려면 여기를 클릭하십시오.
기업 코드 파일 :. 예 SLM 레퍼토리 파일 (period9_003.bmp) 이 파일을 다운로드하려면 여기를 클릭하십시오.
기업 코드 파일 : 예 SLM의 repertoi파일 (period9_004.bmp) 재. 이 파일을 다운로드하려면 여기를 클릭하십시오.
기업 코드 파일 :. 예 SLM 레퍼토리 파일 (period9_005.bmp) 이 파일을 다운로드하려면 여기를 클릭하십시오.
기업 코드 파일 :. 예 SLM 레퍼토리 파일 (period9_006.bmp) 이 파일을 다운로드하려면 여기를 클릭하십시오.
기업 코드 파일 :. 예 SLM 레퍼토리 파일 (period9_007.bmp) 이 파일을 다운로드하려면 여기를 클릭하십시오.
기업 코드 파일 :. 예 SLM 레퍼토리 파일 (period9_008.bmp) 이 파일을 다운로드하려면 여기를 클릭하십시오.
기업 코드 파일 :. 예 SLM 레퍼토리 파일 (period9_009.bmp) 이 파일을 다운로드하려면 여기를 클릭하십시오.
기업 코드 파일 :. 예 SLM 레퍼토리 파일 (period9_mask_1.bmp) 이 파일을 다운로드하려면 여기를 클릭하십시오.
기업 코드 파일 :. 예 SLM 레퍼토리 파일 (period9_mask_2.bmp) 이 파일을 다운로드하려면 여기를 클릭하십시오. >
기업 코드 파일 :. 예 SLM 레퍼토리 파일 (period9_mask_3.bmp) 이 파일을 다운로드하려면 여기를 클릭하십시오.
기업 코드 파일 :. 예 SLM 레퍼토리 파일 (TIRF-SIM_example.rep) 이 파일을 다운로드하려면 여기를 클릭하십시오.
기업 코드 파일 :. 예 격자 생성 코드 (1/2) (generate_gratings.m) 이 파일을 다운로드하려면 여기를 클릭하십시오.
기업 코드 파일 : 예 격자 생성 코드 (2/2) (circular_mask.m).= "https://www.jove.com/files/ftp_upload/53988/circular_mask.m">이 파일을 다운로드하려면 여기를 클릭하십시오.
기업 코드 파일 :. 변조 대비 (calculate_contrast.m)을 계산하는 예제 코드 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이와 프로토콜에 설명 된 설치와 같은 맞춤형 TIRF-SIM 시스템은 시판 현미경에 비해 고속으로 다색 초 - 해상도 이미징 할 수있다. 초 - 해상도 기술로서 SIM의 고유 한 이점은 시간적 해상도가 같은 단일 분자 지역화 현미경 (SMLM) 또는 유도 방출 고갈 현미경과 같은 점 주사 방식 (다른 방법에 비해 형광 물질의 광 물리학에 의해 제한되지 않는다는 STED). 여러 가지 빛깔의 영상이 간단하므로이 다른 기술과 달리, SIM은 광전 환성 또는 공핍 형광을 필요로하지 않습니다. 여기에보고이 개선 인자 반대로 SIM 및 다발성 SIM을 절편 광학 비 TIRF-SIM 시스템은 일반적으로 실질적으로 1.7 배 이하의 해상도의 향상을 달성 할 수 있고, 상용 시스템은 또한 시스템보다 종종 느리고 덜 유연 이 프로토콜에 발표했다.
">이 기술을 구현하는 두 가지 주요 어려움은, 우선 광학 정렬 절차 걸리는 수고와 시간을 필요로 대물 후면 개구의 TIR 영역 내의 여섯 SIM 빔의 정확한 위치에 대한 필요성이있다. 둘째, 높은 패턴 콘트라스트를 제조 샘플에서의 편광 회전이 낮은 NA 2D-SIM 시스템의 편광 회전이 직선 편광의 방향의 신중한 선택에 의해 회피 될 수있다. 필수적이지만, 이는 TIRF-SIM (25)에 대해 불가능하게된다. 고속 다색 이미징, 전기 - 광 편광 제어가 필요하고, 이는 시스템의 복잡성과 비용을 증가시킨다.기술의 한계
TIRF-SIM은 종래 TIRF 같은 자연적 생물학적 구조와 산장의 150-200 나노 침투 깊이에 의해 조명 될 수있는 기저 세포 막에있는 프로세스의 관찰에 한정된다. 동안SIM은 종종 STED 또는 SMLM이, 측면 해상도 배로 여전히 기존의 TIRF 현미경에 비해 최소 4 배 5 광자의 필요한 수를 증가 않는 하나 이상의 세포에 덜 photodamaging 것으로 인용된다. 짧은 노출 시간을 갖는 고속 프레임 레이트로 촬상,이 광자의 증가는 증가 된 조명 세기를 이용 필요로한다. 어떤 형광이 고정 또는 저속 이동 샘플, 고휘도 형광 단백질 또는 향상된 광 안정성과 차세대 합성 염료의 SIM 이미징을 위해 사용될 수 있지만 라이브 세포 이미징을 권장합니다.
이 구현은 20 Hz를 초과하는 SIM 프레임 레이트에서 하나의 색상을 묘화 할 수 있지만, 표시 시스템의 다색 화상이 전동 발광 필터 휠의 절환 시간에 의해 제한된다. 인해 sCMOS 카메라 칩의 큰 크기로, 멀티 밴드 방출 필터와 이미지 분할 광학계의 이용이 가능하고 동시에 전을 허용 할더 속도 저하 여러 파장 maging. 또 다른 가능성은 상이한 여기 레이저를 대체하고 여기 광을 거부하는 다중 대역 노치 필터를 사용하는 것이다. 이 구현에서 이진 강유전체 SLM의 사용은 최적이 아니다. 입사광의 대부분은, 공간 마스크에 의해 필터링되는 0 차 반사되어 있으므로 이러한 SLM의 회절 효율은 매우 낮다. 높은 프레임 레이트를 요구하는 애플리케이션을 위해, 촬상 속도를 따라서 레이저 다이오드의 출력 전력에 의해 제한된다. 은 SLM은 멀리 픽셀이 이상적인 반 파장 판을 사용하지 않는 550 nm의 설계 파장과 파장에 대한 편광의 일부 타원율을 소개합니다. 이 추가 LCVR를 사용하여 보상 될 수 있지만, 최적의 해결책은 패턴 발생기로서, 디지털 마이크로 미러 디바이스 (DMD)를 사용할 수있다.
가능한 수정
설치 prese여기 nted 유연하고보다 쉽게 3D-SIM 고속 2D-SIM, SIM 병소 (MSIM) 비선형 SIM (NL-SIM)되도록 다른 영상 방식이 21,34,35 구현 될 수 상용 상품보다 변경된다.
2D-SIM은 빠른 등 주변 소포체로 구조를 이동, 상대적으로 평면 이미징에 적합 할 수있다. 주변 ER 인해 그 평면 구조에 TIRF 산장하지만를 사용하여 조명 할 수있는 것보다 세포 내 깊은 거짓말을하는 것은 무시할 포커스 아웃 배경으로 표준 2D-SIM을 사용하여 몇 군데 할 수 있습니다. 또한, 개선 된 광 단면 재구성 알고리즘의 사용은 빛이 광학적으로 두꺼운 샘플이이기는 축 해상도가 21 배로하지 않아도되는 2D-SIM의 사용을 확장 포커스 아웃 억제.
MSIM에서, 샘플은 여기 초점 (36)의 성긴 격자에 의해 조명된다. 이러한 양상은 SM (단순히 공간 마스크를 제거함으로써 구현 될 수있다) 및 편광판을 교체. 은 SLM 이제 진폭 변조기로 작동합니다. 는 SLM에 표시된 이진 SIM 격자는 이미지 평면의 회절 제한된 초점의 크기와 동일하도록 선택 스폿의 크기와, 스폿의 2 차원 격자에 의해 대체 될 수있다. 도 7a에서, 4 x 4 픽셀 사각형의 격자는 13.62 μm의의 물리적 SLM의 픽셀 크기 주어진 샘플로 축소된다 때 150 × 150 나노 미터의 회절 제한 초점을 생성하는 SLM (삽입)에 표시됩니다. 여기 초점 다음 SLM상의 격자 패턴을 시프트에 의해 번역 될 수 있고,이보기의 전체 필드를 조명하기 위해 여러 번 반복된다. 이미지는 각각의 번역 패턴의 위치를 취득 스택이되어 배까지의 향상된 해상도의 복원 영상을 생성하는 후 처리  감소 등이 해당 위드 이미지에 비해 아웃 오브 포커스획득 시간은 원시 프레임의 다수로 인해 증가하지만 30.이 양상은 표준 SIM은 염색 적혈구 (도 7c)으로 예를 들어 콘트라스트가 낮은 구조에 대해서는 부적합되는 두꺼운 치밀한 샘플을 영상화하는 데 유용 할 수있다 (이 경우 = 168 N에서) 시야 당이 필요합니다.
감소 등이 해당 위드 이미지에 비해 아웃 오브 포커스획득 시간은 원시 프레임의 다수로 인해 증가하지만 30.이 양상은 표준 SIM은 염색 적혈구 (도 7c)으로 예를 들어 콘트라스트가 낮은 구조에 대해서는 부적합되는 두꺼운 치밀한 샘플을 영상화하는 데 유용 할 수있다 (이 경우 = 168 N에서) 시야 당이 필요합니다.
리 등에 의해 최근에 제시된 마지막 설치 높은 NA 선형 TIRF-SIM 또는 패터닝 활성화 비선형 SIM (PA NL-SIM)를 사용하도록 변경 될 수있다., 초고 1.7 NA 대물 또는 부가를 사용하여 405 나노 미터 photoactivation 레이저 및 SLM 격자 패턴 (35)의주의 최적화.
미래의 응용 프로그램
SIM은 여전히 빠르게 진화하는 기술과 생명 과학의 많은 응용 프로그램은 미래에 활성화됩니다. 기술의 속도, 해상도, 콘트라스트 향상 및 표준 형광체의 m을 사용하는 능력EAN은 bioimaging 위해 SIM 그러한 촛점 넓은 필드 플랫폼과 같은 종래의 수많은 현미경 시스템을 대체하기 위해 설정된다. 상용 SIM 시스템 결정적들이 수정 분야에서 최근 연구 개발을 구현하기 위해 개발 될 융통성 있으며, 그러나, 많은 연구 실험실의 금융 도달 넘어서는 뛰어난 기술 사양 오늘날 이미 사용할 수 있으며. 이들은 또한 필수적인 능력 에지 생명 과학 연구 절삭 종종 심각한 병목 '손 실험에 적용될'으로 부족하다. 여기에 설명 된 시스템은 특히 예를 들면 재료 및 물리학에서 표면 화학을 연구하기 위해, 재구성 이중층 시스템을 시험 관내 연구를 위해, 세포 표면 근처 동적 프로세스를 연구하기에 적합한 것이다. 2D 재료, 및 기타 여러 응용 프로그램.
공개
The authors have nothing to disclose.
감사의 말
이 작품은 레버 흄 신뢰, 공학 및 물리 과학 연구위원회에서 교부금에 의해 지원되었다 [EP / H018301 / 1, EP / G037221 / 1] 알츠하이머 리서치 UK [ARUK EG2012A-1]; 웰컴 트러스트 (Wellcome Trust) [089703 / Z / 09 / Z] 의료 연구위원회 [MR / K015850 / 1, MR / K02292X / 1]. 우리는 HEK293 문화의 준비를 위해 각각 LifeAct-GFP의 형질 전환 및 세포질-GFP 세포에 대한 E. Avezov와 M. 루, 감사 및 W. 첸. 우리는 또한 유용한 토론과 제안 현미경의 디자인 지원 K. O'Holleran 감사 및 L. 샤오와 R. Heintzmann.
자료
| Name | Company | Catalog Number | Comments |
| 488 nm laser | Toptica | iBeam SMART | with digital modulation |
| 561 nm laser | Coherent | OBIS LS | with digital modulation |
| 640 nm laser | Cobolt | MLD | with digital modulation |
| Long-pass dichroic mirrors | Thorlabs | for combining excitation beams | |
| Quad band dichroic mirror | Chroma | ZT405/488/561/640rpc | 3 mm thick, TIRF imaging flat, mounted in Olympus BX filter cube |
| Quad band dichroic mirror | Chroma | ZT405/488/561/640rpc | From same batch as above, 25 x 25 mm |
| 1" square kinematic mount | Edmund Optics | 58-860 | |
| Glan-Taylor calcite polarizers | Thorlabs | GT5-A | For alignment of LCVR |
| Glan-Taylor mount | Thorlabs | SM05PM5 | |
| Achromatic half wave plate | Thorlabs | AHWP05M-600 | 400-800 nm |
| Rotation cage mount | Thorlabs | CRM1/M | For HWP |
| Liquid Crystal Variable Retarder | Meadowlark Optics | SWIFT | Custom built to provide full wave retardance over the range 488 to 640 nm. |
| LCVR controller | Meadowlark Optics | D3060HV | Two channel high voltage controller for liquid crystal retarders |
| Achromatic quarter wave plate | Meadowlark Optics | AQM-100-0545 | |
| Rotation cage mount | Thorlabs | CRM1P/M | For QWP |
| 10 mm achromatic doublet | Thorlabs | AC080-010-A-ML | For beam expander |
| 200 mm achromatic doublet | Thorlabs | AC254-200-A-ML | For beam expander |
| Cage XY Translators | Thorlabs | CXY1 | |
| Ferroelectric spatial light modulator | Forth Dimension Displays | M0787-00249 | SXGA-3DM (IFF) Microdisplay Type M249, 1,280 x 1,024 pixels, with driver board |
| SLM mounting frame | Forth Dimension Displays | M0787-10014 | Fixed to custom built aluminium mount |
| Ø50.8 mm Gimbal Mirror Mount | Thorlabs | GM200/M | For SLM mounting |
| Two-Axis Linear Translation Stage with Rotating Platform | Thorlabs | XYR1/M | For SLM mounting |
| Rail carrier | Newport | M-PRC-3 | For SLM mounting |
| Precision Optical Rail | Newport | PRL-6 | For SLM mounting |
| 300 mm achromatic doublet lens | Qioptiq | G322 273 322 | f = 300 mm, 31.5 mm diameter |
| 140 mm achromatic doublet lens | Qioptiq | G322 239 322 | f = 140 mm, 31.5 mm diameter |
| Precision XY Translation Mounts | Thorlabs | LM2XY | |
| Lens Mounting Adapters | Thorlabs | SM2AD32 | For mounting 31.5 mm lenses in 2" mounts |
| Translation stages | Comar | 12XT65 | Dovetail, side drive |
| XY Translator with Differential Drives | Thorlabs | ST1XY-D/M | for spatial filter |
| Rotation cage mount | Thorlabs | CRM1/M | for spatial filter |
| 300 mm achromatic doublet | Thorlabs | AC508-300-A-ML | Excitation tube lens |
| Automated XY stage with Z-piezo top plate | ASI | PZ-2150-XYFT-PZ-IX71 | with MS-2000 controller |
| Inverted microscope frame | Olympus | IX-71 | |
| Objective lens | Olympus | UAPON100XOTIRF | 100X/1.49NA |
| High speed filter wheel | Prior Scientific | HF110A | with Prior ProScan III controller |
| Bandpass emission filters | Semrock | FF01-525/30, FF01-676/29 | |
| sCMOS camera | Hamamatsu | ORCA Flash v4.0 | |
| Stage top incubator | OKO Lab | H301-K-FRAME | For live cell imaging, with Bold Line temperature and CO2 controllers |
| Stainless steel optical posts | Thorlabs | TR series | for mounting optical components |
| Post holders | Thorlabs | PH series | for mounting optical components |
| Kinematic mirror mounts | Thorlabs | KM100 | for mounting 1" mirrors |
| Shearing interferometer | Thorlabs | SI100 | |
| 100 nm fluorescent microspheres | Life Technologies | T-7279 | Tetraspeck |
| Rhodamine 6G | Sigma Aldrich | 83697-250MG | |
| 8 well glass bottom dishes | ibidi | 80827 | with #1.5 coverglass |
| Nunc Lab-Tek II Chambered Coverglass | Thermo Fisher Scientific | 155409 | with #1.5 coverglass |
| 0.01 mm microscope reticle slide | EMS | 68039-22 | |
| CellLight Tubulin-GFP, BacMam 2.0 | Thermo Fisher Scientific | C10613 |
참고문헌
- Heintzmann, R., Cremer, C. G. Laterally modulated excitation microscopy: improvement of resolution by using a diffraction grating. BiOS Eur. 3568, 185-196 (1999).
- Gustafsson, M. G. L. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. J. Microsc. 198 (2), 82-87 (2000).
- Shim, S. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proc. Natl. Acad. Sci. U. S. A. 109 (35), 13978-13983 (2012).
- Urban, N. T., Willig, K. I., Hell, S. W., Nägerl, U. V. STED Nanoscopy of Actin Dynamics in Synapses Deep Inside Living Brain Slices. Biophys. J. 101 (5), 1277-1284 (2011).
- Liu, Z., Lavis, L. D., Betzig, E. Imaging Live-Cell Dynamics and Structure at the Single-Molecule Level. Mol. Cell. 58 (4), 644-659 (2015).
- Westphal, V., et al. Video-Rate Far-Field Optical Nanoscopy Dissects Synaptic Vesicle Movement. Science. 320 (5873), 246-249 (2008).
- Davies, T., et al. CYK4 Promotes Antiparallel Microtubule Bundling by Optimizing MKLP1 Neck Conformation. PLOS Biol. 13 (4), e1002121 (2015).
- Laine, R. F., et al. Structural analysis of herpes simplex virus by optical super-resolution imaging. Nat. Commun. 6, 5980 (2015).
- Pinotsi, D., et al. Direct observation of heterogeneous amyloid fibril growth kinetics via two-color super-resolution microscopy. Nano Lett. 14 (1), 339-345 (2014).
- Esbjörner, E. K., et al. Direct observations of amyloid β Self-assembly in live cells provide insights into differences in the kinetics of Aβ(1-40) and Aβ(1-42) aggregation. Chem. Biol. 21 (6), 732-742 (2014).
- Michel, C. H., et al. Extracellular monomeric tau protein is sufficient to initiate the spread of tau protein pathology. J. Biol. Chem. 289 (2), 956-967 (2014).
- Pinotsi, D., Kaminski Schierle, G. S., Kaminski, C. F. Optical Super-Resolution Imaging of β-Amyloid Aggregation In Vitro and In Vivo: Method and Techniques. Syst. Biol. Alzheimer's Dis. SE - 6. 1303, 125-141 (2016).
- Axelrod, D. Cell-substrate contacts illuminated by total internal reflection fluorescence. J. Cell Biol. 89 (1), 141-145 (1981).
- Cragg, G. E., So, P. T. Lateral resolution enhancement with standing evanescent waves. Opt. Lett. 25 (1), 46-48 (2000).
- Chung, E., Kim, D., So, P. T. Extended resolution wide-field optical imaging: objective-launched standing-wave total internal reflection fluorescence microscopy. Opt. Lett. 31 (7), 945 (2006).
- Kner, P., Chhun, B. B., Griffis, E. R., Winoto, L., Gustafsson, M. G. L. Super-resolution video microscopy of live cells by structured illumination. Nat. Methods. 6 (5), 339-342 (2009).
- Fiolka, R., Shao, L., Rego, E. H., Davidson, M. W., Gustafsson, M. G. L. Time-lapse two-color 3D imaging of live cells with doubled resolution using structured illumination. Proc. Natl. Acad. Sci. U. S. A. 109 (14), 5311-5315 (2012).
- Brunstein, M., Wicker, K., Hérault, K., Heintzmann, R., Oheim, M. Full-field dual-color 100-nm super-resolution imaging reveals organization and dynamics of mitochondrial and ER networks. Opt. Express. 21 (22), 26162-26173 (2013).
- Förster, R., et al. Simple structured illumination microscope setup with high acquisition speed by using a spatial light modulator. Opt. Express. 22 (17), 20663 (2014).
- Lu-Walther, H. W., et al. fastSIM: a practical implementation of fast structured illumination microscopy. Methods Appl. Fluoresc. 3, 014001 (2015).
- Shaw, M., Zajiczek, L., O'Holleran, K. High speed structured illumination microscopy in optically thick samples. Methods. , (2015).
- von Olshausen, P. . Total internal reflection microscopy: super-resolution imaging of bacterial dynamics and dark field imaging. , (2012).
- Gustafsson, M. G. L., et al. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophys. J. 94 (12), 4957-4970 (2008).
- Meadowlark Optics Inc. . Basic Polarization Techniques and Devices. , (2005).
- O'Holleran, K., Shaw, M. Polarization effects on contrast in structured illumination microscopy. Opt. Lett. 37 (22), 4603 (2012).
- Brankner, S. Z., Hobson, M. . Synchronization and Triggering with the ORCA-Flash4.0 Scientific CMOS Camera. , (2013).
- Gustafsson, M. G. L., et al. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophys. J. 94 (12), 4957-4970 (2008).
- Wicker, K. Non-iterative determination of pattern phase in structured illumination microscopy using auto-correlations in Fourier space. Opt. Express. 21 (21), 24692 (2013).
- Boulanger, J., Pustelnik, N., Condat, L. Non-smooth convex optimization for an efficient reconstruction in structured illumination microscopy. 2014 IEEE 11th Int. Symp. Biomed. Imaging. 3 (1), 995-998 (2014).
- Ströhl, F., Kaminski, C. F. A joint Richardson-Lucy deconvolution algorithm for the reconstruction of multifocal structured illumination microscopy data. Methods Appl. Fluoresc. 3 (1), 014002 (2015).
- Mudry, E., et al. Structured illumination microscopy using unknown speckle patterns. Nat. Photonics. 6 (5), 312-315 (2012).
- Ayuk, R., et al. Structured illumination fluorescence microscopy with distorted excitations using a filtered blind-SIM algorithm. Opt. Lett. 38 (22), 4723 (2013).
- Ball, G., et al. SIMcheck: a Toolbox for Successful Super-resolution Structured Illumination Microscopy. Sci. Rep. 5, 15915 (2015).
- York, A. G., et al. Resolution doubling in live, multicellular organisms via multifocal structured illumination microscopy. Nat. Methods. 9 (7), 749-754 (2012).
- Li, D., et al. Extended-resolution structured illumination imaging of endocytic and cytoskeletal dynamics. Science. 349 (6251), (2015).
- York, A. G., et al. Resolution doubling in live, multicellular organisms via multifocal structured illumination microscopy. Nat. Methods. 9 (7), 749-754 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유