Method Article
임상 샘플에서 RNA 바이러스의 편견 깊은 시퀀싱
요약
This protocol describes a rapid and broadly applicable method for unbiased RNA-sequencing of viral samples from human clinical isolates.
초록
여기서 우리 드 노보 어셈블리 및 임상 적, 생물학적 소스로부터 수집 된 바이러스 게놈 내 호스트 변형 통화를 가능하게하는 차세대 RNA 시퀀싱 프로토콜 개요. 이 방법은 편견과 보편적이다 그것은 cDNA 합성을위한 랜덤 프라이머를 사용하고 바이러스 시퀀스 내용의 사전 지식이 필요하지 않습니다. 를 포함하는 폴리 (RA) 캐리어와 리보솜 RNA - - 바이러스 RNA 샘플에서 라이브러리를 구성하기 전에, 선택의 RNase H 기반의 소화는 원치 않는 RNA를 소모하는 데 사용됩니다. 선택적 공핍 데이터 품질과 고유의 수가 바이러스 RNA 서열 라이브러리 판독 모두를 향상시킨다. 그것은 전체 라이브러리 구축 시간을 감소시키기 때문에 또한, 트랜스 기반 'tagmentation'단계는 프로토콜에서 사용된다. 이 프로토콜은 신속하게 깊은 시퀀싱을 사용하도록 설정 한 600 라사와 에볼라 바이러스 샘플을 포함한 혈액과 조직 모두 분리 및 다른 미생물 유전체 연구에 광범위하게 적용에서 컬렉션.
서문
임상 소스에서 바이러스의 차세대 시퀀싱 전송 및 감염의 역학뿐만 아니라 진단 도움말 지원 소설, 백신 및 치료제 개발을 알릴 수 있습니다. 랜덤 프라이머를 이용하여 cDNA 합성을 발산, 공동 감염 게놈 또는 새로운 바이러스 1, 2의 검출 및 조립을 허용했다. 다른 편견 방법과 마찬가지로, 원치 않는 오염 물질이 많은 순서 읽기 및 부정적인 시퀀싱 결과에 영향을 차지한다. 호스트 및 폴리 (RA) 캐리어 RNA는 많은 기존의 바이러스 샘플 컬렉션에 존재하는 오염 물질이다.
프로토콜은 바이어스 총 RNA-서열에 기초한 깊이 시퀀싱 RNA 바이러스 게놈의 효율적이고 경제적 인 방법을 설명한다. 본 방법은 원하지 않는 호스트 리보솜 RNA 캐리어를 제거하기의 RNase H 선택적 공핍 3 단계를 이용한다. 선택적 결핍 바이러스 콘텐츠 (도 1)에 대한 풍부 시퀀싱 데이터의 전체 품질을 향상임상 샘플에서 (그림 2). 또한 tagmentation은 크게 라이브러리 생성 시간을 단축 같은 프로토콜에 적용된다. 이러한 방법은 신속하고 라사 에볼라 바이러스 게놈 2,4,5- 큰 데이터 세트를 생성하는데 사용되었으며, RNA 바이러스의 광범위한 연구하기 위해 사용될 수있다. 마지막으로, 방법은 인간의 샘플에 제한되지 않는다; 선택적 고갈의 유틸리티는 라사에 감염된 설치류와 인간이 아닌 영장류 질환 모델 5,6에서 수집 한 조직 샘플에서 증명되었다.

그림 1. 총 RNA 콘텐츠 농축 선택적 고갈를 사용 라사 바이러스 내용의 반영. 9 가지 임상 분리에서 rRNA의 고갈에 따라 전체 콘텐츠 (RNA 입력) 및 고유 라사 바이러스 (LASV)의 농축 읽기 (라이브러리 내용을) 시작. 이 수치는 6에서 수정되었습니다 . 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
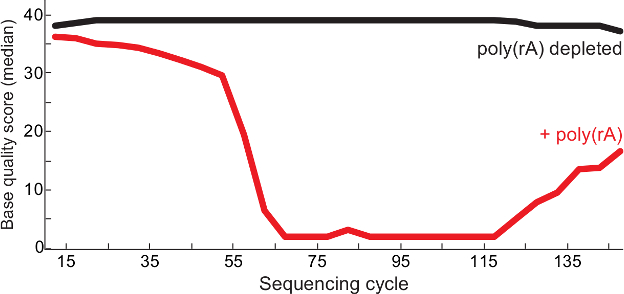
그림 2. 높은 품질 시퀀싱 캐리어 RNA 고갈. 폴리 순서주기 (RA) 당 중간 기본 자질 라사 바이러스 라이브러리 (빨간색) 및 품질 관리 보고서 (13)로부터 제어 (검은 라이브러리에서 관찰없는 캐리어를) -contaminated 후. 모두 1을 읽고 쌍 끝의 2 라이브러리 BAM 파일에 병합 읽기 및 품질 평가 점수는 각 기지에 표시됩니다 읽어 보시기 바랍니다. 이 수치는 6에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
추출에서 직접 라이브러리의 바이러스 성 RNA-SEQ 프로토콜 세부 건설RNA는 임상 적, 생물학적 시료에서 수집. 개인의 안전을 보장하기 위해, 모든 바이러스 혈청, 혈장 및 조직 샘플은 RNA 추출하기 전에 적절한 버퍼에서 불 활성화되어야한다. 일부 불 활성화 및 추출 키트에서, 캐리어 폴리 (RA) RNA가 포함되어 있습니다; 이것은 초기의 RNase H 선택적 고갈 단계에서 제거됩니다. 전체 복구에 기초하여, 캐리어의 예상되는 RNA 농도는 100 NG / μL이다. 프로토콜에서, 110 NG / μL 올리고 DT RNA (1.1 캐리어 농도)는 공핍 사용된다. 폴리 (RA) 캐리어는 샘플에 존재하지 않으면, 올리고 (DT)가 고갈 전에 첨가되어서는 안된다.
다음 프로토콜 (250 μL 부피까지) PCR 플레이트 형식 (24)의 반응을 위해 설계된다. 이 프로토콜의 이전 버전 Matranga, 등으로보고되었다. (6).
프로토콜
윤리 문 : 라사 열 환자는 튤 레인 대학, 하버드 대학, 브로드 연구소, Irrua 전문 교육 병원 (ISTH), 케네 마 정부 병원 (KGH), 건강, 이바 단의 오요 주 교육부에서 사람을 대상으로위원회에 의해 승인 된 프로토콜을 사용하여이 연구를 위해 모집 하였다 나이지리아 보건의 시에라 리온 정부. 모든 환자가 치료의 유사한 표준으로 처리하고, 그들이 연구에 참여하기로 결정 여부 리바비린 약물을 제공 하였다. 라사 열 (LF) 환자, 리바비린 치료는 현재 권장 지침을 따라 일반적으로 빨리 LF 강하게 의심으로 제공되었다.
때문에 에볼라 바이러스 질병 (EVD)에 대한 심각한 발발로, 환자는 우리의 표준 프로토콜을 통해 동의 할 수 없습니다. EVD 환자에서 임상 초과 샘플 대신 사용 평가 및 시에라 리온에 하버드 대학에서 임상 시험 심사 보드에 의해 승인되었다. 작정시에라 리온 윤리 및 과학 심의위원회, 보건 위생의 시에라 리온 정부, 인적 주제의 사용에 하버드위원회의 CE 마크는 시퀀스와 환자와의 접촉 샘플에서 얻은 공개적으로 사용 가능한 바이러스 성 시퀀스를 만들기 위해 동의의 면제를 부여한 시에라 리온에서 에볼라 발생시 수집. 이 단체는 또한 발발 응답하는 동안주의를받는 모든 의심 EVD 환자에서 수집 드 확인 된 샘플에 대한 임상 및 역학 데이터의 사용을 수여했다. 보건 위생의 시에라 리온 정부는 발생 샘플의 게놈 연구에 대한 폭 넓은 연구소와 하버드 대학에 시에라 리온에서 비 감염성, 비 생물학적 샘플의 출하를 승인했다.
샘플 RNA (총 RNA 추출 최대 55 μL ~ 4 시간) 1. DNase를 처리
- 표 1에서 설명한 바와 같이 바이오 캐비닛 얼음에 96 웰 PCR 플레이트에 DNase의 반응을 설정할 1.1 (총 부피 70 μL / 잘) 단계. 참고 : 마스터 믹스 제조 할 수있다.
- 소용돌이 부드럽게하고 철저하게 한 후 1 분 동안 실온에서 280 XG에 원심 분리기.
- 30 분 동안 37 ℃에서 인큐베이션.
- RNA 고체 단계 가역 고정화 (SPRI) 구슬을 사용하여 정리.
- 따뜻한 RNA 비드를 30 분 동안 실온으로.
- 조심스럽게 정착 수있는 자성 입자를 재현 탁하는 RNA 비즈 병을 흔들어. DNase를 처리 RNA (70 μL)에 RNA 구슬의 1.8 배 볼륨 (126 μl를) 추가 피펫으로 10 배를 혼합하고 (물론, 196 μL의 총 부피를) RT에서 5 분 동안 품어.
- 자기 역에 혼합물을 배치합니다. (- 10 분 5) 취소 할 수있는 솔루션을 기다립니다.
- 동안 피펫 및 폐기에 의한 역에 클리어 솔루션을 제거합니다. 역에있는 동안, 70 % 에탄올로 펠렛을 포함하여 구슬을 씻고 1 분 동안 품어. 피펫 및 폐기와 에탄올을 제거합니다. 이 세척의 총 반복합니다.
참고 : 정확하게 70 %를 갓 준비 등을 사용하여샘플 (7)의 손실이 발생할 수 <70 % 에탄올 반면에 높은 비율이, 작은 크기의 분자의 비효율적 세척 발생합니다으로 한올은 중요하다. - 역에 판을 유지하고 자연 건조 개방 둡니다. 참고 : 구슬 균열하기 시작 때까지 비드가 완전히 건조 할 수 있도록해야합니다.
- RNA를 용출 판에 뉴 클레아없는 물 55 μl를 추가합니다. 철저하게 피펫 팅하여 구슬과 물을 혼합 역에서 플레이트를 제거합니다. 참고 : 또는 총 RNA를 집중하기 위해 (10 μL ≤) 적은 물을 사용합니다.
- 다시 역에 접시를 놓습니다. 솔루션은 장기 저장을위한 새로운 스크류 캡 튜브에 피펫으로 전송 클리어 될 때까지 기다립니다 (-80 ° C). 고갈 새로운 96 웰 PCR 플레이트에 5 μL의 RNA를 배치한다 (단계. 2.4).
- 옵션 :. 저장하고 rRNA의의 QRT-PCR 19 μl의 물 (1:20)을 수행 1 μl를 희석 (예를 들면, 18S, 28S rRNA의) (표 2), 바이러스 성 마커 5
바이러스 성 RNA 샘플에서 리보솜과 운반 RNA의 2 선택적 고갈 (~ 4 시간)
- 표 1에 기재된 바와 같이 선형 아크릴 담체와 혼성화 배 및 10 배의 RNase H 반응 버퍼 및 클레아없는 물을 만든다.
- 표 1에 기재된 바와 같이 96 웰 PCR 플레이트에 얼음 rRNA의 공핍 올리고 (표 3) 및 올리고 (DT)와 RNA를 결합하여 혼성화 반응을 설정한다.
참고 : 마스터 믹스 제조 할 수있다. 고유 합성 RNA (ERCCs 8) 50 femtograms (FG)는 바이러스 서열 공정과 잠재 인덱스 판독 교차 오염을 모두 추적을 첨가 할 수있다.- 소용돌이 부드럽게하고 철저하게 한 후 1 분 동안 실온에서 280 XG에 원심 분리기.
초당 -0.1 ° C에서 45 ° C로 2 분, 느린 램핑 95 ° C에서 품어. 45 °의 C에서 열 순환기을 일시 중지합니다.
- 소용돌이 부드럽게하고 철저하게 한 후 1 분 동안 실온에서 280 XG에 원심 분리기.
- 설명으로 얼음의 RNase H의 반응 혼합물을 설정표 1의 D는 다음 2 분 동안 45 ℃에서 예열. 참고 : 마스터 믹스 제조 할 수있다.
- 45 ° C의 열 순환기에 플레이트를 유지하면서 판에 혼성화 반응을 예열하는 RNase H 믹스를 추가한다.
- 8 번 - 부드러운 피펫 (6)에 의해 잘 섞는다. 또 다른 30 분 동안 45 ° C에서 품어. 얼음에 놓습니다.
- 표 1에 설명 된대로 DNase를 얼음에 반응 혼합물을 설정 참고. 마스터 믹스를 제조 할 수있다.
- 플레이트에서의 RNase H 반응을 추가, 소용돌이 부드럽게하고 철저하게 한 후 1 분 동안 실온에서 280 XG에 원심 분리기. 30 분 동안 37 ℃에서 인큐베이션.
- 5 ㎕의 0.5 M EDTA를 추가하여 DNase의 반응을 중지합니다. 소용돌이 부드럽게하고 철저하게 한 후 1 분 동안 실온에서 280 XG에 원심 분리기.
- 1.8 용적 (144 μL)을 사용하여 RNA 비즈 비즈 (단계 1.3 참조)를 사용하여 정리. 클레아없는 물 11 μL에서 용출. 참고 : 안전 저온 저장의 경우, 상점은 RN을 고갈샘플에서 -80 ° C O / N.
3. cDNA를 합성 (~ 6 시간)
- rRNA의 혼합 / 96 웰 PCR 플레이트에 얼음 랜덤 프라이머 캐리어 고갈 RNA 표 1에 기재된 바와 같이, 와류 부드럽게 철저하고 1 분 동안 실온에서 280 × g으로 원심 분리기.
- 열 순환기에서 10 분 동안 70 ℃로 혼합물을 가열한다. 5 분 - 즉시 열 변성 후, 1 얼음에 RNA를 놓습니다. RNA의 이전 제 1 가닥 반응에 이상 5 분 (심지어 얼음) 방치하지 마십시오.
- 표 1과 얼음에 첫 번째 가닥 합성 반응 믹스를 설정합니다.
참고 : 마스터 믹스를 제조 할 수있다.- 접시에 RNA / 랜덤 프라이머 믹스에 추가, 소용돌이 부드럽게하고 철저하게 한 후 1 분 동안 실온에서 280 XG에 원심 분리기. 10 분 동안 25 °의 C - 22 품어.
- 60 분 동안 공기 인큐베이터에서 55 ℃에서 인큐베이션. 반응을 종료 얼음에 플레이트를 놓습니다. 아니E : 공기 인큐베이터의 사용은 프라이머 어닐링 및 제 가닥 신장하기 시작하는 동안 제 1 가닥 반응물을 점차적 온난화를 생성 할 것을 권장한다.
- 표 1에 설명 된 바와 같이 얼음의 2 가닥 합성 반응 믹스를 설정한다.
참고 : 마스터 믹스를 제조 할 수있다.- 접시에 첫 번째 가닥 합성 반응에 추가 소용돌이 부드럽게하고 철저하게 한 후 1 분 동안 실온에서 280 XG에 원심 분리기. 16 ° C (25 ° C에서 뚜껑을 유지)에서 2 시간 동안 품어. 온도가 16 ° C 이상으로 상승하는 것을 허용하지 않습니다.
- 다음 다음 1 분 동안 실온에서 280 XG에 원심 분리기, 부드럽게하고 철저하게 혼합, 0.5 M EDTA의 5 μl를 첨가하여 반응을 비활성화, 얼음에 플레이트를 놓습니다.
- 구슬의 1.8 배 볼륨 (153 μL)를 사용하여 DNA 비즈 (프로토콜의 단계 1.3 참조) 정리. 용출 완충제 9 μL (EB)에서 용출. 정량 1 μl를 저장합니다. subseque에 대한 cDNA를 1 NG를 사용하여NT 단계. cDNA의 농도가 검출 tagmentation 대한 cDNA를 4 μl를 사용하기에 너무 낮 으면 (단계 4.1 참조).
- 안전 저온 저장의 경우, 매장에서의 cDNA를 이중 가닥 4 ° CO / N 또는 -20 장기 저장을위한 C °.
4. 라이브러리 준비 - DNA 도서관 건설 (~ 4 시간)
- 필요한 경우, 96 웰 플레이트에 전사하는 cDNA 4 μl를하고 두 번째 시도에 대한 나머지 cDNA를 저장한다.
- 표 1과 얼음에 tagmentation 반응을 설정합니다.
참고 : 마스터 믹스를 제조 할 수있다. 배경 및 전체 비용을 줄이기 위해 tagmentation 반응의 총 부피는 20 내지 10 μL로 감소된다. cDNA를 제한 요소이므로, 반응에 사용되는 ATM (예 transposome)의 크기는 삽입 부위의 수를 감소하기 위해 감소된다.- 1 분 (실온에서) 280 XG에 부드럽게하고 철저하게 원심 분리 판, 소용돌이에서의 cDNA에 tagmentation 믹스를 추가합니다.10 ° C에서 개최, 5 분 동안 55 ° C에서 품어.
- 일단 10 ° C에서 즉시 반응을 종료 중화 Tagment 버퍼 (NT)의 2.5 μl를 추가합니다. 로 pipetting으로 혼합하고 아래로 다음 1 분 동안 (실온에서) 280 XG에 원심 분리기.
- 5 분 동안 실온에서 인큐베이션.
- 표 1에 설명 된 바와 같이 얼음 PCR 증폭 반응을 설정한다.
- 소용돌이 부드럽게하고 철저하게 한 후 1 분 동안 실온에서 280 XG에 원심 분리기.
- 표 1에 기재된 조건을 이용하여 열 순환기에서 PCR을 수행한다.
참고 : PCR의 12주기가 tagmented cDNA를 1 NG에 대한 제안; 그러나, 바이러스 성 임상 샘플은 종종 cDNA를 발견 할 수없는 양이있다. cDNA를 (<1 NG)의 낮은 양의 시퀀싱을위한 충분한 라이브러리를 만들 PCR의 18주기까지 사용합니다.
- 도서관 준비 - 정리 및 시퀀싱 풀링
- EB 50 μL로 샘플을 가져옵니다.
- 와 정리0.6 볼륨 (30 μL) 구슬을 사용하여 DNA 비즈 (프로토콜의 단계 1.3 참조). 15 ㎕의 EB에서 용출.
- 지역 분석 프라이머 이량 체 (~ 120 BP)를 제외한 bioanalyzer 소프트웨어 (9)를 사용하여 영역 분석 (150 bp의 1,000)를 실시하여 라이브러리 (그림 3)의 농도를 결정합니다. 참고 : 또는 qPCR의 라이브러리 (10)를 정량화하는데 사용될 수있다.
- 이 1nm 이상인 최저 몰 농도 풀 라이브러리. 라이브러리가 1 nm의 아래에있는 경우,이 라이브러리에서 서열 정보를 캡처하는 풀 (다른 라이브러리 ~ 1 배 부피)에 도서관의 작은 볼륨을 추가합니다.
- 위에서 설명한대로 0.7 배의 DNA 구슬 정리 풀 (2 단계 참조). 15 ㎕의 EB에서 용출. 참고 : 구슬의 볼륨 풀의 최종 부피에 따라 달라집니다.
- 풀 9를 분석합니다. 지역 분석 (150 bp의 1,000) (9)을 실시하여 몰 농도를 결정한다. 참고 : 또는 qPCR에 라이브러리 풀 (10) <정량화하는 데 사용할 수 있습니다/ SUP>.
- 이중 바코드 (11)를 읽어와 101 bp의를 생성 오후 10시 라이브러리 농도의로드 시퀀서는, 쌍 엔드 읽습니다.
에볼라 바이러스 임상 샘플에서 건설 3. 라이브러리도. 사 대표 에볼라 바이러스 (EBOV) 라이브러리의 젤 이미지를. 도서관과 프라이머 이량 체의 지역이 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
기술 된 프로토콜은 고유 바이러스 콘텐츠 풍부하면서 고품질 서열의 발생이 낮은 입력 바이러스 RNA 샘플로부터 판독 가능하게한다. 도 1에 도시 된 바와 같이, 프로토콜은 적어도 18S rRNA의 (~ 100 페이지 총 RNA) 중 적어도 하나 만장으로 (비 - 고갈 된 대조군과 비교)의 모든 샘플에서 5 배 고유 라사 바이러스 콘텐츠 농후. 마찬가지로, 시퀀싱의 성공은 소정의 샘플 내의 바이러스의 양의 상관 관계. 바이러스 양에 대한 대리 ~ 가장 자주 전체 어셈블리를 만들어 1000 개 이상의 바이러스 게놈의 복사본을 포함 샘플로 QRT-PCR을 사용하여 (데이터는 도시하지 않음). 또한, 폴리 (RA) 캐리어의 고갈 (그림 2) 읽기 청소기 준비의 결과로 더 나은 품질의 염기 서열을 확보, 도서관에서 A와 T의 단독 중합체 시퀀스를 줄일 수 있습니다. 낮은 입력 바이러스 임상 샘플로부터 최종 라이브러리는 종종 150 내지 1000 bp의 단편을 넓은 길이를 가지고(그림 3).
서열 분석 후, 풀 (12) 내에 라이브러리 간의 샘플 오인 크로스 토크를 줄이기 위해, 단지 인덱스 25 (Q25)의베이스 품질 점수 판독 제로 불일치가 분리 과정 중에 유지되도록. 바이러스 성 게놈은 발산 바이러스 2,4-6에 대한 특정 생물 정보학 파이프 라인을 사용하여 조립된다. 이 도구는 https://github.com/broadinstitute/viral-ngs 또는 상업적 클라우드 플랫폼 (4)를 통해 사용할 수 있습니다.
| 단계 1.1 : DNase의 반응 | |
| 시약 | 반응에 따라 볼륨 (μL) |
| 10 배 DNase의 버퍼 | (7) |
| 클레아없는 물 | 6 |
| 추출 된 바이러스 성 RNA | (55) |
| DNase의 (2 U / & #181; L) | 이 |
| 총 볼륨 | (70) |
| 5 배 하이브리드 버퍼 : 2.1 단계 | |
| 시약 | 1 ml를위한 양 (μL) |
| 5 M NaCl을 | (200) |
| 1 M 트리스 -HCl (PH 7.4) | (500) |
| 클레아없는 물 | (300) |
| 총 볼륨 | 1,000 |
| 단계 2.1 : 10 배의 RNase H의 반응 완충액 | |
| 시약 | 1 ml를위한 양 (μL) |
| 5 M NaCl을 | (200) |
| 1 M 트리스 -HCl (PH 7.5) | (500) |
| 1 M의 MgCl 2 | (200) |
| 클레아없는 물 | (500) |
| 총 볼륨 | 1,000 |
| 단계 2.1 : 물 wi 번째 선형 아크릴 아미드 | |
| 시약 | 1 ml의 버퍼 볼륨 (μL) |
| 클레아없는 물 | 992 |
| 선형 아미드 (5 ㎎ / ㎖) | 8 |
| 총 볼륨 | 1,000 |
| 단계 2.2 : 선택적 공핍 혼성화 반응 | |
| 시약 | 반응에 따라 볼륨 (μL) |
| 5 배 하이브리드 버퍼 | 이 |
| -rRNA의 공핍 올리고 믹스 (100 μM) | 1.22 |
| 올리고 (D) T (550 NG / μL) | 1 |
| DNase의 처리 된 총 RNA | 최대 5 |
| 스파이크 된 RNA (이것은 선택 사항입니다) | 0.5 |
| 물 (선형 아크릴 아미드와) | (10) 총 불러 |
| 총 volu나를 | (10) |
| 단계 2.3 : 선택적 고갈에 대한의 RNase H 반응 | |
| 시약 | 반응에 따라 볼륨 (μL) |
| 10 배의 RNase H의 반응 완충액 | 이 |
| 물 (선형 아크릴 아미드와) | (5) |
| 내열성의 RNase H (5 U / μL) | 삼 |
| 총 볼륨 | (10) |
| 단계 2.4 : DNase의 반응 후 선택적 고갈 | |
| 시약 | 반응에 따라 볼륨 (μL) |
| 10 배 DNase의 버퍼 | 7.5 |
| 물 (선형 아크릴 아미드와) | 44.5 |
| 의 RNase 억제제 (20 U / μL) | 1 |
| 의 RNase없는 DNase의 I를 (2.72 U / μL) | 이 |
| 총 부피 (의 RNase H와 반응) | (75) |
| 단계 3.1 : cDNA 합성, 랜덤 프라이머 하이브리드 | |
| 시약 | 반응에 따라 볼륨 (μL) |
| rRNA의 / 캐리어가 고갈 된 RNA | (10) |
| 3 μg의 랜덤 프라이머 | 1 |
| 총 볼륨 | (11) |
| 단계 3.2 : 첫번째 가닥 cDNA 합성 반응 | |
| 시약 | 볼륨 (μL) |
| 5 배 퍼스트 스트랜드 반응 버퍼 | 4 |
| 0.1 M DTT | 이 |
| 10 밀리미터의 dNTP 믹스 | 1 |
| 의 RNase 억제제 (20 U / μL) | 1 |
| 역전사 효소 (마지막 추가) | 1 |
| (위의 RNA와) 총 볼륨 | (20) |
| 단계 3.3 : 두번째 가닥 cDNA 합성 반응 | |
| 시약 | 볼륨 (μL) |
| 의 RNase없는 물 | (43) |
| 배 둘째 가닥 반응 완충액 | 8 |
| 10 밀리미터의 dNTP 믹스 | 삼 |
| 대장균 DNA 리가 제 (10 U / μL) | 1 |
| 대장균 DNA 중합 효소 I (10 U / μL) | 4 |
| 대장균의 RNase H (2 U / μL) | 1 |
| 전체 볼륨 (1 일 스트랜드 반응) | (80) |
| 단계 4.2 : Tagmentation 반응 | |
| 시약 | 볼륨 (μL) |
| 앰플 리콘 Tagment 믹스 (ATM) | 1 |
| Tagment DNA 버퍼 (TD) | (5) |
| 전체 볼륨 (cDNA를 포함) | (10) |
| 라이브러리 PCR 반응 : 단계 4.3 | |
| 시약 | 볼륨 (μL) |
| PCR 마스터 믹스 (NPM) | 7.5 |
| 인덱스 1 프라이머 (I7) | 2.5 |
| 지수 2 프라이머 (I5) | 2.5 |
| 전체 볼륨 (cDNA의를 tagmented로) | (25) |
| 단계 4.3.2 : 도서관 PCR 조건 | |
| 72 ° C, 3 분 | |
| 95 ° C, 30 초 | |
| 95 ° C에서 18 회 10 초, 55 ° C에서 30 초, 30 초에 최대 72 ° C에서 | |
| 72 ° C, 5 분 | |
| 10 ° C, 영원히 | |
표 1. 반응 설정 및 버퍼 단계별의 모든 버퍼 및 반응 혼합물의 내용 테이블.
표 2 : QRT-PCR 프라이머 시퀀스 호스트 (18S rRNA의) 및 바이러스 (에볼라 및 라사) 함량을 측정하는데 사용하는 프라이머.. 'KGH'는 에볼라 프라이머 2를 시험 하였다 시에라 리온에서 케네 마 정부 병원입니다. 'Kulesh'는 프라이머 세트 (14) 디자인 연구자이다.
표 3 : 리보솜 RNA (rRNA의) 고갈 올리고 선택적 고갈 6 단계에 대한 인간의 rRNA의 보완 195 50 뉴클레오티드 긴 시퀀스.. 이 파일을 다운로드하려면 여기를 클릭하십시오.
| 올리고 이름 | 시퀀스 (5 '3') |
| 에볼라 KGH FW | GTCGTTCCAACAATCGAGCG |
| 에볼라 KGH의 RV | CGTCCCGTAGCTTTRGCCAT |
| 에볼라 KULESH FW | TCTGACATGGATTACCACAAGATC |
| 에볼라 KULESH의 RV | GGATGACTCTTTGCCGAACAATC |
| 라사 SL FW | GTA AGC CCA GCD GYA의 AAB의 CC |
| 라사 SL의 RV | AAG CCA CAG AAA RCT GGS AGC |
| 18S rRNA의 FW | TCCTTTAACGAGGATCCATTGG |
| 18S rRNA의의 RV | CGAGCTTTTTAACTGCAGCAACT |
토론
개설 된 접근 방식은 강력하고 보편적 인, 급속한 시퀀싱을 가능하게하고 2014 년 발발의 2,4- 동안 에볼라 바이러스를 시퀀싱에 사용되었다. tagmentation 라이브러리 구축 선택적 공핍과 cDNA 합성을 연결함으로써, 전체 처리 시간은 이전 어댑터 라이 게이션 방법으로 1 ~ 2 일까지 감소되었다. 최근에,이 프로토콜은 큰 성공 (15, 16)와 국제 공동 작업자 및 다른 사람에 의해 사용되었다, 지역 유전체학 기반 조사 연구 및 진단 (17)를 지원하기 위해 서 아프리카의 실험실에 배포됩니다.
여기에 설명 된 프로토콜은 바이러스 RNA-SEQ의 cDNA 라이브러리를 제조하는 임의의 프라이머를 사용한다. 이전의 바이러스 성 RNA-서열 방식과는 달리, 그것은 어떤 특정 바이러스 또는 계통 군에 대한 시퀀스 데이터 또는 정교하고 시간이 많이 소요되는 프라이머 디자인의 사전 지식을 필요로하지 않는다. 이 방법은 임의의 RNA 바이러스의 샘플에 적용될 수있다. 예를 들면, 모두 에볼라 바이러스로부터 콘텐츠를 생성하는 데 사용 된그리고 라사 샘플 6. 프로토콜은 호스트 transcriptomic, 병원체 군 유전체학 및 검색 서열 프로젝트 하나에 사용될 수있다.
프로토콜의 중요한 단계의 RNase H 소화 높은 처리량 바이러스 샘플로부터 원하지 않는 캐리어 및 숙주 RNA를 제거하기위한 저비용 방법 대상. 프로토콜의 선택적 공핍 단계는 많은 부품을 사용하여 기술과 정확성을 요구한다. 여분의 시간과주의가 초기 설정시주의해야한다.
대부분의 임상 혈청 및 혈장 시료는 종종 아주 작은 핵산을 가지고, 오염 시료 손실이 일반적이다. 이 프로토콜을 사용하는 경우 이러한 문제를 방지하기 위해 특별한주의를 기울여야합니다. 첫째, RNA가 분해에 매우 민감하다; 따라서 모든 영역은 깨끗하고 클레아 없어야합니다. 둘째,이 프로토콜에 사용하기에 적합한 샘플을 식별하는 두 호스트 및 RNA 바이러스 QRT-PCR 분석은 정량 5,6- 사용해야 . 입력을 비교하는 프로토콜에서 시퀀싱 결과, 시퀀싱 성공 금액을 때 (즉, 전체 바이러스 어셈블리에 대한 충분한 데이터의 생성) 적어도 100 페이지 총 RNA 바이러스의 1,000 복사본을 포함 샘플 상관 관계. 핵산의 환경 소스 셋째, 노출은 피해야한다. 여기에 설명 된 프로토콜은 안전주의 사항에 대한 바이오 안전성 캐비닛 및 환경 오염 물질을 제한하는 수행됩니다. 또한, 우리 그룹과 다른 상업 효소는 낮은 입력 샘플 6,18에서 세균의 핵산을 오염의 또 다른 원인이 될 수 있다는 것을 발견했습니다. 깨끗한 작업 공간 (예를 들어, PCR 후드, 바이오 안전성 캐비닛) 및 음성 대조군의 사용 (예를 들면, 물 또는 버퍼)는 각각 완화 및 오염을 추적하는 데 도움이됩니다. 와 샘플은 <총 RNA의 100 페이지는, 단지 폴리 (RA) 캐리어 RNA하지 rRNA의은, 재료의 손실을 제한하면서 고품질의 시퀀싱 결과를 확인하기 위해 소모해야한다. 매우폴리 (RA) 캐리어는 cDNA 합성 전에 제거되어야하지만 낮은 입력 샘플 cDNA를 증폭 방법 (19)에 더 적합 할 수있다.
숙주 rRNA의 고갈 시퀀싱 라이브러리 바이러스 콘텐츠 풍부 혈청 또는 혈장, 설치류 및 비 - 인간 영장류에서 5,6- 조직의 여러 유형을 포함하여 다양한 샘플 수집에 적용 가능하다. 28S rRNA의이 고갈 후 남아에 인간이 아닌 생물에서, rRNA의 인간과 다른 종 6,20 사이에 덜 보존이다 28S를 제안, 정렬 읽기. 비인간 분리하여이 방법을 사용하면, 특정 호스트 3,21의 발산 rRNA의 서열에 상보적인 올리고 DNA로 보충 할 필요가있다.
프로토콜이 편향되기 때문에, 바이러스의 전체 라이브러리 콘텐츠의 작은 부분을 나타낼 수있다 읽는다. rRNA의 가장 풍부한 숙주 RNA 종에만 rRNA의 작은 비율 판독한다 (하지만0 1 %)을 선택적으로 파괴 한 후, 다른 모든 호스트 RNA (예를 들어, mRNA를) 고갈 후 남아 많은 순서 샘플에서 읽기를 차지하고있다 발견된다. 따라서 "오버 샘플링"(즉, oversequencing) 개인 라이브러리는 바이러스 조립 및 변형 통화에 대한 충분한 보상을하기 위해 필요합니다. 우리의 연구를 위해, 우리는 순서에 ~ 20000000 바이러스 성 게놈 및 관련 변종의 분석을위한 충분한 깊이뿐만 아니라 군 유전체학 콘텐츠 2,5을 가지고 샘플 당 읽기를 시도합니다. 군 유전체학 및 병원체 발견 연구를 들면, 숙주 DNA를 오염하는 것은 DNase의 분해에 의해 제거된다는 점에 유의하는 것이 중요하다. 따라서 게놈 DNA를 포함하는 바이러스 및 기타 병원체 과정에서 손실 될 수 있지만 RNA 중간체 여전히 서열화 될 수있다.
공개
The authors have no competing financial interests.
감사의 말
This work has been funded in part with Federal funds from the National Institutes of Health, Office of Director, Innovator (No.: DP2OD06514) (PCS) and from the National Institute of Allergy and Infectious Diseases, National Institutes of Health, Department of Health and Human Services, under Contracts (No:HHSN272200900018C, HHSN272200900049C and U19AI110818).
자료
| Name | Company | Catalog Number | Comments |
| 96-well PCR Plates | VWR | 47743-953 | |
| Strips of Eight Caps | VWR | 47745-512 | |
| Nuclease-free water | Ambion | AM9937 | 50 ml bottle |
| TURBO DNase | Ambion | AM2238 | post RNA extraction step, 2 U/µl, buffer included |
| PCR cycler | any PCR cyclers | ||
| Agencourt RNAClean XP SPRI beads | Beckman Coulter Genomics | A63987 | beads for RNA cleanup |
| Real Time qPCR system | any system | ||
| DynaMag-96 Side Skirted Magnet | Invitrogen | 12027 | |
| 70% Ethanol | prepare fresh | ||
| qRT-PCR primers | IDT DNA | see Table 2 | |
| 5 M NaCl | Ambion | AM9760G | |
| 1 M Tris-HCl pH 7.4 | Sigma | T2663-1L | |
| 1 M Tris-HCl pH 7.5 | Invitrogen | 15567-027 | |
| 1 M MgCl2 | Ambion | AM9530G | |
| Linear acrylamide | Ambion | AM9520 | |
| DNA oligos covering entire rRNA region | IDT DNA | see Table 3, order lab-ready at 100 µM | |
| Oligo (dT) | IDT DNA | 40 nt long, desalted | |
| Hybridase Thermostable RNase H | Epicentre | H39100 | |
| RNase-free DNase Kit | Qiagen | 79254 | post selective depletion step |
| SUPERase-In RNase Inhibitor | Ambion | AM2694 | |
| Random Primers | Invitrogen | 48190-011 | mostly hexamers |
| 10 mM dNTP mix | New England Biolabs | N0447L | |
| SuperScript III Reverse Transcriptase | Invitrogen | 18080-093 | with first-strand buffer, DTT |
| Air Incubator | any air incubator cyclers | ||
| NEBNext Second Strand Synthesis (dNTP-free) Reaction Buffer | New England Biolabs | B6117S | 10x |
| E. coli DNA Ligase | New England Biolabs | M0205L | 10 U/μl |
| E. coli DNA Polymerase I | New England Biolabs | M0209L | 10 U/μl |
| E. coli RNase H | New England Biolabs | M0297L | 2 U/μl |
| 0.5 M EDTA | Ambion | AM9261 | |
| Agencourt AMPure XP SPRI beads | Beckman Coulter Genomics | A63881 | beads for DNA cleanup |
| Elution Buffer | Qiagen | 10 mM Tris HCl, pH 8.5 | |
| Quant-iT dsDNA HS Assay Kit | Invitrogen | Q32854 | |
| Qubit fluorometer | Invitrogen | Q32857 | |
| Nextera XT DNA Sample Prep Kit | Illumina | FC-131-1096 | |
| Nextera XT DNA Index Kit | Illumina | FC-131-1001 | |
| Tapestation 2200 | Agilent | G2965AA | |
| High Sensitivity D1000 reagents | Agilent | 5067-5585 | |
| High Sensitivity D1000 ScreenTape | Agilent | 5067-5584 | |
| BioAnalyzer 2100 | Agilent | G2939AA | |
| High Sensitivity DNA reagents | Agilent | 5067-4626 | |
| Library Quantification Complete kit (Universal) | Kapa Biosystems | KK4824 | alternative to tapestation, bioanalyzer for library quantification |
참고문헌
- Stremlau, M. H., et al. Discovery of novel rhabdoviruses in the blood of healthy individuals from West Africa. PLoS Negl Trop Dis. 9, e0003631(2015).
- Gire, S. K., et al. Genomic surveillance elucidates Ebola virus origin and transmission during the 2014 outbreak. Science. 345, 1369-1372 (2014).
- Morlan, J. D., Qu, K., Sinicropi, D. V. Selective depletion of rRNA enables whole transcriptome profiling of archival fixed tissue. PLoS One. 7, e42882(2012).
- Park, D. J., et al. Ebola Virus Epidemiology, Transmission, and Evolution during Seven Months in Sierra Leone. Cell. 161, 1516-1526 (2015).
- Andersen, K. G., et al. Clinical Sequencing Uncovers Origins and Evolution of Lassa Virus. Cell. 162, 738-750 (2015).
- Matranga, C. B., et al. Enhanced methods for unbiased deep sequencing of Lassa and Ebola RNA viruses from clinical and biological samples. Genome Biol. 15, 519(2014).
- Tang, F., et al. RNA-Seq analysis to capture the transcriptome landscape of a single cell. Nat Protoc. 5, 516-535 (2010).
- Jiang, L., et al. Synthetic spike-in standards for RNA-seq experiments. Genome Res. 21, 1543-1551 (2011).
- Agilennt Technologies. , Available from: http://www.agilent.com/cs/library/usermanuals/Public/G2946-90004_Vespucci_UG_eBook_(NoSecPack).pdf. (2015).
- Kapa Biosystems. , Available from: https://www.kapabiosystems.com/product-applications/products/next-generation-sequencing-2/library-quantification/ (2015).
- Illumina Technologies. , Available from: https://support.illumina.com/content/dam/illumina-support/documents/documentation/system_documentation/miseq/preparing-libraries-for-sequencing-on-miseq-15039740-d.pdf. (2015).
- Kircher, M., Sawyer, S., Meyer, M. Double indexing overcomes inaccuracies in multiplex sequencing on the Illumina platform. Nucleic Acids Res. 40, 3(2012).
- Andrews, S. Babraham Bioinformatics. , Available from: http://www.bioinformatics.babraham.ac.uk/projects/fastqc/ (2010).
- Trombley, A. R., et al. Comprehensive panel of real-time TaqMan polymerase chain reaction assays for detection and absolute quantification of filoviruses, arenaviruses, and New World hantaviruses. Am J Trop Med Hyg. 82, 954-960 (2010).
- Hu, Y., et al. Serial high-resolution analysis of blood virome and host cytokines expression profile of a patient with fatal H7N9 infection by massively parallel RNA sequencing. Clin Microbiol Infect. 21, e1-4 713(2015).
- Simon-Loriere, E., et al. Distinct lineages of Ebola virus in Guinea during the 2014 West African epidemic. Nature. 524, 102-104 (2015).
- Folarin, O. A., Happi, A. N., Happi, C. T. Empowering African genomics for infectious disease control. Genome Biol. 15, 515(2014).
- Blainey, P. C., Quake, S. R. Digital MDA for enumeration of total nucleic acid contamination. Nucleic Acids Res. 39, 19(2011).
- Malboeuf, C. M., et al. Complete viral RNA genome sequencing of ultra-low copy samples by sequence-independent amplification. Nucleic Acids Res. 41, 13(2013).
- Gonzalez, I. L., Sylvester, J. E., Smith, T. F., Stambolian, D., Schmickel, R. D. Ribosomal RNA gene sequences and hominoid phylogeny. Mol Biol Evol. 7, 203-219 (1990).
- Adiconis, X., et al. Comparative analysis of RNA sequencing methods for degraded or low-input samples. Nat Methods. 10, 623-629 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유