Method Article
액체 크로마토 그래피 / 질량 분석 유독 복어의 개선 중합 효소 연쇄 반응 - 제한 조각의 길이 다형성 유전자형
요약
액체 크로마토 그래피 / 질량 분석법에 의해 복어 종 유전형하는 개선 된 중합 효소 연쇄 반응 - 제한 단편 길이 다형성 방법을 설명한다. 역상 실리카 모노리스 컬럼 절단 증폭 산물의 분리에 이용된다. 이 방법은 기본 구성을 식별하는 데 유용 올리고 뉴클레오티드의 모노 이소 토픽 질량을 규명 할 수 있습니다.
초록
중합 효소 연쇄 반응 (PCR) -restriction 단편 길이 다형성 (RFLP) 액체 크로마토 그래피 / 전기 분무 이온화 질량 분석법 (LC / ESI-MS)에 의해 유독 복어 종 유전형위한 방법의 향상된 버전을 설명한다. DNA 추출은 실리카 계 막 DNA 추출 키트를 사용하여 수행된다. 세제없이 PCR 완충액을 사용하여 PCR 증폭 한 후, 제한 효소 반응 액을 정제하지 않고 용액에 첨가된다. 역상 실리카 모노리스 컬럼 및 푸리에 변형 Kingdon이 트랩 분석기를 갖는 고해상도 질량 분석기 각각 분리 및 검출을 위해 사용되는 변환. 400 mM의 1,1,1,3,3,3- 헥사 플루오로 -2- 프로판올로 이루어진 이동상은 15 mM의 트리 에틸 아민 (PH 7.9) 및 메탄올 0.4 ㎖ / 분의 유속으로 전달된다. LC / ESI-MS 분석을위한 사이클 시간은 열 평형 포함 8 분이다. 동위 원소 분포 모델 (을)를 갖는 디컨 볼 루션 소프트웨어올리고 뉴클레오티드 f를 질량 스펙트럼으로부터 대응 된 모노 이소 토픽 질량을 계산하는 데 사용된다. 올리고 뉴클레오티드 (범위 26-79 뉴클레오티드)의 분석을 위해 질량 정확도이었다 0.62 ± 0.74 PPM (N = 280) 및 우수한 정확도 및 정밀도는 잠금 질량 표준을 사용하지 않고 180 시간 동안 지속 하였다.
서문
질량 분석 (MS)은 이온화 1,2- 사용되고 핵산, 매트릭스 보조 레이저 탈착 / 이온화 (MALDI) 및 전기 분무 이온화 (ESI)의 신속하고 신뢰성있는 식별 허용 기술이다. 말디 방법은 일반적으로 비행 시간 (TOF) 분석기와 결합되고; 그러나, MALDI-TOF MS의인가 짧은 올리고 뉴클레오타이드로 제한된다 (~ 25 개 뉴클레오티드 (NT)) 이후의 프래그먼트, 부가 형성 및 낮은 이온화 효율 1,2- 때문에. 반대로, ESI는 긴 올리고 뉴클레오티드 (> 100 NT)에 적용 할 수 있지만, 다수의 다양한 충전 상태 ([M-NH2]가 N-) 생체 거대 분자로부터 동시에 생성되며, 따라서, 분석 물의 질량 상부를 초과 할 수있는 이온을 청구 분광계의 m / z 범위의 제한. 이것은 대응 질량으로 복잡한 스펙트럼의 해석, 즉, 충전 상태의 일련의 변환을 필요디컨 볼 루션을 통해.
작은 분자의 질량 측정의 모노 이소 토픽 질량의 피크, 즉,의 경우, 각 요소의 가장 일반적인 동위 원소를 함유하는 분자의 질량이 가장 풍부한 3 자연적 관찰 하였다. 분자량이 증가함에 따라, 더 높은 m / z와 모노 이소 토픽 피크 동위 원소 분포의 변화는베이스 라인 노이즈 3-5에 의해 가려된다. 모노 아이소 토픽 피크가 더 이상 kDa의 3~10보다 질량 대 검출되면, 중량 평균 분자량은 모노 이소 토픽 질량 (5) 대신 측정에 사용되지 않는다. 이러한 경우, 각각의 피크의 각각의 하나 다에 의해 분리되는 동위 원소 분포는 관찰 될 수있다 때 TOF, 푸리에 Kingdon이 트랩 분석기 (6)를 수정, 변환 또는 푸리에 변환 이온 사이클로트론 공명 등의 고해상도 질량 분석기 분석은 분석을 위해 사용된다. 그러나, 가장 풍부한 피크 (S)는ometimes 평균 분자량 5와 일치하지. 이러한 문제를 정확하게 분석을 결정하는 어려움을 초래할 수 있습니다.
안정 동위 원소의 자연 존재비의 변화와 평균 분자량 결정의 어려움을 감안할 때 모노 이소 토픽 질량의 측정은 생체 분자 3,4의 질량 특성에 적합하다. 실제로, 모노 아이소 토픽 피크가 관찰 여부는, 상기 모노 이소 토픽 질량 모델 검체 4,7-10 계산 이론적으로 관찰 한 동위 원소 분포 패턴을 비교함으로써 추정 될 수있다. 피팅 알고리즘 (8)는 현재 독점 소프트웨어에 통합됩니다.
ESI-MS의 문맥에서, 이중 가닥 DNA, 정제 및 탈염 해리 인해 이온 억제 및 부가 물 형성에 2,10-14 이온화 고장을 피하기 위해 직접 측정에 요구된다. 이러한 절차는 troubl 있습니다esome 그러나, 완전 자동 분석 시스템은 15-20 병원균의 검출을위한 중합 효소 연쇄 반응 (PCR), 샘플 준비 및 ESI-MS와 관련된 상업적으로 개발되어왔다. 또 다른 방법은 분리를위한 액체 크로마토 그래피 (LC)를 소개하고있다. LC는 공존 물질에서 분석의 온라인 분리를 제공하고, 21, 22를 이온화하기 전에 힘든 시료 전처리가 필요하지 않습니다. 그러나, MS 호환 이동상을 사용하여 핵산의 분리는 뉴클레오티드의 음이온 성질 때문에 약물, 펩티드 및 단백질과 같은 대부분의 다른 화합물보다 더 어렵다. LC / MS ESI-가장 성공적인 예는 역상 LC를 이온 쌍의 사용을 포함한다. 1,1,1,3,3,3- 헥사 플루오로 -2- 프로판올의 이동상 (HFIP) -triethylamine (TEA) - 메탄올은 초기 Apffel 등에 의해 제안되었다. 분리 짧은 올리고 뉴클레오티드 (23)를 검출. differentiatio에 대한 LC / ESI-MS의 유전자형의 응용 프로그램병원균 종, 단일 염기 다형성과 짧은 탠덤 반복 N은 더 이상 올리고 뉴클레오티드 1,21,24-33를 분리 할 수 있습니다 모세관 폴리머 모노리스 컬럼을 사용하여보고 된 바있다.
일본과 미국에서는 심각한 식중독을 오인하고 복어 부적절한 제제로 인해 발생하고, 이는 복어의 분포 및 제조 엄격 식품 안전 법규 (34, 35)에 의해 제어되고 있다는 사실에도 불구하고있다. 또한, 복어 추출물을 사용하여 의도적 인 살인 사건은 일본 (36)에서 발생했다. 따라서, 복어 종의 분화는 공중 보건 및 포렌식 조사 관점에서 모두 필요합니다. 자주 복 복어는 다른 종류의 것보다 훨씬 더 고가이기 때문에 또한, 분화 능력은 식품 사기 조사의 문맥에서 필요하다.
여기서, m을 결정하기위한 구체적인 방법역상 실리카 모노리스 컬럼 고분해능 질량 분석기를 사용하여 LC / ESI-MS에 의한 PCR 산물의 질량 onoisotopic 설명한다. 구체적으로, 방법은 MS를 사용하여 동물의 종 분화 제 예인 PCR 제한 단편 길이 다형성 (RFLP) 방법 (37)의 사용에 기초하여 독성 복어 종의 분화를 허용하도록 개발되었다.
프로토콜
1. DNA 추출
참고 사항 : 겔 전기 영동 및 LC / ESI-MS로 DNA 추출 및 사후 PCR 검사에 대해 별도의 공간을 사용합니다. 버퍼 1 (함유 구아니딘 히드로 클로라이드) 및 DNA 추출 키트 프로토콜에 따라 세척 완충액 2 (구아니딘 히드로 클로라이드를 함유하지 않음)을 씻어 에탄올을 추가한다. 생선 샘플은 일본 생선 도매 및 소매 시장에서 얻었다.
- 0.5 ml의 1.5 ml의 microcentrifuge 관에서 물고기 조직의 30 ~ 50 mg을 놓습니다. (핀 피부 제외) 마이크로 주걱을 사용하여 조직 스쿼시.
주 : 핀의 경우에, 침지하는 0.5 ㎖의 튜브를 사용한다. - 용해 버퍼 180 μl를 간단히 테 K와 소용돌이의 40 μl를 추가합니다. 2 시간 또는 밤새위한 블록 히터를 56 ℃에서 인큐베이션. 간단히 배양 동안 매 15 분 텍싱하여 섞는다.
참고 : 완전 용해가 필요하지 않습니다. - 13,000 X g에서 5 분 동안 원심 분리기. 원심 분리 후, 만약 작은 AMO오일 UNT는 간장과 같은 지방산 시료의 경우 표면에 존재하여 버린다. 새로운 1.5 ml의 microcentrifuge 관에 뜨는을 전송합니다.
- 구아니딘 염산염을 포함하는 카오 트로픽 버퍼의 200 μl를 추가하고 텍싱하여 혼합한다. 다시 텍싱에 의해 에탄올 (99.5 %)과 혼합 200 μl를 추가합니다.
- 2 ml의 포집 관에 위치 스핀 컬럼에 혼합물을 전송합니다. 13,000 X g에서 1 분간 원심 분리기. 흐름 -을 통해 폐기하십시오.
주의 : 구아니딘 표백제와 반응성이 높은 화합물을 형성 할 수 있기 때문에 폐기물에 표백제를 추가하지 마십시오. - 13,000 X g에서 1 분 동안 세척 버퍼 1 (포함 구아니딘 염산염) 및 원심 분리기 500 μl를 추가합니다. 을 통해 흐름과 수집 튜브를 폐기하십시오.
- 키트와 함께 제공되는 새로운 2 ㎖의 수집 튜브의 스핀 열의를 놓습니다. 20,000 X g에서 3 분 동안 세척 버퍼 (2) 원심 분리기 500 μl를 추가합니다. 유동 통해 수집 튜브를 폐기하십시오. 새에 스핀 열을 이동1.5 ml의 microcentrifuge 관.
- 피펫 스핀 컬럼 막 중심에 용출 완충액 200 μL. 1 분 후, 6,000 X g에서 1 분간 원심 분리기.
- 피펫 50 UV 일회용 큐벳의 용출액 μL 및 220 ~ 300 nm에서 용출액의 UV 스펙트럼 분광 광도계를 사용하여 260 nm에서 흡광도를 측정한다.
- 260 nm에서의 피크 DNA의 UV 스펙트럼을 확인한다. 간단한 식 사용하여 대략적인 DNA 농도 계산 "DNA 농도 (NG / μL은) 260 나노 미터 × 50에서 흡광도 =".
참고 : 복어의 지느러미에서 추출한 일반적인 DNA 농도는 63 ± 30 NG / μL (N = 20)입니다. - DNA의 농도보다 높은 10 NG / μL이면 / μL 5 NG로 트리스 EDTA (TE) 완충액 (pH 8)로 DNA 샘플을 희석한다.
- -20 ° C에서 샘플을 저장하거나 PCR 증폭 (섹션 2)로 진행합니다.
2. PCR
- 각 extr 25 μl의 PCR을 설정DNA 샘플, 양성 대조군의 오염을 방지하기 위해 클린 벤치에 표 1 및 표 2에 따라, 얼음 및 음성 대조군 (대신 DNA 샘플 ultrapurified 물) (TE 버퍼 pH 8.0에서 표적 서열을 갖는 올리고 뉴클레오티드를 합성 0.2 μM)을 작용.
참고 : 쉬운 조작의 경우, 템플릿 DNA없이 모든 시약을 포함하는 칵테일의 충분한 양을하고 분배. PCR 산물 3 'A 오버행의 첨가를 방지하는 DNA 폴리머 라제를 갖는 교정 작업을 사용한다. - 표 3에 도시 된주기 프로그램을 사용하여 열 순환기에서 PCR 증폭을 수행한다.
3. 효소 소화
- PCR을 용액에 100 mM 트리스 -HCl (pH 7.5), 100 mM의의 MgCl 2, 10 mM의 디티 오 트레이 톨, 500 mM의 NaCl을 함유하는 용액 2 μl를 추가한다.
- 각 제한 효소 1 μL (드라 I 및 MSP I)를 추가하고 부드럽게 섞는다. 일에 37 ° C에서 30 분 동안 품어ermal의 자전거 타는 사람.
- MSP의 생성 I. 스티키 단부를 채우고 나머지 DNA 폴리머 라제를 활성화하기 위해 72 ℃에서 5 분 동안 인큐베이션
- 선택적 : 15 3.33 (중량 %)의 크로스 링크 비율 (%의 C, 비스 아크릴 아미드의 비율) 및 폴리 아크릴 아미드 겔 농도 (%의 T)를 이용하여 폴리 아크릴 아미드 겔 전기 영동에 의해 반응 액을 각 2.5 μl를 분석 (%를 w / v)의 38. 형광 DNA 염색을 사용하여 겔을 염색하고 황색 스크린을 사용하여 청색광 transilluminator가 더블 스트랜드 DNA를 관찰한다.
- 분석 컬럼 손상 것이다 막힘을 방지하기 위해 0.2~0.5 μm의 원심 분리 필터 장치로 반응 용액을 필터.
- 분석 할 때까지 -20 ° C에서 테이퍼 폴리 프로필렌 유리 병 및 저장소에 여과 액을 전송합니다.
4. LC / ESI-MS 분석
- HFIP의 67.2 g (약 42 ㎖), 1 L 병 TEA 1.52 g (약 2.0 ml)에 무게. ultrapurified 물 (LC / MS 감의 955 ML을 추가시약이 완전히 용해 될 때까지 비) 및 교반은 자기 교반기를 사용. 용액의 분취 량을 가지고 pH를 확인 (7.85과 7.95 사이에, 이상적의 pH = 7.9) pH 미터를 사용하여.
참고 : 금속 이온에 의한 오염을 방지하기 위해 병에 나누어지는을 반환하지 마십시오. pH가 7.9을하지 않으면 pH를 조정하고 pH를 다시 측정하는 HFIP 또는 TEA 중 소량의 추가. - 증발을 방지하기 위해 (가정용) 직접 냉각 휴대용 냉장고를 사용하여 병의 냉각 액체 크로마토 그래프의 행으로 병을 연결합니다. B. 라인 메탄올로 채워진 다른 병을 연결합니다
- 보호 컬럼 및 액체 크로마토 그래프로 분석 컬럼 (2.0 × 50 mm의 공극 크기 = 30 ㎚)에 연결합니다. 컬럼을 평형화 초기 이동상 (95 % A 및 5 % B)를 흐르는 시작.
- calibrant 39로 0.5 ㎎ / ㎖ 나트륨 트리 플루오로 아세테이트 (산도 3.5)을 준비합니다.
- 트리 플루오 AC 50mg을 (약 34 μL)를 체중비커의 ID입니다.
- ultrapurified 30 ml의 물을 첨가하고 pH 미터의 도움으로 10 mM의 수산화 나트륨으로 pH 3.5로 적정한다.
- ultrapurified 물 50 ㎖까지 입력합니다. 아세토 니트릴 50 ㎖ (LC / MS 등급)을 추가하고 혼합한다.
- 작동 용액의 일부를 취하여 상온에서 보관. 4 ℃에서 용액의 나머지 부분을 저장한다.
- 다음과 같이 C-트랩의 질소 압력을 줄일 수 있습니다.
참고 : 최근 푸리에, 그대로 단백질 분석에 적합 질량 분석기를 변환 압력을 제어하는 제어 소프트웨어가 있습니다.- 질량 분석기의 왼쪽 상단 덮개를 제거합니다. 은 C-트랩 밸브는 왼쪽 전경의 모퉁이에있다.
- 제어 소프트웨어의 기기 상태 창에서 높은 진공 압력 값을 확인한다.
참고 :이 값은 일반적으로, 3 × 10 -8 바. - 잠금을 해제하고 높은 진공 프레스를 줄이기 위해 매우 천천히 손잡이를 시계 반대 방향으로 회전하는 손잡이를 당겨1/3 (일반적으로 1 × 10 -8 bar)까지 URE. 표시된 압력이 지연된 방식으로 점진적으로 변경해야합니다. 낮은 압력에 대한 경고 메시지를 무시하십시오. 잠글 수있는 손잡이를 밀어 넣습니다.
- 안전을 위해 상단 덮개를 복원합니다.
- 나트륨 트리 플루오로 아세테이트 (39)를 이용하여 질량 분석을 교정.
주 : 일일 질량 교정이 프로토콜로 대체 될 수 있으나, 제조자가 제시 권장 보정이 보정 전에 완료 될 것이다.- 다음 스캔 파라미터 및 튜닝 소프트웨어기구 제어 박스에서 가열 ESI 소스 매개 변수를 설정 스캔 타입을 모든 MS; 검색 범위 m / z 500-4,000; 단편화 (인 소스 충돌 유도 분해 (CID) 전압 60 eV로, 극성이 네거티브, 시스 가스 유량 5; AUX 가스 유량 0; 스윕 가스 자동 이득 제어 (AGC)는 1 × 106 최대 분사 시간 50 밀리 타겟팅 속도 0 흐름, 전압을 스프레이 3 kV의를, 모세관 온도 320 ° C; S-렌즈 무선 주파수 (RF) 수준 (100); 히터 온도 30 ℃로.
- 음이온 입력 목록 m / z 792.85908, 1064.80870, 1336.75832, 1608.70794, 1880.65755, 2152.60717, 2424.55679, 2696.50640, 2968.45602, 3376.38045으로 모니터링 할 수 있습니다.
- 질량 분석 (위치 B)의 계면에 근접한 가열 ESI 프로브를 이동. 프로브와 튜브와 주사기를 연결합니다.
- 임베디드 주사기 펌프를 사용하여 10 μL / 분의 유속으로 일정하게 calibrant 달이다. 사용자 정의 교정 테이블 만 6 낮은 질량 이온 (m / z 792.85908-2152.60717)에서 확인하십시오.
- 신호의 강도가 안정화 된 후 교정을 진행합니다. 보정 한 후에 만 여섯 높은 질량 이온 (m / z 1880.65755-3376.38045)를 확인하고 교정을 진행합니다. 실패를 방지하기 위해 한 번에 모든 이온을 사용하여 교정하지 마십시오.
- 다음 스캔 파라미터 및 튜닝 소프트웨어기구 제어 박스에서 가열 ESI 소스 매개 변수를 설정 스캔 타입을 모든 MS; 검색 범위 m / z 500-4,000; 단편화 (인 소스 충돌 유도 분해 (CID) 전압 60 eV로, 극성이 네거티브, 시스 가스 유량 5; AUX 가스 유량 0; 스윕 가스 자동 이득 제어 (AGC)는 1 × 106 최대 분사 시간 50 밀리 타겟팅 속도 0 흐름, 전압을 스프레이 3 kV의를, 모세관 온도 320 ° C; S-렌즈 무선 주파수 (RF) 수준 (100); 히터 온도 30 ℃로.
- appropria에 프로브를 이동0.4 ㎖ / 분 (위치 D)과의 유량 TE 위치 불활성 금속 튜브와 액체 크로마토 그래프에 연결한다.
- 다음 동조 소프트웨어기구 제어 박스에서 가열 ESI 소스 매개 변수를 설정 시스 가스 유량 (50); AUX 가스 유량 15; 가스 유량 한 스윕; 전압 2.5 kV의 스프레이; 모세관 온도 350 °의 C; S 렌즈 RF 레벨 100; 히터 온도 350 ℃로.
- 쓸모있는 설정 창에서 질량 분석기의 설정 인수 매개 변수를 다음과 같이 방법 시간 8 분; 밸브, 질량 분석기에 3.5-6 분, 0-3.5 및 낭비 6-8 분 전환; 6 분에 런타임 3.5; 음극; 소스 CID 전압 15.0 eV의에; microscans 3; 공칭 해상도 전력 (m에서 / z 200) 140000; AGC 타겟 1 × 106; 최대 이온 시간 50 밀리 초; 스캔 한 수; 검색 범위 m / z 700-3,500; 스펙트럼 데이터 유형 프로필.
- 액체 크로마토 그래프의 설정 매개 변수를 다음과 같이 컬럼 오븐 온도 20 ° C; SAMPL전자 트레이 온도 10 ° C; 구배 프로그램 0-0.5 분 5 % B, 0.5 분 5-30%의 B, 1 ~ 3.5 분, 30 % ~ 40 % B, 3.5 ~ 5 분 40-98%의 B, 5-6 분 98 %의 B, 6 6.05 분 98~5%의 B, 6.05-8 분 5 % B; 속도 0.4 ml / 분 유량.
- 제거는 유리 병의 바닥을 눌러 거품. 샘플을 샘플 튜브 랙을 설정하고 분석을 시작하기 위해 오토 샘플러를 이용하여 샘플의 1.0 μl를 주입.
- 브라우저 소프트웨어를 사용하여 원 데이터 파일을 오픈하여 전체 인수 성공적 양성 및 음성 대조군을 포함한 완료되었는지 확인한다.
주 : 일반적으로, 두 개 또는 세 개의 피크가 4-5.5 분의 체류 시간에서의 총 이온 전류 크로마토 그램에서 관찰 될 복어 DNA가 성공적으로 증폭되고 분해되는 경우.
5. 역대 합과 해석
- 디컨 볼 루션 소프트웨어를 시작합니다. "(동위 원소 해결) 자동 추출"을 선택 실험 유형입니다.
- 다음 매개 변수를 사용하는 방법을 편집 출력 질량 M을; S / N의 thresholD 3, 상대적으로 풍부한 임계 값을 0; 음전하 예; 현재의 크로마토 그램 (XIC) 이온 추출 계산하는 예; m / z 범위 700-3,500; 캐리어 H의 +를 충전; 검출 된 요금 3의 최소; 동위 원소 비 뉴클레오티드; 맞는 계수 80 %; 나머지 임계 값 0 %; 예 중복을 고려; 범위 3-50 충전; 최소 강도 (1); 예상 강도 오류 3.
- 새로운 방법으로 저장을 선택합니다.
- 원시 데이터 파일이 존재하는 디렉토리를 선택합니다. 분석 할 수있는 원시 데이터 파일을 선택하고 버튼을 클릭 '대기열에 추가'.
- 디컨 볼 루션을 시작하는 '실행 큐'탭에서 '실행'버튼을 클릭합니다.
- 큐가 완료되면, 행을 선택하고 컨벌루션의 결과를 얻기 위해 상부 캡션 '열기 결과'를 클릭.
- 표 4를 이용하여 4-5.5 분의 체류 시간에서의 피크로부터 유도 된 모노 이소 토픽 질량의 결과를 해석한다.
결과
세 시판 열은 100 ~ 400 μL / 분의 유량 긴 올리고 뉴클레오티드의 분리에 대해 평가 하였다. 넓은 기공 옥타 탄소 사슬 (C 18) π 결합 미립자 실리카 컬럼 (A)에, 시판의 폴리 (스티렌 - 디 비닐 벤젠) (PS-DVB) 모노리스 컬럼 (B) 및 C (18) π 결합 실리카 모노리스 컬럼 ( c)) (도 1을 비교 하였다. DNA의 이중 가닥 (26, 37, 53 염기쌍)의 세 쌍의 모든 열을 이용하여 분리하고, 18 C π 결합 실리카 모노리스 컬럼은 후속 연구에 사용 하였다.
T.의 근육으로부터 추출한 DNA 시료의 분석 결과를 대표 rubripes는도 2에 도시되어있다. 동위 원소 해결 피크를,도 2a에 도시 한 바와 같이, 성공적으로 모노 이소 토픽 질량을 계산하기 위해 필요하다. 이론과 신체의 체중 측정T.의 ured의 모노 이소 토픽 질량 rubripes는도 2b에 표시됩니다. 엔도 뉴 클레아과 소화의 정제없이 바로 PCR 증폭 이후에 수행되기 때문에, MSP I 효소에 의해 생성 된 3'- 말단 끈끈한 잔여 DNA 폴리머로 채워진다. 합성 DNA 템플릿 유래의 증폭 산물의 분석에 따르면, 질량 정확도 -2.48에서 2.40 ppm으로 (평균 0.62 ± 0.74 ppm으로, N = 280)였다. 따라서, 3 PPM의 질량 공차 종을 (표 4)를 구별을 위해 사용되었다. 테이블을 사용하여, 시장과 상점에서 얻어진 복어 모든 샘플 올바르게 특정 종 (37)으로 구분 하였다.
T.의 합성 DNA 템플릿에서 얻어진 샘플의 주기적 분석에 따르면 chrysops의 분석의 모든 모노 이소 토픽 질량 성공적으로 제작을 위해 ± 3 ppm의에서 결정되었다어떤 질량 보정없이 AST 180 시간 (그림 3). 이 질량 보정이 주 단위로 요구되는 것을 의미한다.
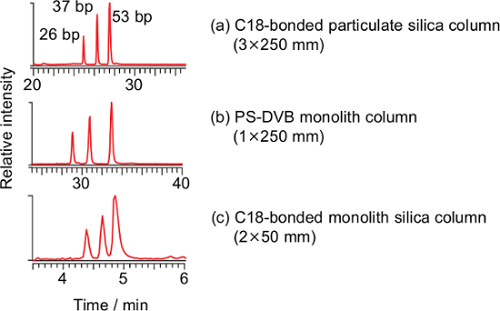
그림 1 : T.의 합성 DNA 템플릿에서 파생 된 PCR-RFLP 제품의 총 이온 전류 크로마토 그램 Pardalis- 가까이는 C 18 π 결합 미립자 실리카 컬럼 (a, 3 × 250mm, 입자 직경이 3 μm), 폴리 (스티렌 - 디 비닐 벤젠)을 사용하여 (PS-DVB) 모노리스 컬럼 (B, 1.0 × 250mm) 및 C (18) π 결합 모노리스 실리카 컬럼 (c, 본 방법) (a)의 조건 :. 유속 0.2 ml / 분; 메탄올의 비율, 0-2 분 5 %, 2-5 분 5 % -25 %, 5 ~ 20 분 25 % -40 %, 20 ~ 35 분 40 % -98 %, 35 ~ 50 분 98 %, 50 51 분 98 % -5 %, 51-65 분, 5 %. 조건 (b) :속도 0.1 ㎖ / 분; 메탄올의 비율, 0-2 분 5 %, 2-5 분 5 % -25 %, 5-35 분 25 % -40 %, 35 ~ 40 분 40 % -98 %, 40-55 분 98 %, 55- 56 분 98 % -5 %, 56-70 분, 5 %. 두 열의 온도는 20 ° C이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
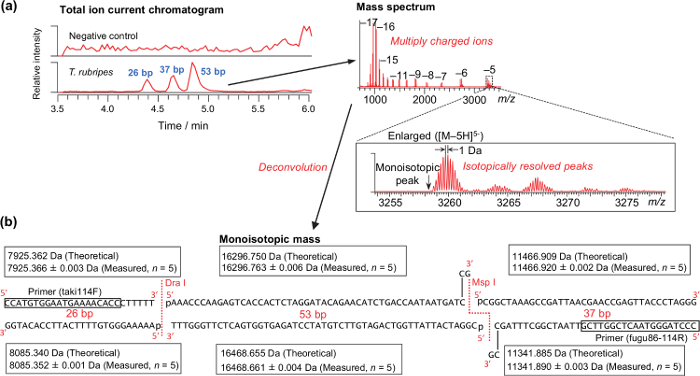
그림 2 : T.의 원시 근육 분석을위한 대표 결과 rubripes. (a) 전형적인 총 이온 전류 크로마토 그램 및 질량 스펙트럼을 나타낸다. (b) T.의 합성 DNA 템플릿 유래의 PCR-RFLP 제품의 이론적 측정 된 모노 이소 토픽 질량 rubripes. 대형을 보려면 여기를 클릭하십시오이 그림의 R 버전입니다.
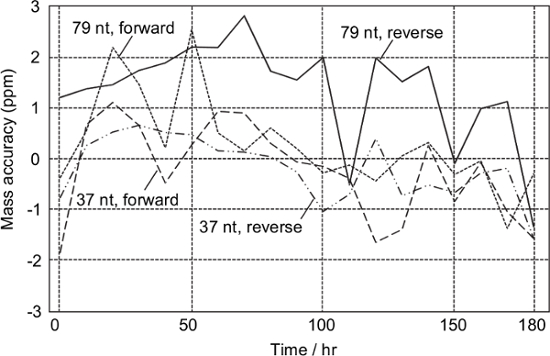
그림 3 :. (T)의 합성 DNA에서 파생 된 안정성 테스트 소화 증폭 chrysops는 매 10 시간을 분석 하였다. 질량 보정이 시험 중에 수행되지 않았습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 이름 | 순서 |
| lago86F | 5'-CCATGTGGAATGAAAACACC -3'- |
| taki114F | 5'-AAAAACAAGAGCCACAGCTCTAA -3'- |
| fugu86-114R | 5'-CCCTAGGGTAACTCGGTTCG -3'- |
표 1 : PCR 프라이머.
| PCR 시약 | 볼륨 사용 | 최종 농도 |
| Ultrapurified 물 | 15.75 μL | |
| 세제없이 5 배 버퍼 | 5.0 μL | 1 배 |
| 의 dNTP 믹스 (10 mM의 각) | 0.5 μL | 0.2 밀리미터 |
| 프라이머 믹스 (TE 버퍼 pH 8.0에서 10 μM lago86F, taki114F 및 fugu86-114R 각) | 1.0 μL | 0.4 μM 각 |
| DNA 중합 효소 (2.5 유닛 / μL) | 0.25 μL | 0.1 단위 / μL |
| TE 버퍼 pH의 템플릿 DNA 8.0 (5.0-10 NG / 추출 된 샘플 μL, 양성 대조군 합성 DNA 0.2 μM) | 2.5 μL | 0.5-1.0 Ng / 추출 된 DNA에 대한 μL 및 합성 DNA 20 nM의 |
| 총 25 μL |
표 2 : 25 μl의 규모 PCR의 구성 요소.
| 주기 | 조건 | 기능 |
| 1 | 95 ° C에서 2 분 | 초기 변성 |
| 이 | 95 ° C에서 30 초 | 변성 |
| 삼 | 56 ° C에서 30 초 | 가열 냉각 |
| 4 | 72 ° C에서 30 초 | 연장 |
| (5) | 2-4 (완전히 30 회)을 반복 | |
| 6 | 72 ° C에서 7 분 | 최종 신장 |
| (7) | 샘플을 제거 할 때까지 12 ° C에서 홀드 |
표 3 : PCR 프로그램입니다.
| 4.0-5.5 분의 체류 시간에서의 피크 개수 | 범위의 세 번째 피크의 모노 이소 토픽 질량 (다) | 범위의 제 2 피크의 모노 이소 토픽 질량 (다) | 복어 종 | ||
| 작은 가닥 | 큰 가닥 | 작은 가닥 | 큰 가닥 | ||
| 이 | → | → | 15890.707-15890.803 | 16177.531-16177.629 | L. inermis |
| 15921.702-15921.797 | 16146.537-16146.634 | L.의 gloveri | |||
| 15930.713-15930.809 | 16137.525-16137.622 | L.의 lunaris | |||
| 15937.697-15937.792 | 16131.537-16131.634 | L. wheeleri | |||
| 24173.034-24173.179 | 24566.905-24567.053 | T.의 chrysops | |||
| 삼 | 16295.706-16295.804 | 16467.610-16467.709 | 11341.851-11341.919 | 11466.875-11466.944 | T. Pardalis- 가까이 T. snyderi T. ocellatus T.의 xanthopterus T.의 stictonotus |
| 11654.908-11654.978 | 11770.920-11770.991 | T.의 niphobles | |||
| 16296.701-16296.799 | 16468.605-16468.704 | → | → | T.의 rubripes | |
| 16311.701-16311.799 | 16452.610-16452.709 | → | → | T.의 poecilonotus T.의 exascurus | |
| 16320.713-16320.811 | 16443.599-16443.697 | → | → | T.의 porphyreus T.의 obscurus에 | |
| 16599.751-16599.851 | 16780.667-16780.767 | → | → | T. vermicularis | |
표 4 : LC / ESI-MS에서 파생 된 모노 이소 토픽 질량에서 복어의 차별화.

표 5 : 증폭 된 DNA 서열 (a) 시퀀스는 동일하다.즉, 표 4에 설명 된대로 다른 복어 종. 이 테이블의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
DNA를 추출하기 위해, 혈액 및 조직으로부터 DNA를 추출하기위한 상업용 키트는 사소한 변형 (프로 테이나 제 K의 양 용해 액을 원심 분리)로 제조자의 프로토콜에 따라 사용된다. 그러나, 임의 추출 키트 한 세포 DNA가 PCR에 적합한 복구 및 순도로 추출 수로 사용될 수있다. 이 방법은 근육, 지느러미, 간, 난소, 피부 (37)를 사용하여 테스트되었습니다. 핀 때문에, 냉동, 건조 삶은 구운 복어 샘플이 성공적으로 37 시험 하였다 테 K. 신선한로 빠르게 용해을 수있는 넓은 표면적, 특히 적합하다.
상기 증폭 된 PCR 프라이머 세트 (표 1)에 대한 설계 복어 복어의 미토콘드리아 16S 리보솜 RNA 유전자를 증폭한다. 증폭 대상 DNA는 114-115 bp의 (속 Takifugu), 86 bp의 (속 Lagocephalus) (표 5)입니다. developme에 방법을 용이NT, 표적 서열을 가지는 합성 올리고 뉴클레오티드 대신에 정통 복어 표본을 수집하는 참조 용으로 사용되었다. 상기 프라이머 세트는 목적에 대응하여 설정된 또 다른 프라이머로 대체 될 수 있지만, 효소 분해 후 최종 DNA 길이가 성공적 컨벌루션 필요한 질량 스펙트럼의 품질 유지의 관점에서 NT 100 미만이어야한다. 또한, C-트랩 질소 압력은 표적 올리고 뉴클레오타이드는 약 75 이상 NT보다 때 감소와 질량 스펙트럼의 품질 성공 컨벌루션 불충분한다. 이러한 제한은 프로토콜 절에 설명 달리 섀시 내부의 C-트랩 밸브 조정되어야 구 소프트웨어에서 최근 개발을 통해 제어 될 수있다. 샘플 준비에 대해서는, 세정제없이 시약의 사용은 적절한 피크 형상 충분한 피크 강도 안정 유지 시간 (31)의 측면에서 후속 LC 중요하다.
은 PS-DVB 모세관 모노리스 컬럼 21,24-33하는 C 18 역상 미립자 실리카 컬럼 23,40,41 및 소수성 상호 작용 크로마토 그래피 (HILIC) 칼럼 (42)가 LC 사용되어왔다 / 올리고 뉴클레오티드의 ESI-MS 분석. 그중 모세관 모노리스 컬럼 분리 능력의 관점에서 다른보다 우수하지만, 최근의 연구에 사용 된 모세관 모노리스 컬럼 자체 제작 및 계측을 필요로하는 낮은 유량 (2 μL / 분)로 작동시켰다 마이크로 LC 최선을 다하고 있습니다. 간단한 조작을 용이하게하기 위해, 시판되는 열은 더 높은 유속 (100-400 μL / 분)의 긴 올리고 뉴클레오타이드의 분리에 대해 평가 하였다. DNA 이중 가닥 (26, 37, 53 염기쌍)의 세 쌍은 상술 된 열을 이용하여 분리하고,하지만 C 18 π 결합 미립자 실리카 컬럼 및 PS-DVB 모노리스 컬럼의 사이클 시간은 각각 65, 70 분이었다 상기 C의 반면 18 π 결합 실리카 모노리스 열은 8 분 (그림 1)이었다. 고려 신속한 분석을 고려하여 C (18) π 결합 실리카 모노리스 열이 제한된 분리 용량에도 불구하고 우리의 목적을 위해 선택되었다; 그러나 개선 된 분리가 요구되는 경우, 나머지 두 개의 열이 이용 될 수있다. 이론적으로, 모노리스 컬럼의 경우가 더 삽입 볼륨없고 이동상 따라서 효율적인 분리 (27)를 가능하게 일관된 경로 길이를 유지하면서, 고상의 기공을 통해 흐르도록 강요된다. 이러한 방법은 대형 분자의 느린 확산로서는, 올리고 뉴클레오티드로서, 특히 생체 거대 분자의 분석에서 발현 될 것이다. 모노리스 컬럼의 실질적인 장점 중 하나는 배압 미립자 실리카 컬럼 (27)보다 낮다는 것이다. 높은 플로우 레이트 (400 μL / 분) 및 낮은 칼럼 온도 (20 ℃)에서의 최대 배압 불구시스템은 MPA는 37 12.5이었다. 이것은 긴 올리고 뉴클레오타이드의 신속한 분석을 위해 C 18 π 결합 실리카 모노리스 컬럼의 이점의 제 증명이다. 높은 유속에 의해, 경계면에서 마이크로 LC 정확한 정렬을위한 전용 장비가 요구되지 않는다. 대신에, 가열 ESI 프로브는 DNA 이중 가닥을 해리 및 후술하는 바와 같이 DNA의 이온화를 지원하기 위해 필요하다.
이온 쌍 크로마토 그래피는 일반적으로 뉴클레오티드의 MS 호환 분리를 위해 사용된다. 그러나, 이온 쌍 시약은 일반적 ESI 공정을 방해하고 ESI-MS의 민감도를 감소시킨다. 따라서, HFIP 자주 올리고 뉴클레오타이드의 감도를 향상시키기 위해 상기 이동 단계에 사용된다. 그러나, HFIP (비점 59 ° C)을 메탄올 (비점 65 ℃), 따라서, 용매의 이러한 손실의 pH를 증가시키고, 이온 쌍 시약의 분해를 촉진 (예 : TEA) 전에 계면에서 급속히 증발올리고 뉴클레오티드에서. 본 방법은 350 ℃에서 고온의 질소 가스로 용출액 nebulizes 가열 ESI 프로브를 사용하기 때문에,이 효과가 지나치게 강조 할 수있다. 때문에 미량의 금속 이온 (33) 부가 형성의 감소 유전자형 분석 대신 HFIP-TEA 완충액, 및 ERB Oberacher는 cyclohexyldimethylammonium 아세테이트 (PH 8.4 CycHDMAA)를 권장합니다. 저자 CycHDMAA 자체가 금속 부가 물의 형성을 억제하는 것으로 추론. 문헌에도 불구하고, 상당한 부가 형성은 본 발명의 방법에서 관찰되지 않았다. 또한, HFIP-TEA - 메탄올 계의 주목할만한 장점은 HFIP-TEA - 메탄올 계 얻어진 피크 면적 T.의 86 bp의 증폭 물을 분석시 CycHDMAA 아세토 니트릴 시스템에 의한 것보다 17 배 더 컸다 있다는 poecilonotus (데이터 미도시). HFIP-TEA - 메탄올 계의 하나의 단점은, 그러나, CycHDMAA 아세토 니트릴 시스템에 대해 증가 된 비용이다.
모노 이소 토픽 질량의 계산은 곱셈으로 하전 된 이온의 동위 원소 피크의 분리가 필요합니다. 따라서, 해상도는, 본 분석을 위해 중요하다. 필요한 해상도 전력 검체의 염기쌍 길이에 의존하지만, 수만의 해상력이 종래의 TOF 분석기는 짧은 올리고 뉴클레오티드의 분석을 위해 제한 될 수있다.
표 4에 나타낸 이론 모노 이소 토픽 질량은 분석의 대응하는베이스 조성물로부터 계산 하였다. 대안 적으로, Muddiman는 외. 정확한 질량 (43)로부터베이스 조성물을 계산하는 소프트웨어 애플리케이션을 개발했다. 비슷한 프로그램이 자동 ESI-MS 시스템 16-18로 통합되었다. 측정 된 모노 이소 토픽 질량 항상 고유베이스 조성물 O에 대응하지 않기 때문에 이러한 알고리즘의 사용은 본 방법의 안정성을 향상시킬 수있다피할 수없는 측정 오차로 인한 3 ppm으로의 질량 허용 오차에 날개. 불행하게도, 우리는 본 연구를 위해이 소프트웨어 제품을 얻을 수있다.
본 방법은베이스 조성물의 분석에 기초 구체적 복어 설계된 절차를 포함하지 않기 때문에, 본 모노 이소 토픽 질량 계 종 결정 복어의 분화뿐만 아니라 다른 DNA 다형성의 검출뿐만 아니라, 적합 할 수있다. DNA 다형성의 검출에 관해서는, 전용의 ESI-MS 시스템은 병원체의 검출 15,17,18,20,30 같은 진단 사용하기에 적합 할 수있는 완전 자동화 및 작동이 용이하다. 반대로, 본 발명의 방법은 연구 용도에 적합하므로 일반적인 연구 장비 및 장치와,와 가능하다. ESI-MS는 이미 단일 염기 다형성 13,28,32, 짧은 탠덤 반복 (26)로 인간의 DNA 다형성에 적용되었습니다그리고 미토콘드리아 DNA는 16, 19는 analsis. 마이크로 RNA는 모세관 LC / ESI-MS (44)를 통해 분석 하였다. 이러한 번역 프로그램도 본 방법에 의해 실현 될 수있다. 또한,이 방법은 저온 분리 때문에 항생제의 작용과 리보솜 RNA 올리고 45과 저분자 화합물 간의 상호 작용을 모니터링하는 데 적합 할 수있다. 이러한 경우, 올리고 뉴클레오티드 및 저분자 화합물은 LC / ESI-MS를 사용하는 장점이있는 동시에 검출한다.
계측은 생거 시퀀싱 및 실시간 PCR과 같은 종래 기술과 같이 병렬 분석을 수행하기에 적합하지 않은 한계가있다. 또한, 본 발명의 방법은 단지베이스 조성물과 동일 분자 내의 염기 치환이 구별 될 수없는 식별한다. 그러나, 여기에 설명 된 MS 기반 DNA 분석 정지 기간의 장점을 가질 수있다이러한 전기 영동 및 실시간 PCR 등의 염료 계 기술을 결합 DNA와 비교하여 정확도들.
공개
The authors have nothing to disclose.
감사의 말
This work was supported by a Grant-in-Aid for Scientific Research by the Japanese Society for the Promotion of Science (15K08060).
자료
| Name | Company | Catalog Number | Comments |
| DNeasy Blood & Tissue Kit (50) | Qiagen | 69504 | DNA extraction kit |
| Proteinase K | Qiagen | 19131 | |
| Ethanol (99.5+ vol%) | Wako | 054-07225 | For dilution of wash buffers |
| TE buffer (pH 8.0) | Wako | 310-90023 | For dilution of DNA sample |
| PCR primer | Fasmac | NA | Purified with reverse-phase cartridge column by the supplier |
| Template DNA | Eurofins Genomics | NA | Purified by HPLC by the supplier |
| Ultrapurified water | NA | NA | Generated with a Milli-Q Direct water purification system (Merck Millipore), used for sample preparation |
| Detergent Free 5x Phusion HF Buffer | Thermo Fisher | F-520L | Use instead of the provided buffer of DNA polymerase |
| Pfu-X DNA polymerase | Jena Bioscience | PCR-207S | |
| dNTP mix (20 mM each) | Jena Bioscience | NA | Supplied with the DNA polymerase |
| 10× Universal buffer M | Takara Bio | NA | Containing 100 mM Tris-HCl (pH 7.5), 100 mM MgCl2, 10 mM dithiothreitol and 500 mM NaCl |
| Dra I | Thermo Fisher | FD0224 | Restriction enzyme |
| Msp I | Thermo Fisher | FD0544 | Restriction enzyme |
| 1,1,1,3,3,3-hexafluoro-2-propanol (HFIP) | Fluka | 42060-50ML | Eluent additive for LC-MS grade. |
| Triethylamine (TEA) | Fluka | 65897-50ML | Eluent additive for LC-MS grade. |
| Trifluoroacetic acid | Sigma-Aldrich | T6508 | For preparation of calibrant. |
| Sodium hydroxide (1.0 M) | Fluka | 72082 | Dilute to 10 mM with ultrapurified water and use for titration of trifluoroacetic acid. |
| Acetonitrile | Fluka | 34967 | For preparation of calibrant, LC/MS grade. |
| Methanol | Kanto | 25185-76 | For mobile phase, LC/MS grade. |
| Water | Thermo Fisher | W6-1 | For mobile phase, LC/MS grade. |
| Microcentrifuge tube (0.5 ml) | Eppendorf | 0030123301 | PCR clean grade |
| Microcentrifuge tube (1.5 ml) | Eppendorf | 0030123328 | PCR clean grade |
| UVette | Eppendorf | 0030106300 | Disposable UV cuvette. |
| Gel Green | Biotium | 41004 | Fluorescent DNA stain |
| Cosmospin filter G (0.2 μm) | Nakalai Tesque | 06549-44 | Made of hydrophilic polytetrafluoroethylene (PTFE) membrane. Any centrifugal filter unit (pore size, 0.2–0.5 μm) made of hydrophilic PTFE or another low-binding membrane is applicable. |
| 300 μl PP screw vial | American Chromatography Supplies | V0309P-1232 | |
| Preassembled screw cap and septa | Finneran | 5395-09R | |
| Monobis C18 analytical column (2.0×50 mm, mesopore size = 30 nm) | Kyoto Monotech | 2050H30ODS | Outside Japan, available for purchase from GL Sciences via its distributors. (http://www.glsciences.com/distributors/) |
| Monobis C18 guard column | Kyoto Monotech | GCSET-ODS3210 | Holder included. |
| Cadenza CW-C18 (3.0×250 mm) | Imtakt | CW036 | C18-bonded particulate silica column |
| ProSwift RP-4H (1.0×250 mm) | Thermo Fisher | 066640 | Poly(styrene-divinylbenzene) monolith column |
| Themo Mixer C | Eppendorf | 5382 000.023 | For digestion of fish tissues. |
| Spectrophotometer | Shimadzu | UV-3150 | Quantification of DNA concentration. |
| Thermal cycler | Bio-Rad | T100 | |
| Portable refrigerator | Twinbird | D-CUBE | For aqueous mobile phase to avoid evaporation of HFIP. This can be replaced by an ice box. |
| Ultimate 3000 liquid chromatograph | Thermo Fisher | NA | |
| Q Exactive mass spectrometer | Thermo Fisher | NA | Fourier transform mass spectrometer equipped with the modified Kingdon trap analyzer. |
| Protein deconvolution 3.0 | Thermo Fisher | NA | Use version 3.0 or higher having an isotopic patter model of nucleotide. |
참고문헌
- Oberacher, H. On the use of different mass spectrometric techniques for characterization of sequence variability in genomic DNA. Anal. Bioanal. Chem. 391, 135-149 (2008).
- Banoub, J. H., Miller-Banoub, J., Jahouh, F., Joly, N., Martin, P., Banoub, J. H., Limbach, P. A. Chapter 1, Overview of recent developments in the mass spectrometry of nucleic acid and constituents. Mass spectrometry of nucleosides and nucleic acids. 1, 1-90 (2010).
- Yergey, J., Heller, D., Hansen, G., Cotter, R. J., Fenselau, C. Isotopic distributions in mass spectra of large molecules. Anal. Chem. 55, 353-356 (1983).
- Zubarev, R. A., Demirev, P. A. Isotope depletion of large biomolecules: Implications for molecular mass measurements. J. Am. Soc. Mass Spectrom. 9, 149-156 (1998).
- Null, A. P., Muddiman, D. C. Determination of a correction to improve mass measurement accuracy of isotopically unresolved polymerase chain reaction amplicons by electrospray ionization Fourier transform ion cyclotron resonance mass spectrometry. Rapid Commun. Mass Spectrom. 17, 1714-1722 (2003).
- Hu, Q., Noll, R. J., Li, H., Makarov, A., Hardman, M., Cooks, R. G. The Orbitrap: a new mass spectrometer. J Mass Spectrom. 40, 430-443 (2005).
- Senko, M. W., Beu, S. C., McLaffertycor, F. W. Determination of monoisotopic masses and ion populations for large biomolecules from resolved isotopic distributions. J. Am. Soc. Mass Spectrom. 6, 229-233 (1995).
- Horn, D. M., Zubarev, R. A., McLafferty, F. W. Automated reduction and interpretation of high resolution electrospray mass spectra of large molecules. J. Am. Soc. Mass Spectrom. 11, 320-332 (2000).
- Frahm, J. L., Mason, C. J., Muddiman, D. C. Utility of accurate monoisotopic mass measurements to confidently identify lambda exonuclease generated single-stranded amplicons containing 7-deaza analogs by electrospray ionization FT-ICR mass spectrometry. Int. J. Mass Spectrom. 234, 79-87 (2004).
- Frahm, J. L., Muddiman, D. C. Nucleic Acid analysis by fourier transform ion cyclotron resonance mass spectrometry at the beginning of the twenty-first century. Curr. Pharm. Des. 11, 2593-2613 (2005).
- Null, A. P., George, L. T., Muddiman, D. C. Evaluation of sample preparation techniques for mass measurements of PCR products using ESI-FT-ICR mass spectrometry. J. Am. Soc. Mass Spectrom. 13, 338-344 (2002).
- Null, A. P., Benson, L. M., Muddiman, D. C. Enzymatic strategies for the characterization of nucleic acids by electrospray ionization mass spectrometry. Rapid Commun. Mass Spectrom. 17, 2699-2706 (2003).
- Manduzio, H., Ezan, E., Fenaille, F. Evaluation of the LTQ-Orbitrap mass spectrometer for the analysis of polymerase chain reaction products. Rapid Commun. Mass Spectrom. 24, 3501-3509 (2010).
- Manduzio, H., Martelet, A., Ezan, E., Fenaille, F. Comparison of approaches for purifying and desalting polymerase chain reaction products prior to electrospray ionization mass spectrometry. Anal. Biochem. 398, 272-274 (2010).
- Hofstadler, S. A., et al. TIGER: the universal biosensor. Int. J. Mass Spectrom. 242, 23-41 (2005).
- Eduardoff, M., et al. Mass spectrometric base composition profiling: Implications for forensic mtDNA databasing. Forensic Sci. Int. Genet. 7, 587-592 (2013).
- Tang, Y. W., et al. Clinical accuracy of a PLEX-ID flu device for simultaneous detection and identification of influenza viruses A and B. J. Clin. Microbiol. 51, 40-45 (2013).
- Legoff, J., et al. Broad-range PCR-electrospray ionization mass spectrometry for detection and typing of adenovirus and other opportunistic viruses in stem cell transplant patients. J. Clin. Microbiol. 51, 4186-4192 (2013).
- Kiesler, K. M., Coble, M. D., Hall, T. A., Vallone, P. M. Comparison of base composition analysis and Sanger sequencing of mitochondrial DNA for four U.S. population groups. Forensic Sci. Int. Genet. 8, 226-232 (2014).
- Bacconi, A., et al. Improved sensitivity for molecular detection of bacterial and Candida infections in blood. J. Clin. Microbiol. 52, 3164-3174 (2014).
- Huber, C. G., Oberacher, H. Analysis of nucleic acids by on-line liquid chromatography-mass spectrometry. Mass Spectrom. Rev. 20, 310-343 (2001).
- Pourshahian, S., McCarthy, S. M., Bonilla, J. V., Srivatsa, G. S. Chapter 4, Analysis of oligonucleotides by liquid chromatography and mass spectrometry. Handbook of Analysis of Oligonucleotides and Related Products. , 137-166 (2011).
- Apffel, A., Chakel, J. A., Fischer, S., Lichtenwalter, K., Hancock, W. S. Analysis of Oligonucleotides by HPLC-Electrospray Ionization Mass Spectrometry. Anal. Chem. 69, 1320-1325 (1997).
- Premstaller, A., Oberacher, H., Huber, C. G. High-performance liquid chromatography-electrospray ionization mass spectrometry of single- and double-stranded nucleic acids using monolithic capillary columns. Anal. Chem. 72, 4386-4393 (2000).
- Oberacher, H., Oefner, P. J., Parson, W., Huber, C. G. On-Line Liquid Chromatography Mass Spectrometry: A Useful Tool for the Detection of DNA Sequence Variation. Angew. Chem. Int. Ed. Engl. 40, 3828-3830 (2001).
- Oberacher, H., Parson, W., Muhlmann, R., Huber, C. G. Analysis of polymerase chain reaction products by on-line liquid chromatography-mass spectrometry for genotyping of polymorphic short tandem repeat loci. Anal. Chem. 73, 5109-5115 (2001).
- Oberacher, H., Huber, C. G. Capillary monoliths for the analysis of nucleic acids by high-performance liquid chromatography-electrospray ionization mass spectrometry. Trends Anal. Chem. 21, 166-174 (2002).
- Oberacher, H., et al. Re-sequencing of multiple single nucleotide polymorphisms by liquid chromatography-electrospray ionization mass spectrometry. Nucleic Acids Res. 30, e67 (2002).
- Oberacher, H., Parson, W., Holzl, G., Oefner, P. J., Huber, C. G. Optimized suppression of adducts in polymerase chain reaction products for semi-quantitative SNP genotyping by liquid chromatography-mass spectrometry. J. Am. Soc. Mass Spectrom. 15, 1897-1906 (2004).
- Mayr, B. M., et al. Identification of bacteria by polymerase chain reaction followed by liquid chromatography-mass spectrometry. Anal. Chem. 77, 4563-4570 (2005).
- Oberacher, H., Niederstatter, H., Casetta, B., Parson, W. Some guidelines for the analysis of genomic DNA by PCR-LC-ESI-MS. J. Am. Soc. Mass Spectrom. 17, 124-129 (2006).
- Beer, B., et al. CYP2D6 genotyping by liquid chromatography-electrospray ionization mass spectrometry. Anal. Bioanal. Chem. 400, 2361-2370 (2011).
- Erb, R., Oberacher, H. Comparison of mobile-phase systems commonly applied in liquid chromatography-mass spectrometry of nucleic acids. Electrophoresis. 35, 1226-1235 (2014).
- Cohen, N. J., et al. Public health response to puffer fish (Tetrodotoxin) poisoning from mislabeled product. J. Food Prot. 72, 810-817 (2009).
- Cole, J. B., et al. Tetrodotoxin poisoning outbreak from imported dried puffer fish--Minneapolis, Minnesota 2014. MMWR Morb. Mortal. Wkly. Rep. 63, 1222-1225 (2015).
- Ohno, Y., et al. The influence of tetrodotoxin on the toxic effects of aconitine in vivo. Tohoku J. Exp. Med. 167, 155-158 (1992).
- Miyaguchi, H., Yamamuro, T., Ohta, H., Nakahara, H., Suzuki, S. Genotyping of Toxic Pufferfish Based on Specific PCR-RFLP Products As Determined by Liquid Chromatography/Quadrupole-Orbitrap Hybrid Mass Spectrometry. J. Agric. Food Chem. 63, 9363-9371 (2015).
- Sambrook, J. F., Russell, D. W. . Neutral polyacrylamide gel electrophoresis. in: Molecular Cloning: A Laboratory Manual. 1, 40-46 (2001).
- Moini, M., Jones, B. L., Rogers, R. M., Jiang, L. Sodium trifluoroacetate as a tune/calibration compound for positive- and negative-ion electrospray ionization mass spectrometry in the mass range of 100-4000 Da. J. Am. Soc. Mass Spectrom. 9, 977-980 (1998).
- Fountain, K. J., Gilar, M., Gebler, J. C. Analysis of native and chemically modified oligonucleotides by tandem ion-pair reversed-phase high-performance liquid chromatography/electrospray ionization mass spectrometry. Rapid Commun. Mass Spectrom. 17, 646-653 (2003).
- Chen, B., Bartlett, M. G. Evaluation of mobile phase composition for enhancing sensitivity of targeted quantification of oligonucleotides using ultra-high performance liquid chromatography and mass spectrometry: application to phosphorothioate deoxyribonucleic acid. J. Chromatogr. A. 1288, 73-81 (2013).
- Gong, L., McCullagh, J. S. Analysis of oligonucleotides by hydrophilic interaction liquid chromatography coupled to negative ion electrospray ionization mass spectrometry. J. Chromatogr. A. 1218, 5480-5486 (2011).
- Muddiman, D. C., Anderson, G. A., Hofstadler, S. A., Smith, R. D. Length and base composition of PCR-amplified nucleic acids using mass measurements from electrospray ionization mass spectrometry. Anal. Chem. 69, 1543-1549 (1997).
- Kullolli, M., Knorf, E., Arampatzidou, M., Tewari, M., Pitteri, S. J. Intact MicroRNA analysis using high resolution mass spectrometry. J. Am. Soc. Mass Spectrom. 25, 80-87 (2013).
- Cummins, L. L., Chen, S., Blyn, L. B., Sannes-Lowery, K. A., Drader, J. J., Griffey, R. H., Hofstadler, S. A. Multitarget affinity/specificity screening of natural products: finding and characterizing high-affinity ligands from complex mixtures by using high-performance mass spectrometry. J. Nat. Prod. 66, 1186-1190 (2003).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유